修回日期: 2008-09-05
接受日期: 2008-09-08
在线出版日期: 2008-09-18
目的: 研究幽门螺杆菌(Helicobacter pylori, H pylori)刺激人胃癌细胞SGC-7901后, 对细胞内SHP-2表达及细胞骨架的影响.
方法: 将临床分离的胃癌H pylori菌体裂解, 以超声提取物刺激SGC-7901细胞1 h, 逆转录聚合酶链式反应(RT-PCR)半定量法测定刺激前后SHP-2表达量的变化; 并将PCR产物进行克隆和测序. 将不同疾病(胃炎, 胃溃疡, 胃癌)的菌株H pylori超声提取物刺激SGC-7901细胞10 min, 采用phalloidin对细胞内骨架进行荧光染色, 研究其对细胞骨架的影响. 将野生型和突变型RhoA质粒转入细胞后, 再以胃癌H pylori超声提取物刺激, 进一步观察细胞内骨架的变化.
结果: 胃癌H pylori菌体超声提取物刺激SGC-7901细胞1 h后, 细胞内SHP-2表达量没有明显变化. 胃炎, 胃溃疡, 胃癌H pylori菌体超声提取物刺激人胃癌细胞SGC-7901后, 与对照组相比, 细胞内骨架增多(65.4±0.510, 63.37±0.475, 64.53±0.522 vs 20.34±1.376, 均P<0.05), 但这三种菌株间相比无统计学意义. 转染入野生型RhoA质粒的细胞经胃癌H pylori菌体超声提取物刺激后, 细胞内骨架较未转染者增多(72.99±1.818 vs 61.78±1.288, P<0.05), 而转染入无活性突变型RhoA质粒的细胞经刺激后, 细胞内骨架与未转染者无明显差别.
结论: 胃癌H pylori超声提取物未能引起细胞内SHP-2 mRNA表达量的改变; 胃炎, 胃溃疡, 胃癌H pylori菌体超声提取物能够增加细胞内骨架的形成, 其作用与H pylori菌种无关, RhoA活性的增强是其中的一个重要中间环节.
引文著录: 张尤历, 陆芬英, 王文兵, 张宇川, 刘勇攀, 吴莺. 幽门螺杆菌对人胃癌细胞SGC-7901中SHP-2及细胞骨架的影响. 世界华人消化杂志 2008; 16(26): 2916-2921
Revised: September 5, 2008
Accepted: September 8, 2008
Published online: September 18, 2008
AIM: To investigate the changes of SHP-2 expression and cytoskeleton in human gastric cancer SGC-7901 cells stimulated by Helicobacter pylori (H pylori).
METHODS: H pylori was isolated from human gastric mucosa and cultured on solid culture plate. The SGC-7901 cells were incubated with the sonicating extract from gastric cancer for 1 h, and the mRNA expression of SHP-2 was measured using semi-quantitative PCR. The PCR products were then cloned and sequenced. After stimulating the SGC-7901 cells with the sonicating extract from gastritis, gastric ulceration and gastric cancer for 10 min, we observed the cytoskeleton using F-actin phalloidin fluorescent staining. After the wild type and mutant pcDNA RhoA was transfected into the cells and stimulated with the sonicating extract from gastric cancer H pylori, the cytoskeleton was further observed.
RESULTS: There was no remarkable change in mRNA expression of SHP-2 following stimulation of SGC-7901 cells with gastric cancer H pylori sonicating extract. After being compared with the sequences in GenBank, the PCR products proved to be SHP-2. However, after stimulation with either gastritis, gastric ulcer and gastric cancer H pylori sonicating extract, the cytoskeleton in SGC-7901 cells significantly increased compared with the control group (65.4 ± 0.510, 63.37 ± 0.475, 64.53 ± 0.522 vs 20.34 ± 1.376, all P < 0.05), but there were no significant difference among the three groups. After stimulation with gastric cancer H pylori sonicating extract, the cytoskeleton in cells transfected with wild type pcDNA RhoA were increased compared with the untransfected cells (72.99 ± 1.818 vs 61.78 ± 1.288, P < 0.05); while mutant pcDNA RhoA had no effect on the cytoskeleton.
CONCLUSION: The sonicating extract from gastric cancer H pylori has no effect on mRNA expression of SHP-2 in human gastric cancer SGC-7901 cells; however sonicating extract from gastritis, gastric ulcer and gastric cancer can increase the cytoskeleton in SGC-7901 cells, and this function is independent of the category of strains. The active form of RhoA plays an important role during this process.
- Citation: Zhang YL, Lu FY, Wang WB, Zhang YC, Liu YP, Wu Y. Influences of Helicobacter pylori on SHP-2 expression and cytoskeleton in human gastric cancer cells SGC-7901. Shijie Huaren Xiaohua Zazhi 2008; 16(26): 2916-2921
- URL: https://www.wjgnet.com/1009-3079/full/v16/i26/2916.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i26.2916
胃自1982年Warren和Marshall et al首次从胃炎和消化性溃疡患者胃窦分离出幽门螺杆菌以来, 因其感染与消化道疾病密切相关, 其致病机制一向是研究的焦点[1]. 蛋白酪氨酸磷酸酶SHP-2[Src homology-2(SH2) domain-containing phosphatase-2, SHP-2]是一种由蛋白酪氨酸磷酸酶N11(PTPN11)基因编码的蛋白酪氨酸磷酸酶, 其分子结构中两个Src同源区(N-SH2和C-SH2)是其发挥作用的基础[2]. 在慢性单核细胞性白血病, 骨髓增生异常综合征以及乳腺癌, 肺癌等疾病中, 均存在PTPN11的异常[3]. SHP-2激活可影响各种信号传导通路, 如激活Rho家族GTP酶, JNK, NF-κB, MAPK和Ras等通道[4]. 小G蛋白RhoA是Rho家族的重要成员之一, 在细胞信号转导通路中也起着重要作用, 他具有与GTP和GDP结合的特性, 在GDP结合状态下无活性, 在GTP结合状态下有活性. RhoA参与了一系列的生物学进程, 包括促进细胞迁移, 调节细胞骨架, 增强肿瘤侵润性等[5-6]. 本研究将H pylori菌体裂解, 以超声提取物刺激SGC-7901细胞, 用逆转录聚合酶链式反应(RT-PCR)半定量法测定刺激前后SHP-2表达量的变化; 用phalloidin对细胞内骨架进行荧光染色, 以探讨SHP-2和RhoA在H pylori致病机制中的作用.
临床H pylori菌株从本院内镜室活检标本分离培养获得. 小牛血清为兰州民海生物工程有限公司产品. DMEM为Gibco公司产品. 大肠杆菌E.coli DH5α为江苏大学生命科学研究院实验室保存. PMD18-T质粒购自上海生工公司. 限制性内切酶、T4 DNA ligase为MBI公司产品. RNase A、Taq酶、dNTPs、λ-DNA/HindⅢ标准分子质量核酸、质粒抽提试剂盒为TaKaRa公司产品. TRIzol购自Invitrogen公司. 野生型和突变型RhoA质粒由江苏大学医学院陈永昌教授惠赠, 梭华阳离子转染试剂购自厦门太阳马生物工程有限公司.
1.2.1 H pylori培养及提取物制备: 取江苏大学附属医院行消化道内窥镜检查患者的胃窦黏膜(距幽门5 cm内)活检组织标本, 经快速尿素酶试验证实H pylori阳性, 病理分别证实为胃炎, 胃溃疡, 胃癌. 将活检新鲜组织用接种环均匀涂于固体琼脂培养基, 在微需氧环境, 37 ℃下培养, 约72 h后收集细菌. 将生长良好的H pylori刮下后用PBS漂洗2遍, 再将之悬于不含血清的DMEM培养液中, 菌体悬液经超声裂解(100 W, 30 s, 10次, 间隔20 s, 冰浴冷却), 低温离心(12000 r/min, 4 ℃, 10 min), 在蛋白浓度测定仪上测定其浓度, 取上清置-20 ℃保存使用.
1.2.2 细胞培养和转染: 人胃癌上皮细胞株SGC- 7901由江苏大学生理教研室提供, 采用含100 mL/L新生牛血清的DMEM培养基于37 ℃、50 mL/L CO2温箱培养, 2-3 d更换培养基1次, 待细胞铺满底后, 用0.25%胰酶消化成单个细胞, 继续培养, 取对数生长期细胞进行实验. 将细胞饥饿12 h后, 加入200 mL浓度为25 g/L的H pylori菌株(胃炎, 胃溃疡, 胃癌)超声提取物, 继续放入培养箱中培养1 h. 转染时, 将细胞消化后, 待长到50%左右时, 将野生型或突变型RhoA质粒与绿色荧光蛋白(GFP)质粒共同转染细胞, 方法按说明书上的进行.
1.2.3 引物设计与合成: 根据GenBank上已公开的SHP-2基因组全序列(GenBank登陆号: NM_002834)中SHP-2基因及其启动子的序列, 合成P1: 5'-CAACACCTTTCTCTCTGATGATGTC-3'; P2:5'-GTGGAGAGAGGAAAGAGTAAATGTG-3', β-actin引物为: P1: 5'-GAGACCTTCAACACCCCAGCC-3', P2: 5'-GGACTACAGGTCTTTGCGGATG-3'. 引物由上海生工生物工程有限公司合成.
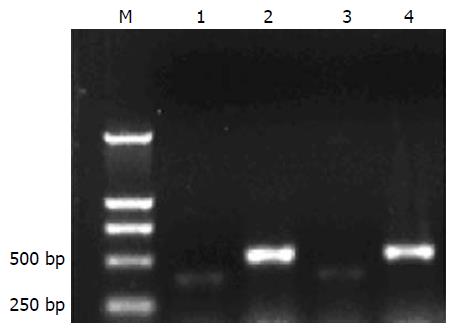
1.2.4 SHP-2目的片段的获得: 用TRIzol试剂提取细胞总RNA, 取2 μg RNA溶液经DNAase消化后逆转录成cDNA, 取1.0 μL cDNA进行PCR. 采用20 μL体系: cDNA 1.0 μL, 10×PCR缓冲液2.0 μL, P1及P2各0.3 μL, 2.5 mmol/L dNTP 1.6 μL, Taq酶0.2 μL, ddH2O 14.6 μL. 扩增条件为94 ℃预变性5 min; 变性94 ℃ 50 s, 58 ℃退火45 s, 72 ℃延伸50 s, 35个循环后, 72 ℃延伸10 min. 扩增产物长度为376 bp, β-actin扩增产物为512 bp. 结果采用SHP-2产物与β-actin比值进行分析. 应用凝胶成像分析系统(美国BIO2RAD公司Multi2Flours分析系统)对条带进行半定量分析, SHP-2基因的表达量通过同时扩增的actin基因的表达进行校正, 即以SHP-2/actin比值作为SHP-2基因表达量.
1.2.5 PCR产物的连接及转化: 连接反应体系为PMD18-T vector DNA 0.5 µL, SolutionⅠ5 µL, PCR产物4.5 µL, ddH2O补至终体积10 µL, 置于 4 ℃下过夜. 取5 µL连接反应液至感受态细胞中, 加入700 µL液体LB培养基, 37 ℃ 150-200 r/min 振荡培养1 h左右; 加100 µL LB培养好的菌液辅至LB/Amp的平板上; 置平板于37 ℃中培养12-16 h, 即可见单个菌落出现.
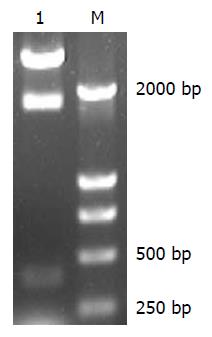
1.2.6 重组质粒的鉴定及克隆分析: 挑取阳性菌落加入LB培养液中, 37 ℃振摇过夜, 用质粒小抽方法抽取重组质粒. 按下列体系进行酶切鉴定: HindⅢ 0.8 μL, XbaⅠ 0.4 μL, Buffer 2.0 μL, 重组质粒2.0 μL, ddH2O 14.8 μL. 置于37 ℃恒温水浴, 酶切3-4 h. 10 g/L琼脂糖凝胶电泳检测, 如果酶切出的外源片段与目的片段大小一致, 即可用来测序, 重组质粒测序由上海生工完成.
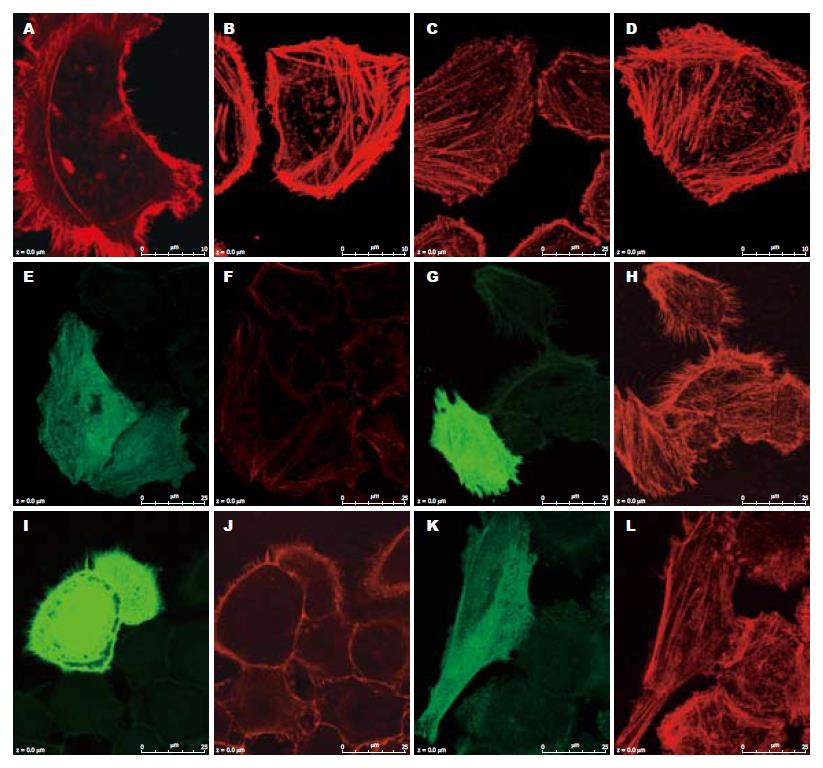
1.2.7 细胞骨架的荧光染色: 将细胞接种到放有爬片的24孔板中, 细胞密度为30%-40%, 细胞贴壁后, 将培养液换成无血清的DMEM培养基,每孔定容到250 μL, 12 h后, 分别加入25 μL浓度为25 g/L的胃炎, 胃溃疡, 胃癌H pylori超声提取物, 刺激10 min. 吸去培养液, 用新鲜配置的20 g/L多聚甲醛在室温下固定15 min, 再用0.3% Triton-X100室温下作用8 min. 细胞用50 mg/L罗丹明标志的鬼笔环肽(phalloidin)直接染色, 室温下孵育30 min. 从固定细胞开始每一部操作以后用PBS洗3次, 每次3 min. 最后用清水漂洗, 300 mL/L甘油(V/V)封片. 在荧光共聚焦显微镜下观察细胞的骨架并进行定量. 转染了RhoA质粒的细胞培养1 d以后, 也按上述方法进行染色.
统计学处理 所得数据用SPSS13.0统计软件进行检验, 细胞骨架的多个均数间比较用单因素方差分析(One-way ANOVA), 两两比较采用SNK检验, 两样本均数比较采用t检验, P<0.05有统计学意义.
扩增产物经10 g/L琼脂糖凝胶电泳, EB染色, 产物大小为376 bp左右(图1). 以Multi2Flours分析系统对条带进行半定量分析, 未见明显差异, 表明胃癌H pylori超声提取物刺激前后SHP-2在mRNA水平无明显变化.
将所得PCR产物与T载体连接, 转化到DH5α菌中, 筛选阳性克隆, 经XbaⅠ、HindⅢ酶切鉴定, 获得与目的片段相一致的阳性克隆(图2).
阳性重组质粒送上海生工进行序列测定, 结果显示插入片段大小为376 bp, 与GenBank中序列进行比对, 证实产物为SHP-2.
细胞固定后用phalloidin对F-actin染色, 发现对照组细胞仅有少量应激纤形成, 而用不同H pylori刺激10 min后, 应激纤维增加利用共聚焦激光扫描显微镜对图像进行F-actin量化, 发现三组刺激组F-actin平均荧强度与对照组相比具有统计学意义, 细胞内骨架增多(65.4±0.510, 63.37±0.475, 64.53±0.522 vs 20.34±1.376, P<0.05), 而三类不同的菌株间无明显差异(P>0.05). 转染入野生型RhoA质粒的细胞中, 与周围的细胞相比, 胃癌H pylori超声提取物刺激可增加应激纤维的形成细胞内骨架较未转染者增多(72.99±1.818 vs 61.78±1.288, P<0.05); 在转染突变型RhoA质粒的细胞中, 应激纤维与未转染的细胞相比无明显变化(图3, P>0.05).
H pylori是一种革兰染色阴性的微需氧的菌, 世界范围内约有50%的人群感染有H pylori, 其感染是消化性溃疡的主要病因之一, 也是胃癌的主要危险因素[7-8]. 本研究采用半定量PCR方法分析胃癌H pylori菌体超声提取物刺激SGC-7901细胞前后, 细胞内SHP-2 mRNA表达量的变化, 结果发现刺激前后SHP-2 mRNA表达量没有明显变化. Higashi et al[9]将CagA重组质粒转染入AGS细胞, 17 h后, 细胞呈现出典型的蜂鸟表型改变; 而将CagA重组质粒与磷酸酶活性缺陷的SHP-2重组质粒转染入细胞后共培养, 出现蜂鸟表型的细胞数明显下降. 这个结果与Higuchi et al[10]的研究成果一致, 他们以SiRNA技术干扰SHP-2表达后, 蜂鸟表型的细胞大大减少, 这些都提示我们在CagA诱导的细胞发生形态学改变的过程中, SHP-2的作用是必不可少的, 而其磷酸酶活性则是其发挥作用的关键. 根据以上结果, 推测胃癌H pylori超声提取物刺激SGC-7901细胞后, 可能是SHP-2的磷酸酶活性发生了变化, 而其在转录水平并没有发生量的增加或减少, 对其磷酸酶活性以及蛋白水平的变化还有待于进一步研究.
本实验中发现H pylori超声提取物刺激后, 细胞骨架较对照组明显增多, 为了进一步证实RhoA在这个过程中的作用, 我们将不同结构的RhoA转染入细胞后, 以胃癌菌株的超声提取物刺激, 发现转染野生型RhoA的细胞受H pylori超声提取物刺激后细胞骨架较未转染者多, 而转染了无活性突变型RhoA的细胞受刺激后与未转染者相比无明显变化, 因活性RhoA在调节细胞骨架以及促进细胞迁移, 增强肿瘤的浸润中起着重要作用[5-6]; 而且已有实验证实H pylori超声提取物能够增加细胞内活性RhoA表达, 促进细胞迁移, 使细胞发生蜂鸟表型改变[11-12]. 因此, H pylori超声提取物刺激细胞以后, 是通过增强RhoA活性这个中间步骤来引起细胞发生一系列行为学变化的.
SHP-2作为RhoA的上游信号, 调节着RhoA的活性, Schoenwaelder et al[13]将SHP-2的特异性抑制剂calpeptin阻断其活性, 发现细胞内活性RhoA水平上升, 细胞内的骨架也明显增多. H pylori刺激宿主细胞后, CagA与SHP-2相互作用, 消耗细胞内的SHP-2, 下调了SHP-2的活性[14], 导致活性RhoA表达增强, 引起细胞发生一系列行为学改变. 以上结果提示, H pylori超声提取物刺激SGC-7901细胞后, SHP-2的磷酸酶活性发生了变化, 导致细胞内无活性RhoA向活性型转变, 从而引起细胞发生一些相关的行为学改变. 有研究报道SHP-2与肿瘤的发生有一定的关联[15-16]; RhoA在多种肿瘤组织中也呈现高表达状态并且和肿瘤恶性程度相关[17], 而H pylori也是胃癌的主要危险因素, 因此, H pylori感染后, CagA, SHP-2与RhoA之间起着协同作用, 最终导致疾病的发生.
流行病学研究发现, 不同的菌株其EPIYA模序的数量和序列是不同的, 因此其结合SHP-2的能力以及诱发"蜂鸟"表型的能力也有所不同[18]. 本研究发现, H pylori超声提取物引起细胞骨架增多的过程中, 三类不同菌株(胃炎, 胃溃疡, 胃癌)相比无明显差异, 而且此实验中所用3个菌株CagA经过测序, 其编码蛋白没有变化. 这就意味着H pylori感染后不仅仅是CagA-SHP-2-RhoA这一通路在发挥作用, 尚有其他信号转导通路参与其中, 加上宿主, 环境等多因素的作用, 最终导致不同的临床结果, 然而, 这些因素之间如何相互作用, H pylori在胃肠道疾病中究竟起多大作用, 其确切的致病机制又是什么, 都还有待于以后的工作中解决.
H pylori是一种革兰染色阴性的微需氧的菌, 世界范围内约有50%的人群感染有H pylori, 其感染是消化性溃疡的主要病因之一, 也是胃癌的主要危险因素. 蛋白酪氨酸磷酸酶SHP-2是一种由蛋白酪氨酸磷酸酶N11(PTPN11)基因编码的蛋白酪氨酸磷酸酶, 其分子结构中两个Src同源区(N-SH2和C-SH2)是其发挥作用的基础. SHP-2激活可影响各种信号传导通路, 如激活Rho家族GTP酶, JNK, NF-κB, MAPK和Ras等通道.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
幽门螺杆菌以来, 因其感染与消化道疾病密切相关, 其致病机制一向是研究的焦点. CagA诱导的细胞发生形态学改变的过程中, SHP-2的作用是必不可少的, 而其磷酸酶活性则是其发挥作用的关键. 推测胃癌H pylori超声提取物刺激SGC-7901细胞后, 可能是SHP-2的磷酸酶活性发生了变化, 而其在转录水平并没有发生量的增加或减少, 对其磷酸酶活性以及蛋白水平的变化还有待于进一步研究.
Higashi et al将CagA重组质粒转染入AGS细胞发现细胞呈现出典型的蜂鸟表型改变; 而将CagA重组质粒与磷酸酶活性缺陷的SHP-2重组质粒转染入细胞后共培养, 出现蜂鸟表型的细胞数明显下降. Hatakeyama发现H pylori刺激宿主细胞后, CagA与SHP-2相互作用, 消耗细胞内的SHP-2, 下调了SHP-2的活性.
本研究发现H pylori感染后不仅仅是CagA-SHP-2-RhoA这一通路在发挥作用, 尚有其他信号转导通路参与其中, 加上宿主, 环境等多因素的作用, 最终导致不同的临床结果, 为下一步进行机制研究提供了一定的理论依据.
本文选题新颖, 讨论深入, 结果有一定实用性, 但学术价值一般.
编辑: 李军亮 电编: 何基才
| 1. | Backert S, Schwarz T, Miehlke S, Kirsch C, Sommer C, Kwok T, Gerhard M, Goebel UB, Lehn N, Koenig W. Functional analysis of the cag pathogenicity island in Helicobacter pylori isolates from patients with gastritis, peptic ulcer, and gastric cancer. Infect Immun. 2004;72:1043-1056. [PubMed] [DOI] |
| 2. | Neel BG, Gu H, Pao L. The 'Shp'ing news: SH2 domain-containing tyrosine phosphatases in cell signaling. Trends Biochem Sci. 2003;28:284-293. [PubMed] [DOI] |
| 3. | Bentires-Alj M, Paez JG, David FS, Keilhack H, Halmos B, Naoki K, Maris JM, Richardson A, Bardelli A, Sugarbaker DJ. Activating mutations of the noonan syndrome-associated SHP2/PTPN11 gene in human solid tumors and adult acute myelogenous leukemia. Cancer Res. 2004;64:8816-8820. [PubMed] [DOI] |
| 4. | Chan G, Kalaitzidis D, Neel BG. The tyrosine phosphatase Shp2 (PTPN11) in cancer. Cancer Metastasis Rev. 2008;27:179-192. [PubMed] [DOI] |
| 5. | Keely PJ. Rho GTPases as early markers for tumour progression. Lancet. 2001;358:1744-1745. [PubMed] [DOI] |
| 6. | Sahai E, Marshall CJ. RHO-GTPases and cancer. Nat Rev Cancer. 2002;2:133-142. [PubMed] [DOI] |
| 7. | Ando T, Goto Y, Maeda O, Watanabe O, Ishiguro K, Goto H. Causal role of Helicobacter pylori infection in gastric cancer. World J Gastroenterol. 2006;12:181-186. [PubMed] |
| 8. | Kim N, Park RY, Cho SI, Lim SH, Lee KH, Lee W, Kang HM, Lee HS, Jung HC, Song IS. Helicobacter pylori infection and development of gastric cancer in Korea: long-term follow-up. J Clin Gastroenterol. 2008;42:448-454. [PubMed] [DOI] |
| 9. | Higashi H, Tsutsumi R, Muto S, Sugiyama T, Azuma T, Asaka M, Hatakeyama M. SHP-2 tyrosine phosphatase as an intracellular target of Helicobacter pylori CagA protein. Science. 2002;295:683-686. [PubMed] |
| 10. | Higuchi M, Tsutsumi R, Higashi H, Hatakeyama M. Conditional gene silencing utilizing the lac repressor reveals a role of SHP-2 in cagA-positive Helicobacter pylori pathogenicity. Cancer Sci. 2004;95:442-447. [PubMed] [DOI] |
| 11. | 李 Z妍, 汤 燕, 王 瑛, 王 华, 陈 永昌. 幽门螺杆菌调控胃上皮细胞基因表达的机制. 江苏大学学报(医学版). 2006;16:13-15. |
| 12. | 陆 芬英, 张 尤历, 王 文兵, 陈 永昌, 张 宇川, 刘 勇攀, 吴 莺. 幽门螺杆菌提取物体外对人胃癌细胞SGC-7901形态的影响. 世界华人消化杂志. 2008;16:919-923. [DOI] |
| 13. | Schoenwaelder SM, Petch LA, Williamson D, Shen R, Feng GS, Burridge K. The protein tyrosine phosphatase Shp-2 regulates RhoA activity. Curr Biol. 2000;10:1523-1526. [PubMed] [DOI] |
| 14. | Hatakeyama M. Deregulation of SHP-2 tyrosine phosphatase by the Helicobacter pylori virulence factor CagA. Keio J Med. 2002;51 Suppl 2:26-32. [PubMed] |
| 15. | Mohi MG, Neel BG. The role of Shp2 (PTPN11) in cancer. Curr Opin Genet Dev. 2007;17:23-30. [PubMed] [DOI] |
| 16. | Chan RJ, Feng GS. PTPN11 is the first identified proto-oncogene that encodes a tyrosine phosphatase. Blood. 2007;109:862-867. [PubMed] [DOI] |
| 17. | Yoshioka K, Nakamori S, Itoh K. Overexpression of small GTP-binding protein RhoA promotes invasion of tumor cells. Cancer Res. 1999;59:2004-2010. [PubMed] |
| 18. | Hatakeyama M. Oncogenic mechanisms of the Helicobacter pylori CagA protein. Nat Rev Cancer. 2004;4:688-694. [PubMed] [DOI] |