修回日期: 2008-08-13
接受日期: 2008-08-19
在线出版日期: 2008-09-08
目的: 调查北京地区艾滋病患者肝脂变的发生率, 研究艾滋病患者肝组织中瘦素与肝脂变的关系.
方法: 应用免疫组织化学法检测18例国人艾滋病患者肝组织中瘦素、CD68及TNF-α的表达, 评价这些患者肝脏的组织学改变及脂变状况, 分析性别、年龄、肝功能、血脂水平、空腹血糖、HIV病毒载量、CD4+细胞计数和CD8+细胞计数与肝脂变的关系.
结果: 本组病例艾滋病患者肝脂变的发生率为61.1%(11/18), 其中大泡脂变占72.7%(8/11), 合并肝病相关性机会性感染者占22.2%(4/18). 18例肝组织中瘦素检出率为44.4%, 有肝脂变的肝组织其瘦素及CD68表达的阳性率高于无脂变组, 但无统计学意义, 脂变组TNF-α的阳性率显著高于无脂变组(100% vs 42.9% P = 0.012). 除CD8+细胞计数(×106个/L)在脂变组显著低于无脂变组(142.0±93.0 vs 515.6±320.7, P = 0.026)外, 其余因素如年龄, 体质量指数、肝功能、血脂水平、空腹血糖、HIV载量、CD4+细胞计数及是否合并丙型肝炎感染均与肝脂变的发生无显著相关.
结论: 艾滋病患者中肝脂变发生率较高, 肝脂变的发生与瘦素的表达未见明显相关, 可能与肝组织损伤修复机制有关.
引文著录: 兰孟东, 孙成福, 赵红心, 沈冰, 张亮, 赵辉, 卢联合, 王笑梅, 郎振为, 李兴旺, 毛羽. 艾滋病患者肝组织瘦素的表达及与肝脂变的关系. 世界华人消化杂志 2008; 16(25): 2836-2840
Revised: August 13, 2008
Accepted: August 19, 2008
Published online: September 8, 2008
AIM: To investigate the prevalence of hepatic steatosis and its correlation with the expression of leptin in patients with acquired immunodeficiency syndrome (AIDS) in Beijing district.
METHODS: A total of 18 Chinese AIDS patients were included in this study. Immunohistochemistry was used to detect the expression of leptin, CD68 and tumor necrosis factor-α (TNF-α) in liver specimens of these patients. The hepatic steatosis and histopathological changes of these liver specimens were evaluated. Meanwhile, we also analyzed the relations of age, gender, body mass index (BMI), liver function, fasting blood glucose, cholesterol, triglyceride, HIV load, CD4+ count and CD8+ count with hepatic steatosis.
RESULTS: In this group of AIDS patients with AIDS, the prevalence of hepatic steatosis was 61.1% (11/18). Macrovesicular steatosis was 72.7% (8/11). The patients complicated with liver disease-associated opportunistic infections accounted for 22.2% (4/18). The positive rate of leptin was 44.4% in AIDS patients, and the positive rates of leptin and CD68 in steatosis patients were higher than those in non-steatosis patients without statistical significances. The positive expression of TNF-α in AIDS patients with steatosis was significantly higher than those in patients without steatosis (100% vs 42.9%, P = 0.012), but the CD8+ cell count (× 106 cells/L) was just the opposite (142.0 ± 93.0 vs 515.6 ± 320.7, P = 0.026). Hepatic steatosis had no correlations with the patients' age, gender, BMI, liver function, blood-fasting sugar, cholesterol, triglyceride, HIV load, CD4+ count and coinfection of hepatitis C virus.
CONCLUSION: Hepatic steatosis is highly prevalent in AIDS patients and shows no significant relations with leptin expression, which seems to associate with the mechanism of injury-repair in liver.
- Citation: Lan MD, Sun CF, Zhao HX, Shen B, Zhang L, Zhao H, Lu LH, Wang XM, Lang ZW, Li XW, Mao Y. Relationship between leptin expression and hepatic steatosis in liver tissues of patients with acquired immunodeficiency syndrome. Shijie Huaren Xiaohua Zazhi 2008; 16(25): 2836-2840
- URL: https://www.wjgnet.com/1009-3079/full/v16/i25/2836.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i25.2836
肝脂变是非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)常见的和重要的组织学改变. 慢性人类免疫缺陷病毒(human immuno-deficiency virus, HIV)感染者可能成为越来越多的NAFLD的危险因素之一[1]. 由脂肪细胞分泌的瘦素是一种具有多种生理功能的内分泌调节激素[2]. 瘦素水平的升高, 可促进肝细胞内脂肪酸堆积, 从而促进肝脂变的发生[3]. 艾滋病患者中肝脂变的发生率及其相关因素国内研究尚少. 本研究应用免疫组织化学法检测艾滋病患者肝组织中瘦素的表达, 探讨肝组织中瘦素的表达与肝脂变的关系以及肝脂变的相关因素.
1995-03/2007-07在北京地坛医院就诊的艾滋病患者18例, 14例尸解患者发病前均有性乱行为史, 入院时均已是艾滋病临终期患者, 其中男13例, 女1例, 年龄22-53(平均38.4±9.8)岁, 其外周血CD4+细胞计数5-97/µL, 2例HBV血清学标志物阳性. 4例肝活检患者中, 男3例, 女1例, 年龄11-36岁, 2例有明确输血史, 3例血清抗-HCV及HCV RNA阳性, 外周血CD4+细胞计数25-356/µL. 仅1例患者接受高效抗逆转录病毒治疗(highly active antiretroviral therapy, HAART)3 wk, 其他病例均未接受抗病毒治疗.
1.2.1 肝组织学检查: 14例患者为尸体解剖取得肝组织标本, 4例为活检获得肝组织, 肝活检采用美国Bard Magnum型穿刺枪, 16G穿刺针实行1 s快速肝穿刺术, 获取长度为1.5-2.5 cm之肝组织于40 g/L的中性甲醛溶液中固定, 石蜡包埋, 4 µm厚连续切片, 分别做HE、网状纤维、Masson染色. 肝组织学评价应用Knodell[4]HAI评分系统. 肝脂变程度的分类参照文献[5]: 脂变肝细胞少于肝小叶的5%为阴性; 超过5%为阳性, 其中5%-25%为轻度; 大于26%为重度.
1.2.2 免疫组织化学检测: 瘦素, CD68及肿瘤坏死因子-α(TNF-α)的检测应用EnVision两步法. 具体步骤如下: 石蜡切片常规脱蜡至水, 应用0.3%双氧水室温孵育10 min以消除内源性过氧化物酶活性, EDTA缓冲液高压抗原修复后, 分别滴加CD68 mAb(购自北京中杉生物技术有限公司, 1:160稀释); 兔抗人-TNF-α抗体(购自北京中杉生物技术有限公司, 1:200稀释); 兔抗人-瘦素抗体(购自武汉博士德生物技术有限公司, 1:180稀释), 4 ℃过夜, 磷酸盐缓冲液(PBS)洗片后滴加辣根过氧化物酶标志的二抗(购自北京基因公司), 湿盒37 ℃孵育30 min, 3, 3'-二氨基联苯胺(购自北京基因公司)显色, 苏木素复染, 封片. 在以上步骤中以PBS代替一抗作为空白对照.
瘦素表达的评价参考卢建华 et al[6]的评价方法: 肝组织中细胞内有瘦素信号表达者为阳性, 未见阳性信号者为阴性. TNF-α表达的半定量评价方法参考丁效蕙 et al[7]并加以修改: 未见阳性信号者为阴性, 阳性细胞占间质细胞数的1%-5%为+, 超过5%为++. CD68的半定量评价方法: 阳性细胞占间质细胞数的1%-10%为+, 10%-20%为++, 超过20%为+++.
1.2.3 血清学检测: 乙肝五项、抗-HCV采用MEIA(微粒子酶免分析)方法, 试剂为美国Abbott公司生产. 血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、总胆红素(TBIL)、碱性磷酸酶(alkaline phosphatase, ALP)、γ-谷氨酰转肽酶(gamma-glutamy-ltransferase, GGT)、甘油三酯(triglyceride, TG)、总胆固醇(cholesterol, CHO)采用HITACHI-7180型全自动生物化学分析仪检测. 空腹血糖(FBS)采用美国德灵公司Dimension-RXL型全自动生物化学分析仪检测.
统计学处理 计量资料以mean±SD表示, 应用Student t, Mann-Whitney U检验, 比较脂变组与无脂变组之间的差异; 计数资料应用χ2检验或Fisher精确检验, P<0.05表示差异有统计学意义. 所有统计处理均使用SPSS13.0统计软件.
18例肝组织标本中, 13例患者出现点灶性坏死, 8例出现轻至中度的肝细胞水肿, 个别患者出现肝细胞气球样变, 8例出现汇管区炎症, 炎症细胞以淋巴细胞为主, 未见显著的淋巴细胞聚集或淋巴滤泡形成, 17例出现轻至中度的汇管区纤维化. 典型的肝硬化表现1例(例5); 合并肝病相关性机会性感染者4例, 占22.2%, 其中3例尸解肝组织中发现肉芽肿及干酪样坏死, 抗酸染色证实为结核分枝杆菌感染(例7, 10, 14, 表1), 1例尸解肝组织中发现巨细胞病毒感染(例3, 表1). 应用Knodell HAI评分系统评价, 本组18例患者肝组织HAI分值0-13分, 中位数为3分, 按是否存在肝脂变分组, 肝脂变组与无脂变组比较, 其HAI值无显著性差异(4.8±3.6 vs 3.9±2.1, P = 0.531, 表2).
| 序号 | 病历号 | 性别 | 年龄(岁) | Knodell HAI分值 | 机会性感染 |
| 1 | 68584 | 男 | 53 | 7 | 无 |
| 2 | 66579 | 男 | 22 | 3 | 无 |
| 3 | 63385 | 男 | 45 | 3 | 巨细胞病毒 |
| 4 | 62436 | 男 | 41 | 3 | 无 |
| 5 | 58862 | 女 | 37 | 13 | 无 |
| 6 | 57513 | 男 | 35 | 3 | 无 |
| 7 | 55897 | 男 | 36 | 5 | 分枝杆菌 |
| 8 | 49075 | 男 | 42 | 0 | 无 |
| 9 | 53671 | 男 | 51 | 3 | 无 |
| 10 | 82279 | 男 | 27 | 4 | 分枝杆菌 |
| 11 | 82623 | 男 | 26 | 8 | 无 |
| 12 | 82589 | 男 | 47 | 8 | 无 |
| 13 | 87752 | 男 | 29 | 1 | 无 |
| 14 | 94676 | 男 | 47 | 3 | 分枝杆菌 |
| 15 | 89306 | 男 | 36 | 6 | 无 |
| 16 | 78096 | 男 | 36 | 2 | 无 |
| 17 | 92178 | 女 | 11 | 4 | 无 |
| 18 | 59801 | 男 | 35 | 4 | 无 |
| 肝脂变组(n = 11) | 无脂变组(n = 7) | P值 | |
| 年龄(岁) | 37.5±8.1 | 34.7±14.5 | 0.600 |
| 性别(男%) | 10(85.7) | 6(90.9) | 0.641 |
| BMI(kg/m2) | 17.5±2.1 | 17.1±2.4 | 0.676 |
| ALT(U/L) | 40.5±35.8 | 49.4±49.1 | 0.684 |
| AST(U/L) | 122.8±93.2 | 50.6±16.7 | 0.408 |
| TBIL(mmol/L) | 28.3±37.2 | 10.1±4.1 | 0.606 |
| ALP(U/L) | 388.7±810.8 | 135.8±73.9 | 0.465 |
| GGT(U/L) | 202.6±287.7 | 111.6±113.1 | 0.478 |
| TG(mmol/L) | 1.9±1.1 | 1.5±0.6 | 0.504 |
| CHO(mmol/L) | 3.6±1.5 | 2.9±0.7 | 0.426 |
| BFS(mmol/L) | 5.7±4.4 | 4.6±3.0 | 0.597 |
| Log(HIV load) | 6.1±0.6 | 6.0±0.5 | 0.862 |
| CD4+计数(×106 个/L) | 35.1±28.4 | 83.2±137.1 | 0.434 |
| CD8+计数(×106 个/L) | 142.0±93.0 | 515.6±320.7 | 0.026 |
| HAI分值 | 4.8±3.6 | 3.9±2.1 | 0.531 |
| 瘦素(阳性%) | 6(54.5) | 2(28.6) | 0.278 |
18例艾滋病患者肝组织中, 伴有肝脂变占61.1%(11/18), 其中轻度脂变者占33.3%(6/18), 重度脂变者占27.8%(5/18), 无脂变者仅7例. 在脂变患者肝组织中, 大泡脂变8例, 微泡脂变6例, 混合脂变4例. 在4例肝活检组织中, 有3例血清抗-HCV及HCV RNA阳性, 但均无肝脂变出现. 合并有肝脂变的肝组织中, 脂变的肝细胞多见于肝小叶的3区带, 伴肝细胞气球样变.
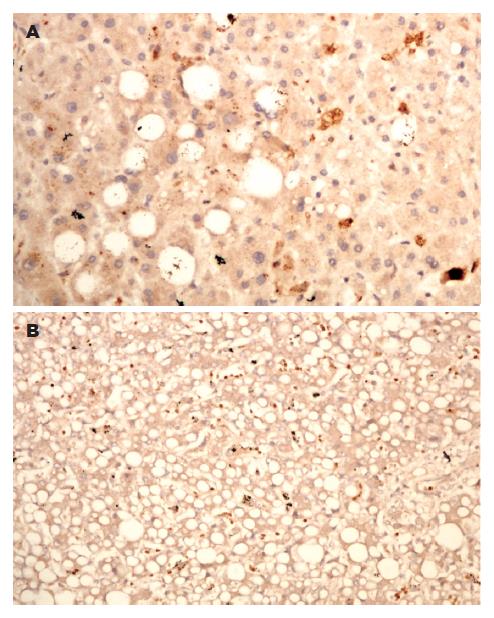
瘦素表达的阳性细胞主要位于汇管区及肝窦纤维化部位, 位于肝窦间质细胞的胞质中(图1A). 18例肝组织中, 瘦素表达的总阳性率为44.4%(8/18). 有肝脂变的肝组织中, 瘦素阳性表达占54.5%(6/11), 而无脂变的肝组织中, 瘦素阳性表达的仅占28.6%(2/7)(表2), 但两组比较无统计学差异(P>0.05).
肝组织中枯否氏细胞可以应用CD68 mAb标志. 18例肝组织中均可见CD68阳性细胞, 主要分布于肝窦中, 汇管区也可见到. 脂变组中72.7%的肝组织CD68阳性细胞增生活跃, 在脂变区较显著, 但增生程度在这两组中无显著性差异. TNF-α表达的阳性细胞主要见于单个核细胞及活化的肝星状细胞. 有肝脂变的肝组织中均可见TNF-α的表达(图1B), 其中TNF-α弱表达的有8例(72.7%), TNF-α强表达的有3例(27.3%), 而无脂变的肝组织中, TNF-α弱表达的有3例(42.9%)(表3), 两组比较差异显著(P<0.05).
| TNF-α | 肝脂变组(n = 11) | 无脂变组(n = 7) | P值 |
| - | 0(0) | 4(57.1) | |
| + | 8(72.7) | 3(42.9) | |
| ++ | 3(27.3) | 0(0) | 0.012 |
本研究对这些患者的一般人口学资料, 如性别、年龄等, 临床及实验室资料, 如体质量指数、肝功能、血脂水平, 空腹血糖, HIV载量, CD4+细胞计数, CD8+细胞计数, 是否合并丙型肝炎感染与肝脂变的发生进行了相关性分析, 其中TNF-α, CD8+细胞计数在脂变组显著低于无脂变组外(P<0.05), 其余因素均与艾滋病患者的肝脂变发生无显著相关性(表2).
肝脂变是脂肪性肝病的组织学改变之一, 脂肪性肝病包括酒精性肝病和非酒精性脂肪性肝病, 其中非酒精性脂肪性肝病的发病率不断增加. 目前, 我国的艾滋病感染者已由高危人群向一般人群扩散, 脂肪肝也成为艾滋病患者较常见的肝脏组织学表现. 在欧美国家, 通过艾滋病患者的肝活检及尸解研究发现脂肪肝的发生率超过30%[9-10]. 而国内艾滋病患者的肝脂变发生率则未见报道. 本研究通过对14例艾滋病患者的尸解资料及4例肝活检资料的研究发现脂肪肝的发生率为61.1%, 较欧美国家的报道明显增加, 分析原因包括: (1)本组资料多为艾滋病尸解资料, 而艾滋病尸解患者多为艾滋病终末期. (2)这些尸解患者普遍存在恶液质及严重营养不良, 从而引起脂肪代谢紊乱. (3)这些患者常合并多种机会性感染, 感染引发的毒血症及脓毒血症可加剧营养不良及脂肪代谢紊乱.
Sutinen et al[11]报道HARRT治疗可能增加脂肪性肝病的发生的危险因素如肥胖, 脂肪性营养失调及胰岛素抵抗. 本研究中的艾滋病尸解患者多为2001年以前的患者, 那时我国尚罕有使用HARRT治疗者. 本组病例中仅有1例患者接受过HARRT治疗. 另外, 美国学者Gaslightwala et al[12]的研究认为: 肝脂变在HIV合并HCV感染者中更常见及更严重. 本组病例中有3例患者合并HCV感染, 但合并HCV感染对肝脂变未见明显影响. 这可能与本组病例较少有关, 因此尚需要积累更多的资料.
瘦素是瘦素基因的产物, 通过与瘦素受体结合发挥其生理效应, 增加能量消耗, 抑制脂肪合成[2]. 有研究表明, NAFLD患者往往伴有高瘦素血症, 这与一些刺激脂肪细胞瘦素合成和(或)分泌的因素, 如细胞因子、性激素、胰岛素和皮质醇的水平增加有关, 从而调节脂肪细胞瘦素基因表达的信号机制, 使脂肪组织释放瘦素增加, 而瘦素水平与肝脏的脂肪变性程度呈正相关[13-14]. 但瘦素引起肝脏脂肪变性的机制尚不明确, 可能的原因是当瘦素水平升高时, 引起胰岛素抵抗, 脂肪变性呈渐进性加重[15], 同时, 瘦素还能增强肝脏枯否细胞对TNF-α, 白介素6(IL-6), IL-12等细胞因子的分泌, 促进肝细胞的变性坏死[16]. 卢建华 et al[6]应用免疫组织化学法研究HBV感染者肝组织中瘦素的表达, 发现肝脂变对瘦素表达无影响, 说明肝组织原位瘦素的表达不是脂变所导致, 而可能是肝组织损伤修复机制所引起. 本研究的结果显示, 艾滋病患者肝组织瘦素的原位表达虽然脂变组阳性率高于无脂变组, 但统计学处理未显示差异. 进一步检测肝组织中CD68及TNF-α的表达, 发现脂变组CD68及TNF-α的阳性表达显著高于无脂变组, 提示艾滋病患者肝脂变可能与炎症因子TNF-α的分泌增加有关. 由于本组病例未检测患者血清胰岛素水平, 无法测算是否存在胰岛素抵抗; 而且本组病例较少, 增加研究病例数是否增加艾滋病患者中肝脂变与瘦素的原位表达的相关性, 尚需进一步研究.
另外, 本研究中还发现一个有趣的现象: CD8+ T淋巴细胞胞计数在脂变组显著低于无脂变组. CD8+细胞为细胞毒性T淋巴细胞, 在艾滋病感染者中能够杀死被艾滋病病毒感染的细胞, 因此CD8+细胞在艾滋病病毒清除中起重要作用. 因此, 艾滋病患者的脂变是否与HIV病毒的复制及机体免疫状态有关, 尚需要进一步研究.
总之, 本研究的结果表明, 本组病例艾滋病患者中肝脂变发生率较高, 肝脂变的发生与瘦素的表达未见明显相关, 而可能与肝组织损伤修复机制有关.
肝脂变是非酒精性脂肪性肝病(NAFLD)主要的组织学表现. 目前, 有较多的研究探讨了NAFLD的发生, 发展及发病机制. 随着我国艾滋病感染者由高危人群向一般人群扩散, 脂肪肝也成为艾滋病患者较常见的肝脏组织学表现. 但我国艾滋病感染者的肝脂变发生率及肝脂变发生的相关因素研究则少有报道.
朱传武, 副主任医师, 江苏省苏州市第五人民医院传染科; 宣世英, 教授, 山东省青岛市市立医院肝病内科
脂肪因子在NAFLD中的作用及其机制研究是该领域中的研究热点. 有研究表明, NAFLD患者往往伴有高瘦素血症, 而瘦素水平与肝脏的脂肪变性程度呈正相关. 艾滋病感染者的肝脂变是否与瘦素原位高表达有关, 值得探讨.
国外Sutinen et al报道HARRT治疗可能增加脂肪性肝病的发生的危险因素如肥胖, 脂肪性营养失调及胰岛素抵抗. 另外, 美国学者Gaslightwala et al的研究认为: 肝脂变在HIV合并HCV感染者中更常见及更严重.
本研究为国内首次研究艾滋病患者的肝脂变的特点及脂肪因子在肝脂变中的作用及意义.
本文选题新颖, 方法得当, 数据可靠, 虽然样本例数过少, 但提供了一些很明确的数据, 为艾滋病患者肝脂变的研究提供了真实的数据.
编辑: 李军亮 电编: 何基才
| 1. | Ristig M, Drechsler H, Powderly WG. Hepatic steatosis and HIV infection. AIDS Patient Care STDS. 2005;19:356-365. [PubMed] [DOI] |
| 2. | Ahima RS, Flier JS. Leptin. Annu Rev Physiol. 2000;62:413-437. [PubMed] [DOI] |
| 3. | Kaplan LM. Leptin, obesity, and liver disease. Gastroenterology. 1998;115:997-1001. [PubMed] [DOI] |
| 4. | Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, Kiernan TW, Wollman J. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology. 1981;1:431-435. [PubMed] [DOI] |
| 5. | Altlparmak E, Koklu S, Yalinkilic M, Yuksel O, Cicek B, Kayacetin E, Sahin T. Viral and host causes of fatty liver in chronic hepatitis B. World J Gastroenterol. 2005;11:3056-3059. [PubMed] |
| 7. | 丁 效蕙, 赵 景民, 孙 艳玲, 周 光德, 潘 登, 杨 建法, 赵 雨来. 非酒精性脂肪性肝组织TNF-α、TGF-b1和Leptin的表达及意义. 解放军医学杂志. 2006;31:750-754. |
| 8. | Albisetti M, Braegger CP, Stallmach T, Willi UV, Nadal D. Hepatic steatosis: a frequent non-specific finding in HIV-infected children. Eur J Pediatr. 1999;158:971-974. [PubMed] [DOI] |
| 9. | Poles MA, Dieterich DT, Schwarz ED, Weinshel EH, Lew EA, Lew R, Scholes JV. Liver biopsy findings in 501 patients infected with human immunodeficiency virus (HIV). J Acquir Immune Defic Syndr Hum Retrovirol. 1996;11:170-177. [PubMed] |
| 10. | Trojan A, Kreuzer KA, Flury R, Schmid M, Schneider J, Schröder S. [Liver changes in AIDS. Retrospective analysis of 227 autopsies of HIV-positive patients]. Pathologe. 1998;19:194-200. [PubMed] [DOI] |
| 11. | Sutinen J, Häkkinen AM, Westerbacka J, Seppälä-Lindroos A, Vehkavaara S, Halavaara J, Järvinen A, Ristola M, Yki-Järvinen H. Increased fat accumulation in the liver in HIV-infected patients with antiretroviral therapy-associated lipodystrophy. AIDS. 2002;16:2183-2193. [PubMed] [DOI] |
| 12. | Gaslightwala I, Bini EJ. Impact of human immunodeficiency virus infection on the prevalence and severity of steatosis in patients with chronic hepatitis C virus infection. J Hepatol. 2006;44:1026-1032. [PubMed] [DOI] |
| 13. | Chitturi S, Farrell G, Frost L, Kriketos A, Lin R, Fung C, Liddle C, Samarasinghe D, George J. Serum leptin in NASH correlates with hepatic steatosis but not fibrosis: a manifestation of lipotoxicity? Hepatology. 2002;36:403-409. [PubMed] [DOI] |
| 14. | 戚 丽, 路 中. 非酒精性脂肪肝胰岛素抵抗及血清瘦素和脂联素水平的研究. 中国中西医结合消化杂志. 2006;14:167-170. |
| 15. | Sweeney G, Keen J, Somwar R, Konrad D, Garg R, Klip A. High leptin levels acutely inhibit insulin-stimulated glucose uptake without affecting glucose transporter 4 translocation in l6 rat skeletal muscle cells. Endocrinology. 2001;142:4806-4812. [PubMed] [DOI] |
| 16. | Nicolás JM, Fernández-Solà J, Fatjó F, Casamitjana R, Bataller R, Sacanella E, Tobías E, Badía E, Estruch R. Increased circulating leptin levels in chronic alcoholism. Alcohol Clin Exp Res. 2001;25:83-88. [PubMed] |