修回日期: 2008-08-06
接受日期: 2008-08-09
在线出版日期: 2008-09-08
目的: 探讨瘦素对肝细胞脂质变性的作用及其机制.
方法: 以离体人肝L-02细胞株制备肝细胞脂肪变性模型. 实验分为正常肝细胞组、人肝L-02细胞脂肪变性模型组、瘦素不同浓度处理Ⅰ、Ⅱ、Ⅲ组(浓度分别为10-8、10-7、10-6 mol/L)和阳性对照组. 孵育24 h后, 油红O染色观察细胞形态和细胞内脂滴的形成, 高效液相色谱法(HPLC)检测细胞内甘油三酯(TG)的含量, RT-PCR检测过氧化物酶体增殖物激活受体α(PPARα)及其目标基因肉碱转移酶-I(CPT-I) mRNA水平的表达.
结果: 模型组和瘦素Ⅰ组细胞质中有较多的脂滴形成, 而瘦素Ⅱ、Ⅲ组、正常组、阳性对照组胞质中脂滴较少. 瘦素浓度为10-8、10-7、10-6 mol/L时, 肝细胞中TG的含量为1.063±0.146、0.648±0.023、0.553±0.045 mmoL/g蛋白, 呈细胞依赖性减少. 瘦素Ⅱ、Ⅲ组与阳性对照组比较, PPARα的mRNA表达上升更为明显, 差别有统计学意义(P<0.01); 但瘦素Ⅰ组与阳性对照组之间无显著性差异. 模型组与正常组比较, CPT-I mRNA表达无明显改变, 经瘦素处理后, 较模型组相比, CPT-I mRNA表达明显上升(P<0.01).
结论: 瘦素能降低人肝L-02脂变细胞内TG的含量, 呈剂量依赖关系, 其降低细胞内TG作用可能与PPARα及其目标基因表达上调有关.
引文著录: 谭英征, 陈双华, 阳学风, 胡剑峰, 傅京力, 胡杨. 瘦素对脂变人肝细胞TG的含量及PPARα、CPT-I表达的影响. 世界华人消化杂志 2008; 16(25): 2809-2814
Revised: August 6, 2008
Accepted: August 9, 2008
Published online: September 8, 2008
AIM: To the influence of leptin on lipid degeneration of hepatocytes and its mechanism.
METHODS: The model of hepatocyte fatty degeneration was prepared using human L-02 liver cells. This experiment included the following groups: normal hepatocytes group, fatty degeneration model group, positive control group (treated with gemfibrozil), and leptin treatment groups I, II and III (using 10-8, 10-7 and 10-6 mol/L leptin, respectively). After 24-hour incubation, cell morphology and the formation of intracellular lipid droplets were observed by oil red O staining and the content of intracellular triglyceride (TG) was detected through high performance liquid chromatography (HPLC). Besides, the mRNA expression levels of peroxisome proliferator activated receptor α (PPARα) and its target gene carnitine palmitoyltransferase-I (CPT-I) were detected by semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: The intracellular lipid droplets were increased in the model group and leptin group I as compared with those in the other groups. The contents of intracellular TG were 1.063 ± 0.146, 0.648 ± 0.023 and 0.553 ± 0.045 mmol/g protein respectively when leptin was used at concentrations of 10-8, 10-7 and 10-6 mol/L. In comparison with that in the positive control group, the mRNA expression of PPARα was increased significantly in the leptin groups II or III (P < 0.01); but PPARα mRNA expression was not remarkably different between the leptin group I and the positive control group. There was no marked difference between the model group and the normal group in CPT-I mRNA expression, but it was significantly elevated after leptin treatments (P < 0.01).
CONCLUSION: Leptin decreases the content of TG in human L-02 hepatocytes with fatty degeneration in a dose-dependent manner, and its mechanism may be related to the up-regulation of PPARα and its target genes.
- Citation: Tan YZ, Chen SH, Yang XF, Hu JF, Fu JL, Hu Y. Effects of leptin on the content of triglyceride and the expression of peroxisome proliferator activated receptor α and carnitine palmitoyltransferase-I in human hepatocytes with fatty degeneration. Shijie Huaren Xiaohua Zazhi 2008; 16(25): 2809-2814
- URL: https://www.wjgnet.com/1009-3079/full/v16/i25/2809.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i25.2809
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是一种肝组织病理学改变与酒精性肝病相似但无过量饮酒史的临床综合征, 表现为肝细胞脂肪变性, 伴轻重不等的炎症和肝纤维化. 目前, NAFLD的发病率和早期诊断率逐年上升, 发病年龄年轻化, 已成为全球性的公共卫生问题[1-2]. 瘦素作为肥胖基因(obese gene, ob gene)编码的蛋白产物, 其主要功能是调节能量平衡, 参与肝脏糖原及脂肪的代谢调节, 对NAFLD的发生、发展具有一定作用. 本实验旨在观察瘦素对脂变人肝L-02细胞的甘油三酯(TG)含量、脂滴形成的影响, 并通过测定PPARα及其目的基因CPT-I mRNA表达, 初步探讨瘦素对肝细胞脂质变性的防治作用及其可能机制.
RPMI 1640为Gibco公司产品, 胎牛血清为杭州四季青公司产品, 无支原体级, 瘦素、胰蛋白酶、油红O试剂均为美国Sigma公司产品, MMLV第一链cDNA合成试剂盒、即用PCR扩增试剂盒为上海生物工程公司产品, PPARα、CPT-I、GAPDH引物均由上海生物工程公司合成, 人肝L-02细胞购自武汉细胞典藏中心, CO2培养箱为美国Fisher, Scientific 1168751H型, 倒置相差显微镜为日本产Nikon TMS, 美国产Beckman J6-HC型低温离心机, 美国Beckman公司LE-80型低温超速离心机, 美国Agilent1100LC高效液相色谱仪.
1.2.1 细胞培养: 人肝L-02细胞用含100 mL/L胎牛血清的RPMI 1640完全培养液, 于37 ℃、50 mL/L CO2条件下常规培养. 用胰蛋白酶消化后收集细胞并传代.
1.2.2 肝细胞脂肪变性模型的建立: 人肝L-02细胞达1×109个/L时用完全培养基重新悬浮, 并以1:3的比例传代, 取对数生长期细胞, 更换新鲜培养液后, 用含100 mL/L医用脂肪乳注射液和100 mL/L胎牛血清的RPMI 1640完全培养基孵育人肝L-02细胞24 h, 低倍镜下每单位面积见1/3以上的肝细胞脂肪变性, 细胞内出现脂滴或泡沫样物沉积, 则制成肝细胞脂肪变性模型(镜像比较造模前后细胞内的脂滴变化, 组织学上低倍镜下每单位面积见1/3以上的肝细胞脂肪变性和脂肪储积, 无其他明显组织学改变). 将所得细胞改置于含1 mL/L胎牛血清的RPMI 1640培养基中, 使其静止24 h后, 再按实验分组做相应的处理.
1.2.3 实验分组: 实验分为正常肝细胞组(培养48 h)、人肝L-02细胞脂肪变性模型组(造模24 h后, 再孵育24 h)、瘦素Ⅰ组(造模24 h后, 加瘦素使其终浓度为10-8 mol/L, 共同孵育24 h)、瘦素Ⅱ组(造模24 h后, 加瘦素使其终浓度为10-7 mol/L, 共同孵育24 h)、瘦素Ⅲ组(造模24 h后, 加瘦素使其终浓度为10-6 mol/L, 共同孵育24 h)、阳性对照组(造模24 h后, 加吉非罗齐使其终浓度为4 mmol/L, 共同孵育24 h). 实验重复5次, 结果取平均值.
1.2.4 油红O染色观察细胞内脂滴变化: 将细胞培养于放有无菌盖玻片的6孔培养板, 细胞被处理后, 用PBS洗3次, 6.53 mol/L异丙醇固定1 min, 油红O染色液染色10 min, 蒸馏水冲洗3次, 每次1 min, 苏木素染色5 min, 蒸馏水冲洗3次, 27.4 mmol/L盐酸分色及氨水返蓝, 明胶封片, HPIAS-1000型图像分析系统收集图像.
1.2.5 HPLC测量细胞内TG含量: 参照文献[3-4]方法, 细胞培养瓶中细胞达到109个/L时, 弃去培养基, 加2 mL生理盐水吹打细胞, 1500转离心5 min, 弃上清液, 加细胞裂解液200 μL, 3000 r/min 10 min, 取上清, 即得细胞样品. 取细胞裂解液10 μL进行BCA蛋白定量. 采用美国Agilent1100LC高效液相色谱仪, Hypersil ODS 4.6 mm×250 mm色谱柱, 柱温25 ℃, 检测波长230 nm, 流速0.7 mL/min, 流动相A为1%水的乙腈溶液, 流动相B为1%乙腈水溶液; 采用两相梯度洗脱, 梯度洗脱时间为0-12 min: 75%A-95%A; 12-18 min: 75%A. 以峰面积对甘油浓度绘制标准曲线, 并进行线性回归, 所得结果除以细胞蛋白定量值, 计算出细胞内游离甘油与总甘油的含量, 总甘油与游离甘油之差即为细胞内TG的量, 以mmol/g细胞蛋白为单位.
1.2.6 RT-PCR检测PPARα、CPT-I mRNA: 收集培养的细胞, 按TRIzol试剂的说明书, 分别提取总RNA, 用紫外分光光度计定量后, 调整RNA的浓度为0.2 g/L. RT-PCR的反应体系为: 两对引物各1.0 μL、10×Buffer 5 μL、25 mmol/L MgSO4 1 μL、10 mmol/L dNTP mix 0.5 μL、DNA聚合酶0.5 μL及逆转录酶0.5 μL, 用去离子水补至25 μL. PPARα上游引物5'-CAAGTGCCTTTCTGTCGG-3', 下游引物5'-TGTTTCCATCTTCGCTGT-3', 扩增产物长度374 bp, 反应条件为: 94 ℃ 1 min、50 ℃ 1 min、72 ℃ 1 min, 共30个循环, 于72 ℃再延伸10 min. CPT-I上游引物5'-TCCAGTTGGCTTATCGTGGTG-3', 下游引物5'-CGTTTCCAGAGTCCGATTGATTT-3', 扩增产物长度102 bp, 反应条件为: 94 ℃ 1 min、56 ℃ 1 min、72 ℃ 1 min, 共30个循环, 72 ℃再延伸10 min. GAPDH上游引物5'-TCACCATCTTCCAGGAGCGAG-3', 下游引物5'-TGTCGCTGTTGAAGTCAGAG-3', 扩增产物长度697 bp. 紫外灯下凝胶成像分析系统记录结果, 待测基因mRNA相对表达量以其扩增带吸光度值与相应内参照扩增带吸光度值的比值表示.
统计学处理 计量资料均以mean±SD表示, 先进行方差齐性检验, 如具有方差齐性, 采用方差分析, 多个样本均数间的两两比较采用SNK-q检验; 方差不齐则采用秩和检验. 全部资料均用SPSS13.0统计软件进行分析.
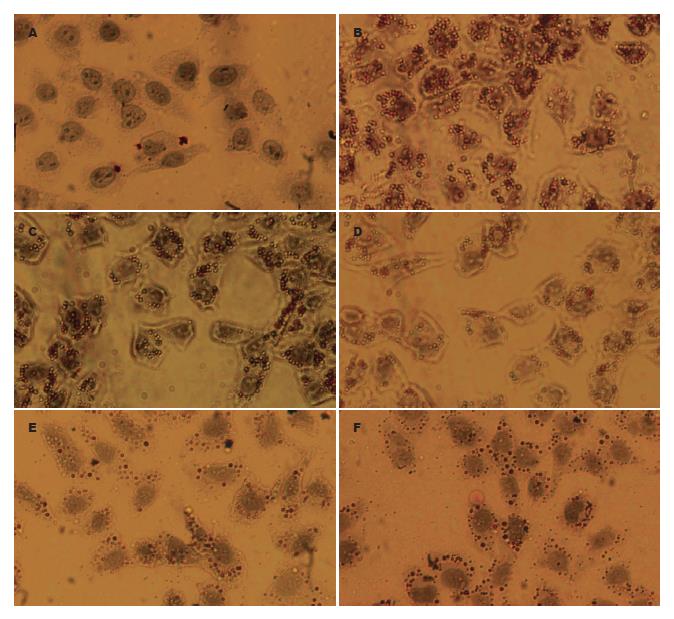
在显微镜下, 观察到模型组和瘦素10-8 mol/L组细胞质中有较多的脂滴形成, 而瘦素10-7 mol/L、10-6 mol/L组、正常组、阳性对照组胞质中脂滴较少, 说明瘦素10-7 mol/L、10-6 mol/L组瘦素对细胞内的脂肪沉积有一定的抑制作用, 而瘦素10-8 mol/L组的作用不明显(图1).
不同浓度的瘦素(10-8 mol/L, 10-7 mol/L, 10-6 mol/L)分别加入模型组中, 处理24 h后高效液相色谱分析结果发现, 瘦素在浓度为10-8 mol/L到10-6 mol/L范围内, 肝细胞中TG的含量呈细胞依赖性减少(表1).
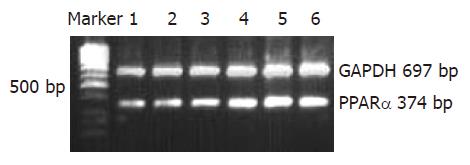
为研究瘦素对细胞PPARα在转录水平的影响, 我们采用了半定量RT-PCR法检测了正常肝细胞、模型组肝细胞及不同浓度瘦素处理组肝细胞, 结果显示: 模型组与正常组比较, PPARα的mRNA表达无明显差异, 经瘦素处理后, 与模型组相比, PPARα的mRNA表达明显上升, 且呈浓度依赖性, 有统计学意义(图2, P<0.01). 瘦素(10-7 mol/L, 10-6 mol/L)处理组与阳性对照组比较, PPARα的mRNA表达上升更为明显, 差别有统计学意义(P<0.01); 但瘦素10-8 mol/L处理组与阳性对照组之间无显著性差异.
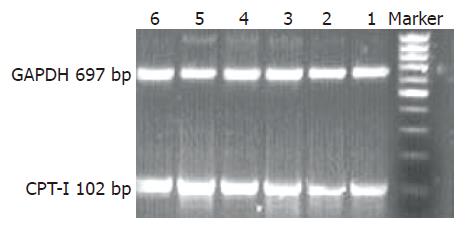
为进一步研究瘦素降低细胞内TG与CPT-I mRNA水平上表达的关系. 我们采用了半定量RT-PCR法检测了人肝L-02细胞的CPT-I的mRNA水平. 结果显示, 模型组与正常组比较, CPT-I mRNA表达无明显改变, 经瘦素处理后, 较模型组相比, CPT-I mRNA表达明显上升, 有统计学意义(图3, P<0.01).
瘦素是人类肥胖基因(obese gene, ob gene)编码的一个由167个氨基酸组成的蛋白质, 具有广泛的生物学效应. 瘦素作为一种脂源性"脂肪调节激素", 是调节能量平衡的重要因子, 研究发现瘦素的缺乏及瘦素受体基因敲除可导致高胰岛素血症、脂肪肝的形成[5]; Shimomura et al[6]通过先天性脂肪营养不良(CGL)大鼠模型观察到了瘦素的缺乏可引起胰岛素抵抗, 从而造成高胰岛素血症、高血糖及肥胖, 促进脂肪肝的发生; 给CGL大鼠连续滴注重组瘦素, 可以改善胰岛素抵抗, 逆转肝脏脂肪沉积. 肝细胞有大量瘦素受体表达, 瘦素的作用不仅限于调节体内能量代谢和脂肪沉积, 还参与了多种肝病的发生发展.
本研究用重组人瘦素作为处理因素, 处理细胞后, 油红O染色结果显示: 正常组细胞形态正常, 无明显脂滴形成; 模型组细胞质内可见大量红色的小泡性脂滴; 瘦素(10-8 、10-7、10-6 mol/L)处理组及阳性对照组细胞质内只有少量红色的小泡性脂滴; 高效液相色谱分析结果发现: 正常组与模型组比较, 细胞内TG含量由0.417±0.045 mmol/g蛋白上升至1.612±0.104 mmol/g蛋白, 明显增高, 差别有统计学意义(P<0.01); 瘦素(10-8、10-7、10-6 mol/L)处理组及阳性对照组细胞内TG含量分别为1.063±0.146 mmol/g蛋白, 0.648±0.023 mmol/g蛋白和0.553±0.045 mmol/g蛋白, 0.865±0.143 mmol/g蛋白, 与模型组比较均明显降低, 差别有统计学意义(P<0.01), 说明细胞内TG含量随瘦素剂量的增高而降低. 瘦素(10-7 mol/L, 10-6 mol/L)处理组与瘦素(10-8 mol/L)处理组及阳性对照组比较, 前两者细胞内TG含量下降较后两者更为明显, 差别有统计学意义(P<0.01); 说明增加瘦素的剂量可增强降细胞内TG的效果, 当其剂量达到一定时, 其降TG的效果可高于阳性对照组, 但瘦素处理组10-7 mol/L与10-6 mol/L之间无显著性差异. 说明外源性瘦素可直接作用于肝细胞, 能降低肝细胞内TG含量, 减轻肝细胞脂肪变性, 其作用呈剂量依赖性.
PPARα由468个氨基酸残基组成, 位于鼠的15号染色体, 人的22号染色体[7]. 他高表达于具有丰富线粒体和β氧化活性的组织如肝、肾皮质、肠黏膜和心脏, 而在一些其他组织也发现了PPARα的低水平表达. 近年研究发现PPARα可通过调节编码肝脂肪酸结合蛋白、载脂蛋白Al等基因的转录、活化, 影响脂肪酸的摄取、结合及脂质转运[8], PPARα还可通过与活化蛋白-1(activator protein-1, AP-1), 核因子-κB(nuclear factor-kappa B, NF-κB)相互作用, 抑制炎性因子的表达, 阻止泡沫细胞的形成[9], 当PPARα表达受抑会影响肝细胞线粒体和过氧化物酶体的氧化、减少脂肪组织消耗, 引起肝细胞脂肪变性、坏死和炎性细胞浸润[10], 越来越多的证据表明PPARα具有调节脂肪代谢和调节炎症、免疫以及细胞分化等作用, 从而参与脂肪性肝病的发病机制, 越来越多的证据表明PPARα是代谢综合征的一个重要调节因子.
PPARα主要在肝脏表达, 被配体激活后, 可引起乙酰辅酶A合酶(acetyl CoA synthetase, ACS)、肉碱转移酶I(CPT-I)、脂蛋白脂酶(lipoprotein lipase, LPL)的转录增强[11], 其中CPT-I是长链脂肪酸进入线粒体进行β氧化的第1个限速酶, 表达水平与体脂含量相关, 表达水平升高有助于增加脂肪酸分解, 降低体脂肪含量[12], 具有对抗肝脂肪变、延缓脂肪肝形成的作用; 本实验中我们采用了半定量RT-PCR法检测了人肝L-02细胞的PPARα及目标基因CPT-I的mRNA表达, 结果显示肝细胞在高脂环境造模过程中, PPARα及目标基因CPT-I的mRNA呈弱表达, 当予以瘦素干预后, 较模型组相比, RT-PCR显示PPARα及目标基因CPT-I的mRNA表达增强, 有统计学意义(P<0.01), 且与瘦素呈剂量依赖性关系. CPT-I基因是在转录水平上受到调控, PCR扩增肝脏组织CPT-I基因的5'-端证明了这一片段具有转录活性, 而且该区域存在有PPARα的反应元件, 他的表达受脂肪酸和过氧化物酶体增殖剂的调节[13]. CPT-I是脂酸α氧化的限速酶, 其表达增加, 可增强脂肪酸的氧化代谢, 可见瘦素能促进PPARα及目标基因CPT-I的mRNA的表达, 起对抗肝脂肪变、延缓脂肪肝形成的作用. 本实验通过高效液相色谱分析也显示瘦素处理后脂肪变肝细胞内TG量明显减少. 本课题组其他成员观察了瘦素能上调肝细胞内微粒体TG转移蛋白(microsmal triglyceride transfer protein, MTP)mRNA的表达, MTP对VLDL自肝细胞中组装和分泌是必须的, 能加速TG排泄及极低密度脂蛋白的合成. 因此, 瘦素可能是通过多个途径影响肝细胞TG代谢, 减轻肝细胞脂肪变性.
非酒精性脂肪性肝病(NAFLD)是指除酒精和其他明确的损肝因素所致的, 以弥漫性肝细胞脂肪变为主要特征的临床病理综合征. NAFLD的发病率和早期诊断率逐年上升, 该病是胃肠病中最常见的疾病之一, 发病年龄年轻化, 已成为全球性的公共卫生问题, 但其发病原因和发病机制至今尚不完全明了.
吴君, 主任医师, 贵州省贵阳市贵阳医学院附属医院感染科
瘦素作为肥胖基因编码的蛋白产物, 其能调节能量平衡, 参与肝脏糖原及脂肪的代谢调节, 对NAFLD的发生、发展具有很大作用. 从而瘦素的研究成为热门课题, 而瘦素的作用机制是其中的研究热点.
目前的研究认为, NAFLD的发生肝脏脂质合成与排泄失衡, 引起肝细胞内甘油三酯(TG)堆积, 最终导致中性脂肪在肝细胞内过度沉积而形成脂肪肝.
本文通过研究人肝L-02细胞的甘油三酯含量和PPARα及其目的基因CPT-I mRNA表达变化的关系, 初步探讨瘦素对肝细胞脂质变性的防治作用.
人肝L-02细胞的甘油三酯含量减少与PPARα及其目的基因CPT-I mRNA表达变化有关, 为探讨瘦素影响肝细胞甘油三酯代谢, 改善肝细胞脂肪变性提供了新的依据.
代谢综合征: 葡萄糖调节受损或糖尿病, 和(或)胰岛素抵抗, 并伴有另外两项或两项以上的成分, 如高血压、高甘油三酯血症和(或)低高密度脂蛋白胆固醇血症、中心性肥胖、微量白蛋白尿.
本文的科学性、可读性均能较好的反映我国或国际胃肠病学临床和基础研究的先进水平, 具有一定的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, Grundy SM, Hobbs HH. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004;40:1387-1395. [PubMed] [DOI] |
| 2. | Chitturi S, Farrell GC, George J. Non-alcoholic steatohepatitis in the Asia-Pacific region: future shock? J Gastroenterol Hepatol. 2004;19:368-374. [PubMed] [DOI] |
| 3. | Mingrone G, Rosa G, Greco AV, Manco M, Vega N, Hesselink MK, Castagneto M, Schrauwen P, Vidal H. Decreased uncoupling protein expression and intramyocytic triglyceride depletion in formerly obese subjects. Obes Res. 2003;11:632-640. [PubMed] [DOI] |
| 4. | 董 莉娜, 苏 耀东, 沈 玉桓, 朱 立岳. 反相高效液相色谱法测定人血清中甘油三酯含量. 同济大学学报(医学版). 2004;25:104-107. |
| 5. | Koteish A, Diehl AM. Animal models of steatosis. Semin Liver Dis. 2001;21:89-104. [PubMed] [DOI] |
| 6. | Shimomura I, Hammer RE, Ikemoto S, Brown MS, Goldstein JL. Leptin reverses insulin resistance and diabetes mellitus in mice with congenital lipodystrophy. Nature. 1999;401:73-76. [PubMed] [DOI] |
| 7. | Desvergne B, Wahli W. Peroxisome proliferator-activated receptors: nuclear control of metabolism. Endocr Rev. 1999;20:649-688. [PubMed] [DOI] |
| 8. | Mano H, Kimura C, Fujisawa Y, Kameda T, Watanabe-Mano M, Kaneko H, Kaneda T, Hakeda Y, Kumegawa M. Cloning and function of rabbit peroxisome proliferator-activated receptor delta/beta in mature osteoclasts. J Biol Chem. 2000;275:8126-8132. [PubMed] [DOI] |
| 9. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] [DOI] |
| 10. | Neve BP, Fruchart JC, Staels B. Role of the peroxisome proliferator-activated receptors (PPAR) in atherosclerosis. Biochem Pharmacol. 2000;60:1245-1250. [PubMed] [DOI] |
| 11. | Rocchi S, Auwerx J. Peroxisome proliferator-activated receptor gamma, the ultimate liaison between fat and transcription. Br J Nutr. 2000;84 Suppl 2:S223-S227. [PubMed] [DOI] |
| 12. | 张 芳林. 肉碱棕榈酰转移酶-Ⅰ的研究进展. 国外医学·内分泌学分册. 2002;22:166-170. |
| 13. | Mascaró C, Acosta E, Ortiz JA, Marrero PF, Hegardt FG, Haro D. Control of human muscle-type carnitine palmitoyltransferase I gene transcription by peroxisome proliferator-activated receptor. J Biol Chem. 1998;273:8560-8563. [PubMed] [DOI] |