修回日期: 2008-07-26
接受日期: 2008-07-29
在线出版日期: 2008-08-18
目的: 探讨靶向结缔组织生长因子(CTGF)的锤头核酶抑制TGF-β1作用下人肝星状细胞(HSC)Ⅰ型胶原(Col I)合成及其细胞周期进程的作用.
方法: 构建含有人CTGF锤头核酶cDNA序列的重组质粒pTriCTGF-Rz. 将空质粒pTriEx2和重组质粒pTriCTGF-Rz分别转染人肝星状细胞系(LX-2)细胞. 细胞分为4组: pTriEx2转染组, pTriEx2转染加TGF-β1组, pTriCTGF-Rz转染加TGF-β1组和pTriCTGF-Rz转染组. 采用半定量RT-PCR测定LX-2细胞CTGF mRNA和Col I mRNA转录水平, 采用ELISA和流式细胞仪分别用于LX-2细胞Col I分泌功能和LX-2细胞周期进程的检测.
结果: TGF-β1可明显提高LX-2细胞CTGF mRNA和Col I mRNA的转录水平及分泌Col I蛋白功能(t = 11.14, 14.36, 7.17, 均P<0.01); pTriCTGF-Rz转染LX-2细胞既能降低基础CTGF mRNA 和Col I mRNA水平及Col I蛋白水平(t = 2.86, 3.06, 2.97, 均P<0.05), 又能部分拮抗TGF-β1诱导LX-2细胞CTGF mRNA和Col I mRNA转录和Col I蛋白分泌的增加(t = 2.99, 3.09, 3.02, 均P<0.05). TGF-β1对LX-2细胞周期进程无影响.
结论: CTGF是TGF-β1作用下人肝星状细胞合成Col I的下游介导者, TGF-β1对HSC周期进程无影响, 靶向CTGF有可能成为肝纤维化基因治疗的新靶点.
引文著录: 齐晓艳, 高润平, 王淑华, 张瑞娟, 包万国, 金清龙, 辛桂杰, 杨永广. 靶向CTGF锤头核酶对TGF-β1作用下人肝星状细胞合成Ⅰ型胶原的作用. 世界华人消化杂志 2008; 16(23): 2587-2591
Revised: July 26, 2008
Accepted: July 29, 2008
Published online: August 18, 2008
AIM: To observe the effect of hammerhead ribozyme targeting connective tissue growth factor (CTGF) on TGF-β1-induced collagen I synthesis and cell cycle progression in human hepatic stellate cells (HSCs).
METHODS: CTGF hammerhead ribozyme cDNA plus two self-cleaving sequences were inserted into pTriEx2 to construct recombinant vector pTriCTGF-Rz. Both vectors were transfected into human hepatic stellate cell line (LX-2) individually, which was then stimulated by addition of TGF-β1 to the culture media. Semi-quantitative reverse-transcription polymerase chain reaction was used to determine the transcription of CTGF mRNA and collagen I mRNA in LX-2 cells. Collagen I secretion and cell cycle progression were measured by enzyme-linked immunosorbent assay (ELISA) and flow cytometry, respectively.
RESULTS: TGF-β1 obviously increased the transcription of CTGF mRNA and collagen I mRNA and secretion of collagen I protein in pTriEx2-transfected LX-2 cells (t = 11.14, 14.36, 7.17; all P < 0.01). pTriCTGF-Rz-transfected LX-2 cells showed a decrease in the basic transcription of CTGF mRNA and collagen I mRNA as well as in the secretion of collagen I protein (t = 2.86, 3.06, 2.97; all P < 0.05). Furthermore, TGF-β1-induced increase of CTGF mRNA and collagen I mRNA transcription as well as collagen I secretion were partially inhibited in pTriCTGF-Rz-transfected LX-2 cells (t = 2.99, 3.09, 3.02; all P < 0.05). TGF-β1 had no effect on LX-2 cell cycle progression.
CONCLUSION: CTGF is an essential downstream mediator for TGF-β1-induced collagen I production in human HSCs, but TGF-β1 has no effect on CTGF-mediated cycle progression of HSCs. CTGF may become a new target of gene therapy for liver fibrosis.
- Citation: Qi XY, Gao RP, Wang SH, Zhang RJ, Bao WG, Jin QL, Xin GJ, Yang YG. Inhibitory effect of hammerhead ribozyme targeting connective tissue growth factor on TGF-β1-induced collagen I synthesis in human hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2008; 16(23): 2587-2591
- URL: https://www.wjgnet.com/1009-3079/full/v16/i23/2587.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i23.2587
肝星状细胞(hepatic stellate cell, HSC)被认为是多种原因引起肝纤维化发生、发展过程中起着关键作用的细胞. 一些细胞因子作用于HSC的表面受体、通过信号传导分子及转录因子在转录、转录后水平诱导HSC的基因表达、参与HSC介导肝纤维化的发生[1-4]. TGF-β1可刺激HSC合成包括Ⅰ型胶原(Collagen I, Col I)在内的细胞外基质(extracellular matrixc, ECM), 是非常重要的纤维源性细胞因子[2,4]. 结缔组织生长因子(connective tissue growth factor, CTGF)和TGF-β1共同承担诱导肝纤维化发生的功能. TGF-β1通过调控CTGF启动子活性诱导CTGF的产生. CTGF是TGF-β1诱导大鼠HSC、成骨细胞合成ECM的下游介导者[5-6]. 因此, CTGF可作为肝纤维化基因治疗的一个新靶点. 本研究将靶向人CTGF的锤头核酶cDNA序列插入pTriEx2质粒, 转染人肝星状细胞系(LX-2)细胞, 观察锤头核酶对TGF-β1作用下LX-2细胞Col I合成及细胞周期进程的影响.
DMEM培养基(Gibco BRL公司), 胎牛血清(Hyclone公司), 人TGF-β1(Peprotech公司). 肝星状细胞系LX-2细胞由Friedman教授(美国)与徐列明教授(上海中医药大学肝病研究所)惠赠. pTriEx2质粒(Novagen公司), XhoⅠ、NcoⅠ(Toyobo公司), LipofectamineTM2000、TRIzol(Invitrogen公司), AMV、TagDNA聚合酶(Promega公司), 人Col I ELISA检测试剂盒(美国Unionhonest公司). CO2孵箱(德国 BB16/BB5060), PCR仪(德国Biometra, UNOⅡ), 酶标仪(美国BLO-RAD), 流式细胞仪(美国BD Bioscience公司).
1.2.1 锤头核酶的设计与重组质粒的构建: 采用中科院上海生化所陈农安研究员核酶设计软件设计出针对人CTGF mRNA(NCBI, gi: 98986335)第896碱基切割位点CUA的锤头核酶cDNA序列, 正义链: 5'-CTTCTCCTGATGAGTCCGTGAGGACGAAAGCCTG-3', 反义链: 5'-CAGGCTTTCGTCCTCACGGACTCATCAGGAGAAG-3'; 在5'和3'端分别连接一自剪酶cDNA序列. 全部序列由上海生工生物工程技术服务有限公司合成, 并插入pBluescriptⅡSK9(-)克隆载体上. 采用XhoⅠ和NcoⅠ分别对上述克隆载体及pTriEx2质粒进行双酶切, 通过胶回收、T4连接酶作用及测序, 成功构建含有针对CTGF mRNA的锤头核酶和两个自剪酶cDNA序列的pTriCTGF-Rz重组质粒.
1.2.2 LX-2细胞培养及质粒转染: LX-2细胞采用含100 mL/L胎牛血清(FBS)的DMEM(含青霉素和链霉素各100 kU/L), 于37℃, 50 mL/L CO2孵箱培养. 生长良好的LX-2细胞用2.5 g/L胰酶消化, 无钙镁离子hank氏液洗涤, 25 mL/L FBS DMEM培养基悬浮, 调节细胞浓度为1×108/L, 分别置于100 mm培养皿经造模型后用于CTGF mRNA和Col I mRNA检测及细胞周期进程检测或置于12孔培养板用于LX-2细胞Col I分泌测定. LX-2细胞首先于25 mL/L FBS DMEM培养基培养24 h, 改用1 mL/L FBS DMEM培养24 h, 然后用LipofectamineTM2000进行质粒转染, 细胞分为4组: (1)pTriEx2转染组, (2)pTriEx2转染加TGF-β1组, (3)pTriCTGF-Rz转染加TGF-β1组, (4) pTriCTGF-Rz转染组; 各组质粒转染4 h后, 换用1 mL/L FBS DMEM培养液, 于(2)、(4)组分别加入TGF-β1 20 μg/L, 各组继续培养24 h, 用于各种检测.
1.2.3 CTGF mRNA与Col I: mRNA转录水平测定: 收集上述LX-2模型细胞提取总RNA, 通过半定量PCR筛选出最佳模板RNA含量为0.8 μg, 各组均取0.8 mg RNA进行逆转录, 然后取5 μL cDNA分别针对CTGF、Ⅰ型胶原和b-actin进行PCR扩增; 人CTGF上游引物: 5'-CCTGGTCCAGACCACAGAGT-3'; 下游引物: 5'-ATGTCTTCATGCTGGTGCAG-3', 扩增产物239 bp. 人Ⅰ型胶原上游引物: 5'-CCTCAAGGGCTCCAACGAG-3'; 下游引物: 5'-TCAATCACTGTCTTGCCCCA-3', 扩增产物117 bp. 人b-actin上游引物: 5'-GTCCTCTCCCAAGTCCACAC-3'; 下游引物: 5'-GGGAGACCAAAAGCCTTCAT-3', 扩增产物187 bp. PCR循环参数: 94℃ 30 s, 58℃ 30 s, 72℃ 1 min, 32个循环. PCR产物经10 g/L琼脂糖电泳, 使用Gelpro3.2软件与同组b-actin进行灰度分析.
1.2.4 LX-2细胞分泌Col: I功能测定: 按上述方法制造LX-2细胞模型后, 收取培养上清, 通过ELISA测定LX-2分泌Col I的功能, 具体操作按ELISA试剂盒说明书进行.
1.2.5 LX-2细胞周期进程检测: 收集上述方法制造的LX-2模型细胞, 每组含1×106个细胞, 经洗涤、750 mL/L乙醇固定、PI染色, 采用流式细胞仪于激发波长488 nm条件下, 测定细胞内DNA含量, 通过流式细胞仪配套软件分析各组处于不同细胞增殖周期的百分比.
统计学处理 用SPSS11.0统计软件中的t检验进行统计分析, P<0.05为差异有显著性.
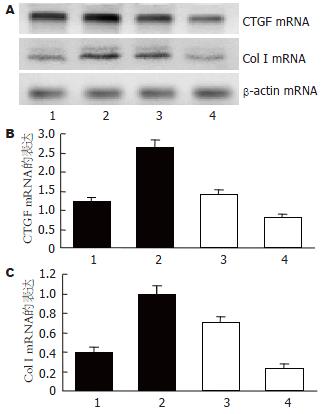
CTGF mRNA的作用 TGF-β1作用下pTriEx2空质粒转染LX-2细胞CTGF mRNA转录水平明显高于pTriEx2空质粒转染LX-2细胞(t = 11.14, P<0.01); pTriCTGF-Rz可抑制LX-2细胞CTGF mRNA基础转录水平和部分抑制TGF-β1诱导CTGF mRNA的转录水平(t值分别为2.86和2.99, P值均<0.05, 图1A-B).
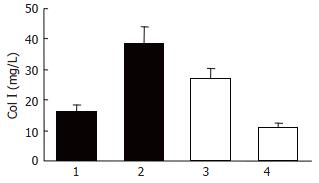
pTriEx2空质粒转染LX-2细胞具有基础水平Col I mRNA转录和Col I蛋白分泌功能, TGF-β1可明显提高pTriEx2转染LX-2细胞Col I mRNA转录水平和Col I蛋白分泌功能(t值分别为14.36和7.17, P值均<0.01); pTriCTGF-Rz可降低LX-2细胞Col I mRNA和Col I蛋白的基础水平(t值分别为3.06和2.97, P值均<0.05)和部分抑制TGF-β1刺激下LX-2细胞Col I mRNA转录和Col I蛋白分泌(t值分别为3.09和3.02, P值均<0.05, 图1A, C, 图2).
流式细胞仪检测结果显示: pTriEx2空质粒转染LX-2细胞加TGF-β1作用其G0-G1期, S期及G2M期细胞百分比与空质粒转染组是一致的, 提示TGF-β1无促进LX-2细胞周期进程作用. pTriCTGF-Rz转染组LX-2细胞是否加TGF-β1均显示G0-G1期细胞数增多, 反映DNA合成的S期细胞减少(表1).
| 分组 | G0-G1期 | S期 | G2M期 |
| 空质粒转染组 | 60.64 | 27.53 | 11.83 |
| 空质粒加TGF-b1组 | 58.32 | 28.72 | 12.96 |
| 重组质粒加TGF-b1 | 65.27 | 24.21 | 10.52 |
| 重组质粒转染组 | 80.45 | 10.83 | 8.27 |
肝纤维化是各种慢性肝脏疾病导致严重后果的必然途径. 近年来, 随着对肝纤维化发病机制的深入研究, 明确提出肝纤维化是可逆转的观点, 肝纤维化的有效治疗可使硬化肝脏重构、肝功能改善及门脉高压得以控制[1-2,4]. 在肝纤维化的发生、发展过程中, HSC从含有维生素A脂滴的静止状态转化为另一种"激活"的肌成纤维样细胞. 激活的HSC可表达a-平滑肌动蛋白、具有高增殖活性及合成肝脏绝大部分ECM的特征[7]. 因此, 激活的HSC是肝纤维化发生的关键细胞. 本研究使用的人肝星状细胞系LX-2细胞具有在无血清条件下存活和高转染特性[8]. 因此, LX-2细胞比较适合于研究靶向细胞因子的肝纤维化基因治疗.
人类CTGF基因定位于6号染色体长臂上(6q23.1), 含5个外显子和4个内含子. 在人CTGF基因5'-端的启动子含有TGF-b反应元件是TGF-b在转录水平调节CTGF表达的重要部位. CTGF是一种促纤维化的细胞因子, 其过度表达参与多种器官组织的纤维化[9]. 免疫组织化学研究显示, CTGF主要分布在慢性丙型肝病肝组织纤维间隔、窦周间隙及肝硬化结节周围纤维条带的激活HSC[10], 丙型肝炎肝硬化患者肝脏CTGF mRNA较健康人升高6.5倍, 与TGF-β1 mRNA升高呈一致性[11]. 慢性丙型肝炎和酒精性肝病患者血清CTGF的升高可直接反应其肝纤维化的进展性[12]. 这些研究结果说明CTGF与人类肝纤维化有关.
TGF-b家族含有3个密切相关的异构体(TGF-β1, TGF-β1, TGF-b3). TGF-β1是肝纤维化发生学重要的细胞因子[2,13]. CTGF和TGF-β1共同承担诱导肝纤维化发生的功能: 首先, TGF-β1通过调控CTGF启动子内TGF-β1反应元件和Smad结合元件诱导CTGF的产生[5,14]; CTGF是TGF-β1诱导大鼠HSC、胰星状细胞、成骨细胞合成ECM的下游介导者[5-6,15-16]; TGF-β1在组织纤维化呈现早期表达, 而CTGF持续表达则是纤维化病变缓慢进展的重要因素; CTGF通过增加TGF-β1纤维原性和抑制BMP-7抗纤维化作用进一步加强CTGF致纤维化作用[2]. 由于CTGF主要限于结缔组织内间质细胞表达, 靶向CTGF的抗肝纤维化治疗不影响TGF-b抗炎和调节免疫功能[17]. 因此, CTGF是一个较阻断TGF-b更有效和特异的靶点.
Kozue Uchio采用CTGF反义寡核苷酸使小鼠肝内部分CTGF mRNA受到抑制, 初步显示其具有治疗实验性小鼠肝纤维化的作用[18], 最近, 有人采用siRNA诱导大鼠肝纤维化肝组织CTGF的基因沉默, 部分地减少CTGF引起的HSC激活, 下调CTGF和TGF-β1基因表达, 由此发挥抗纤维化作用[19]. 核酶既能发挥反义RNA阻断靶RNA的作用, 又能以酶的高效催化作用, 在RNA链GUX或CUX的3'端将其裂解破坏. 核酶裂解靶RNA后自动解离, 参与新的靶RNA切割, 这样循环往复. 因此, 核酶治疗较反义寡核苷酸更为有效. 本研究采用核酶设计软件成功的设计并构建了含有针对人类CTGF mRNA 986位点锤头核酶cDNA和两个自剪酶序列的pTriCTGF-Rz重组质粒, 将其转染LX-2细胞, 结果显示: 靶向CTGF的锤头核酶能有效切割LX-2细胞CTGF mRNA, 进而抑制TGF-β1诱导LX-2细胞Col I mRNA转录和蛋白的分泌. 本研究结果表明: CTGF是TGF-β1诱导人肝星状细胞合成Col I的下游介导者, 靶向CTGF的锤头核酶有可能成为肝纤维化基因治疗的新途径.
肝纤维化是继发于多种慢性致病原因引起以肝内HSC激活和ECM过多产生为病理特征. 近年来研究表明: 细胞因子TGF-β1与CTGF共同承担诱导多种脏器纤维化的发生. CTGF作为TGF-β1的下游介导者作用于大鼠HSC表面受体, 通过信号传导在转录、转录后水平诱导HSC合成Ⅰ型胶原. 因此, CTGF有可能成为肝纤维化基因治疗的一个新靶点.
张绪清, 副教授, 中国人民解放军第三军医大学附属西南医院全军感染病研究所; 阴赪宏, 研究员, 首都医科大学附属北京友谊医院感染暨急救医学科
大鼠体内、外的研究显示: 静止HSC激活是肝纤维化发生的关键环节, CTGF参与HSC激活, 并且在HSC介导肝纤维化的过程中发挥重要的作用. 近年来已有在啮齿类动物以HSC为靶细胞、CTGF为治疗靶点进行基因治疗的报道, 然而, 靶向CTGF的基因治疗抑制人类HSC介导肝纤维化的作用尚不完全清楚.
2004年, Kozue Uchio采用CTGF反义寡核苷酸使小鼠肝内部分CTGF mRNA受到抑制, 初步显示其具有治疗实验性小鼠肝纤维化的作用. 2007年, George采用 siRNA诱导大鼠肝纤维化肝组织CTGF基因沉默, 使CTGF和TGF-β1基因表达部分下调, HSC激活也受到抑制, 减轻了纤维化的程度.
核酶既能发挥反义RNA阻断靶RNA的作用, 又能以酶的高效催化活性裂解破坏靶RNA, 而且核酶可重复利用. 因此, 核酶治疗较反义寡核苷酸更为有效. 本文旨在阐明靶向CTGF锤头核酶对人HSC系LX-2细胞合成Ⅰ型胶原及细胞周期进程的影响, 为人类肝纤维化基因治疗提供理论依据.
肝纤维化基因治疗可明显抑制或逆转动物肝纤维化甚至肝硬化进程, 有良好的应用前景. 但基因治疗从动物模型到临床实验, 需经过相当长的时间以证实其临床效果及可能出现的不良反应. 本研究在人HSC系LX-2细胞水平上进行了靶向CTGF锤头核酶抑制肝纤维化的基因治疗, 对人类肝纤维化的治疗具有实际推动作用.
本研究设计合理, 方法科学, 结论较为准确, 为肝纤维化的防治提供新的靶点提供实验依据, 学术价值较好.
编辑: 李军亮 电编:郭海丽
| 1. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 2. | Gressner OA, Weiskirchen R, Gressner AM. Evolving concepts of liver fibrogenesis provide new diagnostic and therapeutic options. Comp Hepatol. 2007;6:7. [PubMed] [DOI] |
| 3. | Mann DA, Mann J. Epigenetic regulation of hepatic stellate cell activation. J Gastroenterol Hepatol. 2008;23 Suppl 1:S108-S111. [PubMed] [DOI] |
| 4. | Moreira RK. Hepatic stellate cells and liver fibrosis. Arch Pathol Lab Med. 2007;131:1728-1734. [PubMed] |
| 5. | Gao R, Ball DK, Perbal B, Brigstock DR. Connective tissue growth factor induces c-fos gene activation and cell proliferation through p44/42 MAP kinase in primary rat hepatic stellate cells. J Hepatol. 2004;40:431-438. [PubMed] [DOI] |
| 6. | Arnott JA, Nuglozeh E, Rico MC, Arango-Hisijara I, Odgren PR, Safadi FF, Popoff SN. Connective tissue growth factor (CTGF/CCN2) is a downstream mediator for TGF-beta1-induced extracellular matrix production in osteoblasts. J Cell Physiol. 2007;210:843-852. [PubMed] [DOI] |
| 7. | Friedman SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol Rev. 2008;88:125-172. [PubMed] [DOI] |
| 8. | Xu L, Hui AY, Albanis E, Arthur MJ, O'Byrne SM, Blaner WS, Mukherjee P, Friedman SL, Eng FJ. Human hepatic stellate cell lines, LX-1 and LX-2: new tools for analysis of hepatic fibrosis. Gut. 2005;54:142-151. [PubMed] [DOI] |
| 9. | de Winter P, Leoni P, Abraham D. Connective tissue growth factor: structure-function relationships of a mosaic, multifunctional protein. Growth Factors. 2008;26:80-91. [PubMed] [DOI] |
| 10. | Paradis V, Dargere D, Vidaud M, De Gouville AC, Huet S, Martinez V, Gauthier JM, Ba N, Sobesky R, Ratziu V. Expression of connective tissue growth factor in experimental rat and human liver fibrosis. Hepatology. 1999;30:968-976. [PubMed] [DOI] |
| 11. | Abou-Shady M, Friess H, Zimmermann A, di Mola FF, Guo XZ, Baer HU, Bachler MW. Connective tissue growth factor in human liver cirrhosis. Liver. 2000;20:296-304. [PubMed] [DOI] |
| 12. | Gressner AM, Yagmur E, Lahme B, Gressner O, Stanzel S. Connective tissue growth factor in serum as a new candidate test for assessment of hepatic fibrosis. Clin Chem. 2006;52:1815-1817. [PubMed] [DOI] |
| 13. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 14. | Rachfal AW, Brigstock DR. Structural and functional properties of CCN proteins. Vitam Horm. 2005;70:69-103. [PubMed] [DOI] |
| 15. | Yuhua Z, Wanhua R, Chenggang S, Jun S, Yanjun W, Chunqing Z. Disruption of connective tissue growth factor by short hairpin RNA inhibits collagen synthesis and extracellular matrix secretion in hepatic stellate cells. Liver Int. 2008;28:632-639. [PubMed] |
| 16. | Gao R, Brigstock DR. Connective tissue growth factor (CCN2) in rat pancreatic stellate cell function: integrin alpha5beta1 as a novel CCN2 receptor. Gastroenterology. 2005;129:1019-1030. [PubMed] [DOI] |
| 17. | Qi W, Chen X, Poronnik P, Pollock CA. Transforming growth factor-beta/connective tissue growth factor axis in the kidney. Int J Biochem Cell Biol. 2008;40:9-13. [PubMed] [DOI] |
| 18. | Uchio K, Graham M, Dean NM, Rosenbaum J, Desmouliore A. Down-regulation of connective tissue growth factor and type I collagen mRNA expression by connective tissue growth factor antisense oligonucleotide during experimental liver fibrosis. Wound Repair Regen. 2004;12:60-66. [PubMed] |