修回日期: 2008-06-15
接受日期: 2008-06-17
在线出版日期: 2008-08-08
目的: 构建hHGF真核表达载体, 并在HepG2细胞中表达, 筛选其对HepG2细胞的差异表达基因.
方法: 构建pcDNA3.1(-)-hHGF载体, 测序鉴定; 转染HepG2细胞后蛋白免疫印迹检测; 运用基因表达谱芯片技术, 筛选pcDNA3.1(-)-hHGF和pcDNA3.1(-)载体分别转染HepG2细胞后, 提取mRNA并逆转录为cDNA, 经表达谱芯片分析差异表达基因.
结果: 构建的表达载体经酶切和测序确定; 转染HepG2细胞后hHGF表达经蛋白免疫印迹证实; 经20000个基因的表达谱芯片分析发现, 其中有430个基因表达水平显著上调, 88个基因表达水平显著下调.
结论: 筛选出HGF转染HepG2细胞后的差异表达基因, 对其在肝细胞中多种作用机制研究提供了重要依据.
引文著录: 张维燕, 张锦前, 李晓光, 成军, 李国力, 王琦, 张晨宇, 王晓春, 柴艳云. hHGF转染HepG2细胞后基因表达谱差异筛选. 世界华人消化杂志 2008; 16(22): 2458-2463
Revised: June 15, 2008
Accepted: June 17, 2008
Published online: August 8, 2008
AIM: To construct the eukaryotic expression vector of pcDNA3.1(-)-hHGF, and to screen the differentially expressed genes in HepG2 cells transfected with the vector.
METHODS: We constructed the expression vector of pcDNA3.1(-)-hHGF, which was confirmed by restriction enzyme digestion and DNA sequencing, and then transfected it into HepG2 cell line. The expression of HGF protein was observed by Western blotting. At last, we compared the differentially expressed genes between HepG2 cells transfected with pcDNA3.1(-)-hHGF and pcDNA3.1(-) respectively by cDNA microarray technique.
RESULTS: The expression vector was constructed successfully and confirmed by restriction enzyme digestion and DNA sequencing analysis. The expression of hHGF protein was confirmed by Western blotting. High quality mRNA and cDNA had been prepared and successful microarray screening had been conducted. From the scanning results, we found 430 genes that were up-regulated and 88 genes down-regulated in HepG2 cells transfected with hHGF.
CONCLUSION: cDNA microarray technology is successfully used to screen the genes differentially expressed in HepG2 cells transfected with hHGF, which brings some new clues for studying the regulatory mechanism of hHGF in liver cells.
- Citation: Zhang WY, Zhang JQ, Li XG, Cheng J, Li GL, Wang Q, Zhang CY, Wang XC, Chai YY. Screening of genes differentially expressed in HepG2 cells transfected with human hepatocyte growth factor. Shijie Huaren Xiaohua Zazhi 2008; 16(22): 2458-2463
- URL: https://www.wjgnet.com/1009-3079/full/v16/i22/2458.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i22.2458
人肝细胞生长因子(human hepatocyte growth factor, hHGF)具有多种生物学作用[1], 与其受体c-met介导信号传导, 是正常胚胎发育、多种组织器官(如肝、肾、肠、骨骼、神经系统、造血)发生过程中一个重要调控因子[2]. 近年来国内外对hHGF作用机制的研究涉及到hHGF在肺成纤维细胞、血管内皮细胞、肺癌细胞等多种细胞信号转导途径, 细胞凋亡机制和hHGF对糖类和脂类代谢的影响. 研究显示hHGF可阻止慢性肝炎向肝硬化发展, 减缓急性肝衰竭的发展, 改善肝硬化临床症状[3]. 但是目前hHGF促进肝细胞再生、改善肝纤维化及肝硬化的信号转导途径及其机制、其是否抑制细胞调亡、及其对糖类和脂类代谢的影响的机制研究较少, 尚无明确结论. 本研究应用基因芯片技术, 筛选hHGF对HepG2细胞差异表达的基因, 为进一步深入研究hHGF在肝细胞的多种作用机制提供了坚实的理论依据.
质粒pGEM-ThHGF由吉林大学第一医院惠赠, 真核表达质粒pcDNA3.1(-)质粒购自Invitrogen公司; HepG2细胞购自协和医院细胞中心, 细胞培养相关试剂及总RNA提取试剂TRIzol均购自Gibco公司, 限制性内切酶ApaⅠ、BstⅪ 购自Toyobo生物科技有限公司; T4 DNA连接酶均购自MBI公司; 去内毒素质粒提取试剂盒购自Toyobo生物科技有限公司; 小鼠抗人HGF的抗体, 购自Simga公司. 基因芯片检测由上海联合基因有限公司完成.
1.2.1 构建hHGF基因真核表达载体: 将质粒pGEM-T hHGF转化感受态菌X后, 提取该转化菌质粒pGEM-T hHGF并将该质粒用ApaⅠ、BstⅪ 双酶切、PCR确定; 测序质粒pGEM-ThHGF测定其基因序列约为2200 bp, 结果与目的基因序列hHGF对照, 其序列长度一致且同源性为99.5%. 以pGEM-T hHGF为模板用ApaⅠ及SalⅠ双酶切, 回收2.2 kb左右的目的片段, 与表达载体pcDNA3.1(-)连接, 再转化入宿主菌BL21(DE3)后提取质粒pcDNA3.1(-)-hHGF进行ApaⅠ及SalⅠ双酶切鉴定.
1.2.2 HepG2细胞的转染和筛选: HepG2细胞株用DMEM培养基(含有100 kU/L氨青霉素的100 mL/L小牛血清)常规培养, 待生长到50%-70%融合时, 采用Lipofectin脂质体法(转染程序参照Manitsans方法)将pcDNA3.1(-)及pcDNA3.1(-)-hHGF质粒转染细胞, 含G418的培养基继续培养48 h, 裂解细胞后留取上清, 用于表达产物Western blot检测. hHGF蛋白Western blot检测: 将上清于SDS-PAGE胶电泳, 于TPBS(30 g/L牛血清白蛋白)封闭液室温封闭2 h, 加入封闭液稀释过的抗体(小鼠抗人HGF的抗体, 1:500稀释), 4℃孵育1 h, 用PBS液漂洗4-6次, 每次5 min, 再与封闭液稀释的酶标抗体(山羊抗鼠IgG-HRP, 1:1000稀释)于30℃温育60 min, PBS漂洗4-5次后滤纸吸干残余液体, 加入ECL化学发光底物, 在X光片曝光, 显影、定影后可见结果.
1.2.3 总RNA提取及mRNA纯化: 在35 mm培养皿中常规培养HepG2细胞, 细胞生长至对数期时分别将pcDNA3.1(-)及pcDNA3.1(-)-hHGF转染细胞3、6、12、24、48 h后收获细胞. 使用TRIzol试剂一步法提取细胞总RNA(对照组和实验组), 样品经分光光度计检测吸光度A值, 并行热稳定实验, 于-20℃和70℃保温1 h后, 经琼脂糖凝胶电泳检测28S、18S条带变化. 以Qiagen公司Oligotex mRNA Midi Kit纯化得mRNA. 操作按说明书进行, 并行电泳检测.
1.2.4 探针标记和芯片制备: 常规方法逆转录标记cDNA探针并纯化. Cy3-dUTP标记对照组细胞mRNA(5 μg), Cy5-dUTP标记实验组细胞mRNA(5 μg). 乙醇沉淀后溶解在20 μL 5×SSC+2 g/L SDS杂交液中. 芯片包含的20 000个cDNA由上海联合基因有限公司提供, 包括原癌基因和抑癌基因、免疫调节相关基因、细胞凋亡和应激反应蛋白相关基因、信号转导相关基因等. 以通用引物进行PCR扩增, PCR产物长度为1000-3000 bp. 靶基因以0.5 g/L溶解于3×SSC溶液中, 用Cartesian公司的Cartesian 7500点样仪及TeleChem公司的硅烷化玻片进行点样. 玻片经水合(2 h)、室温干燥(0.5 h), UV交联, 再分别用2 g/L SDS、水及2 g/L的硼氢化钠溶液处理10 min, 晾干备用.
1.2.5 杂交及洗涤: 将基因芯片和杂交探针在95℃水浴变性5 min, 将混合探针加在基因芯片上, 置于60℃杂交15-17 h. 后用SSC及SDS混合液洗涤10 min, 室温晾干.
1.2.6 检测与分析: 用General Scanning公司的ScanArray 3000扫描芯片. 用预先选定的内参照基因(24条管家基因, 每个基因点2个点, 共48个点)对Cy3和Cy5的原始提取信号进行均衡和修正.用ImaGene3.0软件分析Cy3、Cy5两种荧光信号的强度, 计算Cy5/Cy3比值.阳性结果判断: Cy5/Cy3>1.8, 红色荧光, 显示表达增强; Cy5/Cy3<0.6, 为绿色荧光, 显示表达减弱.
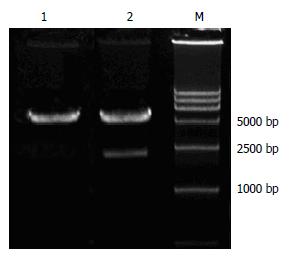
将质粒pGEM-T hHGF转化感受态菌X后, 提取该转化菌质粒pGEM-T hHGF并将该质粒用ApaⅠ、BstⅪ双酶切、PCR确定; 测序质粒pGEM-T hHGF测定其基因序列约为2 200 bp, 结果与目的基因序列hHGF对照一致; 以pGEM-T hHGF为模板用ApaⅠ及SalⅠ双酶切, 回收2.2 kb左右的目的片段, 与表达载体pcDNA3.1(-)连接, 再转化入宿主菌BL21(DE3)后提取质粒pcDNA3.1(-)-hHGF进行ApaⅠ及SalⅠ双酶切鉴定(图1).
HepG2细胞株用DMEM培养基培养, 待生长到50%-70%融合时, Lipofectin脂质体法将pcDNA3.1(-)及pcDNA3.1(-)-hHGF质粒分别转染细胞, 培养48 h后裂解细胞后留取上清于SDS-PAGE胶电泳, Western blot检测(图2).
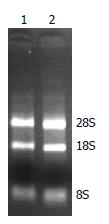
在35 mm培养皿中常规培养HepG2细胞, 细胞生长至对数期时分别将pcDNA3.1(-)及pcDNA3.1(-)-hHGF转染细胞48 h后收获细胞, 使用TRIzol试剂一步法提取细胞总RNA, 琼脂糖凝胶电泳可见28S、18S及8S条带(图3).
用General Scanning公司的ScanArray 3000扫描芯片. 用预先选定的内参照基因(24条管家基因, 每个基因点2个点, 共48个点)对Cy3和Cy5的原始提取信号进行均衡和修正. 用ImaGene3.0软件分析Cy3、Cy5两种荧光信号的强度, 计算Cy5/Cy3比值. 阳性结果判断: Cy5/Cy3>1.8, 红色荧光, 显示表达增强; Cy5/Cy3<0.6, 为绿色荧光, 显示表达减弱.
经20 000个基因的表达谱芯片分析发现, 其中有430个基因表达水平显著上调, 88个基因表达水平显著下调. 表达增强的基因有信号传导子及转录激活子1(signal transducers and activators of transcription 1, STAT1)、蛋白酪氨酸激酶9(protein tyrosine kinase 9, PTK9)、促分裂原活化蛋白激酶4(mitogen-activated protein kinase kinase kinase kinase 4, MAPK4)、磷脂酰肌醇-3-磷酸相关蛋白、磷酯酰肌醇4-激酶、RAS癌基因家族成员等多个涉及Ras/MAP kinase和Jak-STAT通路相关的信号转导蛋白. 表达显著增强及减弱的主要基因见表1-2.
| 序号 | GenBank | 编码蛋白 | Cy5/Cy3 |
| 1 | NM_021033.4 | RAS癌基因家族成员 | 2.78 |
| 2 | NM_003722.3 | 肿瘤蛋白P73-like | 4.89 |
| 3 | NM_002940.1 | ATP-结合盒 | 2.09 |
| 4 | XM_371177.2 | 癌胚抗原相关细胞黏附因子1 | 2.01 |
| 5 | NM_007315.2 | (STAT1)信号传导子及转录激活子1 | 2.65 |
| 6 | NM_005734.2 | Fas相互作用丝氨酸-苏氨酸激酶3 | 3.65 |
| 7 | NM_021970.2 | 促分裂原活化蛋白激酶激酶1相互作用蛋白1 | 2.84 |
| 8 | NM_003930.3 | scr家族相关磷酸蛋白2 | 2.08 |
| 9 | NM_198974.1 | 蛋白酪氨酸激酶9 | 2.57 |
| 10 | NM_145686.2 | 促分裂原活化蛋白激酶4 | 2.81 |
| 11 | NM_019061.2 | 磷脂酰肌醇-3-磷酸相关蛋白 | 2.29 |
| 12 | NM_018323.2 | 磷酯酰肌醇4-激酶 | 2.35 |
| 13 | NM_182804.1 | 载脂蛋白B48受体 | 3.18 |
| 14 | NM_000384.1 | 载脂蛋白B | 2.54 |
| 15 | NM_003234.1 | 转铁蛋白受体 | 2.57 |
| 16 | NM_030777.3 | 葡萄糖转运蛋白10 | 2.08 |
| 17 | NM_003852.3 | 转录中介因子1 | 2.01 |
| 18 | NM_014739.1 | Bcl-2相关转录因子1 | 2.51 |
| 19 | NM_016205.1 | 血小板衍生的生长因子C | 2.11 |
| 序号 | GenBank | 编码蛋白 | Cy5/Cy3 |
| 1 | NM_004292.1 | Ras和Rab作用因子1 | 0.45 |
| 2 | NM_001761.1 | 细胞周期调节蛋白 | 0.47 |
| 3 | NM_000755.2 | 肉毒碱乙酰转移酶 | 0.43 |
| 4 | NM_014266.3 | 造血细胞信号传导器 | 0.49 |
| 5 | NM_031925.1 | 肿瘤坏死因子诱导跨膜蛋白 | 0.47 |
| 6 | NM_004512.3 | 白细胞介素-11受体 | 0.41 |
| 7 | NM_183075.1 | 细胞色素P450 | 0.45 |
| 8 | NM_153486.2 | 乳酸脱氢酶D | 0.45 |
| 9 | NM_000579.1 | 趋化因子受体5 | 0.48 |
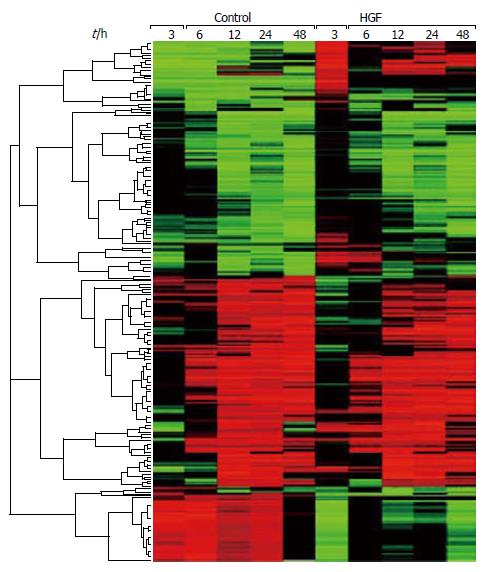
对照组及hHGF转染组各时间点表达谱芯片结果, 用cluster 3.0软件进行聚类分析(图4).
HGF具有多种生物学功能, 其可以逆转肝纤维化及改善肝硬化的发生和发展; 可以用于治疗脂肪肝、防止肺纤维化; 也可以用于治疗血管性疾病、胃溃疡、糖尿病等多种疾病. 近年来, 对HGF生物学功能的相关机制研究也逐渐深入并涉及到了肿瘤发生、细胞凋亡、信号转导等领域, 尤其是在HGF的信号转导途径以及能量代谢方面的研究则是更为引人注目, 但HGF对肝细胞的作用机制仍然很不明确. 因此研究HGF转染HepG2细胞后的差异表达基因, 对深入研究相关的作用机制具有十分重要的意义. 本研究应用表达谱芯片技术筛选HGF转染HepG2细胞的差异表达基因, 并从20 000个基因中筛选出518个差异表达的基因, 其中涉及细胞信号转导、凋亡、能量代谢、肿瘤发生等多个领域, 这与HGF的多样化生物学功能密切相关.
首先, 在有关HGF的信号转导途径的相关研究领域中, Liang et al[4]早在1998年就进行了HGF和KGF(keratinocyte growth factor)促视网膜上皮细胞再生时Ras/MAP kinase和Jak-STAT通路的研究, 并证实此信号转导途径的存在. 近来又有多位研究者进行了HGF在其他种类细胞中信号转导途径的研究: HGF在肺成纤维细胞通过激活促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路和基质金属蛋白酶1(matrix-metalloproteinase 1, MMP-1), 减少胶原和结缔组织生长因子[5]; 肺小细胞癌是激活MAPK等参与信号传导[6]; HGF还通过Ras信号途径调节卵巢癌的转移能力[7]; 而对凋亡的调控是通过磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase, PI3K)和促分裂原活化蛋白激酶激酶通路[8], 增强抗凋亡基因Bcl-2表达[9].
HGF在肝脏首先与肝细胞表面的c-met结合后通过后者将信号传导入胞内, 促进肝细胞的DNA合成导致肝细胞的增殖、有丝分裂, 促进肝细胞及肝脏再生. 而这些过程中相关的信号通路并不明确, 国内外尚未见有关研究报道. 本研究提示HGF作用于HepG2细胞表达增强的基因有信号传导子及转录激活子1(STAT1)、蛋白酪氨酸激酶9(PTK9)、促分裂原活化蛋白激酶4(MAPK4)、磷脂酰肌醇-3-磷酸相关蛋白、磷酯酰肌醇4-激酶、RAS癌基因家族成员等多个涉及Ras/MAP kinase和Jak-STAT通路相关的信号转导蛋白. 我们考虑HGF可能同时通过Ras和JAK-STAT两种信号转导途径调节肝细胞再生. 本研究中HGF显著上调Bcl-2相关转录因子, 提示HGF也可能通过增强抗凋亡基因Bcl-2表达抑制肝细胞凋亡, 从而减轻肝脏损害. 以上结果为相关研究提示了大量的研究方向和思路, 我们拟进一步深入研究确定.
HGF在上皮细胞中的作用研究较多, 在脂肪形成中的作用并不清楚. 对HGF转基因老鼠研究显示, 正常饮食时转基因老鼠血清微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein, MTP)活性和载脂蛋白B(apolipoprotein B, ApoB)水平与甘油三酯同时升高, 在高脂饮食时MTP活性上调更加明显, HGF高表达显著改善高脂饮食导致的脂肪肝, 同时给予HepG2细胞系重组人HGF, 可以刺激MTP和ApoB表达, 同时减少细胞内脂肪. 而这种HGF诱导的MTP和ApoB高表达可以显著被PD98059(MAPK抑制剂)抑制. HGF通过激活MTP和ApoB改善高脂饮食诱导的脂肪肝, 并且其信号转导途径也是Ras/MAP kinase[10]. 本研究显示HGF在HepG2细胞中上调ApoB和ApoB48受体, 提示HGF可能参与载脂蛋白的表达调控, 这可能与脂类代谢和脂肪肝也密切相关.
另外, HGF与糖代谢、肥胖和代谢综合征密切相关[11-12]. 肥胖患者HGF血清水平显著升高, 并随着体质量指数增加而增加[13]. 手术减肥后HGF水平显著下降[14], 提示HGF与肥胖密切相关. 在老鼠3T3-L1脂肪细胞中HGF刺激磷脂酰肌醇-3-激酶(PI3K)依赖的蛋白激酶B活性、葡萄糖转运蛋白-4易位和糖摄取增加[15]. 胰腺β细胞C-met受体失活基因敲出小鼠出现轻度高血糖、胰岛素水平下降, 以及糖代谢失调和β细胞对糖摄入后的急性胰岛素分泌完全丧失、葡萄糖转运蛋白2下调等等, 这些提示HGF/c-met信号通路在调节B细胞功能和维持糖稳态具有重要意义[16]. 本研究显示HGF上调葡萄糖转运蛋白10, 说明HGF可能参与了肝细胞对糖类代谢的调节, 这一现象及其机制还需要进一步研究.
总之, 我们筛选了hHGF转染HepG2细胞的差异表达基因后发现, 参与多种生物学过程的多种基因都存在明显的表达差异, 其主要与细胞信号转导、细胞增殖与分化、能量代谢、细胞凋亡和肿瘤发生等密切相关. 本实验结果为进一步研究HGF在肝细胞中相关生物学过程及其信号转导机制提供了坚实的基础, 尤其在HGF与糖、脂类代谢相关性的方面则更具重要意义.
hHGF具有多种生物学功能, 其可以逆转肝纤维化及改善肝硬化、治疗脂肪肝、防止肺纤维化, 以及治疗血管性疾病、胃溃疡、糖尿病等多种疾病. 近年来, 在hHGF的信号转导途径及代谢方面的研究则更引人注目, 但相关的作用机制尚不明确.
唐霓, 副研究员, 重庆医科大学教育部感染性疾病分子生物学重点实验室; 刘杞, 教授, 重庆医科大学病毒性肝炎研究所
关于HGF生物学功能的相关机制研究热点逐渐深入并涉及到肿瘤发生、细胞凋亡、信号转导、物质代谢等领域, 而后两方面的研究则更为引人注目, 但这些作用机制仍不明确. 因此, 本研究筛选相关基因, 从而为相关机制的研究提供思路和方向.
本研究应用基因芯片技术筛选HGF对HepG2细胞差异表达的基因, 发现了与多种生物学功能有关的多种基因都存在明显的表达差异, 其中部分是原有国内外研究工作中从未见文字报道的基因, 尤其在物质代谢和作用机制方面的新发现更具研究意义.
本文的研究工作为hHGF在参与物质代谢和细胞凋亡、肿瘤发生等的相关机制提供了实验依据和方向, 极具研究价值和前景.
hHGF: 一种多功能生长因子, 是一种在胚胎形成、器官发生和器官再生的过程中形成正常组织结构的关键因子. 他具有多种生物学作用, 与其受体c-met介导信号传导, 是正常胚胎发育、多种组织器官(如肝、肾、肠、骨骼、神经系统、造血)发生过程中一个重要调控因子.
本研究有一定新意, 所得的结果对其他进行相关研究的人员有一定参考和借鉴价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Yang J, Chen S, Huang L, Michalopoulos GK, Liu Y. Sustained expression of naked plasmid DNA encoding hepatocyte growth factor in mice promotes liver and overall body growth. Hepatology. 2001;33:848-859. [PubMed] [DOI] |
| 2. | Grassinger J, Mueller G, Zaiss M, Kunz-Schughart LA, Andreesen R, Hennemann B. Differentiation of hematopoietic progenitor cells towards the myeloid and B-lymphoid lineage by hepatocyte growth factor (HGF) and thrombopoietin (TPO) together with early acting cytokines. Eur J Haematol. 2006;77:134-144. [PubMed] [DOI] |
| 3. | Arthur LG, Schwartz MZ, Kuenzler KA, Birbe R. Hepatocyte growth factor treatment ameliorates diarrhea and bowel inflammation in a rat model of inflammatory bowel disease. J Pediatr Surg. 2004;39:139-143; discussion 139-143. [PubMed] [DOI] |
| 4. | Liang Q, Mohan RR, Chen L, Wilson SE. Signaling by HGF and KGF in corneal epithelial cells: Ras/MAP kinase and Jak-STAT pathways. Invest Ophthalmol Vis Sci. 1998;39:1329-1338. [PubMed] |
| 5. | Bogatkevich GS, Ludwicka-Bradley A, Highland KB, Hant F, Nietert PJ, Singleton CB, Silver RM. Down-regulation of collagen and connective tissue growth factor expression with hepatocyte growth factor in lung fibroblasts from white scleroderma patients via two signaling pathways. Arthritis Rheum. 2007;56:3468-3477. [PubMed] [DOI] |
| 6. | Ma PC, Tretiakova MS, Nallasura V, Jagadeeswaran R, Husain AN, Salgia R. Downstream signalling and specific inhibition of c-MET/HGF pathway in small cell lung cancer: implications for tumour invasion. Br J Cancer. 2007;97:368-377. [PubMed] [DOI] |
| 7. | Ueoka Y, Kato K, Wake N. Hepatocyte growth factor modulates motility and invasiveness of ovarian carcinomas via ras mediated pathway. Mol Cell Endocrinol. 2003;202:81-88. [PubMed] |
| 8. | Reveneau S, Paumelle R, Deheuninck J, Leroy C, De Launoit Y, Fafeur V. Inhibition of JNK by HGF/SF prevents apoptosis induced by TNF-alpha. Ann N Y Acad Sci. 2003;1010:100-103. [PubMed] [DOI] |
| 9. | Nakagami H, Morishita R, Yamamoto K, Taniyama Y, Aoki M, Yamasaki K, Matsumoto K, Nakamura T, Kaneda Y, Ogihara T. Hepatocyte growth factor prevents endothelial cell death through inhibition of bax translocation from cytosol to mitochondrial membrane. Diabetes. 2002;51:2604-2611. [PubMed] [DOI] |
| 10. | Kosone T, Takagi H, Horiguchi N, Ariyama Y, Otsuka T, Sohara N, Kakizaki S, Sato K, Mori M. HGF ameliorates a high-fat diet-induced fatty liver. Am J Physiol Gastrointest Liver Physiol. 2007;293:G204-G210. [PubMed] [DOI] |
| 11. | Bell LN, Ward JL, Degawa-Yamauchi M, Bovenkerk JE, Jones R, Cacucci BM, Gupta CE, Sheridan C, Sheridan K, Shankar SS. Adipose tissue production of hepatocyte growth factor contributes to elevated serum HGF in obesity. Am J Physiol Endocrinol Metab. 2006;291:E843-E848. [PubMed] [DOI] |
| 12. | Hiratsuka A, Adachi H, Fujiura Y, Yamagishi S, Hirai Y, Enomoto M, Satoh A, Hino A, Furuki K, Imaizumi T. Strong association between serum hepatocyte growth factor and metabolic syndrome. J Clin Endocrinol Metab. 2005;90:2927-2931. [PubMed] [DOI] |
| 13. | Rehman J, Considine RV, Bovenkerk JE, Li J, Slavens CA, Jones RM, March KL. Obesity is associated with increased levels of circulating hepatocyte growth factor. J Am Coll Cardiol. 2003;41:1408-1413. [PubMed] [DOI] |
| 14. | Swierczynski J, Korczynska J, Goyke E, Adrych K, Raczynska S, Sledzinski Z. Serum hepatocyte growth factor concentration in obese women decreases after vertical banded gastroplasty. Obes Surg. 2005;15:803-808. [PubMed] [DOI] |
| 15. | Bertola A, Bonnafous S, Cormont M, Anty R, Tanti JF, Tran A, Le Marchand-Brustel Y, Gual P. Hepatocyte growth factor induces glucose uptake in 3T3-L1 adipocytes through A Gab1/phosphatidylinositol 3-kinase/Glut4 pathway. J Biol Chem. 2007;282:10325-10332. [PubMed] [DOI] |
| 16. | Roccisana J, Reddy V, Vasavada RC, Gonzalez-Pertusa JA, Magnuson MA, Garcia-Ocaña A. Targeted inactivation of hepatocyte growth factor receptor c-met in beta-cells leads to defective insulin secretion and GLUT-2 downregulation without alteration of beta-cell mass. Diabetes. 2005;54:2090-2102. [PubMed] [DOI] |