修回日期: 2008-05-21
接受日期: 2008-06-02
在线出版日期: 2008-07-28
目的: 考察抗人胃癌抗体可变区轻、重链序列, 选择合适的连接肽构建单链抗体, 并模拟其三级结构, 预测单链抗体结构与功能关系.
方法: 利用获得的源自抗人胃癌噬菌体抗体库中筛选出的抗体可变区轻、重链序列, 通过分析抗体轻重链可变区C-端、N-端结构特征, 选择合适的连接肽, 进而利用分子模拟原理构建单链抗体可变区的空间构象; 经过力学优化、动力学模拟确定其稳定的三维结构; 借助距离几何学、表观静电分布、溶液可及性表面积分析, 对单链抗体的结构特征及理化性质进行理论分析.
结果: 成功获得的单链抗体稳定构象, 除连接肽位置的1个氨基酸构象不合理之外, 其他位置构象合适. 轻链CDR1、CDR2以及重链CDR3溶液可及性表面积分布较强, 而轻链CDR3、重链CDR1、CDR2分布较弱. 重链CDR3区带有较强的负电性.
结论: 所构建的单链抗体三维空间结构具有较高的合理性和可靠性.
引文著录: 杨丽娟, 侯颖春, 白玉杰, 药立波, 苏成芝. 抗胃癌单链抗体可变区序列分析及空间结构模拟. 世界华人消化杂志 2008; 16(21): 2333-2336
Revised: May 21, 2008
Accepted: June 2, 2008
Published online: July 28, 2008
AIM: To analyze the sequence of heavy and light chain of the variable region (VH and VL) in the anti-human gastric cancer antibody, select a suitable linker peptide to construct single chain antibody, model the 3-D structure and predict the relationship between its structure and function.
METHODS: Using the sequences of VH and VL, which derived from the phage display library of antibodies against human gastric cancer, a suitable linker peptide was chosen to obtain the primary structure of the single-chain antibody with considering the C-terminal and N-terminal structural character. Furthermore, the 3-D theoretical structure was modeled with computer-guided homology modeling method. The stable spatial conformation of the single-chain variable region was determined with mechanism optimization and molecular dynamic simulation. The structural property and physical-chemical characters were analyzed using the distance geometry, surface electrostatic distribution and solvent accessible surface calculation.
RESULTS: The conformation of the successfully constructed single-chain antibody was stable. Except one amino acid conformation of connecting peptide, others' were reasonable. VL CDR1, CDR2 and VH CDR3 solution accessibility surface area distributed strongly, but VL CDR3, VH CDR1, and CDR2 were comparatively weak. VH CDR3 region had strong electronegativity.
CONCLUSION: The 3-D structure of the created single chain antibody is proved reasonable and reliable.
- Citation: Yang LJ, Hou YC, Bai YJ, Yao LB, Su CZ. Analysis of primary structure and modeling of spatial structure of single-chain variable region of antibody against human gastric cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(21): 2333-2336
- URL: https://www.wjgnet.com/1009-3079/full/v16/i21/2333.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i21.2333
胃癌是我国最常见的恶性肿瘤之一, 其发病率及病死率均为恶性肿瘤的第1位[1], 因此, 胃癌的早期诊断和有效治疗就显得极为重要. 单链抗体作为抗体分子中保留抗原结合部位的最小功能片段, 在肿瘤的早期诊断和治疗中越来越受到人们的广泛关注. 本研究利用源自噬菌体抗体库技术获得的鼠抗人胃癌轻、重链可变区片段, 通过分析其N-端、C-端序列及结构特征, 选择合适的连接肽构建单链抗体, 经计算机辅助分子模拟方法构建其空间构象. 利用相关理论方法对其结构进行分析, 预测了结构功能关系, 为进一步抗体的合理改造奠定基础.
细菌菌株E.coli TG1, 克隆及表达载体pCANTAB5E, 分别扩增轻链可变区片段(VL)和重链可变区片段(VH), 引物及RS Primer Mix均为Pharmacia公司产品. 其他有关分子生物学试剂系华美公司和Promega公司产品. InsightⅡ(2005)软件包为MSI公司产品.
抗人胃癌抗体轻、重链序列参见文献[2]. 分析人胃癌抗体轻、重链可变区序列, 借助其空间构象分析其N-、C-端结构特征, 选择合适的连接肽(GGGGS)3, 利用分子模拟方法搭建单链抗体空间构象. 依次选择CVFF力场、Gromos96力场, 利用Discover、Discover_3程序包, 经最陡下降、共轭梯度算法进行分子力学优化; 通过常温动力学模拟, 收集100个稳定构象进行分析, 最终确定单链抗体的稳定构象. 利用Profile_3D对单链抗体的结构进行可信性分析; 进而通过Access_Surf模块对单链抗体的表面溶液可及程度进行分析; 利用Delphi程序, 考虑溶剂效应进行表观静电分布分析.
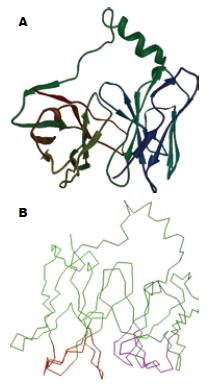
考察抗体重链、轻链可变区N、C端氨基酸理化特征, 选择合适的连接肽(GGGGS)3, 构建单链抗体可变区序列. 通过http://www.ncbi.nlm.nih.gov/BlastP, 检索PDB数据库, 得到模板蛋白, 其PDB注册号为1h8s. 利用同源模建方法搭建其三维结构, 通过分子力学、动力学模拟获得其稳定构象(图1A-B).
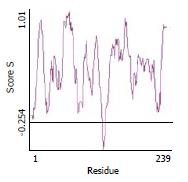
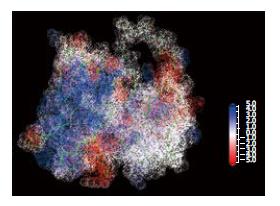
为评判模拟构象结构的可靠性, 我们对优化获得的单链抗体空间结构进行了理论评估, 结果模拟的构象除连接肽位置的1个氨基酸构象不合理之外, 其他位置构象合适(图2).
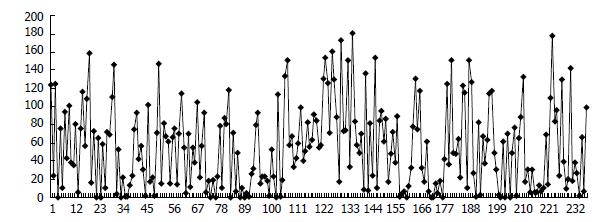
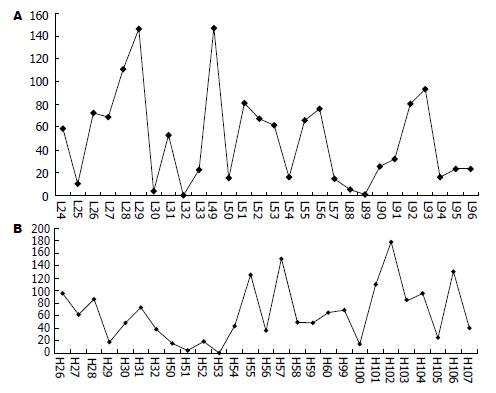
轻链CDR1、CDR2以及重链CDR3溶液可及性表面积分布较强, 而轻链CDR3、重链CDR1、CDR2分布较弱, 提示在发挥作用的过程中, 重链CDR3区参与跟抗原的结合(图3-4). 重链CDR3区带有较强的负电性, 提示在与相应抗原作用过程中, 通过与正电的抗原表位发生静电作用(图5).
人们通过对类似蛋白质空间结构的对比发现, 蛋白质的三维结构较其一级序列更为保守. 因此, 用类似蛋白来预测目标蛋白的空间构象是比较可靠的[6]. 据此原理, 人们已成功预测了许多目标蛋白, 在抗体的结构预测中尤为突出[4-10], 这对抗体工程的发展具有十分重要的意义, 能够使人们在了解抗体空间结构及其与生物学功能关系之基础上, 对已有的抗体分子加以改造, 使其更符合临床诊断和治疗的需要.
小分子抗体具有分子小, 免疫原性弱, 穿透力强易于进入实体瘤周围的微循环, 血清和全身廓清快, 无肾脏蓄积作用, 肿瘤显像时清晰度高, 可作载体与药物、同位素、毒素等结合之优点[11], 在肿瘤的诊断和治疗方面有极高的理论和应用价值. 单链抗体是小分子抗体的一种, 其由VH和VL和连接肽构成, 是抗体分子中保留抗原结合部位的最小功能片段. 本研究利用计算机辅助分子设计与蛋白空间结构模拟技术, 利用获得的源自抗人胃癌噬菌体抗体库中筛选出的VH、VL序列, 通过分析抗体轻重链可变区C-端、N-端结构特征, 选择合适的连接肽, 进而利用分子模拟原理构建单链抗体可变区的空间构象; 经过力学优化、动力学模拟确定其稳定的三维结构; 借助距离几何学、表观静电分布、溶液可及性表面积分析, 对单链抗体的结构特征及理化性质进行了理论分析. 获得的单链抗体构象表明, 其CDR区形成合理的口袋结构, 易于结合抗原表位而发挥功能. 这为该抗体的进一步合理化改造提供了理论依据.
在肿瘤的诊断治疗中, 抗体占有很重要的作用. 本研究利用噬菌体抗体库技术, 绕过杂交瘤技术, 获得了鼠抗人胃癌重链及轻链可变区片段, 并通过分析其N-端、C-端序列及结构特征, 选择合适的连接肽构建单链抗体, 经计算机辅助分子模拟方法构建其空间构象. 为今后胃癌的显像和导向治疗奠定了一定的基础.
李奇林, 教授, 南方医科大学附属珠江医院急诊部.
目前所获得的抗体大部分为鼠源性, 在应用过程中会引发HAMA反应而限制了其应用. 必须先进行人源化改造, 才能更好地应用于临床. 如何进行人源化改造是亟待研究的问题.
人们通过对类似蛋白质空间结构的对比发现, 蛋白质的三维结构较其一级序列更为保守. 氨基酸残基序列有50%相同的蛋白质, 约有90%的Ca原子偏差不超过0.3 nm, 均方根偏差约0.1 nm, 氨基酸的残基替换通常发生在蛋白质表面回折区域. 蛋白质主链结构, 特别是疏水中心的结构受序列变异的影响很小. 因此, 用类似蛋白来预测目标蛋白的空间构象是比较可靠的.
C本文先从噬菌体抗体库着手, 得到抗体重链及轻链可变区片段后, 选择合适的连接肽, 利用三维重建得到空间结构, 为人源化改造奠定基础.
本文在查阅了大量文献资料的基础上进行设计, 对胃癌的研究有较大的指导性, 为防治消化系肿瘤提供了较好的基础研究理论.
编辑: 李军亮 电编:郭海丽
| 3. | Blundell TL, Sibanda BL, Sternberg MJ, Thornton JM. Knowledge-based prediction of protein structures and the design of novel molecules. Nature. 1987;326:347-352. [PubMed] [DOI] |
| 4. | Fontayne A, Vanhoorelbeke K, Pareyn I, Van Rompaey I, Meiring M, Lamprecht S, Roodt J, Desmet J, Deckmyn H. Rational humanization of the powerful antithrombotic anti-GPIbalpha antibody: 6B4. Thromb Haemost. 2006;96:671-684. [PubMed] |
| 5. | Paula S, Monson N, Ball WJ Jr. Molecular modeling of cardiac glycoside binding by the human sequence monoclonal antibody 1B3. Proteins. 2005;60:382-391. [PubMed] [DOI] |
| 6. | Thompson AJ, Price KL, Reeves DC, Chan SL, Chau PL, Lummis SC. Locating an antagonist in the 5-HT3 receptor binding site using modeling and radioligand binding. J Biol Chem. 2005;280:20476-20482. [PubMed] [DOI] |
| 7. | Mendez R, Leplae R, Lensink MF, Wodak SJ. Assessment of CAPRI predictions in rounds 3-5 shows progress in docking procedures. Proteins. 2005;60:150-169. [PubMed] [DOI] |
| 8. | Gee GV, Tsomaia N, Mierke DF, Atwood WJ. Modeling a sialic acid binding pocket in the external loops of JC virus VP1. J Biol Chem. 2004;279:49172-49176. [PubMed] [DOI] |
| 9. | Arndt MA, Krauss J, Schwarzenbacher R, Vu BK, Greene S, Rybak SM. Generation of a highly stable, internalizing anti- CD22 single-chain Fv fragment for targeting non-Hodgkin's lymphoma. Int J Cancer. 2003;107:822-889. [PubMed] [DOI] |
| 10. | Mohan S, Sinha N, Smith-Gill SJ. Modeling the binding sites of anti-hen egg white lysozyme antibodies HyHEL-8 and HyHEL-26: an insight into the molecular basis of antibody cross-reactivity and specificity. Biophys J. 2003;85:3221-3236. [PubMed] |
| 11. | Colcher D, Bird R, Roselli M, Hardman KD, Johnson S, Pope S, Dodd SW, Pantoliano MW, Milenic DE, Schlom J. In vivo tumor targeting of a recombinant single-chain antigen-binding protein. J Natl Cancer Inst. 1990;82:1191-1197. [PubMed] [DOI] |