修回日期: 2008-05-07
接受日期: 2008-05-12
在线出版日期: 2008-07-18
目的: 采用均匀设计法筛选及验证小鼠骨髓基质干细胞体外转化为肝细胞的最佳诱导培养体系.
方法: 获取小鼠骨髓基质干细胞, 根据均匀设计法分8组进行体外诱导实验. 通过流式细胞术检测各组ALB及CK18的阳性表达率, 通过逐步回归分析法确立最佳细胞因子组合及浓度. 从基因水平、蛋白水平以及细胞合成代谢功能检测, 证实诱导的细胞为有功能的肝细胞.
结果: FGF取35 μg/L, OSM取30 μg/L时, ALB及CK18的阳性细胞达到最高值. 采用该最佳诱导体系诱导过程中可检测到细胞表达ALB mRNA、CK18 mRNA、AFP mRNA、TTR mRNA; 以及ALB、CK18蛋白表达; 第21天最佳体系诱导组ALB阳性细胞的比例为82.83%±9.03%, CK18阳性细胞的比例为74.79%±8.41%. 诱导培养过程中细胞分泌尿素及白蛋白, 且随诱导时间的延长而增强.
结论: 均匀设计法可有效进行最佳诱导体系的筛选, 以35 μg/L FGF、30 μg/L OSM为主的诱导培养体系, 可以有效地促进骨髓基质干细胞体外定向转化为有功能的肝细胞.
引文著录: 施晓雷, 毛谅, 许碧云, 谢婷, 朱章华, 陈军浩, 李雷, 丁义涛. 小鼠骨髓基质干细胞体外转化为肝细胞最佳诱导体系的筛选及验证. 世界华人消化杂志 2008; 16(20): 2217-2223
Revised: May 7, 2008
Accepted: May 12, 2008
Published online: July 18, 2008
AIM: To explore the most effective directed differentiation medium (MEDDM) for differen-tiating mouse bone marrow mesenchymal stem cells (mMSCs) into hepatocytes in vitro.
METHODS: Eight differentiation medium groups were arranged following uniform design. Positive expression rates of ALB+ and CK18+ cells in each group were determined using flow cytometry. The best suitable factors and their concentrations in MEDDM were then identified using stepwise regression analysis. Determination and confirmation of hepatocytes from mMSCs were performed using RNA and protein expression and synthesis.
RESULTS: At concentrations of 35 μg/L hepatocyte growth factor (FGF) and 30 μg/L oncostatin M (OSM), the medium yielded the highest percentage of ALB+ and CK18+ cells. During directed differentiation using MEDDM, expression of ALB, CK18, TTR, AFP mRNAs were detected. And ALB and CK18 proteins were detected in cells. On day 21, the ratio of ALB-positive cells was 82.83% ± 9.03%, and the ratio of CK18-positive cells was 74.79% ± 8.41%. The differentiated cells produced albumin and urea in a time dependent manner.
CONCLUSION: Uniform design is adequate for choosing the MEDDM of mMSCs. MEDDM containing 35 μg/L FGF and 30 μg/L OSM is effective to differentiate mMSCs into hepatocytes.
- Citation: Shi XL, Mao L, Xu BY, Xie T, Zhu ZH, Chen JH, Li L, Ding YT. Optimization of an effective directed differentiation medium for mouse bone marrow mesenchymal stem cells into hepatocytes in vitro. Shijie Huaren Xiaohua Zazhi 2008; 16(20): 2217-2223
- URL: https://www.wjgnet.com/1009-3079/full/v16/i20/2217.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i20.2217
干细胞是一种具有克隆形成和自我更新能力的细胞, 在恰当的条件下或给予不同信号刺激能转化为不同组织来源的细胞[1]. 目前研究已经证实骨髓中存在一种基质干细胞系能转化为肝细胞[2-6]. 干细胞的分化过程复杂, 细胞外基质及多种可溶性配体组成的信号链, 操纵着干细胞的生长、分化及形态发展[7-8]. 其中, 肝细胞生长因子(hepatocyte growth factor, HGF)、成纤维样细胞生长因子4(fibroblast growth factor-4, FGF-4)、抑瘤素(oncostatin M, OSM)和表皮生长因子(epithermal growth factor, EGF)等对肝脏的发生发展起重要作用[9-12]. 之前的研究中, 我们采用FGF-4, OSM, HGF和EGF细胞因子作为诱导因子, 成功地将小鼠骨髓基质干细胞(mouse bone marrow mesenchymal stem cells, mMSCs)诱导为肝细胞样细胞[13], 但影响骨髓基质干细胞体外诱导为肝细胞样细胞的确切因子还未说明. 本文, 我们对各种细胞生长因子的交互作用进行分析, 以期能够筛选出骨髓基质干细胞体外转化肝细胞的最佳诱导体系. 并通过mRNA分析, 蛋白表达, 细胞功能测定等手段检测该最佳体系在体外将骨髓基质干细胞诱导为肝细胞样细胞的可行性及效果.
SPF级近交系C57BL/6小鼠, 体质量10-12 g, 购于南京大学模式动物中心. DMEM-LG、IMDM、L-谷氨酰胺(L-glutamine)及FCS购于Hyclone公司; MCDB-201、ITS、地塞米松(dexamethasone)、抗坏血酸、胰岛素(insulin)、青霉素(penicillin)、链霉素(streptomycin)、FITC-连接的二抗、PE-连接的二抗、TRIzol RNA提取试剂盒Ⅱ型胶原酶、HRP-连接的二抗、FITC-连接的二抗、PE-连接的二抗、TRITC-连接的二抗及纤维连接蛋白(fibronectin)均购于Sigma公司; 重组人肝细胞生长因子(rhHGF)、重组人碱性成纤维样细胞生长因子4(rhFGF-4)及rhOSM及重组小鼠表皮生长因子(rmEGF)购于RD公司; 抗小鼠白蛋白抗体购于Dako公司; 抗小鼠CK18抗体购于Chemicon公司; TITANIUMTM one-step RT-PCR试剂盒购于Clontech公司; Modified lowry protein assay kit购于Pierce公司; 抗小鼠白蛋白抗体购于Dako公司; 抗小鼠CK18抗体及抗小鼠HNF-3ß抗体购于Chemicon公司; 抗小鼠β-actin抗体购于Abcam公司; DAB(diaminiobenzidene)显色试剂盒购于北京中山生物公司.
1.2.1 小鼠骨髓基质干细胞的分离与鉴定: 骨髓基质干细胞的准备如参考文献[14]所述, 采用SPF级近交系C57BL/6小鼠, 无菌条件下从股骨和胫骨抽取新鲜骨髓5-7 mL, 悬浮于DMEM-LG培养液, 离心去除脂肪等杂质; 细胞重悬后加于密度为1.077 kg/L的Percoll分离液上层, 室温下以2200 r/min离心30 min; 吸取Percoll分离液表面的白膜层, 洗涤后重悬. 台盼蓝染色计算细胞活力, 细胞活力>95%才被使用.
骨髓基质干细胞接种于事先用10 mg/L纤维连接蛋白处理过的培养瓶中, 以540 g/L DMEM-LG, 360 g/L MCDB 201, 100 mL/L FCS, 1×ITS, 10-8 mol/L地塞米松, 10-4 mol/L抗坏血酸, 100 kU/L青霉素, 100 mg/L链霉素, 2 mmol/L L-谷氨酰胺作为基础培养体系. 细胞在37℃ 5%饱和湿度培养箱中培养. 3 d后去除未贴壁细胞并更换新鲜培养液. 以后每3-4 d换液1次. 细胞达到80%融合后, 胰酶消化并传代. 通过这种贴壁选择的方法不断纯化骨髓基质干细胞, 直至第4代细胞后开始行干细胞表面标志鉴定.
获取第4代骨髓基质干细胞, 用含50 mL/L FBS的PBS洗涤后, 将2×105细胞重悬于含20 g/L 多聚甲醛的0.5 mL PBS中. 在冰浴中避光分别与下列荧光抗体孵育30 min: CD29-PE、CD44-PE、CD90-PE和CD45-FITC, 后通过流式细胞仪检测.
1.2.2 筛选最佳诱导体系: 根据预实验结果, 我们选取4个因子在4个浓度水平进行分析. 4因子分别为HGF、FGF-4、EGF和OSM. 每个因子设4个浓度, 分别为HGF和FGF-4: 0、20、40、60 mg/L; EGF和OSM: 0、10、20、30 mg/L. 考虑到各因素之间的交互作用, 并忽略高阶交互作用, 通过查阅和分析, 我们选择比较恰当的8组实验均匀设计表U8(44)(网址: http://www.math.hkbu.edu.hk/uniform design). 以此为依据, 我们建立了8组不同的诱导培养体系, 分别对骨髓基质干细胞在不同的体系下进行诱导培养. 除采用共同的基础培养体系外, 每组按表1添加不同浓度的诱导因子. 细胞在37℃ 5%饱和湿度培养箱中培养, 每3 d换液1次, 第21天所有细胞消化后进行流式细胞检测.
| 分组 | HGF | FGF-4 | EGF | OSM |
| 1 | 40 | 0 | 10 | 0 |
| 2 | 20 | 40 | 30 | 0 |
| 3 | 0 | 20 | 0 | 10 |
| 4 | 40 | 0 | 20 | 30 |
| 5 | 40 | 40 | 0 | 30 |
| 6 | 60 | 60 | 30 | 10 |
| 7 | 0 | 60 | 10 | 20 |
| 8 | 60 | 20 | 30 | 20 |
各组培养第21天细胞消化后顺序与一抗抗小鼠白蛋白、抗小鼠CK18和二抗(FITC-连接的二抗或PE-连接的二抗)孵育, 生理盐水重悬后于流式细胞仪进行检测.
1.2.3 采用最佳诱导体系体外诱导骨髓基质干细胞: 骨髓基质干细胞接种于事先用10 mg/L的Fibronectin处理过的培养瓶中, 接种密度为5×105/cm2. 基础培养体系: 540 g/L DMEM-LG, 360 g/L MCDB201, 100 mL/L FCS, 1×ITS, 10-8 mol/L地塞米松, 10-4 mol/L抗坏血酸, 100 kU/L青霉素, 100 mg/L链霉素, 2 mmol/L L-谷氨酰胺. 诱导组加入下列细胞因子: FGF-4 35 mg/L, OSM 30 mg/L; 非诱导组(对照组)不加上述细胞因子, 直接以基础培养体系进行培养. 在培养过程中, 通过Olympus倒置显微镜观察细胞形态的变化, 第21天所有细胞消化后进行相关检测.
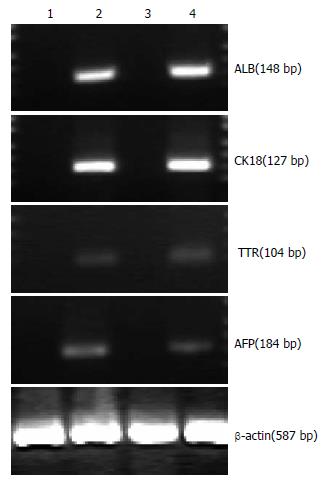
1.2.4 RT-PCR检测肝细胞特异性基因表达: 分别从新鲜mMSCs、非诱导组mMSCs、最佳诱导体系诱导组mMSCs中采用TRIzol试剂抽提总RNA, 并以小鼠肝脏细胞作为阳性对照. RT-PCR采用一步法, 对于ALB、CK18、AFP和TTR, 具体反应条件如下: 50℃逆转录1 h; 94℃ RNA/DNA杂交变性及逆转录酶失活5 min; PCR: 40个循环, 94℃变性30 s, 60℃退火1 min, 72℃延伸1 min, 72℃再延伸5 min. 引物序列如下: AFP(184 bp): 5'-GTGAAACAGACTTCCTGGTCCT-3', 5'-GCCCTACAGACCATGAAACAAG-3'; Albumin (148 bp): 5'-TCAACTGTCAGAGCAGAGAAGC-3', 5'-AGACTGCCTTGTGTGGAAGACT-3'; CK18(127 bp): 5'-TGGTACTCTCCTCAATCTGCTG-3', 5'-CTCTGGATTGACTGTGGAAGTG-3'; TTR(105 bp): 5'-TCTCTCAATTCTGGGGGTTG-3', 5'-TTTCACAGCCAACGACTCTG-3'; Beta-actin(587 bp): 5'-CCAAGGCCAACCGCGAGAAGATGAC-3', 5'-AGGGTACATGGTGGTGCCGCCAGAC-3'. 所有引物由上海生物工程公司合成, 以β-actin作为内参, 扩增产物在含有溴化乙锭的10 g/L琼脂糖凝胶上电泳, 电泳结果应用紫外成像分析.
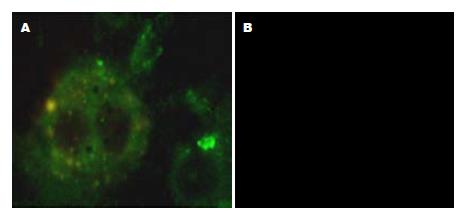
1.2.5 免疫荧光染色检测ALB及CK18: 将非诱导组21 d的细胞及诱导组第21天的细胞离心涂片, 用4%多聚甲醛室温固定10 min、-20℃甲醇固定2 min后, 用山羊血清室温封闭1 h. 分别进行下列反应: 1:100抗小鼠白蛋白单抗室温作用1h, 1:100 FITC标记二抗1 h; 1:100抗小鼠CK18 单抗室温作用1 h, 1:100 TRITC标记二抗1 h. 以小鼠肝细胞作为阳性对照, PBS替代一抗作为阴性对照, 最后用荧光显微镜观察.
1.2.6 流式细胞术检测ALB+和CK18+细胞: 培养第21天细胞消化后顺序与一抗抗小鼠白蛋白、抗小鼠CK18和二抗(FITC-连接的二抗或PE-连接的二抗)孵育, 生理盐水重悬后上机检测.
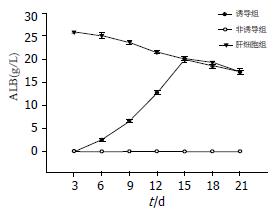
1.2.7 白蛋白分泌功能检测: 在诱导组和非诱导组分别取第3、6、9、12、15、18、21天的细胞培养液, 以小鼠肝细胞作为阳性对照, 包被缓冲液以1:100稀释特异性抗小鼠白蛋白抗体并包被96孔板, 每孔加入100 mL抗体稀释液, 孵育60 min; 移去上述液体后, 洗液洗涤; 每孔加入200 mL封闭液, 孵育30 min, 移去上述液体后, 用洗液洗涤3遍; 用样品稀释液倍比稀释标准品(即小鼠参照血清), 其浓度由10 000 mg/L, 500 mg/L至7.8 mg/L, 用于制作标准曲线; 将稀释的标准品及样品以100 mL/孔加入96孔板内(每一时点均有复孔), 孵育60 min, 移去孔内液体并清洗, 将HRP以1:10 000稀释后加入样品孔内, 100 mL/孔, 孵育60 min, 移去孔内液体并清洗; 加入酶显色剂TMB后孵育30 min; 加入2 mol/L H2SO4 100 mL/孔终止显色反应, 酶标仪测A值(TMB检测波长为450 nm), 绘制曲线.
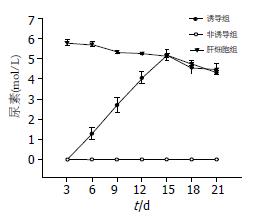
1.2.8 尿素合成实验: 在诱导组和非诱导组组分别取第3、6、9、12、15、18、21天的细胞, 在培养体系中加入5 mmol/L NH4Cl于37℃在50 mL/L CO2培养箱中孵育24 h, 通过日立全自动生化分析仪测量细胞上清液中尿素的浓度. 小鼠肝细胞用于阳性对照, 培养液用于阴性对照.
统计学处理 使用SPSS-15.0软件进行统计学分析. 连续性资料两个样本均数比较用Student's test, 多组样本均数比较用One-ANOVA及Student-Newman-Keuls post-hoc比较. 检验水准: P = 0.05.
CD29, CD44, CD45和CD90作为细胞表面标志进行流式鉴定, 超过90%的P4细胞为CD45阴性, CD29, CD44, CD90阳性.
各组细胞ALB和CK18阳性表达率见表2. 变量定义: X1-X4分别代表4个细胞生长因子HGF、FGF-4、EGF和OSM, X5-X14为其二阶主效应及交互项. 他们分别表示: X5 = X1×X1; X6 = X2×X2; X7 = X3×X3; X8 = X4×X4; X9 = X1×X2; X10 = X1×X3; X11 = X1×X4; X12 = X2×X3; X13 = X2×X4; X14 = X3×X4. 其中X5 = X1×X1表示变量X5是变量X1的二阶主效应, X9 = X1×X2表示变量X9是X1与X2的交互项, 依次类推. Y11代表"ALB"%; Y12代表"CK18"%. 逐步回归分析: 由于无细胞因子培养体系中不会出现ALB和CK18阳性细胞数, 因此在建模时不考虑截距项, 变量筛选采用向前法, 变量进入模型的显著性水平定为0.05. 对于Y11的筛选结果, 只有X4进入模型, 回归模型为Y11 = 2.82629×X4; R2 = 0.6873, 提示Y11与X4有关, 且取最大值35 mg/L时Y11达到最大. 对于Y12的筛选结果, 回归模型为Y12 = 2.77339×X2-0.03840×X2×X2+1.03535×X4; R2 = 0.9465. 解该方程的方法: 每个因素的浓度以5个单位递增, 寻找不同组合下的最大值, 结果为: X2 = 35 mg/L, X4 = 30 mg/L时, Y12最大. 35 mg/L FGF和30 mg/L OSM时为我们筛选的理想结果.
| 分组 | ALB | CK18 |
| 1 | 47.76±9.84 | 19.85±5.12 |
| 2 | 52.48±10.12 | 47.21±8.64 |
| 3 | 78.95±11.23 | 69.54±9.79 |
| 4 | 47.54±8.76 | 39.95±8.22 |
| 5 | 85.91±11.67 | 67.37±10.01 |
| 6 | 29.44±5.61 | 47.83±6.91 |
| 7 | 50.88±9.53 | 44.74±9.22 |
| 8 | 90.43±10.71 | 57.22±9.87 |
2.3.1 肝脏特异性标记物基因的表达: 诱导组21天肝脏特异性标记物基因ALB、CK18、TTR和AFP均有表达, 而新鲜mMSCs及非诱导组则无表达, 小鼠肝细胞为阳性对照(图1).
2.3.2 肝脏特异性标记物的蛋白表达: 诱导组中, 细胞同时表达ALB和CK18, ALB表达于胞质和胞膜, CK18表达于胞质(图2). 第21天流式细胞术检测诱导组ALB阳性细胞的比例为82.83%±9.03%, CK18阳性细胞的比例为74.79%±8.41%
2.3.3 肝细胞功能实验: 在诱导组中, 细胞从3 d以后开始分泌ALB, 并随着诱导时间的延长, 分泌ALB量不断增多; 到第15天时, ALB的分泌达到高峰, 以后随着诱导时间的延长, ALB分泌量略有减少, 但仍维持在较高水平(图3)在诱导组中, 细胞第3天开始具有合成尿素的能力, 并随着诱导时间的延长, 合成尿素的功能不断增强, 到第15天时, 尿素的合成达到高峰, 以后随着诱导时间的延长, 尿素合成略有减少, 但仍维持在较高水平(图4).
肝脏的发生发育需要一系列生理过程. 在该过程中, 多种生长因子和细胞因子参与肝脏的发生发展. 小鼠的胎肝发生于胚胎期第9天, 在胚胎发育过程中, 肝脏属于内胚层来源, 由前肠内胚层和心脏源性中胚层的相互作用而形成[15-16]. 在此过程中, FGF-4可以作用于肝脏发生的起始阶段, 参与了内胚层向肝脏的转化[9], OSM则在胚胎发育的中晚期对肝脏的发育成熟具有重要作用[10]. 另外, HGF对于肝脏的产生、分化以及出生后肝脏的成熟过程中具有重要作用[11]. 其他细胞因子如EGF, TGF等在肝脏发育及再生过程中也有重要作用[12].
细胞体外诱导分化的条件可能有别于体内. 在骨髓干细胞体外向肝细胞转化的研究中, HGF[17-19], HGF和EGF[20], HGF和/或FGF-4[21]均有采用, 但是目前仍未有对其相互作用做系统深入研究的报道. 在体外的诱导培养条件中, HGF, FGF-4, EGF, OSM[9-12,15]对骨髓干细胞转化为肝细胞是否都有作用? 他们之间有无交互作用? 本研究的目的就是通过统计学交叉设计分组研究的方法, 对各种细胞生长因子的交互作用进行探讨, 以期能够筛选出骨髓单个核细胞体外转化肝细胞的最佳诱导体系. 并采用通过RNA水平、蛋白水平以及细胞的功能实验3方面检测来验证该最佳体系的实际诱导效果. 我们之前的研究清晰地显示采用FGF-4, OSM, HGF和EGF[13]可以将骨髓基质干细胞诱导为肝细胞样细胞, 所以我们选取该4个因子在4个不同浓度水平进行分析. ALB和CK18是目前认同的可以用来确定细胞是否为肝细胞的标记物[16-18]. 故我们选择ALB和CK18作为2变量, 通过研究HGF, FGF-4, EGF, OSM这4个因素和CK18和ALB 2变量之间的定性和定量关系, 来筛选最佳的因素组合.
通常采用的实验设计方法有全面实验法、正交实验法和均匀设计法. 全面实验法是让每个因素的每个水平都有配合的机会, 并且配合的次数一样多, 其优点是结论较精确, 缺点是实验次数太多[24]. 本实验设计4因素4浓度水平的研究, 如果使用全面实验法, 所要分的实验组或实验次数为256组/次, 显然不符合实验实际情况; 正交实验法是使用一套规格化的正交表, 排出最有代表新的实验, 合理节省实验次数, 并从实验数据中充分提取所需信息, 特点是具有均匀分散, 整齐可比性. 在正交实验中, 如果有s个因素, 他们各取q个水平, 如果高阶交互作用可以忽略不计, 其实验数n必须大于s(q-1)+0.5s(s-1)(q-1)2[25-27]. 本实验如果考虑使用正交设计, 在高阶交互作用忽略不计情况下, 实验次数还需要66次, 也不符合实验实际情况. 故我们采用4因素4水平的均匀设计法, 均匀设计是一种以最少的实验次数揭示事物本质的实验设计与参数优化方法, 每因素容纳较多的水平, 不考虑"整齐可比"而保持"均衡分散", 用多元回归分析等数理统计手段对实验结果进行定量分析, 按均匀设计表即U表安排实验, 用更少的实验次数获取更多的信息[27-28]. 因此, 这种实验方法的主要优点为: 第一, 实验次数少, 节约时间和成本; 第二, 可以考虑因素之间的交互作用; 第三, 能够建立描述各实验因素在其条件范围内与实验指标间关系的数学模型(建立回归模型), 筛选变量方便; 第四, 在建立了有效回归模型后找出使实验指标达到最好的各实验因素间的水平组合方式, 使实验条件最优化; 第五, 均匀设计表即U表在网上可以直接查阅并使用, 网址为http://www.math.hkbu.edu.hk/uniformdesign[28-29].
以此为依据, 我们建立8组不同的诱导培养体系, 分别对骨髓基质干细胞在不同的体系下进行诱导培养. 我们选择ALB和CK18阳性细胞的百分率作为研究的变量. 通过流式细胞仪检测在不同诱导体系下ALB和CK18阳性细胞的百分率. 实验结果通过线性回归分析, 我们发现CK18的表达和FGF与OSM有关; ALB的表达和OSM有关. 结合肝脏发生发育过程中, 各细胞因子和生长因子对肝脏发生发育的影响和作用[9-10,15-16], 我们在体外实验中筛选的结果和肝脏发生发育的理论是吻合的, 说明均匀设计实验方法在本实验设计中运用是准确的, 研究结果可靠.
为了验证最佳诱导体系的诱导效率及效果, 我们通过RNA水平、蛋白水平以及细胞的功能实验三方面研究和鉴定. 首先, 我们选择AFP, ALB, CK18和TTR作为肝细胞特异性标记. AFP是内胚层分化以及胎肝细胞早期的标记; ALB在胎肝细胞中开始表达, 成熟肝细胞表达最高[22]; CK18是细胞骨架蛋白, 表达于成熟肝细胞; TTR在肝脏发育的整个过程都有表达[30]. 本实验中, 我们在干细胞诱导的过程中, 在基因水平和蛋白水平均检测到以上标志的表达. 体外诱导转化的细胞还能够合成尿素和分泌白蛋白, 这些合成功能有时间依赖性. 尽管肝细胞和肾小管上皮均能产生尿素, 而白蛋白的产生是肝细胞特有的功能活动[31]. 因此实验的结果足以说明诱导的细胞表现了肝细胞的合成和代谢功能. 并且其诱导效率高于以往研究报道[13]. 研究结果表明, 通过以FGF-4和OSM等诱导因子为主建立的诱导体系的培养, 骨髓基质干细胞可以转化为具有肝细胞形态, 结构和功能的细胞, 诱导体系的建立是成功的. 同时, 诱导体系中采用FGF-4 35 mg/L和OSM 30 mg/L可以获得最佳的诱导结果, 具有合理性和有效性. 该结果有助于其在人工肝支持系统以及肝细胞输注方面的应用.
均匀设计实验方法可以有效筛选出骨髓基质干细胞体外分化为肝细胞的最佳诱导体系, 以35 mg/L FGF、30 mg/L OSM为主的诱导培养体系, 可以有效地促进骨髓干细胞体外定向转化为肝细胞.
以往研究报道, 在一定的体外条件下, MSC可以向肝样细胞进行分化. 但多数报道仅是对此进行现象观察, 而未重视其可重复性和如何提高分化效率. 本实验通过研究HGF, FGF-4, EGF, OSM这4个因素和ALB和CK18两变量之间的定性和定量关系, 来筛选最佳的因素组合.
刘彬彬, 副研究员, 复旦大学附属中山医院、复旦大学肝癌研究所; 潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
近年来对骨髓干细胞的研究发现, 在体外通过特殊的诱导分化条件, 可以使骨髓干细胞分化为肝样细胞. 其中, 诱导分化条件的设定直接影响诱导后分化的效果. 所以对诱导体系的优化是最近该领域的研究重点, 而可重复性和诱导效率则是评价诱导体系优劣的最为重要的指标.
在骨髓干细胞体外向肝细胞转化的研究中, 细胞因子HGF, HGF和EGF, HGF和/或FGF-4均有采用. 但这些细胞因子间的相互作用以及如何组合搭配方能提高可重复性、获得较高的诱导效率则尚无相关研究报道.
本实验借助统计学均匀设计的方法, 研究了不同诱导因子在诱导体系中的作用, 进而筛选出最佳诱导体系需含的诱导因子种类及浓度. 并采用该最佳诱导体系成功且高效地将骨髓基质干细胞在体外诱导分化为肝样细胞.
实验者通过均匀设计的方法进行实验分组, 每组搭配不同的诱导因子及浓度. 在规定的诱导时间, 对各组有多少干细胞分化为肝细胞进行计数, 经过统计学分析计算后, 找到具体的诱导因子及其浓度. 采用以上的最佳诱导体系, 从细胞形态, 特征性基因、蛋白质表达情况, 以及合成、代谢功能的检测, 来验证分化得到的是有功能的肝细胞.
本文实验设计合理, 方法得当, 结果可靠, 有较好的学术价值.
编辑: 李军亮 电编:郭海丽
| 1. | Weissman IL. Stem cells: units of development, units of regeneration, and units in evolution. Cell. 2000;100:157-168. [PubMed] [DOI] |
| 2. | Theise ND, Badve S, Saxena R, Henegariu O, Sell S, Crawford JM, Krause DS. Derivation of hepatocytes from bone marrow cells in mice after radiation-induced myeloablation. Hepatology. 2000;31:235-240. [PubMed] [DOI] |
| 3. | Alison MR, Poulsom R, Jeffery R, Dhillon AP, Quaglia A, Jacob J, Novelli M, Prentice G, Williamson J, Wright NA. Hepatocytes from non-hepatic adult stem cells. Nature. 2000;406:257. [PubMed] [DOI] |
| 4. | Theise ND, Nimmakayalu M, Gardner R, Illei PB, Morgan G, Teperman L, Henegariu O, Krause DS. Liver from bone marrow in humans. Hepatology. 2000;32:11-16. [PubMed] [DOI] |
| 5. | Lagasse E, Connors H, Al-Dhalimy M, Reitsma M, Dohse M, Osborne L, Wang X, Finegold M, Weissman IL, Grompe M. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat Med. 2000;6:1229-1234. [PubMed] [DOI] |
| 6. | Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature. 2002;418:41-49. [PubMed] [DOI] |
| 7. | Hemler ME, Rutishauser U. Cell-to-cell contact and extracellular matrix. Editorial overview Curr Opin Cell Biol. 2000;12:539-541. [PubMed] [DOI] |
| 8. | Birchmeier C, Brohmann H. Genes that control the development of migrating muscle precursor cells. Curr Opin Cell Biol. 2000;12:725-730. [PubMed] [DOI] |
| 9. | Wells JM, Melton DA. Vertebrate endoderm development. Annu Rev Cell Dev Biol. 1999;15:393-410. [PubMed] [DOI] |
| 10. | Taga T, Kishimoto T. Gp130 and the interleukin-6 family of cytokines. Annu Rev Immunol. 1997;15:797-819. [PubMed] [DOI] |
| 11. | Somerset DA, Afford SC, Strain AJ, Kilby MD. Fetal growth restriction and hepatocyte growth factor. Arch Dis Child Fetal Neonatal Ed. 1997;77:F244-F248. [PubMed] |
| 12. | Kamiya A, Kinoshita T, Miyajima A. Oncostatin M and hepatocyte growth factor induce hepatic maturation via distinct signaling pathways. FEBS Lett. 2001;492:90-94. [PubMed] [DOI] |
| 13. | Shi XL, Qiu YD, Wu XY, Xie T, Zhu ZH, Chen LL, Li L, Ding YT. In vitro differentiation of mouse bone marrow mononuclear cells into hepatocyte-like cells. Hepatol Res. 2005;31:223-231. [PubMed] [DOI] |
| 14. | Levite M, Meshorer A, Reisner Y. A rapid method for obtaining murine bone marrow cells in high yield. Bone Marrow Transplant. 1991;8:225-227. [PubMed] |
| 16. | Zaret KS. Hepatocyte differentiation: from the endoderm and beyond. Curr Opin Genet Dev. 2001;11:568-574. [PubMed] [DOI] |
| 17. | Wang PP, Wang JH, Yan ZP, Hu MY, Lau GK, Fan ST, Luk JM. Expression of hepatocyte-like phenotypes in bone marrow stromal cells after HGF induction. Biochem Biophys Res Commun. 2004;320:712-716. [PubMed] [DOI] |
| 18. | Oh SH, Miyazaki M, Kouchi H, Inoue Y, Sakaguchi M, Tsuji T, Shima N, Higashio K, Namba M. Hepatocyte growth factor induces differentiation of adult rat bone marrow cells into a hepatocyte lineage in vitro. Biochem Biophys Res Commun. 2000;279:500-504. [PubMed] [DOI] |
| 19. | Fiegel HC, Lioznov MV, Cortes-Dericks L, Lange C, Kluth D, Fehse B, Zander AR. Liver-specific gene expression in cultured human hematopoietic stem cells. Stem Cells. 2003;21:98-104. [PubMed] [DOI] |
| 20. | Miyazaki M, Akiyama I, Sakaguchi M, Nakashima E, Okada M, Kataoka K, Huh NH. Improved conditions to induce hepatocytes from rat bone marrow cells in culture. Biochem Biophys Res Commun. 2002;298:24-30. [PubMed] [DOI] |
| 21. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] |
| 22. | Pan CJ, Lei KJ, Chen H, Ward JM, Chou JY. Ontogeny of the murine glucose-6-phosphatase system. Arch Biochem Biophys. 1998;358:17-24. [PubMed] [DOI] |
| 23. | Tateno C, Yoshizato K. Growth and differentiation in culture of clonogenic hepatocytes that express both phenotypes of hepatocytes and biliary epithelial cells. Am J Pathol. 1996;149:1593-1605. [PubMed] |
| 24. | Atkinson AC, Donev AN. Optimum Experimental Designs. 1992;. |
| 25. | Goupy JL. Methods for experimental design:Principles and Application for physicists and Chemists. 1993;. |
| 27. | 曾 昭钧. 均匀设计及其应用. 第1版. 沈阳: 辽宁人民出版社 1994; 54-60. |
| 28. | Fang KT, Lin DKJ, Winker P, Zhang Y. Uniform design: Theory and Applications. Technometrics. 2000;42; 237-248. [DOI] |
| 29. | Liang YZ, Xu QS, Xu QS. Uniform design and its applications in chemistry and chemical engineering. Chemometrics and Intelligent Laboratory Systems. 2001;58:43-57. |
| 30. | Makover A, Soprano DR, Wyatt ML, Goodman DS. An in situ-hybridization study of the localization of retinol-binding protein and transthyretin messenger RNAs during fetal development in the rat. Differentiation. 1989;40:17-25. [PubMed] [DOI] |
| 31. | Dunn JC, Tompkins RG, Yarmush ML. Long-term in vitro function of adult hepatocytes in a collagen sandwich configuration. Biotechnol Prog. 1991;7:237-245. [PubMed] [DOI] |