修回日期: 2008-05-01
接受日期: 2008-05-12
在线出版日期: 2008-07-08
目的: 采用RNA干扰技术(siRNA)阻断5-LOX基因的表达, 观察其抑制人胰腺癌细胞增殖及诱导细胞凋亡的作用.
方法: 构建靶向5-LOX的siRNA质粒表达载体, 采用Lipofectamine-2000转染人胰腺癌细胞株SW1990, 采用RT-PCR检测RNA干扰后5-LOX mRNA表达, MTT法检测细胞的增殖抑制率, 流式细胞仪检测细胞凋亡率.
结果: 靶向5-LOX序列特异性的三条siRNA(组1、组2、组3)可以有效地抑制SW1990细胞5-LOX基因表达, 其表达抑制率分别为19.6%±1.9%、55.4%±2.6%和55.2%±2.7%. 转染靶向5-LOX siRNA的三个质粒表达载体可以显著抑制SW1990细胞的增殖, 细胞接种24 h后, 三组增殖抑制率分别为5.37%±1.19%、11.63%±1.25%和13.67%±1.04%; 48 h后其增殖抑制率分别为16.13%±1.5%、26.63%±1.22%和25.47%±1.67%, 各siRNA组增殖抑制率高于空白组和阴性对照组(均P<0.05), 转染后24 h和48 h三组细胞凋亡率分别为5.56%±1.05%、11.45%±1.44%、12.13%±1.36%和7.37%±1.23%、18.75%±1.5%和22.02%±1.45%, 均高于空白对照组和阴性对照组(P<0.05).
结论: 所构建的靶向5-LOX的siRNA质粒表达载体可以有效阻断SW1990细胞5-LOX基因表达, 显著地抑制SW1990细胞增殖, 并在一定程度上诱导其凋亡.
引文著录: 张海峰, 周国雄, 丁晓凌, 沈勤, 杨江勇. 靶向5-LOX的siRNA诱导胰腺癌细胞的凋亡. 世界华人消化杂志 2008; 16(19): 2107-2111
Revised: May 1, 2008
Accepted: May 12, 2008
Published online: July 8, 2008
AIM: To investigate the effects of siRNA (small interfering RNA) on cell proliferation, apoptosis in human pancreatic cancer cell line SW1990 through knockout of 5-lipoxygenase (5-LOX).
METHODS: The siRNA expression vectors targeted at 5-LOX gene were designed and DNA template was synthesized, then siRNA was obtained by in vitro transcription. After siRNA was transfected into cell line SW1990 with Lipofectamine-2000, the expression level of 5-LOX mRNA was detected using RT-PCR, SW1990 cell proliferation inhibition was evaluated by MTT assay and apoptosis rate was measured by flow cytometry.
RESULTS: The sequence-specific siRNA effectively suppressed 5-LOX mRNA expression in cell line SW1990. The expression inhibition rates (19.6% ± 1.9%, 55.4% ± 2.6% and 55.2% ± 2.7%) of 5-LOX mRNA in group 1-3 were all higher than those in negative control groups (2.9%). At 24 h and 48 h after cell seeding, the proliferation inhibition rates (5.37% ± 1.19%, 11.63% ± 1.25% and 13.67% ± 1.04%; 16.13% ± 1.5%, 26.63% ± 1.22% and 25.47% ± 1.67%) of cell line SW1990 in group 1-3 were significantly higher than those in blank control group and negative control group, respectively (P < 0.05). Apoptosis inhibition rates (5.56% ± 1.05%, 11.45% ± 1.44% and 12.13% ± 1.36%; 7.37% ± 1.23%, 18.75% ± 1.5% and 22.02% ± 1.45%) of cell line SW1990 in group 1-3 were also higher than those in blank control group and negative control group (P < 0.05).
CONCLUSION: siRNA plasmid expression vectors targeted at 5-LOX in vitro effectively block 5-LOX gene expression, significantly inhibit cell proliferation, and induce cell apoptosis to some extent of cell line SW1990.
- Citation: Zhang HF, Zhou GX, Ding XL, Shen Q, Yang JY. Small interfering RNA targeted on 5-lipoxygenase induces apoptosis of pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(19): 2107-2111
- URL: https://www.wjgnet.com/1009-3079/full/v16/i19/2107.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i19.2107
胰腺癌是一种恶性程度极高、预后极差的肿瘤, 发病率在国内外呈上升趋势. 胰腺癌的治疗是临床一大难题, 其主要原因是缺乏早期诊断的方法, 手术机会少, 而现有各项非手术疗法的效果又极为不佳, 因此, 迫切需要进行胰腺癌相关基因的基础研究, 为临床诊治提供指导. 目前对脂质代谢紊乱与肿瘤相关性的研究显示, 5-脂氧合酶(5-lipoxygenase, 5-LOX)代谢途径异常是促进多种肿瘤发生发展的重要原因之一. RNA干扰(RNA interference, RNAi)是双链RNA介导的转录后基因沉默, 具有高度的特异性和有效性, 正在成为基因功能研究的有力工具. 因此我们构建了靶向5-LOX的小干扰RNA(small interference RNA, siRNA)质粒表达载体, 并转染人胰腺癌细胞株SW1990, 观察其抑制SW1990细胞增殖及诱导细胞凋亡的作用.
人胰腺癌细胞株SW1990为贴壁细胞, 由上海交通大学附属第一人民医院消化内科王兴鹏教授惠赠. RT试剂盒购自美国Fermentas公司、PCR试剂盒购自上海生物工程有限公司、PCR扩增仪购自美国ABI公司、流式细胞仪购自美国BD公司、CO2细胞培养箱Series5400购自美国NAPCO公司.
1.2.1 胰腺癌细胞株和培养: 采用含100 mL/L小牛血清、1×105 U/L青霉素、0.1 g/L链霉素的DMEM培养基(Gibco)在37℃、50 mL/L CO2饱和湿度的条件下传代培养.
1.2.2 靶向5-LOX的siRNA质粒表达载体的构建: 由上海吉玛公司构建针对5-LOX基因的发夹状RNA的真核表达质粒pshRNA(含绿色荧光蛋白基因)3条, 以及阴性对照1条. 阴性对照序列: 载体名称pGPU6/GFP/Neo-shNC, 正义链: 5-TTCTCCGAACGTGTCACGT-3; 反义链: 5-ACGTGACACGTTCGGAGAA-3. 目的基因5-LOX siRNA的载体1: pGPU6/GFP/Neo-ALOX5-149, 正义链: 5-GCACTGACGACTACA TCACCT-3; 反义链: 5-AGGTAGATGTAGTCG TCAGTGC-3. 载体2: pGPU6/GFP/Neo-ALOX5-315, 正义链: 5-GCGCAAGTACTGGCT GAATGAT-3; 反义链: 5-ATCATTCAGCCAGTA CTTGCGC-3. 载体3: pGPU6/GFP/Neo-ALOX5-1021, 正义链: 5-GCTCCCATCTGCTTG CTGTATT-3; 反义链: 5-AATACAGCAAGCAGATGGGAGC-3.
1.2.3 SW1990细胞的转染: 常规消化收集细胞后, 将细胞接种于24孔培养板, 分为5组: (1)空白对照组; (2)阴性对照组; (3)靶基因5-LOX siRNA组1; (4)5-LOX siRNA组2; (5)5-LOX siRNA组3; 每组2个培养孔. 空白对照组转染时仅加入LipofectamineTM 2000, 阴性对照组转染时使用Lipofectamine 2000+阴性对照质粒, 阳性实验组转染时使用Lipofectamine 2000+相应质粒. 转染前1 d换用不含抗生素、含有血清(100 mL/L)的培养基. 待细胞生长至密度为70%-80%时, 进行转染. 用Opti-MEM将质粒1 μg、Lipofectamine 2000 3 μg分别稀释至50 μL, 混匀后室温放置5 min, 然后将二者混合均匀, 室温放置20 min后加入培养孔中. 多孔转染, 按上述比例批量制作转染混合物后进行转染. 转染后6 h, 换用完全培养基, 24 h后于倒置荧光显微镜下观察细胞增强绿色荧光蛋白的表达情况.
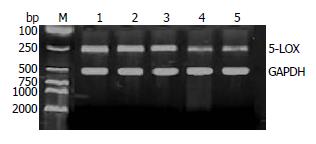
1.2.4 RT-PCR检测5-LOX基因mRNA表达的变化: 转染后24 h消化收集1×106个细胞, 按TRIzol试剂说明书提取总RNA. 紫外分光光度计测定其浓度和纯度. RT-PCR反应采用两步法. (1)cDNA的合成: 采用RevertAidTM第一链cDNA合成试剂盒, 按操作说明书合成cDNA; (2)PCR反应: 采用一管便捷式PCR反应试剂盒. 内参照GAPDH的引物序列采用国际标准序列: 5'-CGA AGTCAACGGATTTGGTCGTAT-3'(上游引物); 5'-AGCCTTCTCGGTGGTGAAGAC-3'(下游引物), 扩增产物大小为306 bp. 5-LOX的引物序列为: 5'-TCATCGTGGACTTTGAGCTG-3'(上游引物): 5'-AGAAGGTGGGTGATGGTCTG-3'(下游引物), 扩增产物大小为262 bp. 用凝胶成像分析仪进行摄像, 观察mRNA的表达.
1.2.5 MTT法检测对胰腺癌细胞增殖的抑制作用: 将细胞接种于6孔培养板中并进行转染, 分组及转染同上. 12 h后消化、收集细胞, 调整细胞浓度为1×106个/L, 分别将各组细胞接种于96孔培养板. 每组6孔, 每孔200 μL. 另设对照孔调零, 每个检测时间点接种1板, 共3板. 于细胞接种后0、24、48 h分别采用MTT法检测SW1990细胞增殖抑制率. 增殖的抑制率(PI) = (1-观察组A490值/对照组A490值)×100%.
1.2.6 流式细胞术检测细胞凋亡: 采用PI单染法检测SW1990细胞凋亡. 细胞接种于6孔培养板中并进行转染, 分组及转染同前. 分别于转染24、48 h后消化、收集细胞, 每次每组各取3孔细胞. PBS清洗2次, 用预冷的750 mL/L乙醇固定过夜, 1000 r/min, 5 min离心, 倾去上清液, PBS清洗2次, 加入0.05 g/L的RNA酶, 室温避光30 min,去除细胞内的RNA, 加入0.06 g/L的PI, 室温避光30 min后上机检测. 实验重复至少3次.
统计学处理 数据以mean±SD表示, 组间差异采用Stata软件进行方差分析或t检验, P<0.05有统计学意义.
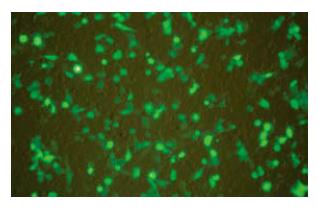
SW1990细胞转染含有绿色荧光蛋白基因的pshRNA 12 h后, 于倒置荧光显微镜下观测可见到增强绿色荧光蛋白的表达, 24 h左右表达最强(图1), 荧光显微镜直接观察转染效率约70%.
本研究中5-LOX基因mRNA在阴性对照组表达抑制率为2.9%±1.3%, 组1-组3表达抑制率分别为19.6%±1.9%、55.4%±2.6%和55.2%±2.7%. siRNA处理各组5-LOX mRNA水平有不同程度下调, 以2、3组最明显, 而在空白对照组和阴性对照组内5-LOX mRNA表达无明显改变, 表明5-LOX siRNA对SW1990细胞5-LOX基因mRNA的表达有明显的抑制效果(图2).
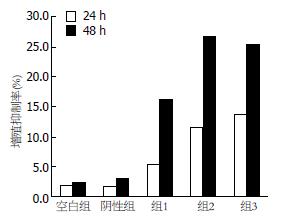
24 h增殖抑制率: 空白对照组1.80%±0.76%, 阴性对照组为2.30%±1.05%, 组1-组3分别为5.37%±1.19%、11.63%±1.25%和13.67%±1.04%; 48 h增殖抑制率: 空白对照组为2.40%±0.96%, 阴性对照组为2.70%±1.03%, 组1-组3分别为16.13%±1.5%、26.63%±1.22%和25.47%±1.67%(图3). 空白组与阴性对照对照组之间两无显著差异(P>0.05), 各siRNA组增殖抑制率高于空白组、阴性对照组(P<0.05), 其中组2、组3增殖抑制率明显高于组1(P<0.05).
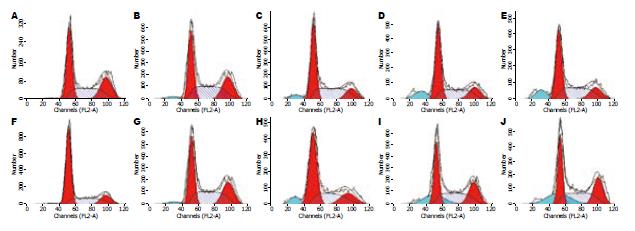
空白对照组和阴性对照组24 h凋亡率分别是1.14%±0.63%和1.98%±0.86%, 组1-组3的24 h凋亡率分别是5.56%±1.05%、11.45%±1.44%和12.13%±1.36%. 空白对照组和阴性对照组48 h凋亡率为1.71%±0.95%、2.87%±1.03%, 组1-组3的48 h凋亡率分别为7.37%±1.23%、18.75%±1.5%和22.02%±1.45%(图4). 空白对照组与阴性对照组之间两无显著性差异(P>0.05), 各siRNA组凋亡率高于空白对照组和阴性对照组(P<0.05), 其中组2、组3凋亡率明显高于组1(P<0.05).
近年来研究发现, 5-LOX对肿瘤细胞的促增殖和抗凋亡作用是肿瘤发生发展的重要环节[1]; 抑制5-LOX能使多种恶性肿瘤细胞增殖降低并诱导细胞凋亡, 且5-LOX抑制剂抑制肿瘤生长的作用比COX强[15-17]. 多聚不饱和脂肪酸代谢与肿瘤形成之间关系的分子学研究为肿瘤的发生和发展提供了新的理论, 也为肿瘤的预防和治疗提供了新的靶作用分子. RNA干扰是由双链RNA(double-stranded RNA, dsRNA)诱导的在转录后mRNA水平关闭相应基因表达的过程, 导致序列特异性的基因沉默, 作为一种引起基因沉默的新技术, 能够快速、高效、特异地抑制靶基因表达, RNAi相关技术在肿瘤研究中涉及肿瘤发生发展、侵袭与转移、信号转导、周期调控、凋亡和治疗方面, 是研究肿瘤发生发展机制强有力的工具. 目前有许多研究通过siRNA技术抑制胰腺癌的基因K-ras、Survivin、bcl-2等的表达, 使肿瘤细胞生长抑制并出现凋亡[2-8]. 我们以5-LOX作为靶点, 设计合成了高特异性的siRNA序列, 研究发现通过siRNA转染可显著下调5-LOX mRNA表达, 其表达抑制率分别为19.6%±1.9%、55.4%±2.6%和55.2%±2.7%. 细胞转染24和48 h后其增殖抑制率分别为5.37%±1.19%、11.63%±1.25%、13.67%±1.04%和16.13%±1.50%、26.63%±1.22%和25.47%±1.67%; 细胞凋亡率分别为5.56%±1.05%、11.45%±1.44%、12.13%±1.36%和7.37%±1.23%、18.75%±1.50%和22.02%±1.45%, 说明转染靶向5-LOX的siRNA质粒表达载体可以显著抑制SW1990细胞的增殖, 并诱导肿瘤细胞凋亡. 这与我们先前报道的应用雷公藤内酯醇、齐留通等抑制5-LOX表达能抑制细胞生长, 诱导细胞凋亡是相符的, 提示采用基因技术封闭5-LOX蛋白表达, 可以达到治疗目的[9-14]. RNA干扰的方法可以较好抑制SW1990细胞的5-LOX mRNA表达, 并能导致细胞的增殖抑制和凋亡, 为胰腺癌的临床诊治提供了新的思路. 本实验中第二、三组抑制效果较一组更为明显, 提示RNA干扰技术抑制基因表达的效果与靶位点的选择密切相关.
本研究中我们采用靶向5-LOX的siRNA质粒表达载体抑制了细胞中5-LOX mRNA的表达, 而对GAPDH的表达却无抑制作用, 设计的阴性对照质粒转染细胞后未对胰腺癌细胞的生物活性产生影响, 说明RNA干扰具有高度特异性、安全性. 在5-LOX表达抑制后, 细胞的生长增殖被明显抑制, 细胞凋亡显著增加. 因此有理由相信可以通过抑制5-LOX表达来预防和治疗5-LOX高表达肿瘤.
总之, 通过构建靶向5-LOX的siRNA真核表达载体导入细胞可以有效特异地抑制人胰腺癌细胞中5-LOX的表达. 应用RNA干扰的方法抑制5-LOX的表达来预防和治疗5-LOX高表达肿瘤的方法具有高效、特异、安全的特点, 值得深入研究.
胰腺癌是一种恶性程度极高、预后极差的肿瘤, 发病率在国内外呈上升趋势. 胰腺癌的治疗是临床一大难题, 其主要原因是缺乏早期诊断的方法, 手术机会少, 而现有各项非手术疗法的效果又极为不佳, 因此, 迫切需要进行胰腺癌相关基因的基础研究, 为临床诊治提供指导. 目前对脂质代谢紊乱与肿瘤相关性的研究显示, 5-脂氧合酶(5-LOX)代谢途径异常是促进多种肿瘤发生发展的重要原因之一.
谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科
如何抑制5-LOX异常表达而达到治疗肿瘤的目的是该领域研究热点.
近年来研究发现, 5-LOX对肿瘤细胞的促增殖和抗凋亡作用是肿瘤发生发展的重要环节, 抑制5-LOX能使多种恶性肿瘤细胞增殖降低并诱导细胞凋亡, 且5-LOX抑制剂抑制肿瘤生长的作用比COX强. 此外, 多种致IR物质, 如FFA、TNF-α等也可影响PI-3K活性, 说明PI-3K是这些物质导致IR的中介分子之一.
构建的靶向5- LOX的siRNA质粒表达载体可以有效阻断SW1990细胞5-LOX基因表达, 显著地抑制SW1990细胞增殖, 并在一定程度上诱导其凋亡.
本研究符合伦理学要求, 材料方法使用恰当, 结论可靠, 能够反映我国胃肠病学基础研究的先进水平.
编辑: 李军亮 电编:何基才
| 1. | 邹 来玉, 李 建英, 王 小众. 5-脂氧合酶与消化系肿瘤的关系. 国外医学·内科学分册. 2006;4:177-180. |
| 2. | Wang W, Wang CY, Dong JH, Chen X, Zhang M, Zhao G. Identification of effective siRNA against K-ras in human pancreatic cancer cell line MiaPaCa-2 by siRNA expression cassette. World J Gastroenterol. 2005;11:2026-2031. [PubMed] |
| 3. | 张 峰, 刘 晔, 刘 三光, 谢 绍建, 李 冬斌, 李 荣琴, 蔡 建辉. 基因枪转导突变特异性K-ras siRNA对胰腺癌细胞生长的抑制作用. 中华实验外科杂志. 2006;23:28-30. |
| 4. | Chen LM, Le HY, Qin RY, Kumar M, Du ZY, Xia RJ, Deng J. Reversal of the phenotype by K-rasval12 silencing mediated by adenovirus-delivered siRNA in human pancreatic cancer cell line Panc-1. World J Gastroenterol. 2005;11:831-838. [PubMed] |
| 6. | Ocker M, Neureiter D, Lueders M, Zopf S, Ganslmayer M, Hahn EG, Herold C, Schuppan D. Variants of bcl-2 specific siRNA for silencing antiapoptotic bcl-2 in pancreatic cancer. Gut. 2005;54:1298-1308. [PubMed] [DOI] |
| 7. | Tsuji N, Asanuma K, Kobayashi D, Yagihashi A, Watanabe N. Introduction of a survivin gene-specific small inhibitory RNA inhibits growth of pancreatic cancer cells. Anticancer Res. 2005;25:3967-3972. [PubMed] |
| 8. | Kami K, Doi R, Koizumi M, Toyoda E, Mori T, Ito D, Kawaguchi Y, Fujimoto K, Wada M, Miyatake S. Downregulation of survivin by siRNA diminishes radioresistance of pancreatic cancer cells. Surgery. 2005;138:299-305. [PubMed] [DOI] |
| 13. | 陈 浩莉, 邹 来玉, 李 建英, 王 小众, 陈 治新, 黄 月红. 联合抑制环氧合酶-2与5-脂氧合酶对胃癌细胞增殖凋亡的影响. 世界华人消化杂志. 2007;15:323-331. [DOI] |
| 14. | Zhou GX, Ding XL, Huang JF, Zhang H, Wu SB. Suppression of 5-lipoxygenase gene is involved in triptolide-induced apoptosis in pancreatic tumor cell lines. Biochim Biophys Acta. 2007;1770:1021-1027. [PubMed] |
| 15. | Hennig R, Ding XZ, Tong WG, Schneider MB, Standop J, Friess H, Büchler MW, Pour PM, Adrian TE. 5-Lipoxygenase and leukotriene B(4) receptor are expressed in human pancreatic cancers but not in pancreatic ducts in normal tissue. Am J Pathol. 2002;161:421-428. [PubMed] |
| 16. | Ding XZ, Iversen P, Cluck MW, Knezetic JA, Adrian TE. Lipoxygenase inhibitors abolish proliferation of human pancreatic cancer cells. Biochem Biophys Res Commun. 1999;261:218-223. [PubMed] [DOI] |
| 17. | Tong WG, Ding XZ, Adrian TE. The mechanisms of lipoxygenase inhibitor-induced apoptosis in human breast cancer cells. Biochem Biophys Res Commun. 2002;296:942-948. [PubMed] [DOI] |