修回日期: 2008-04-02
接受日期: 2008-05-14
在线出版日期: 2008-06-28
目的: 探讨阿司匹林提高幽门螺杆菌(H. pylori)对克拉霉素敏感性的机制.
方法: 二氧化硅法提取细菌基因组DNA, 限制性片段长度多态性(PCR-RFLP)检测阿司匹林处理前后23SrRNA突变位点的变化. 液体闪烁计数法与SDS-PAGE电泳法分别测定阿司匹林处理前后H. pylori胞内[7-3H]四环素的放射活性和外膜蛋白的变化. 实时定量PCR(Taqman探针法)测定编码H. pylori孔蛋白基因(hopA、hopB、hopC、hopD和hopE)及外流泵蛋白基因(hefA、hefB和hefC)的变化.
结果: 阿司匹林不改变H. pylori克拉霉素耐药菌株23SrRNA基因的2143A-G突变位点, 其增加H. pylori胞内放射活性. 阿司匹林处理后H. pylori外膜蛋白在分子量55-72 kDa之间有两条带表达改变, 其不改变H. pylori孔蛋白基因hopA、hopB、hopC、hopD、hopE及外流泵蛋白基因hefA、hefB、hefC的mRNA水平.
结论: 阿司匹林可能通过改变H. pylori外膜蛋白的表达, 提高H. pylori外膜对抗生素的通透性, 增加H pylori胞体内抗生素浓度.
引文著录: 张孝平, 王蔚虹, 田雨, 高文, 胡伏莲, 李江. 阿司匹林提高幽门螺杆菌对克拉霉素敏感性的机制. 世界华人消化杂志 2008; 16(18): 1990-1996
Revised: April 2, 2008
Accepted: May 14, 2008
Published online: June 28, 2008
AIM: To investigate the mechanisms of aspirin increasing the susceptibility of H. pylori to clarithromycin.
METHODS: Mutations in V function domain of 23SrRNA gene were identified by polymerase chain reaction (PCR) and restriction fragment length polymorphism analysis. H. pylori strain 26695 treated with or without aspirin was incubated with [7-3H] tetracycline. Endocellular radioactivity at different time points was analyzed in a liquid scintillation counter. Outer membrane proteins (OMPs) of H. pylori 26695 were depurated and analyzed by SDS-PAGE. Total RNA of H. pylori 26695 was extracted and the cDNA of the 5 porins (hopA, hopB, hopC, hopD, hopE) and the putative RND efflux system (hefABC) were obtained by reverse transcription (RT). The expression of the above 8 cDNAs were analyzed using Taqman-based real-time PCR.
RESULTS: Position 2143A-G mutations in V function domain of 23SrRNA gene did not change in clarithromycin resistant strains treated with aspirin. The radioactivities of H. pylori cells increased when treated with aspirin, indicating that aspirin improved the permeability of the outer membrane of H. pylori to antimicrobials. The OMP profiles of H. pylori treated with aspirin were similar to that of controls. However, the expression of two OMPs between 55-72 kDa altered in the presence of aspirin. Irrespective of the presence of aspirin, the expression of hopA, hopB, hopC, hopD, hopE and hefA, hefB, hefC did not change at the mRNA level.
CONCLUSION: Aspirin may enhance the permeability of the outer membrane of H. pylori to antimicrobials, and thus increase the endocellular concentrations of antimicrobials probably by altering the OMP expression.
- Citation: Zhang XP, Wang WH, Tian Y, Gao W, Hu FL, Li J. Mechanisms of aspirin increasing the susceptibility of Helicobacter pylori to clarithromycin. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 1990-1996
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/1990.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.1990
幽门螺杆菌(H. pylori)感染在世界范围内广泛存在, 被认为是导致慢性胃炎、消化性溃疡及胃癌的重要致病因子. 预防及根除H. pylori感染已成为预防和治疗上述疾病的主要措施. 近年随着H. pylori对抗生素耐药性的逐年增加, 目前国内外共识推荐的质子泵抑制剂加克拉霉素、甲硝唑或阿莫西林的三联方案的根除率正在逐年下降, 临床迫切需要寻找根除H. pylori的新方案及克服细菌耐药性的新方法. 非甾体类消炎药(nonsteroidal anti-inflamatory drugs, NSAIDs)是临床应用最广泛的药物之一, 很久以来就有学者注意到NSAIDs特别是阿司匹林可抑制某些细菌的生长, 改变细菌毒力因子的产生, 并影响某些细菌对抗生素的敏感性[1]. 近年研究显示, 在体外培养的条件下, 阿司匹林(乙酰水杨酸), 水杨酸钠, 吲哚美辛及选择性的环氧化酶抑制剂SC-236均可剂量依赖性的抑制H. pylori生长[2-4], 并可降低H. pylori尿素酶和空泡毒素活性[4-5]. 在较低的体外抑菌浓度下, 阿司匹林, 吲哚美辛及SC-236还可以降低H. pylori对克拉霉素, 阿莫西林及甲硝唑的最低抑菌浓度(minimal inhibitory concentration, MIC), 从而提高H. pylori对这些临床一线使用的抗生素的敏感性, 甚至使某些H. pylori的耐药菌株变为敏感菌株[2-4]. 本研究以限制性片段长度多态性的方法, 检测阿司匹林对克拉霉素耐药菌株的23SrRNA基因突变位点的影响, 初步探讨阿司匹林提高H. pylori对克拉霉素敏感性的机制.
标准菌株H. pylori 26695及3株临床分离的克拉霉素耐药菌株. 阿司匹林及CCCP购自Sigma公司, 分别溶于二甲基亚砜(DMSO)中备用; [7-3H]tetracycline(0.6 Ci/mmol_; 22.2 GBq/mmol; Dupont/NEN Research Products, Boston, Mass.)购自Perkin-Elmer公司, 溶于稀盐酸中备用; 限制性内切酶BsaⅠ酶购自New Egland Biolabs公司.
1.2.1 E-test检测H. pylori的MIC: 收集含80 g/L羊血的Columbia琼脂培养基上培养48 h的克拉霉素耐药H. pylori菌株, 调整浓度至3×1011 cfu/L, 接种于含和不含阿司匹林(1 mmol/L)的平皿中, L棒均匀涂开, 晾干后放置一条含克拉霉素的E-test药条(OXOID公司), 37℃微需氧培养72 h.
1.2.2 H. pylori液体培养体系的建立: 收集培养48 h的H. pylori, 于含有100 mL/L胎牛血清的布氏肉汤培养液中, 调整浓度在1×1010-1×1011 cfu/L, 20 mL菌液加入灭菌10 cm的培养皿中, 37℃, 微需氧, 空气摇床60 r/min, 培养48 h.
1.2.3 H. pylori基因组DNA的提取: 收集液体培养的H. pylori, 以Tris-HCl洗涤, 细菌沉淀溶于100 mL TE中, 加入二氧化硅溶液5 mL及结合液(4 mol/L异硫氰酸胍, 50 mmol/L Tris-HCl, 20 mmol/L EDTA)400 mL, 55℃加热5 min, 每分钟振摇1次. 室温8000 r/min离心, 30 s, 弃上清. 以清洗液(20 mmol/L Tris-HCl, 1 mmol/L EDTA, 100 mmol/L NaCl高压消毒后加入等量无水乙醇)反复洗涤3次. 沉淀置于55℃干燥后溶于50 mL TE中备用.
1.2.4 克拉霉素耐药基因突变位点的检测: PCR扩增包含23SrRNA基因V功能区的DNA片段: 上游引物: 5'-CCACAGCGATGTGGTCTCAG-3', 下游引物: 5'-CTCCATAAGAGCCA AAGCCC-3'. PCR反应总体积50 mL, 包括H. pylori基因组DNA 5 mL、10×PCR Buffer 5 mL, dNTPs(各2.5 mmol/L)5 mL, 上、下游引物(各5 mmol/L)2 mL、1 U TaqDNA聚合酶0.5 mL. 反应条件: 94℃预变5 min, 94℃变性1 min、55℃退火1 min、72℃延伸1 min, 35个循环, 72℃延伸10 min. 扩增产物预期长度为425 bp. 10 mL PCR产物用BsaⅠ限制性内切酶酶切, 15 g/L琼脂糖凝胶电泳观察PCR产物及酶切产物.
1.2.5 检测H. pylori外膜对抗生素通透性: 收集液体培养6 h的H. pylori 26695, 以HEPES Buffer(pH7.2, 内含100 mmol/L MgCl2)洗涤、悬浮. 10 mL细菌悬液(约3-5×1012/L)加入[7-3H]tetracycline至5 mCi., 室温下孵育, 每10 min取1 mL. 20 min后, 将细菌悬液分成两份, 其中1份中加入100 mmol/L CCCP, 继续每10 min取1 mL, 直至60 min. 取出的每份菌液立即离心, 以PBS洗涤3次, 沉淀以闪烁液稀释后, 用液体闪烁计数仪(TRI-CARB 2100TR)测定其放射性.
1.2.6 H. pylori外膜蛋白的提取: 收集液体培养的H. pylori 26695, 以Tris-Mg液洗涤三次并重悬, 超声破碎(每次30 s, 间隔3-5 s, 总时间5 min)细菌至镜下呈细颗粒状. 6000 r/min, 4℃离心, 取上清. 50 000 g, 4℃离心60 min, 弃上清. 沉淀重悬于含20 mL/L Triton Tris-Mg(pH7.5)液中, 室温孵育30 min, 重复离心、孵育, 再次离心得到沉淀即为细菌外膜蛋白. 考马斯亮蓝G250法测定细菌外膜蛋白浓度.
1.2.7 SDS-PAGE凝胶电泳: 取外膜蛋白10 mg, 进行SDS-PAGE垂直电泳, 分离胶100 g/L, 浓缩胶50 g/L, 恒压电泳, 浓缩胶60 V, 分离胶100 V, 固定液固定30 min, 2.5 g/L考马斯亮兰R250染色30 min, 脱色液反复脱色后观察.
1.2.8 H. pylori总RNA的提取: 收集液体培养的H. pylori 26695, 以Tris-HCl洗涤. 依次采用TRIzol裂解细菌, 氯仿进行液相分离, 异丙醇沉淀RNA, 最后以750 mL/L乙醇洗盐. 得到的RNA经无RNA酶的DNA酶Ⅰ处理以去除DNA污染. 紫外分光光度法测定RNA浓度, 置-70℃冰箱中备用.
1.2.9 实时定量PCR: 取RNA 4 mg, DEPC水稀释后70℃, 5 min, 冰上15 min, 加入5×RT Buffer 4 mL, RNasin 0.4 mL, dNTPs 4 mL, Random Primers 2 mL, M-MLV 1 mL, 37℃ 1 h, 95℃ 5 min, 得到cDNA 20 mL. Taqman探针5'端标记的FAM为荧光报告基因, 3'端标记的TAMRA为荧光淬灭基因. H. pylori孔蛋白基因(hopA, hopB, hopC, hopD和hopE)及外流泵蛋白基因(hefA、hefB、hefC)Tagman探针及引物设计采用Primer Express 3.0软件(Applied Biosystem Perkin-Elmer), 核苷酸序列5'-3'如下: hopA F: ATCATGCTAGTGATGGCGTTAAAG, hopA R: CAGGCATAGACGGAGGCAAT, hopA Probe: CCAAAAATATTGCATGCGTTCCCGC; hopB F: CTTGGTGCAAAACATCGTCAAT, hopB R: CCCGCCATAGCTCACTTGAT, hopB Probe: TAACGCTAGCCAACAACGCTAACATCAGCA; hopC F: CGCTCTTTATAACGCGCAAGTAA, hopC R: GCTGTTCCCGGCTCTGAAT, hopC Probe: TGGATAAAATCAACGCGCTCAACAATCAG; hopD F: CTGCTTGAGCGCGGTTTAA, hopD R: CAACCTAGACACTGGGAAAGCAT, hopD Probe: CTTGCGCTCTAGCGTTAGCGAACATGC; hopE F: GGATTGCACAGGGAGTGTTGT, hopE R: GCCCCATTAGCGTATTTAGCAT, hopE Probe: TTGCCCCCCAGGTCTTACCGCT; hefA F: AGGGCGTTTTGGGAATTTCT, hefA R: GCATGATGGATTGTTTTTGCA, hefA Probe: CCCCGGTCAGCAAAATACGGC TG; hefB F: AGGGCGATGTTTTGTTGCTT, hefB R: CCCCCAATTTTGCTGTATCGT, hefB Probe: AATCAAGACAAACAGGCTCAAAGCGATTCC; hefC F: GTTTGCGTTCTTGCGTAACG, hefC R: TGTTTAATGAAAAGCCCATCCA, hefC Probe: CACGATCACCCTCGTTTCAGCGATC. 50 mL PCR反应体系包括: 10×PCR Buffer(内含15 mmol/L MgCl2)5 mL, cDNA 4 mL, 上下游引物(各5 mmol/L)3 mL, dNTPs(各2.5 mmol/L)4 mL, Tagman探针2 mL, ROX 1 mL, 1 U TaqDNA聚合酶0.5 UL. 反应循环参数: 95℃ 10 min, 后95℃ 15 s, 60℃ 1 min, 40个循环. ABI PRISM 7300 Detector System自动检测每个PCR循环Reporter荧光的释放, 根据已知初始cDNA分子数的标准曲线, 得出样本的cDNA分子数.
统计学处理 实验数据mean±SD表示, 采用t检验, 以软件SPSS13.0处理.
在培养基中含1 mmol/L阿司匹林条件下, 3株克拉霉素耐药的H. pylori菌株的MIC均减小: 其中C1菌株的MIC由16 mg/L降低为<0.016 mg/L, C2菌株由12 mg/L降低为<0.016 mg/L, C3菌株由64 mg/L降低为8 mg/L. 说明阿司匹林可以提高H. pylori对克拉霉素的敏感性, 其中C1及C2株菌株由克拉霉素耐药菌株转变为敏感菌株.
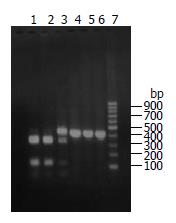
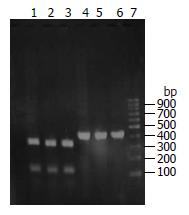
3株克拉霉素耐药菌株经PCR均扩增出425 bp的DNA片段, 其中包含23SrRNA基因V功能区, C1及C2菌株的PCR产物可以被BsaⅠ限制性内切酶酶切成两个片段, 提示C1、C2菌株在23SrRNA基因V功能区第2143位点有A-G突变. C3菌株的425 bp的DNA片段未能被BsaⅠ酶完全酶切(图1). 经阿司匹林处理后C2菌株转变为克拉霉素敏感菌株C2a, 其PCR产物仍可被BsaⅠ限制性内切酶酶切成两个片段, 提示阿司匹林不改变C2菌株在23SrRNA基因V功能区的第2143位A-G突变位点(图2).
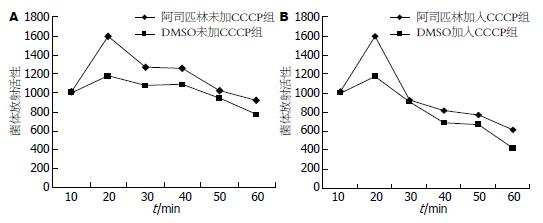
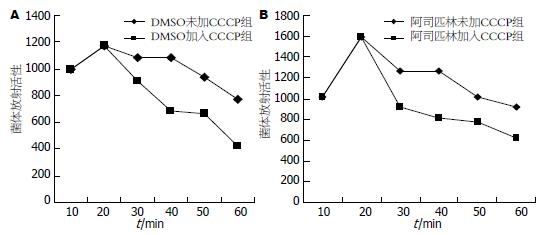
未加入CCCP及加入CCCP实验组中, 经阿司匹林处理的H. pylori在各时间点上与DMSO溶媒对照相比放射活性较高, 说明在阿司匹林作用下, 进入H. pylori胞体内的[7-3H]tetracycline增多, 提示阿司匹林增加H. pylori外膜对抗生素的通透性(图3). 阿司匹林组与DSMO对照组在加入外流泵抑制剂CCCP后, H pylori胞体内放射活性均下降, 说明药物在细菌胞内聚集减少(图4), 提示CCCP破坏细菌膜两侧的pH梯度, 使得细菌内的药物浓度下降.
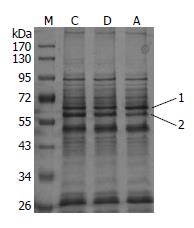
阿司匹林处理后的H. pylori 26695外膜蛋白经100 g/L SDS-PAGE得到多条电泳条带, 与对照组相比基本相同, 但在分子质量55-72 kDa之间有两蛋白条带1、2, 阿司匹林处理后表达改变, 其中条带1似有增加, 条带2似有减少(图5).
阿司匹林处理后, H. pylori孔蛋白基因hopA、hopB、hopC、hopD、hopE及外流泵蛋白基因hefA、hefB、hefC的cDNA相对含量与DSMO对照组及空白对照组相比均无明显差别(P>0.05, 表1), 提示阿司匹林不改变H. pylori上述孔蛋白及外流泵蛋白基因的mRNA含量.
| 基因 | 阿司匹林组 | DMSO对照组 | 空白对照组 |
| hopA | 963.60±23.33 | 1087.75±26.42 | 856.27±25.43 |
| hopB | 84.00±15.97 | 91.45±14.83 | 100.15±16.28 |
| hopC | 52.98±11.67 | 51.77±12.01 | 52.79±10.27 |
| hopD | 83.86±14.09 | 92.46±17.78 | 89.92±13.72 |
| hopE | 54.07±10.58 | 52.77±11.93 | 52.12±9.92 |
| hefA | 12.31±2.12 | 12.51±1.99 | 12.97±2.76 |
| hefB | 25.47±4.73 | 28.48±5.07 | 25.60±4.99 |
| hefC | 55.62±8.89 | 52.08±9.78 | 53.37±10.04 |
H. pylori感染是慢性活动性胃炎、消化性溃疡的主要致病因素, 与胃癌、胃黏膜相关淋巴样组织(MALT)淋巴瘤的发生密切相关. 1994年世界卫生组织国际癌症研究机构(IARC)将其列为人类Ⅰ类致癌原. 近年研究表明, H. pylori感染在心脑血管性疾病、免疫性疾病、营养代谢性疾病和皮肤病等疾病的发病中起一定的作用[6]. 根除H. pylori对治疗和预防上述疾病是十分重要的. 但随着抗生素在临床上的广泛应用, H. pylori的耐药问题已经显得越来越突出, 临床研究表明, H. pylori对克拉霉素耐药是导致根除治疗失败的主要原因[7-9].
早期研究表明, 水杨酸盐可以抑制大肠杆菌、肺炎克雷伯氏杆菌、铜绿假单胞菌及表皮葡萄球菌的生长, 并影响细菌的菌毛、鞭毛、生物被膜等毒力因子的活性, 从而可能改变细菌的致病性[10-17]. 水杨酸盐制剂对不同细菌对不同抗生素敏感性的影响却显示不同: 水杨酸盐可以诱导大肠杆菌、鼠伤寒沙门杆菌、金黄色葡萄球菌产生对多种抗生素的多重耐药, 但却可以提高这些细菌对氨基糖甙类抗生素的敏感性[18-25]. 我们近期研究也显示, 在体外培养条件下, 阿司匹林不仅抑制H. pylori的生长, 而且可以降低H. pylori对甲硝唑, 阿莫西林和克拉霉素的体外MIC, 从而提高H. pylori对这三种抗生素的敏感性, 甚至使耐药菌株转变为敏感菌株[2-4]. 本研究在此基础上, 进一步探讨阿司匹林提高H. pylori根除一线方案的关键抗生素克拉霉素敏感性的机制.
通常情况下, 细菌是通过以下途径产生对抗生素耐药: (1)产生抗生素的灭活酶; (2)减低膜对抗生素的通透性; (3)增加抗生素外流; (4)改变细菌药物作用的靶位结构. 克拉霉素、甲硝唑和阿莫西林分属于不同种类的抗生素, 分别作用于细菌的不同位点而发挥抗菌作用, H. pylori对这些抗生素耐药性的产生也是通过各自不同的作用机制实现的. 我们推测阿司匹林使这些具有不同作用机制的抗生素对H. pylori的敏感性提高, 并不是通过分别作用于细菌体内不同的靶位点, 而是通过某种机制提高菌体内抗生素的浓度, 增加抗生素对H. pylori菌靶位点的作用, 使得H. pylori对相应抗生素的敏感性提高. 本研究使用[7-3H]tetracycline以同位素闪烁技术测定了阿司匹林对H. pylori菌体内抗生素浓度的影响, 结果显示阿司匹林增加[7-3H]tetracycline进入细菌胞体内, 证实了阿司匹林增加H. pylori外膜对抗生素的通透性的推测.
H. pylori对克拉霉素耐药是由于细菌23SrRNA发生点突变, 使得H. pylori核糖体结构发生改变, 减少药物与细菌的结合造成的. Taylor et al将这两个与克拉霉素耐药有关的位置定为A2142和A2143[26], 现有较多学者将这两个位点称为A2143和A2144. 本研究应用BsaⅠ限制性内切酶进行PCR-RFLP分析显示, 阿司匹林使H. pylori由克拉霉素耐药菌株转变为敏感菌株并未导致23SrRNA A2143G突变位点发生改变.
细菌胞体内抗生素浓度的增加可能有两方面的原因, 一是药物被动进入细菌的量增加, 二是细菌主动泵出药物减少. 早期在大肠杆菌对多种抗生素耐药机制的研究显示, 水杨酸盐可作用于大肠杆菌多抗生素耐药基因(mar), 改变细菌膜蛋白的表达, 减低膜对抗生素的通透性, 增加抗生素的外流, 从而增加大肠杆菌对多种抗生素的耐药性[27-29]. 就H. pylori而言, 大多数抗生素进入细菌胞体内的通道是Porin蛋白所形成的亲水性孔道, 现已发现了至少五种微孔蛋白命名为HopA至HopE[30-31], 并认为可能与细菌的耐药性有关[30]. 此外, H. pylori有三种RND(resistance-nodulation-division)家族外流系统可能与抗生素耐药有关, 即HefABC, HefDEF, HefGHI[32], 而在体外培养的条件下, 与多重抗生素耐药相关的外流泵系统只有HefABC[33]. 然而本研究以实时定量PCR技术对H. pylori编码的Porin蛋白基因hopA、hopB、hopC、hopD、hopE及编码外流泵蛋白基因hefA、hefB、hefC的检测, 未发现阿司匹林从基因转录水平改变H. pylori上述8种外膜蛋白的表达. 然而, 细菌外膜对药物通透性的改变必然伴随着外膜相关蛋白的改变, H. pylori外膜蛋白的SDS-PAGE分析发现, 经阿司匹从处理后的细菌外膜蛋白电泳条带与对照组比较, 在分子质量55-72 kDa之间有两条蛋白条带表达改变. 因此, 阿司匹林对H. pylori外膜蛋白从功能到表型上的改变作用是源于蛋白质翻译水平、还是翻译后蛋白质的修饰过程, 抑或影响其他Porin蛋白及外流泵系统的表达尚有待进一步研究.
早期研究表明, 水杨酸盐可以抑制某些细菌的生长, 并影响其毒力因子的活性, 从而可能改变细菌的致病性. 水杨酸盐制剂对不同细菌的不同抗生素敏感性影响却显示不同: 水杨酸盐可以部分细菌产生多重抗生素耐药, 但却可以提高这些细菌对氨基糖甙类抗生素的敏感性.
白爱平, 副教授, 南昌大学第一附属医院消化病研究所; 杨建民, 教授, 浙江省人民医院消化内科.
H. pylori感染是慢性活动性胃炎、消化性溃疡的主要致病因素,与胃癌、胃黏膜相关淋巴样组织(MALT)淋巴瘤的发生密切相关. 近年研究表明, H. pylori感染在心脑血管性疾病、免疫性疾病、血液系统疾病、营养代谢性疾病和皮肤病等疾病的发病中起一定的作用. 根除H. pylori对治疗和预防上述疾病是十分重要的. 但H. pylori的耐药问题已经显得越来越突出, 临床研究表明, H. pylori对克拉霉素耐药是导致根除治疗失败的主要原因.
Wang et al研究发现, 在体外培养条件下, 阿司匹林及吲哚美辛不仅剂量依赖性地抑制H. pylori的生长, 而且可以降低H. pylori对甲硝唑, 阿莫西林和克拉霉素的体外MIC, 从而提高H. pylori对这三种抗生素的敏感性, 甚至使耐药菌株转变为敏感菌株. Gu et al研究发现, 吲哚美辛及选择性COX-2抑制剂SC-236可以抑制H. pylori的生长及其尿素酶的活性, 还可以提高H. pylori对甲硝唑和克拉霉素的敏感性. 马惠霞 et al研究发现阿司匹林及COX-2抑制剂塞莱昔布可以剂量依赖性地抑制H. pylori的生长, 还可以抑制其毒力因子尿素酶及细菌空泡毒素的活性, 并可能改变其外膜蛋白的表达.
本研究是在针对临床根除H. pylori治疗中突出的耐药问题, 发现阿司匹林可以提高H. pylori对克拉霉素敏感性的基础上, 进一步探讨阿司匹林提高H. pylori根除一线方案的关键抗生素克拉霉素敏感性的机制.
通过对阿司匹林提高H. pylori抗生素敏感性的相关分子机制的研究, 将有助于更进一步认识H. pylori的耐药机制, 并为临床上探寻更加有效的根除H. pylori方案打下基础.
间苯腙氯羰氰(CCCP): 一种外排泵抑制剂, 能破坏细菌跨胞质膜的质子梯度, 导致转运蛋白失去能量供应, 使药物在细菌体内的蓄积浓度增加, 从而抑制药物外排泵. 在敏感菌中加入CCCP后药物积聚降低, 其原因主要是由于药物在细菌胞内的积聚为被动积聚, 最终分布由质膜两侧的pH梯度(△pH)所决定, 由于CCCP可以破坏这种pH梯度, 因此加入CCCP后敏感菌胞内药物浓度降低. CCCP在耐药菌中同样存在这种作用, 只是他抑制主动外排机制使胞内药物增加的作用远远大于降低作用.
本文研究具有科学性, 实验手段先进, 结果结论可信.
编辑: 李军亮 电编:吴鹏朕
| 1. | Christopher TD, Lee IR, Gustafson JE, The effects of salicylate on bacteria. Int J Biochem Cell Biol. 2000;32:1029-1043. [PubMed] [DOI] |
| 2. | Wang WH, Hu FL, Benjamin CY, Wong WM, Berg DE, Lam SK, Inhibitory effects of aspirin and indometacin on the growth of Helicobacter pylori in vitro. Chinese J Dig Dis. 2002;3:172-177. [DOI] |
| 3. | Wang WH, Wong WM, Dailidiene D, Berg DE, Gu Q, Lai KC, Lam SK, Wong BC. Aspirin inhibits the growth of Helicobacter pylori and enhances its susceptibility to antimicrobial agents. Gut. 2003;52:490-495. [PubMed] [DOI] |
| 4. | Gu Q, Xia HH, Wang WH, Wang JD, Wong WM, Chan AO, Yuen MF, Lam SK, Cheung HK, Liu XG. Effect of cyclo- oxygenase inhibitors on Helicobacter pylori susceptibility to metronidazole and clarithromycin. Aliment Pharmacol Ther. 2004;20:675-681. [PubMed] [DOI] |
| 6. | 刘 文忠. 幽门螺杆菌研究进展. 第1版. 上海: 上海科学技术文献出版社 2001; 309. |
| 7. | Mégraud F. Antibiotic resistance in Helicobacter pylori infection. Br Med Bull. 1998;54:207-216. [PubMed] |
| 8. | Realdi G, Dore MP, Piana A, Atzei A, Carta M, Cugia L, Manca A, Are BM, Massarelli G, Mura I. Pretreatment antibiotic resistance in Helicobacter pylori infection: results of three randomized controlled studies. Helicobacter. 1999;4:106-112. [PubMed] [DOI] |
| 9. | Pilotto A, Leandro G, Franceschi M, Rassu M, Bozzola L, Furlan F, Di Mario F, Valerio G. The effect of antibiotic resistance on the outcome of three 1-week triple therapies against Helicobacter pylori. Aliment Pharmacol Ther. 1999;13:667-673. [PubMed] [DOI] |
| 10. | Kunin CM, Hua TH, Guerrant RL, Bakaletz LO. Effect of salicylate, bismuth, osmolytes, and tetracycline resistance on expression of fimbriae by Escherichia coli. Infect Immun. 1994;62:2178-2186. [PubMed] |
| 11. | Farber BF, Wolff AG. The use of salicylic acid to prevent the adherence of Escherichia coli to silastic catheters. J Urol. 1993;149:667-670. [PubMed] |
| 12. | Kunin CM, Hua TH, Bakaletz LO. Effect of salicylate on expression of flagella by Escherichia coli and Proteus, Providencia, and Pseudomonas spp. Infect Immun. 1995;63:1796-1799. [PubMed] |
| 13. | Farber BF, Hsieh HC, Donnenfeld ED, Perry HD, Epstein A, Wolff A. A novel antibiofilm technology for contact lens solutions. Ophthalmology. 1995;102:831-836. [PubMed] |
| 14. | Muller E, Al-Attar J, Wolff AG, Farber BF. Mechanism of salicylate-mediated inhibition of biofilm in Staphylococcus epidermidis. J Infect Dis. 1998;177:501-503. [PubMed] |
| 15. | Teichberg S, Farber BF, Wolff AG, Roberts B. Salicylic acid decreases extracellular biofilm production by Staphylococcus epidermidis: electron microscopic analysis. J Infect Dis. 1993;167:1501-1503. [PubMed] |
| 16. | Domenico P, Schwartz S, Cunha BA. Reduction of capsular polysaccharide production in Klebsiella pneumoniae by sodium salicylate. Infect Immun. 1989;57:3778-3782. [PubMed] |
| 17. | Salo RJ, Domenico P, Tomás JM, Straus DC, Merino S, Benedí VJ, Cunha BA. Salicylate-enhanced exposure of Klebsiella pneumoniae subcapsular components. Infection. 1995;23:371-377. [PubMed] [DOI] |
| 18. | Rosner JL. Nonheritable resistance to chloramphenicol and other antibiotics induced by salicylates and other chemotactic repellents in Escherichia coli K-12. Proc Natl Acad Sci U S A. 1985;82:8771-8774. [PubMed] [DOI] |
| 19. | Cohen SP, McMurry LM, Hooper DC, Wolfson JS, Levy SB. Cross-resistance to fluoroquinolones in multiple-antibiotic- resistant (Mar) Escherichia coli selected by tetracycline or chloramphenicol: decreased drug accumulation associated with membrane changes in addition to OmpF reduction. Antimicrob Agents Chemother. 1989;33:1318-1325. [PubMed] |
| 20. | Sulavik MC, Dazer M, Miller PF. The Salmonella typhimurium mar locus: molecular and genetic analyses and assessment of its role in virulence. J Bacteriol. 1997;179:1857-1866. [PubMed] |
| 21. | Domenico P, Hopkins T, Cunha BA. The effect of sodium salicylate on antibiotic susceptibility and synergy in Klebsiella pneumoniae. J Antimicrob Chemother. 1990;26:343-351. [PubMed] [DOI] |
| 22. | Gustafson JE, Candelaria PV, Fisher SA, Goodridge JP, Lichocik TM, McWilliams TM, Price CT, O'Brien FG, Grubb WB. Growth in the presence of salicylate increases fluoroquinolone resistance in Staphylococcus aureus. Antimicrob Agents Chemother. 1999;43:990-992. [PubMed] |
| 23. | Price CT, O'Brien FG, Shelton BP, Warmington JR, Grubb WB, Gustafson JE. Effects of salicylate and related compounds on fusidic acid MICs in Staphylococcus aureus. J Antimicrob Chemother. 1999;44:57-64. [PubMed] [DOI] |
| 24. | Domenico P, Straus DC, Woods DE, Cunha BA. Salicylate potentiates amikacin therapy in rodent models of Klebsiella pneumoniae infection. J Infect Dis. 1993;168:766-769. [PubMed] |
| 25. | Aumercier M, Murray DM, Rosner JL. Potentiation of susceptibility to aminoglycosides by salicylate in Escherichia coli. Antimicrob Agents Chemother. 1990;34:786-791. [PubMed] |
| 26. | Taylor DE, Ge Z, Purych D, Lo T, Hiratsuka K. Cloning and sequence analysis of two copies of a 23S rRNA gene from Helicobacter pylori and association of clarithromycin resistance with 23S rRNA mutations. Antimicrob Agents Chemother. 1997;41:2621-2628. [PubMed] |
| 27. | Ma D, Cook DN, Alberti M, Pon NG, Nikaido H, Hearst JE. Genes acrA and acrB encode a stress-induced efflux system of Escherichia coli. Mol Microbiol. 1995;16:45-55. [PubMed] [DOI] |
| 28. | Fralick JA. Evidence that TolC is required for functioning of the Mar/AcrAB efflux pump of Escherichia coli. J Bacteriol. 1996;178:5803-5805. [PubMed] |
| 29. | Rosner JL, Chai TJ, Foulds J. Regulation of ompF porin expression by salicylate in Escherichia coli. J Bacteriol. 1991;173:5631-5638. [PubMed] |
| 30. | Doig P, Exner MM, Hancock RE, Trust TJ. Isolation and characterization of a conserved porin protein from Helicobacter pylori. J Bacteriol. 1995;177:5447-5452. [PubMed] |
| 31. | Exner MM, Doig P, Trust TJ, Hancock RE. Isolation and characterization of a family of porin proteins from Helicobacter pylori. Infect Immun. 1995;63:1567-1572. [PubMed] |
| 32. | Bina JE, Nano F, Hancock RE. Utilization of alkaline phosphatase fusions to identify secreted proteins, including potential efflux proteins and virulence factors from Helicobacter pylori. FEMS Microbiol Lett. 1997;148:63-68. [PubMed] [DOI] |
| 33. | Bina JE, Alm RA, Uria-Nickelsen M, Thomas SR, Trust TJ, Hancock RE. Helicobacter pylori uptake and efflux: basis for intrinsic susceptibility to antibiotics in vitro. Antimicrob Agents Chemother. 2000;44:248-254. [PubMed] [DOI] |