修回日期: 2008-04-18
接受日期: 2008-05-13
在线出版日期: 2008-06-28
目的: 探讨核因子-κB(nuclear factor-kappaB, NF-κB)及活性氧簇(reactive oxygen species, ROS)在大鼠SAP发病过程中的作用; 并观察NF-κB必需调节蛋白结合域(NF-κB essential modifier binding domain, NBD)多肽对大鼠SAP的干预作用.
方法: 逆行胰胆管内注射50 g/L牛磺胆酸钠(1 mL/kg)制备大鼠SAP模型. 大鼠64只, 随机分成4组: 假手术组, SAP组, TAT-NBD(WT)多肽组和TAT-NBD(MT)多肽组. 术后6, 12 h处死大鼠, 观察胰腺组织病理、血清淀粉酶和胰腺组织NF-κB P65蛋白的变化, 检测胰腺组织MDA含量及T-SOD活力.
结果: 与假手术组比较, SAP模型组6, 12 h大鼠NF-κB P65蛋白表达显著升高(49.3±2.2 vs 4.3±1.4, 65.8±1.8 vs 5.0±1.3, 均P<0.05); MDA生成增加(212.7±12.5 vs 87.7±7.5, 296.8±13.3 vs 96.2±8.3, 均P<0.05), T-SOD活力下降(88±10 vs 183±10, 65±7 vs 194±10, 均P<0.05); 与SAP模型组比较, TAT-NBD(WT)多肽预处理6, 12 h后, NF-κB P65蛋白表达 (25.9±2.3, 38.9±2.6)显著降低(P<0.05), MDA生成(102.5±10.4, 164.5±12.2)降低(P<0.05); T-SOD活力(153±11, 168±12)增加(P<0.05), 胰腺病理学评分下降(5.04±0.41 vs 8.71±0.45, 5.45±0.34 vs 10.31±1.23, 均P<0.05), 淀粉酶无明显变化. TAT-NBD(MT)多肽组上述指标均无明显变化.
结论: SAP时大鼠胰腺组织的NF-κB过度激活, 活性氧簇生成增加; NBD多肽预处理可以抑制NF-κB过度活化, 减少活性氧簇生成, 减轻胰腺局部炎症损伤.
引文著录: 谢文瑞, 陈垦, 阳小雅, 龙友明, 王晖, 刘君君, 杨剑. 核因子-κB在急性胰腺炎中的激活及NBD多肽的干预作用. 世界华人消化杂志 2008; 16(18): 1980-1984
Revised: April 18, 2008
Accepted: May 13, 2008
Published online: June 28, 2008
AIM: To study the role of nuclear factor-kappa B (NF-κB) and reactive oxygen species (ROS) in rats with severe acute pancreatitis (SAP), and to evaluate the effect of NF-κB essential modifier binding domain (NBD) peptides on this model.
METHODS: Sodium taurocholate (50 g/L, 1 mL/kg body weight) was retrogradely injected into rats' biliopancreatic ducts to induce the SAP model. Sixty-four rats were randomly divided into 4 groups: sham operation group, SAP group, TAT-NBD (WT) peptides group and TAT-NBD (MT) peptides group. The drugs were intraperitoneally injected into the rats 30 minutes before the operation. The changes of NF-κB P65 protein in pancreas, pancreatic histopathology, serum amylase, and malondialdehyde (MDA), total-superoxide dismutase (T-SOD) in pancreas were evaluated 6 and 12 h after operation.
RESULTS: In comparison with that in the sham operation group, the expression of NF-κB p65 protein was significantly enhanced in the SAP group at 6 or 12 h (49.3 ± 2.2 vs 4.3 ± 1.4, 65.8 ± 1.8 vs 5.0 ± 1.3, both P < 0.05); the production of MDA was also increased (212.7 ± 12.5 vs 87.7 ± 7.5, 296.8 ± 13.3 vs 96.2 ± 8.3, both P < 0.05); however, the activity of T-SOD was lowered (88 ± 10 vs 183 ± 10, 65 ± 7 vs 194 ± 10, both P < 0.05). In comparison with that in the SAP group, the expression of NF-κB p65 protein (25.9 ± 2.3, 38.9 ± 2.6) or the production of MDA (102.5 ± 10.4, 164.5 ± 12.2) was markedly decreased in the TAT-NBD (WT) group, while the activity of T-SOD was notably increased (153 ± 11, 168 ± 12) (P < 0.05); the histological scores for pancreas were also reduced (5.04 ± 0.41 vs 8.71 ± 0.45, 5.45 ± 0.34 vs 10.31 ± 1.23, both P < 0.05); the level of serum amylase had no obvious change. The above indexes had no marked changes in the TAT-NBD (MT) group.
CONCLUSION: NF-κB is over-activated and the production of ROS increases in SAP rats. NBD peptides could selectively inhibit the activation of NF-kappa B, the production of ROS, and thus lessen the inflammatory inury during SAP.
- Citation: Xie WR, Chen K, Yang XY, Long YM, Wang H, Liu JJ, Yang J. Activation of nuclear factor-κB and intervention of NBD peptides in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 1980-1984
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/1980.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.1980
机体通过酶系统和非酶系统产生氧自由基, 病原体入侵后导致细胞发生适度的氧化效应产生的活性氧簇(reactive oxygen species, ROS)对于机体抵抗微生物是一道重要的屏障, 但过量ROS的产生则可能产生灾难性后果, 引发脂质过氧化, 多形核白细胞黏附、聚集, 诱发和加重炎症反应. NF-κB是一种重要的炎症调控因子, 调节细胞因子、化学趋化因子、细胞黏附分子、氧自由基、iNOS等的表达. 抑制NF-κB的过量表达可能对急性胰腺炎有治疗效果.
Sprague-Dawley大鼠64只, 雌雄不拘, 体质量200±10 g, 由广东医学院实验动物中心提供. 牛磺胆酸钠(STC)购自Sigma公司; MDA, T-SOD试剂盒、淀粉酶试剂盒购于南京建成生物工程公司; NF-κB P65 mAb和S-P免疫组化试剂盒购于Santa Cruz公司. 具有细胞穿透性的小分子NBD多肽序列根据参考文献设计[1], 其为蛋白转导多肽TAT和NBD多肽的融合性多肽, 简称为TAT-NBD多肽, 委托西安美联生物公司合成, 其序列为: YGRKKRRQRRR-G-TTLDWSWLQME, 由于此连接的NBD肽和野生型(wild type, WT)NBD序列一致, 简称为TAT-NBD(WT). 为分析NBD多肽和NEMO结合的特异性我们设计一条突变型(mutant type, MT) TAT-NBD(MT), 其序列为: YGRKKRRQRRR-G-TTLDASALQME融合性多肽.
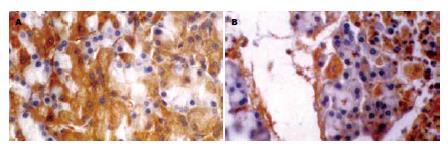
Sprague-Dawley大鼠64只, 随机分成4组: 假手术组, SAP组, TAT-NBD(WT)多肽组, TAT-NBD(MT)组, 每组在术后6, 12 h时间点随机取8只处死. 胰腺炎模型的建立[2]: 大鼠造模前, 禁食12 h, 自由饮水. 造模前按13 mg/kg予TAT-NBD(WT)多肽或等量NS或TAT-NBD(MT)预处理后, 30 g/L戊巴比妥钠(1 mL/kg)ip麻醉, 开腹寻找到胰胆管, 5号针头逆行插入胆胰管, 无损伤静脉夹临时阻断胰胆管的上下端后加压注射50 g/L STC(l mL/kg体质量), 注射速度为0.2 mL/min, 注射完毕后3 min拔针, 关腹; 假手术组仅开腹, 翻动胰腺, 再关腹. 每组大鼠麻醉苏醒后, 自由饮水、进食. 标本处理: 于术后6、12 h随机取各组大鼠8只剖腹, 下腔静脉采血5 mL, 3000 r/min离心10 min, 分离血清并-20℃保存备用. 取头、体部胰腺组织4块留待病理分析和免疫组织化学分析. 血清淀粉酶:参照试剂盒说明书, 测定其吸光度值. 取胰腺组织固定于40 g/L甲醛溶液, 常规脱水、透明、包埋、切片(4 μm)、HE染色观察组织学改变, 根据Spormann et al[3]评定标准按水肿、炎症浸润、脂肪坏死、实质坏死程度评分. 另石蜡切片经脱蜡, 梯度水化后, 内源性过氧化物酶阻断剂37℃ 10 min; 置10 mmol/L柠檬酸缓冲液pH = 6.0, 用微波处理以修复抗原, 冷却至室温; 滴加正常血清, 室温30 min以封闭非特异性抗原, 倾去血清滴加1:50的兔抗鼠NF-κB p65 mAb, 4℃过夜; PBS冲洗; 滴加生物素化二抗, 室温15 min, PBS冲洗, 滴加辣根过氧化物酶标记的卵白素, 室温15 min; DAB显色; 苏木精复染; 中性树脂封片. 结果判定: PBS代替一抗作为空白对照, 细胞染色为黄色者为阳性, 定位于细胞质和/或细胞核. 每张切片随机选取10个高倍视野(×400), 用美国Nikon Spot图像采集处理系统采图后, 采用Image-Pro Plus 5.0专业图像分析软件进行图像分析, 计算阳性细胞百分率和平均光密度值. 胰腺组织MDA含量采用硫代巴比妥酸(TBA)比色法, T-SOD活力检测采用黄嘌呤氧化酶法, 严格按试剂盒说明书进行.
统计学处理 各指标(计量资料)用mean±SD表示, SPSS11.0统计软件进行单因素方差分析(ANOVA), 预先进行正态性检验和方差齐性检验(Levene's test检验), 如方差齐用LSD检验, 非正态分布或方差不齐者, 以lg(X+1)进行变量代换. 率的比较采用确切概率法(Fisher's test), P<0.05差异有统计学意义.
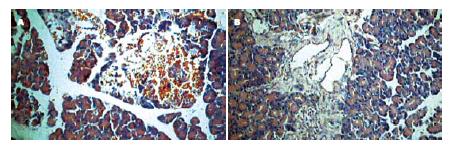
假手术组肉眼和镜下基本正常, 余各组胰腺实质及脂肪中肉眼和光镜下可见有不同程度的出血、水肿和坏死; 处死时可见不同程度的胰腺旁组织坏死和容量不等的血性腹水及钙化灶形成. 除假手术组外, 余每组间的12 h病理学评分均比6 h高(P<0.05, 表1). 同SAP组比较, 对应的时间点TAT-NBD(WT)多肽组的病理学评分下降, 差异有统计学意义(P<0.05); TAT-NBD(MT)多肽组变化不明显(P>0.05, 图1).
假手术组MDA无明显改变, 余各组12 h MDA比6 h高(P<0.05), 与SAP组比较, TAT-NBD(WT)多肽处理组MDA水平下降(P<0.05), TAT-NBD(MT)组无明显变化(P>0.05); SAP组及TAT-NBD(MT)组的T-SOD 12 h比6 h下降, TAT-NBD多肽(WT)处理组T-SOD 12 h比6 h上升, 与SAP组比较, 相应时间点的T-SOD升高明显(P<0.05), TAT-NBD(MT)组无明显变化(P>0.05, 表2).
急性胰腺炎可从局部炎症发展至全身性炎症反应综合征, 最后导致多器官功能衰竭. 尽管目前提出多种AP病理生理机制, 但尚未完全阐明. 大量研究证实, NF-κB在AP发病的早期即被激活, 诱导细胞因子、化学趋化因子、细胞黏附分子、氧自由基、iNOS等的表达, 促进局部炎症病变向全身多系统多脏器发展. 在AP时的胰腺腺泡细胞凋亡、感染和内毒素血症、AP相关的肝、肺损伤及SIRS和MODS的发生发展过程中均起到重要的作用[4]. NF-κB参与了细胞因子和炎症介质的瀑布样级联反应, 在炎症反应的放大和维持方面起着核心的作用. NF-κB与AP的关系已成为研究的热点之一[5]. 许多学者针对细胞因子对AP进行了抗细胞因子的治疗研究, 细胞因子抗体(TNF、PAF、IL-6)、可溶性细胞因子受体(重组二聚体P55或P75TNF)、抗炎症细胞因子(IL-10)等均已证实可降低实验性AP的严重度和动物死亡率[6]. ROS被认为是AP的发生和发展过程一种重要致病因素, 同时也是NF-κB的一种重要激活剂. Yu et al[7]用雨蛙肽建立大鼠AP模型后发现可迅速诱导胰腺腺泡细胞产生ROS, 脂质过氧化物和过氧化氢大量产生, IκBα的降解, NF-κB激活, IL-1β、IL-6等细胞因子表达明显上调. 抗氧化剂谷胱甘肽、PDTC等处理后, ROS产生水平下降, NF-κB的活化亦受到抑制, 胰腺腺泡细胞的炎症反应减轻. Rakonczay et al[8]用PDTC或甲基强的松龙(methylprednisolone, MP)预处理左旋精氨酸(L-Arg)诱导的大鼠AP模型后可以剂量依赖方式阻断NF-κB的活化和促炎症细胞因子的表达, 有效改善AP严重程度的各项指标(如胰腺与体质量的比值、胰腺髓过氧化物酶MPO的活性、淀粉酶和胰蛋白酶原的浓度、脂质过氧化和蛋白质氧化的程度和非蛋白质巯基的浓度)和大体病变程度. Haraldsen et al[9]通过多种方式建立AP的体内/外模型后均发现NF-κB的激活、脂质过氧化物和过氧化氢产生增加、促炎症细胞因子的表达上调, 用NAC预处理或治疗后, ROS产生减少, 内皮细胞完整性恢复, AP相关的肝、肺损伤减轻, AP严重度及其相关的全身并发症减轻, 总体死亡率下降. Steinle et al[10]认为, PDTC可抑制AP时NF-κB的活性, 但明显加重高淀粉酶血症, 血清LDH明显升高, 动物炎症反应加重, 甚至出现空泡形成和坏死. NAC处理后也出现类似结局. 因而用PDTC或NAC抑制NF-κB的活性会加重AP病情. Grisham [11]认为, 这种现象可能与抑制剂的种类和NF-κB的活性是否受到完全抑制等有关. 我们发现, 在STC诱导的SAP中, NF-κB表达显著升高, 胰腺组织的脂质过氧化产物MDA明显增加(P<0.05), 提示机体内大量活性氧产生, 同时组织细胞破坏, 胰腺炎症反应加重, 组织坏死增加. 机体抗氧化能力下降, 总超氧化物歧化酶(T-SOD)合成明显减少, 进一步加重ROS对机体的损害.
IKK复合物是NF-κB激活调节的关键, 结构亚基IKKα、IKKβ和调节亚基NF-κB必需调节蛋白(NEMO)是所有前炎症信号通路激活NF-κB的必需组件[12]. 研究表明, 针对IKK-NEMO相互作用这一靶点设计的小分子NBD多肽, 由于结合了NBD位点, 因而破坏了IKKα、IKKβ和NEMO(IKKγ)相互作用, 从而抑制IKK活性, 并且还可以使已形成的IKK复合物裂解, 最终起到抑制NF-κB活性的作用. NBD小分子多肽并没有完全阻断NF-κB的活性, 其维持细胞正常生长增殖等功能仍然不受明显影响[13]. 在角叉菜胶诱导的大鼠足环急性肿胀模型中, 野生型NBD小分子多肽可显著减弱NF-κB表达, 炎症浸润减少, COX-2、TNF-α表达下降, 足环肿胀减轻. 突变型NBD多肽无此作用[14]. May et al[13]研究结果表明, NBD小分子多肽可减轻佛波酯诱导的小鼠耳壳水肿, 作用效果与糖皮质激素相类似, 突变型NBD多肽无抑制水肿作用. 而且两种多肽均不影响无佛波脂作用下的正常耳壳的NF-κB基本活性. 在酵母多糖ip建立的腹膜炎模型中, NBD小分子多肽可有效抑制炎症渗出物和多型核细胞的腹腔移位, 以及NO在腹腔的过量堆积, 显著减轻小鼠的炎症损伤严重度. 本实验表明, NBD多肽可减低NF-κB表达, ROS合成减少, 胰腺病理损伤减轻, 提示NBD小分子多肽可用于实验性SAP治疗, 其作用可能是通过抑制NF-κB激活, 调节ROS合成. 但NBD小分子多肽不能降低胰腺炎淀粉酶水平.
急性胰腺炎是临床常见的危重疾病, 详细的发病机制尚未完全阐明. 目前研究发现, 核因子-κB在胰腺炎的发生发展中有重要意义.
潘秀珍, 教授, 福建省立医院消化研究室; 赵景民, 主任医师, 中国人民解放军第三〇二医院病理科.
NBD小分子多肽已有报道应用于大鼠足环急性肿胀以及腹膜炎模型的实验治疗中, 并取得了良好的效果.
本研究以核因子-κB调控为中心, 观察特异性的核因子-κB上游激酶抑制因子NBD小分子多肽对实验性急性胰腺炎的疗效, 为开发多肽类药物治疗胰腺炎提供理论依据.
本研究为进一步开发多肽类药物治疗急性胰腺炎提供了前期的理论基础.
本研究立题依据充分, 目的明确, 设计严谨, 实验材料与方法规范, 技术难度较大, 统计正确, 结果可信, 对SAP的理论与临床研究有帮助.
编辑: 李军亮 电编:吴鹏朕
| 1. | Dasgupta S, Jana M, Zhou Y, Fung YK, Ghosh S, Pahan K. Antineuroinflammatory effect of NF-kappaB essential modifier- binding domain peptides in the adoptive transfer model of experimental allergic encephalomyelitis. J Immunol. 2004;173:1344-1354. [PubMed] [DOI] |
| 2. | Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] [DOI] |
| 3. | Spormann H, Sokolowski A, Letko G. Effect of temporary ischemia upon development and histological patterns of acute pancreatitis in the rat. Pathol Res Pract. 1989;184:507-513. [PubMed] [DOI] |
| 4. | Chen X, Ji B, Han B, Ernst SA, Simeone D, Logsdon CD. NF-kappaB activation in pancreas induces pancreatic and systemic inflammatory response. Gastroenterology. 2002;122:448-457. [PubMed] [DOI] |
| 6. | Granger J, Remick D. Acute pancreatitis: models, markers, and mediators. Shock. 2005;24 Suppl 1:45-51. [PubMed] [DOI] |
| 7. | Yu JH, Lim JW, Namkung W, Kim H, Kim KH. Suppression of cerulein-induced cytokine expression by antioxidants in pancreatic acinar cells. Lab Invest. 2002;82:1359-1368. [PubMed] |
| 8. | Rakonczay Z Jr, Jarmay K, Kaszaki J, Mandi Y, Duda E, Heqyi P, Boros I, Lonovics J, Takacs T. NF-kappaB activation is detrimental in arginine-induced acute pancreatitis. Free Radic Biol Med. 2003;34:696-709. [PubMed] [DOI] |
| 9. | Haraldsen P, Sun ZW, Borjesson A, Olanders K, Lasson A, Andersson R. Multimodal management - of value in fulminant acute pancreatitis? Pancreatology. 2003;3:14-25. [PubMed] [DOI] |
| 10. | Steinle AU, Weidenbach H, Wagner M, Adler G, Schmid RM. NF-kappaB/Rel activation in cerulein pancreatitis. Gastroenterology. 1999;116:420-430. [PubMed] [DOI] |
| 11. | Grisham MB. NF-kappaB activation in acute pancreatitis: protective, detrimental, or inconsequential? Gastroenterology. 1999;116:489-492. [PubMed] [DOI] |
| 12. | Strickland I, Ghosh S. Use of cell permeable NBD peptides for suppression of inflammation. Ann Rheum Dis. 2006;65 Suppl 3:iii75-iii82. [PubMed] [DOI] |
| 13. | May MJ, D'Acquisto F, Madge LA, Glockner J, Pober JS, Ghosh S. Selective inhibition of NF-kappaB activation by a peptide that blocks the interaction of NEMO with the IkappaB kinase complex. Science. 2000;289:1550-1554. [PubMed] [DOI] |
| 14. | di Meglio P, Ianaro A, Ghosh S. Amelioration of acute inflammation by systemic administration of a cell-permeable peptide inhibitor of NF-kappaB activation. Arthritis Rheum. 2005;52:951-958. [PubMed] [DOI] |