修回日期: 2008-04-07
接受日期: 2008-05-06
在线出版日期: 2008-06-08
目的: 应用酵母双杂交技术, 筛选人胰腺cDNA文库中与HBV核心抗原结合的蛋白的基因.
方法: 扩增人胰腺cDNA文库并纯化鉴定, 将其转化至酵母菌Y187; 诱饵质粒pGBKT7-HBcAg转化酵母菌AH109并筛选鉴定. 应用酵母双杂交系统3进行配合, 在SD/-Trp/-Leu/-His/-Ade培养基和含X-gal的SD/-Trp/-Leu/-His/-Ade培养基上进行双重筛选, 提取阳性酵母菌落的质粒转化大肠埃希菌DH5α, 提取质粒并测序, 对测序结果进行生物信息学分析.
结果: 人胰腺cDNA文库的构建以及pGBKT7-HBcAg质粒转化AH109酵母菌株均获成功, 并从人胰腺cDNA文库中筛选出9个与HBcAg蛋白相结合的蛋白基因, 分别与以下已知的9种编码蛋白基因序列同源: 人胰脂肪酶(PNLIP)、人胆盐刺激酯酶(CEL)、人胰凝乳蛋白C(CTRC)、人胰蛋白酶原、人羧肽酶B1(CPB1)、人线粒体全基因组、人胰弹性酶2A、人辅脂肪酶(CLPS)和人核糖体蛋白(RPL10A).
结论: 筛选出的与HBcAg蛋白相结合的蛋白基因主要与胰腺外分泌功能相关, HBV感染可能通过与胰腺所分泌的糖、脂类代谢相关的酶类结合, 而引发代谢性疾病.
引文著录: 张维燕, 张锦前, 王琦, 李国力, 王晓春, 张晨宇, 杨涤, 成军. 酵母双杂交技术对人胰腺cDNA文库中HBcAg结合蛋白基因的筛选. 世界华人消化杂志 2008; 16(16): 1746-1750
Revised: April 7, 2008
Accepted: May 6, 2008
Published online: June 8, 2008
AIM: To screen proteins in human pancreas cDNA library interacting with hepatitis B core antigen (HbcAg) by yeast two-hybrid system.
METHODS: After amplification, purification, and identification, the human pancreas cDNA library plasmid was transformed into yeast Y187. Thereafter, the reconstructed bait plasmid (pGBKT7-HBcAg) was transformed into yeast cells AH109. Then, the transformed AH109 was mated with Y187 that contained the library plasmid. The diploid yeast cells were plated on nutrient deficiency medium SD/-Trp/-Leu/-His/-Ade and SD/-Trp/-Leu/-His/-Ade containing X-α-gal for selecting. The plasmids in diploid yeast cells were extracted and electrotransformed into E.coli DH5α. The plasmids in DH5α were extracted, sequenced and analyzed by bioinformatic methods.
RESULTS: The human pancreas cDNA library was constructed successfully. The reconstructed bait plasmid (pGBKT7-HBcAg) was transformed into yeast cells AH109 successfully. Nine proteins interacting with HBcAg were screened, and their sequences were homologous with human pancreatic lipase (PNLIP), CEL, CTRC, trypsinogen, carboxypeptidase 1 (CPB1), human complete mitochondrial genome, human pancreatic elastinase 2A, human complement lipase (CLPS) and human ribosomal protein (RPL10A).
CONCLUSION: HBcAg protein may be related with the exocrine pancreatic function and metabolism of glucose or lipid. HBV infection probably leads to metabolic abnormality or metabolic diseases through interacting with pancreatic enzymes.
- Citation: Zhang WY, Zhang JQ, Wang Q, Li GL, Wang XC, Zhang CY, Yang D, Cheng J. Screening of proteins binding to hepatitis B core antigen from human pancreas cDNA library by yeast two-hybrid system. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1746-1750
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1746.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1746
近年来国内外大量的临床病例研究资料及文献提示, 慢性乙型肝炎患者2型糖尿病发病率显著高于普通人群并存在胰岛素抵抗, 这种现象逐渐受到人们关注[1-5]. 有研究者还进行了相关的机制研究, 但尚无法定论. 研究者通过对胰腺组织进行原位杂交及免疫组化检测发现, HBV慢性感染者胰腺组织中存在HBsAg、HBcAg及HBV DNA[6-8]. 这些提示HBV慢性感染时除引起肝脏病变外, 可能同时还侵犯胰腺并引起相应的病理改变, 进而影响胰腺的分泌功能致糖、脂类物质代谢异常甚至是代谢性疾病. 但这些可能性及其机制还需要进一步研究验证. 因此, 我们从蛋白质水平运用酵母双杂交技术筛选人胰腺cDNA文库中与HBcAg结合蛋白的基因, 从而为相关理论提供实验依据, 为相关研究的提供思路和方向.
酵母双杂交系统3该试剂盒包括人类胰腺cDNA文库、pGADT7-AD克隆载体、pGBKT7-BD克隆载体、酵母菌株AH109、酵母菌株Y187, 购自Clontech公司. BglⅡ购自TaKaRa公司. X-α-gal、酵母YPD培养基、酵母YPDAgar培养基、SD/-Trp、SD/-Leu、SD/-Trp/-Leu、SD/-Trp/-Leu/-His以及SD/-Trp/-Leu/-His/-Ade培养基均购自Clontech公司. 鲑精DNA(DNA, from herring sperm)购自Sigma公司. 引物合成及测序由奥科公司完成.
酵母胰腺cDNA文库的构建按Clontech 公司的说明书对文库进行扩增, 用Qiagen公司的操作手册(Qiagen plasmid Maxi kit)对文库进行纯化. 取纯化的文库质粒1 μL转化DH5α感受态细胞, 随机挑取6个单克隆提取质粒, EcoRⅠ、XhoⅠ双酶切鉴定cDNA文库多样性. 文库质粒转化酵母, 制备酵母人胰腺cDNA文库. 提取新鲜生长的Y187酵母菌落接种于YPDA液体培养基中, 振摇后以醋酸锂法将文库质粒转化至其中, 然后将转化物铺SD/-Leu板孵育. 同时将转化产物按1:10, 1:102, 1:1×104, 1:1×106, 1:1×108分别铺于SD/-Leu培养基上检验转化效率. HBcAg蛋白的酵母表达载体pGBKT7-HBcAg由本室构建, 醋酸锂法转入酵母菌株AH109. 转化后铺板筛选, 挑取新鲜生长的经菌落PCR鉴定正确的AH109酵母菌落接种于SD/-Trp液体培养基中, 振摇培养后, 离心并重悬于2×YPDA培养基中, 与含胰腺文库的酵母细胞配合24 h. 观察到三叶草状的二倍体细胞后, 将其离心并重悬于0.25×YPDA培养基中, 然后铺SD/-Trp/-Leu/-His平板和SD/-Trp/-Leu/-His/-Ade平板各25块, 孵育培养. 同时将配合产物按1:10 , 1:102, 1:103分别铺于培养基上检验配合效率. 生长16 d后把直径>2 mm的菌落划线于铺有X-Gal的培养基, 在此培养基上生长且变成蓝色的为阳性菌落. 挑取阳性菌落于液体培养基中, 振摇后提取酵母质粒. 电穿孔法将提取的质粒转化感受态细胞并于含有氨苄青霉素的LB平板上培养, 所获得菌落质粒行BglⅡ酶切鉴定后测序, 对测序结果进行生物信息学分析.
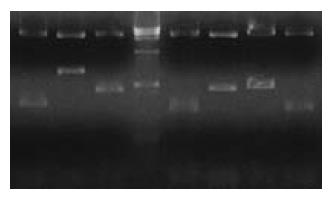
经测定, 待转化的胰腺cDNA文库滴度在4×107左右. 用EcoRⅠ、 XhoⅠ双酶切鉴定cDNA文库的多样性. 结果显示插入片段大小不一(图1), 说明文库具有很好的多样性. 经转化效率的检验, 确定文库细胞计数大于1×109细胞/L.
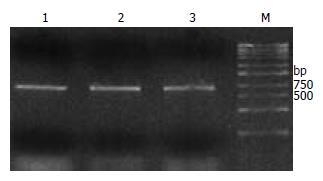
用醋酸锂法转化酵母细胞后在缺陷型SD/-Trp培养基上筛选生长. 培养4 d后, 挑取菌落进行PCR扩增HBcAg, 结果显示转化成功(图2).
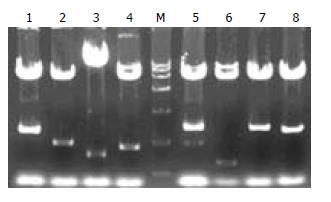
pACT2载体上含有的2个BglⅡ酶切位点分别位于多克隆位点两侧, 故使用该内切酶消化将释放出所筛选到的胰腺文库的基因片段. 图3所示BglⅡ酶切、琼脂糖凝胶电泳后的不同大小胰腺cDNA文库片段.
挑选26个阳性克隆测序后, 进行生物学信息学分析(表1).
| 序号 | GenBank序号 | 已知的同源序列编码蛋白基因 | 相同克隆数 | 同源性 |
| 1 | 000936.2 | 人胰脂肪酶(PNLIP) | 5 | 98 |
| 2 | 001807.2 | 人胆盐刺激酯酶(CEL) | 1 | 97 |
| 3 | 007272.2 | 人胰凝乳蛋白C(CTRC) | 1 | 100 |
| 4 | 002769.2 | 人胰蛋白酶原 | 4 | 99 |
| 5 | 001871.2 | 人羧肽酶B1(CPB1) | 2 | 98 |
| 6 | 001807.4 | 人线粒体全基因组 | 1 | 97 |
| 7 | 033440.1 | 人胰弹性酶2A | 1 | 99 |
| 8 | 001832.2 | 人辅脂肪酶(CLPS) | 2 | 99 |
| 9 | 007104.4 | 人核糖体蛋白(RPL10A) | 2 | 100 |
HBV慢性感染除引起肝脏损害外还可能与很多肝外组织损害密切相关, 尤其与2型糖尿病之间的关联更是引起众多学者的关注. 国内外很多研究者提供的流行病学和临床病例资料报道提示, HBV慢性感染患者糖尿病的发病率显著高于普通人群[9-10]. Custro et al[11]报道, 成人慢性乙型肝炎2型糖尿病的发病率为25%, 是普通人群发病率的4倍. 北京地坛医院[2]曾调查北京2303例慢性肝炎患者, 发现2型糖尿病发病率是普通人群的3倍. 这些说明HBV慢性感染可能会导致2型糖尿病的发生, 也可能2型糖尿病的又一危险因素.
有研究者发现, HBV慢性感染者伴发2型糖尿病与HBV损伤胰岛细胞有关. 研究显示慢性HBV感染患者中糖耐量异常者(IGT)胰腺细胞HBV DNA检测阳性率显著高于糖耐量正常者(NGT), 免疫荧光组织化学双重染色显示胰岛细胞胰岛素受体阳性部位有HBsAg存在, 提示HBV不仅能侵害肝细胞, 也可能直接侵害胰岛细胞, 可能是HBV感染伴发2型糖尿病的原因之一[5]. HBV DNA可能会导致胰岛β细胞功能障碍, 或者造成编码胰岛素基因突变, 使胰腺β细胞不能分泌成熟的胰岛素, 而分泌更多的前体胰岛素或变形胰岛素. 还有研究发现HBV病毒核心抗原(HBcAg)结合蛋白C-12与胰岛素受体有相互作用关系[12]. 这些研究从机制方面进一步说明了HBV慢性感染与2型糖尿病可能密切相关, 但是糖代谢过程及其机制极为复杂, HBV慢性感染是影响这一过程中的某一环节还是某几个环节, 而且是通过怎样的作用过程和机制影响的我们还不清楚. 到目前为止, 国内外相关机制的研究报道甚少, 更缺少充分的证据.
我们在此基础上考虑, HBV慢性感染时某些病毒蛋白可能影响了糖代谢过程的某些环节. 因此我们采用酵母双杂交技术从蛋白质水平研究相关的机制, 本文筛选了人胰腺cDNA文库中的HBcAg结合蛋白基因, 发现了与HBcAg存在相互作用的几种胰腺分泌的酶, 如胰弹性蛋白酶、胰脂肪酶、辅脂肪酶、胆盐刺激酯酶, 而这些酶是胰腺外分泌功能中的重要组分, 他们在糖、脂代谢过程中均起重要作用.
值得人们关注的是, 大约10%-30%的1型和2型糖尿病患者存在胰腺外分泌功能异常, 并且与早发的胰腺功能衰竭、低体质量指数、糖尿病病程有关[13-15]. 2型糖尿病患者胰腺外分泌功能障碍显著高于正常对照组, 并且随着体重指数的增加胰腺外分泌发生障碍的可能性也会相应增加[16]. 而粪胰弹性酶是一个重复性非常好的评价胰腺外分泌功能的指标[17-18]. Vesterhus et al[19]研究发现, 所有青春期糖尿病(MODY3)患者中胰弹性酶缺乏者脂肪排泄增加. 有研究发现, 弹性酶可抑制大白鼠和小白鼠自发性糖尿病; 抑制实验性肝纤维化、增强脂肪肝时的肝脏脂肪分解. 其作为药物主要可用于防治动脉硬化症、高脂血症(高胆固醇、高甘油三酯)、高血压、糖尿病和脂肪肝等[20-24].
另外, 胰腺分泌的脂肪分解酶包括胰脂肪酶(pancreatic lipase, PL)和胆盐刺激酯酶(carboxyl ester lipase, CEL). PL主要分解食物中的甘油三酯; CEL主要消化胆固醇酯和视黄酯. 而辅脂肪酶是胰脂肪酶对消化脂类物质时不可缺少的辅助因子. 他们作为胰腺外分泌的主要成分都参与食物脂肪的消化和吸收. 对小鼠动物模型的研究发现, PL和CEL主要作用分别是机体对甘油三酯和胆固醇的吸收. 还有研究发现PL和CEL在脂类吸收中有互补作用[20]. 辅脂肪酶基因敲除小鼠试验中同样出现脂肪吸收下降[26]. 脂肪酶在糖代谢中也具有重要作用[27-28]. 有研究发现, 对非糖尿病CEL基因变异者行MRI和超声检查提示胰腺存在脂肪变倾向, 他们在发生2型糖尿病之前胰腺脂肪聚集[29]. 而胰腺脂肪量是胰腺B细胞功能障碍的原因之一, 并可能影响2型糖尿病的发展[30].
这些研究提示胰腺外分泌功能障碍在胰腺脂肪变和糖尿病发展进程中起了一定作用. 这些胰腺外分泌功能中重要的酶类物质, 如果他们的分泌及功能出现异常则极可能进一步影响相应的代谢过程而导致脂类代谢异常, 甚至最终引发胰岛素抵抗、糖代谢异常和2型糖尿病. 而HBcAg与这些酶类物质结合后就可能影响他们的结构、功能, 从而进一步导致一系列的不良结果. 因此, HBV慢性感染影响胰腺外分泌功能可能就是其影响糖、脂代谢过程的可能机制之一, 这需要进一步证实.
总之, HBV慢性感染时同样可能感染胰腺细胞, 我们的研究发现HBcAg与胰腺分泌的多种酶类物质存在相互作用, 尤其是其中几种与胰腺外分泌功能密切相关. 他们之间的相互作用可能就是HBV感染引发糖、脂类代谢异常甚至糖尿病的可能机制. 我们的研究为进一步探索HBV慢性感染与胰腺功能、糖类代谢、脂类代谢和2型糖尿病提供了新的良好的思路和研究方向.
近年来国内外大量的临床病例研究资料及文献提示, 慢性乙型肝炎患者2型糖尿病发病率显著高于普通人群, HBV慢性感染时除引起肝脏病变外, 可能同时还侵犯胰腺进而影响胰腺的分泌功能致糖、脂类代谢异常. 但机制不清, 相关研究甚少.
高春芳, 研究员, 中国人民解放军第二军医大学附属长征医院全军医学免疫诊断中心/实验诊断科; 王凯, 教授, 山东大学齐鲁医院肝病科
有研究通过对胰腺组织进行原位杂交及免疫组化检测发现, HBV慢性感染者胰腺组织中存在HBsAg、HBcAg及HBV DNA. 这提示HBV慢性感染时可能侵犯胰腺并引起相应的病理改变, 进而影响胰腺的分泌功能致糖、脂类物质代谢异常甚至是代谢性疾病.
本研究从蛋白质水平运用酵母双杂交技术筛选人胰腺cDNA文库中与HBcAg结合蛋白的基因, 从而证实HBV慢性感染致胰腺损害的机制及其与糖、脂类代谢相关性.
本研究为HBV慢性感染致胰腺损害及其与糖、脂类代谢异常、2型糖尿病相关性的机制提供实验依据, 为进一步研究提供思路和指导.
本文选题明确, 设计思路清晰合理, 研究方法简单可靠, 可重复性强, 具有较强的科学性和创新性.
编辑: 李军亮 电编:何基才
| 1. | Mohammad Alizadeh AH, Fallahian F, Alavian SM, Ranjbar M, Hedayati M, Rahimi F, Khedmat H, Etemadi A, Zali MR, Azizi F. Insulin resistance in chronic hepatitis B and C. Indian J Gastroenterol. 2006;25:286-289. [PubMed] |
| 3. | Tai TY, Lu JY, Chen CL, Lai MY, Chen PJ, Kao JH, Lee CZ, Lee HS, Chuang LM, Jeng YM. Interferon-alpha reduces insulin resistance and beta-cell secretion in responders among patients with chronic hepatitis B and C. J Endocrinol. 2003;178:457-465. [PubMed] [DOI] |
| 4. | Kwon SY, Kim SS, Kwon OS, Kwon KA, Chung MG, Park DK, Kim YS, Koo YS, Kim YK, Choi DJ. Prognostic significance of glycaemic control in patients with HBV and HCV-related cirrhosis and diabetes mellitus. Diabet Med. 2005;22:1530-1535. [PubMed] [DOI] |
| 5. | Akbar DH, Siddique AM, Ahmed MM. Prevalence of Type-2 diabetes in patients with hepatitis C and B virus infection in Jeddah, Saudi Arabia. Med Princ Pract. 2002;11:82-85. [PubMed] [DOI] |
| 6. | 时 德仁, 东 传凌, 陆 立, 丛 闻天, 周 燕. 肝硬化时糖代谢紊乱与肝细胞胰岛素受体及胰腺细胞HBV DNA表达的关系. 中华实验和临床病毒学杂志. 2003;17:372-374. |
| 7. | 李 雪梅, 郎 振为, 崔 世昌, 朱 仁平, 廖 惠钰, 秦 天云. 重症乙肝患者肝、胰组织内HBsAg、HBcAg的检测及其与糖代谢异常关系的探讨重症乙肝患者肝、胰组织内HBsAg、HBcAg的检测及其与糖代谢异常关系的探讨. 首都医科大学学报. 2001;22:52-54. |
| 9. | Jan CF, Chen CJ, Chiu YH, Chen LS, Wu HM, Huang CC, Yen MF, Chen TH. A population-based study investigating the association between metabolic syndrome and hepatitis B/C infection (Keelung Community-based Integrated Screening study No. 10). Int J Obes (Lond). 2006;30:794-799. [PubMed] [DOI] |
| 10. | Zhang X, Shen W, Shen DM. A clinical analysis of liver disease patients with abnormal glucose metabolism. Zhonghua Ganzangbing Zazhi. 2006;14:289-292. [PubMed] |
| 11. | Custro N, Carroccio A, Ganci A, Scafidi V, Campagna P, Di Prima L, Montalto G. Glycemic homeostasis in chronic viral hepatitis and liver cirrhosis. Diabetes Metab. 2001;27:476-481. [PubMed] |
| 12. | 陆 荫英, 刘 妍, 成 军, 梁 耀东, 陈 天艳, 邵 清, 王 琳, 张 玲霞. HBsAg结合蛋白C-12基因转染肝癌细胞的基因表达谱芯片分析. 世界华人消化杂志. 2004;12:62-65. [DOI] |
| 13. | Hardt PD, Hauenschild A, Nalop J, Marzeion AM, Jaeger C, Teichmann J, Bretzel RG, Hollenhorst M, Kloer HU. High prevalence of exocrine pancreatic insufficiency in diabetes mellitus. A multicenter study screening fecal elastase 1 concentrations in 1,021 diabetic patients. Pancreatology. 2003;3:395-402. [PubMed] |
| 14. | Adedeji OO, Oyakhire GK, Ene DM, Al-Ghamdi SA. Role of lipase in glucose and lipid metabolisms. Saudi Med J. 2007;28:841-843. [PubMed] |
| 15. | Hardt PD, Hauenschild A, Nalop J, Marzeion AM, Jaeger C, Teichmann J, Bretzel RG, Hollenhorst M, Kloer HU. High prevalence of exocrine pancreatic insufficiency in diabetes mellitus. A multicenter study screening fecal elastase 1 concentrations in 1,021 diabetic patients. Pancreatology. 2003;3:395-402. [PubMed] |
| 16. | Nunes AC, Pontes JM, Rosa A, Gomes L, Carvalheiro M, Freitas D. Screening for pancreatic exocrine insufficiency in patients with diabetes mellitus. Am J Gastroenterol. 2003;98:2672-2675. [PubMed] [DOI] |
| 17. | Naruse S, Ishiguro H, Ko SB, Yoshikawa T, Yamamoto T, Yamamoto A, Futakuchi S, Goto H, Saito Y, Takahashi S. Fecal pancreatic elastase: a reproducible marker for severe exocrine pancreatic insufficiency. J Gastroenterol. 2006;41:901-908. [PubMed] [DOI] |
| 18. | Mancilla A C, Hurtado H C, Tobar A E, Orellana N I, Pineda B P, Castillo M I, Ledezma R R, Berger F Z. Pancreatic exocrine function in diabetes mellitus. Determination of fecal elastase. Rev Med Chil. 2006;134:407-414. [PubMed] |
| 19. | Vesterhus M, Raeder H, Johansson S, Molven A, Njølstad PR. Pancreatic exocrine dysfunction in maturity-onset diabetes of the young type 3. Diabetes Care. 2008;31:306-310. [PubMed] [DOI] |
| 20. | Garcia-Touchard A, Henry TD, Sangiorgi G, Spagnoli LG, Mauriello A, Conover C, Schwartz RS. Extracellular proteases in atherosclerosis and restenosis. Arterioscler Thromb Vasc Biol. 2005;25:1119-1127. [PubMed] [DOI] |
| 25. | Gilham D, Labonté ED, Rojas JC, Jandacek RJ, Howles PN, Hui DY. Carboxyl ester lipase deficiency exacerbates dietary lipid absorption abnormalities and resistance to diet-induced obesity in pancreatic triglyceride lipase knockout mice. J Biol Chem. 2007;282:24642-24649. [PubMed] [DOI] |
| 26. | D'Agostino D, Cordle RA, Kullman J, Erlanson-Albertsson C, Muglia LJ, Lowe ME. Decreased postnatal survival and altered body weight regulation in procolipase-deficient mice. J Biol Chem. 2002;277:7170-7177. [PubMed] [DOI] |
| 27. | Adedeji OO, Oyakhire GK, Ene DM, Al-Ghamdi SA. Role of lipase in glucose and lipid metabolisms. Saudi Med J. 2007;28:841-843. [PubMed] |
| 28. | Raeder H, Johansson S, Holm PI, Haldorsen IS, Mas E, Sbarra V, Nermoen I, Eide SA, Grevle L, Bjørkhaug L. Mutations in the CEL VNTR cause a syndrome of diabetes and pancreatic exocrine dysfunction. Nat Genet. 2006;38:54-62. [PubMed] [DOI] |
| 29. | Raeder H, Haldorsen IS, Ersland L, Grüner R, Taxt T, Søvik O, Molven A, Njølstad PR. Pancreatic lipomatosis is a structural marker in nondiabetic children with mutations in carboxyl-ester lipase. Diabetes. 2007;56:444-449. [PubMed] [DOI] |
| 30. | Tushuizen ME, Bunck MC, Pouwels PJ, Bontemps S, van Waesberghe JH, Schindhelm RK, Mari A, Heine RJ, Diamant M. Pancreatic fat content and beta-cell function in men with and without type 2 diabetes. Diabetes Care. 2007;30:2916-2921. [PubMed] [DOI] |