修回日期: 2008-04-07
接受日期: 2008-05-02
在线出版日期: 2008-06-08
目的: 利用RNAi技术特异性的抑制NF-κB亚单位p65的表达, 观察其对p65表达的抑制作用及联合5-FU对食管鳞癌细胞Eca109和EC9706的影响.
方法: 将终浓度为50 nmol/L的p65 siRNA转染到食管鳞癌细胞EC9706和Eca109中, 通过RT-PCR检测0、24、48和72 h时段p65 mRNA的表达水平. Western blotting法检测p65和Bcl-2蛋白表达, Annexin V/PI复染结合流式细胞仪检测细胞凋亡, 显微镜下观察p65 siRNA与5-FU单独或联合应用对食管鳞癌细胞形态学特性的影响.
结果: EC9706和Eca109细胞转染p65siRNA 24、48和72 h后, p65 mRNA的表达水平随时间的延长逐渐下调, 在72 h的阻断效率最为明显, 与0 h相比, 差异有显著性(0.12±0.01 vs 0.28±0.05, 0.1±0.01 vs 0.38±0.04, 均P<0.05), 转染72 h后, p65和Bcl-2蛋白表达水平下调. EC9706和Eca109转染p65siRNA后, 细胞凋亡指数明显升高(6.65%±0.27% vs 2.03%±0.08%, 8.03%±0.06% vs 2.66%±0.25%, 均P<0.05); p65 siRNA转染72 h后, EC9706和Eca109细胞增殖较慢; 当p65 siRNA与5-FU联合作用, 细胞增殖明显受到抑制.
结论: p65 siRNA可阻断NF-κB信号通路, 下调NF-κB下游基因中抗凋亡蛋白Bcl-2的表达, 表明活化的NF-κB信号通路可成为食管鳞癌基因治疗中一个重要的分子靶点.
引文著录: 田芳, 宋敏, 许培荣, 刘红涛, 薛乐勋. siRNA阻断NF-κB信号通路联合5-FU对食管鳞癌细胞凋亡的促进作用. 世界华人消化杂志 2008; 16(16): 1716-1721
Revised: April 7, 2008
Accepted: May 2, 2008
Published online: June 8, 2008
AIM: To evaluate the inhibitory effects of nuclear factor-kappa B p65 (NF-κB p65) on expression of p65 and to determine its combinatory effects with 5-FU on proliferation and apoptosis in EC9706 and Eca109 esophageal squamous cell carcinoma (ESCC).x
METHODS: EC9706 and Eca109 cells were transfected with 50 nmol/L p65 siRNA. The expression level of p65 mRNA was measured using PT-PCR at 0, 24, 48 and 72 h. P65 and Bcl-2 protein levels were determined using Western blotting. The cells were also stained with FITC-annexin V and PI, and cancer cell apoptosis was detected by flow cytometry using CellQuest acquisition and analysis programs. Morphological changes of ESCC cells were observed microscopically following p65 siRNA transfection with or without 5-FU.
RESULTS: For EC9706 and Eca109 transfected with p65 siRNA, the expression level of the p65 mRNA in ESCC cells was down-regulated with time. Peak inhibitory effect occured at 72 h and a significant difference was detected, compared with 0 h (0.12 ± 0.01 vs 0.28 ± 0.05, 0.1 ± 0.01 vs 0.38 ± 0.04, both P < 0.05). The protein levels of p65 and Bcl-2 decreased after transfection with p65 siRNA at 72 h. There was a significant increase in apoptosis level at 72 h following p65 siRNA transfection (6.65% ± 0.27% vs 2.03% ± 0.08%, 8.03% ± 0.06% vs 2.66% ± 0.25%, both P < 0.05). The proliferation of EC9706 and Eca109 was slow after transfection with p65 siRNA at 72 h, while p65 siRNA in combination with 5-FU significantly inhibited cell proliferation.
CONCLUSION: p65 siRNA can block NF-κB signaling pathway, down-regulates expression of Bcl-2, which makes activated NF-κB pathway a potential key target in gene therapy for ESCC.
- Citation: Tian F, Song M, Xu PR, Liu HT, Xue LX. Effect of siRNA-mediated inhibition of nuclear factor-κB in combination with 5-FU on apoptosis of squamous cell carcinoma cell lines. Shijie Huaren Xiaohua Zazhi 2008; 16(16): 1716-1721
- URL: https://www.wjgnet.com/1009-3079/full/v16/i16/1716.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i16.1716
食管癌是世界上最常见的恶性肿瘤之一, 其死亡率为整个肿瘤死亡的第六位[1]. 化疗药5-FU是食管癌治疗中最常用的药物之一, 但是逐渐出现的耐药却成为治疗中的一个难题. 核因子κB(nuclear factor-kappa B, NF-κB)是近年来发现的转录调控因子, 最常见的形式是由p50和p65组成的异源二聚体, 活化的NF-κB信号通路可增强肿瘤细胞对放化疗药物的敏感性. 有研究表明, 在许多人类肿瘤如肝癌、肠癌、宫颈癌中NF-κB信号通路的激活在肿瘤的发生发展中起着重要的作用[2-7]. RNA干扰(RNA interference, RNAi)是由双链RNA(double-stranded RNA, dsRNA)引发的转录后基因静默机制, 在很多生物中都发现了这种现象, 包括果蝇、线虫、原生动物、脊椎动物以及高等植物[8-10]. RNAi是双链RNA介导的特异性基因沉默现象, 是目前研究基因功能强有力的工具之一[11-13]. 本研究拟应用RNA干扰技术, 使用针对NF-κB信号通路中p65的特异性siRNA, 观察其对p65表达的抑制作用及联合化疗药5-FU对食管鳞癌细胞Eca109和EC9706的影响, 探讨将NF-κB作为基因治疗靶点的价值.
食管癌细胞系Eca109由本室保存, 食管癌细胞系EC9706由中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室惠赠. 细胞在含有100 mL/L的胎牛血清, 100 kU/L青霉素, 100 mg/L链霉素的1640培养液(Gibco公司)中于37℃, 50 mL/L CO2的条件下培养, 实验细胞均处于对数生长期. 鼠抗人p65(sc-8008)和鼠抗人Bcl-2(sc-7382)抗体购自Santa Cruz Biotechnology 公司; NF-κB p65 siRNA干扰试剂盒购自Cell Signaling Technology公司; 凋亡试剂盒Annexin V-FITC Kit购自美国Eckman CoulterTM公司.
1.2.1 siRNA的转染: 按照siRNA干扰试剂盒说明书的要求, 进行转染. 在转染前, EC9706(5×104)和Eca109(6×104)按一定细胞数铺于6孔板中, 使用无抗生素的培养基培养24 h. 将含有siRNA的转染试剂与细胞共孵育5 h后, 加入新鲜培养基孵育24 h.
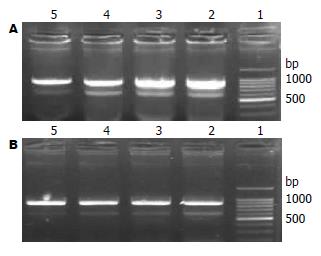
1.2.2 细胞总RNA的提取和引物设计: p65 siRNA转染0、24、48和72 h后, 用TRIzol试剂从EC9706和Eca109细胞中提取总RNA, 样品经琼脂糖凝胶电泳观察. 设计p65上下游引物: p65的上游引物为5'-ATAGAAGAGCAGCGTGGGGACT-3', 下游引物为5'-GGATGACGTAAAGGG ATAGGGC-3'; 内参GAPDH的上游引物为5'-AAGGTCGGAGTCAACGGATTTG-3, 下游引物为 5'-CTTGACAAAGTGGTCGTTGAGG-3'.
1.2.3 RT-PCR分别合成p65和GAPDH的cDNA第一链: 取总RNA 1 μg, 随机六合引物1 μL, 5×AMV Buffer 4 μL, Rnase Inhibitor(20 U/μL)1 μL, dNTP(10 mmol/L)2 μL, AMV RT 1 μL, 加DEPC处理水至20 μL, 稍离心后混匀, 42℃水浴60 min, 70℃水浴10 min. 从上述反应体系中取2 μL, 加10×PCR Buffer 5 μL, 2 mmol/L dNTP 1 μL, 25 mmol/L MgCl2 3 μL, 50 mmol/L的引物各0.5 μL, 1 U/50 μL Taq酶1 μL, 无菌水36 μL, 总体积为50 μL. 反应体系为: 94℃预变性2 min后开始循环, 95℃变性1 min, 57℃退火1 min, 72℃延伸1 min, 30个循环, 最后72℃延伸5 min.
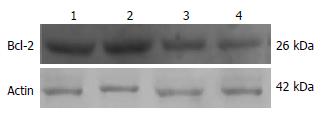
1.2.4 Western blotting测定蛋白的表达: 按照细胞质蛋白提取试剂盒说明书(Pierce公司), 提取细胞质蛋白, Bradford法检测蛋白质的含量, -70℃保存. 转染p65 siRNA 72 h后, 从Eca109和EC9706细胞中取细胞质蛋白, 与预染的蛋白质分子量标准一起上样. 检测p65和非靶向MAPK蛋白, 及抗凋亡蛋白Bcl-2的表达, 经120 g/L SDS-PAGE分离, 电转到硝酸纤维膜上. 5%的脱脂奶粉TBST溶液封闭2 h, 抗体按1:100孵育4℃过夜, TBST溶液洗涤10 min×3次, 硝酸纤维膜分别与辣根过氧化物酶标记的二抗(1:50000)室温孵育1 h后, TBST溶液洗涤10 min×3次, DAB显色. 实验重复3次.
1.2.5 流式细胞仪检测凋亡细胞: 转染和未转染p65siRNA的食管鳞癌细胞, 单独或联合使用5-FU治疗后72 h, 制备各组单细胞悬液, 做细胞计数. 取至少106个细胞移入新的1.5 mL离心管中, 4℃下500转离心5 min, 形成细胞团. 小心移去上清液, 冰预冷PBS洗细胞2次, 保证每管细胞数至少106个细胞. 加5 μL Annexin V-FITC和2.5 μL PI到100 μL的细胞悬液中, 轻轻混匀; 以未染色细胞调零机器, 以Annexin V-FITC单染管和PI单染管做为基准参照, 测定每个上样管数据, 利用CellQuest3.0软件进行参数获取和资料分析, 计算凋亡细胞百分比.
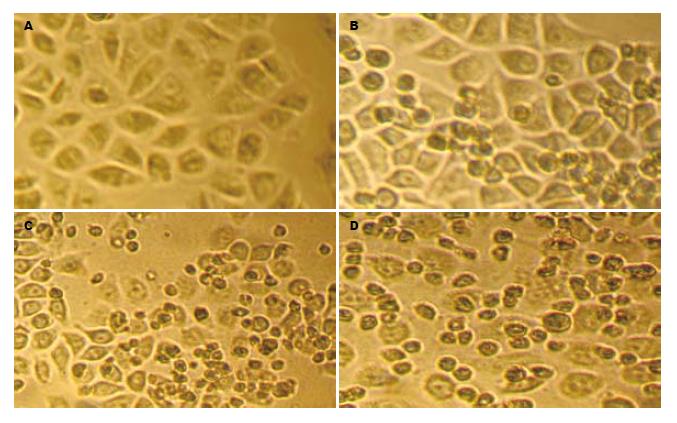
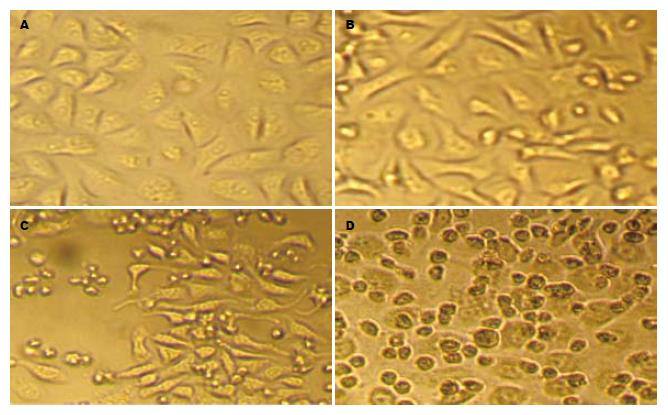
1.2.6 治疗前后细胞形态学观察: 在细胞培养状态下, 用倒置显微镜分别观察两种食管鳞癌细胞未转染组、转染72 h组、5-FU治疗组、转染48 h+5-FU 24 h治疗组的细胞生长状态及形态学改变.
统计学处理 应用SPSS13.0统计软件进行统计学处理, 统计学数据用mean±SD表示, 对计量资料, 两样本均数比较采用t检验. 检验水准α = 0.05.
与未转染p65 siRNA的EC9706和Eca109细胞相比, 转染后的EC9706和Eca109细胞, p65 mRNA的表达水平下调, 与内参吸收峰面积相比, 他们的相对含量见表1. 72 h的阻断效率最为明显, 与0 h相比, 差异有显著性(P<0.05). 在食管鳞癌细胞中, p65siRNA可以特异性的降解p65 mRNA(图1, 表1).
EC9706和Eca109细胞转染siRNA 72 h后, 收集各组细胞提取细胞质蛋白, Western blotting 检测细胞中p65的蛋白表达水平(图2). 结果表明, 与未转染p65 siRNA的EC9706和Eca109细胞相比, 转染后的EC9706和Eca109细胞, p65蛋白的表达水平下调, 而非靶向蛋白MAPK的表达无影响. 说明针对p65的siRNA可特异性的抑制p65的表达, 对其他蛋白的表达无影响.
NF-κB可以调控多种下游基因的表达, 如cyclin D1、c-myc、Bcl-2等, 这些基因的表达有助于肿瘤细胞的增殖、抗凋亡. 食管鳞癌细胞EC9706和Eca109在转染p65 siRNA 72 h后, 提取细胞总蛋白检测抗凋亡蛋白Bcl-2的表达情况. 结果表明, 在转染72 h Bcl-2的表达下降(图3).
流式细胞仪检测细胞凋亡结果显示, EC9706和Eca109在转染p65siRNA后, 细胞凋亡指数明显升高(表2, P<0.05); 当与5-FU(327 mg/L)联合使用时, 凋亡和坏死的细胞均显著增加(表2, P<0.05).
经p65 siRNA转染72 h后, EC9706和Eca109细胞出现细胞形态缩小, 漂浮数增加, 细胞增殖较慢; 在p65 siRNA转染48 h后, 与5-FU联合作用24 h, EC9706和Eca109细胞出现细胞形态缩小, 胞质凝缩, 细胞漂浮数明显增加, 细胞数量下降, 增殖明显受到抑制(图4-5).
我们前期研究表明, 活化的NF-κB信号通路存在于食管鳞癌细胞中[14-15], 但是, 激活的NF-κB信号通路在食管鳞癌细胞的增殖、凋亡及对化疗药的耐受性等机制中是否起作用, 尚不清楚. 本研究使用RNA干扰技术, 特异性的阻断NF-κB亚单位p65的表达, RT-PCR结果发现, p65 siRNA的mRNA水平随着时间的延长而下降, 在72 h p65的表达受到明显抑制. 根据RT-PCR的结果, Western blotting实验中发现, 在转染72 h后, 与未转染细胞相比, p65的蛋白表达水平也明显下降, 而非靶向抗体MAPK的表达水平未受到影响.
化学治疗和放射治疗是通过诱导肿瘤细胞的凋亡起到抗肿瘤的作用[16-18], 活化的NF-κB信号通路在肿瘤细胞的增殖、抗凋亡中起着重要的作用, 一些研究发现, NF-κB在肿瘤细胞抗化疗或抗放疗中也起着一定的作用[19-21]. 化疗药5-FU是食管癌治疗中最常用的药物之一, 但是逐渐出现的耐药却成为治疗中的一个难题[22]. Bcl-2是一类新的癌基因家族成员, 基因转染实验显示Bcl-2高表达广泛抑制大多数刺激剂诱导的细胞凋亡[23-25]. Huang et al[26]使用针对Bcl-2的siRNA转染宫颈癌细胞, 通过下调其表达, 研究他在肿瘤细胞凋亡中的作用, 结果发现Bcl-2的低表达会增加肿瘤细胞对化疗药的敏感性. 在乳腺癌等多种肿瘤细胞的研究中, 通过使用NF-κB抑制剂可以下调Bcl-2的表达, 促进肿瘤细胞的凋亡, 提示NF-κB和Bcl-2能够成为肿瘤治疗的新靶点[27-28].
NF-κB调控的下游基因包括IL-1、COX2、MMP9等促进肿瘤发生的基因; VEGF、TNF等与肿瘤血管生成有关的基因; ICAM-1、VCAM-1等与肿瘤转移有关的基因; Bcl-2、cIAP、TRAF等与肿瘤抗凋亡有关的基因[29-30]. 我们采用Western blotting法, 检测转染p65 siRNA, 阻断NF-κB信号通路后, 是否能够下调抗凋亡基因Bcl-2的表达, 结果发现, 与未转染细胞相比, 转染细胞中Bcl-2的表达受到抑制. 本研究还采用流式细胞仪检测食管鳞癌细胞在转染前后及单独或联合应用5-FU后, 对细胞凋亡的影响. EC9706和Eca109在转染p65 siRNA后, 细胞凋亡数开始增加; 当转染细胞联合使用5-FU时, 细胞凋亡数明显增加(P<0.05), 同时细胞死亡数也明显增加. 以上结果显示, Bcl-2是肿瘤细胞抵抗凋亡的一个重要的调节者, 当使用p65 siRNA阻断食管鳞癌细胞中NF-κB信号通路时, Bcl-2的表达下调, 细胞凋亡数增加, 提示Bcl-2也是受NF-κB调节的一个重要的下游基因, NF-κB可以通过下调抗凋亡基因Bcl-2的表达, 增加食管鳞癌细胞的凋亡; 当联合使用化疗药时, 可以明显提高食管鳞癌细胞的凋亡数. 因此, 食管鳞癌细胞对5-FU敏感性的增加, 或许是由于NF-κB信号通路的阻断, 抑制了抗凋亡基因Bcl-2的表达, 促进食管鳞癌细胞凋亡.
因此, 激活的NF-κB信号通路在食管鳞癌细胞的增殖、抗凋亡及耐药中起着重要的作用, 通过转染p65 siRNA可以特异性的阻断NF-κB信号通路, 促进细胞的凋亡, 增加细胞对化疗药的敏感性, 提示NF-κB信号通路可以成为食管癌基因治疗中一个强有力的作用靶点.
食管癌是世界上最常见的恶性肿瘤之一, 尤其在中国河南省林县, 食管癌的发生率和死亡率均较高. 目前, 中国食管癌的主要类型仍是鳞癌.
周晓东, 研究员, 中山大学附属二院医学研究中心; 施瑞华, 教授, 南京医科大学第一附属医院消化科
化疗药5-FU是食管癌治疗中最常用的药物之一, 但是逐渐出现的耐药却成为治疗中的一个难题.
Ma et al的研究中发现, 与正常的造血细胞相比, 骨髓瘤细胞中存在有IκBα的磷酸化和降解以及NF-κB活性的增强, 并且NF-κB的激活也与骨髓瘤细胞对化疗药物的抗性有关; 使用蛋白酶抑制剂PS-341可以阻断NF-κB的核转录及其与DNA的结合活性, 降低骨髓瘤细胞对化疗药物的耐受性, 而对正常的造血细胞无明显的影响, 并且PS-341与化疗药物联合使用可以降低化疗药的副作用.
NF-κB信号通路可以成为食管癌基因治疗中一个强有力的作用靶点, 为食管癌的分子靶向治疗提供基础.
本研究立题依据充分, 实验设计合理, 内容丰富, 数据可靠, 结论正确, 是一篇较好的科研论文.
编辑: 李军亮 电编:何基才
| 1. | Pisani P, Parkin DM, Bray F, Ferlay J. Estimates of the worldwide mortality from 25 cancers in 1990. Int J Cancer. 1999;83:18-29. [PubMed] [DOI] |
| 2. | Wang J, Huang Q, Chen M. The role of NF-kappaB in hepatocellular carcinoma cell. Chin Med J (Engl). 2003;116:747-752. [PubMed] |
| 3. | Qin JM, Wan XW, Zeng JZ, Wu MC. Effect of Sirpalpha1 on the expression of nuclear factor-kappa B in hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2007;6:276-283. [PubMed] |
| 4. | Yu HG, Yu LL, Yang Y, Luo HS, Yu JP, Meier JJ, Schrader H, Bastian A, Schmidt WE, Schmitz F. Increased expression of RelA/nuclear factor-kappa B protein correlates with colorectal tumorigenesis. Oncology. 2003;65:37-45. [PubMed] [DOI] |
| 5. | Yu LL, Yu HG, Yu JP, Luo HS, Xu XM, Li JH. Nuclear factor-kappaB p65 (RelA) transcription factor is constitutively activated in human colorectal carcinoma tissue. World J Gastroenterol. 2004;10:3255-3260. [PubMed] |
| 6. | Nair A, Venkatraman M, Maliekal TT, Nair B, Karunagaran D. NF-kappaB is constitutively activated in high-grade squamous intraepithelial lesions and squamous cell carcinomas of the human uterine cervix. Oncogene. 2003;22:50-58. [PubMed] [DOI] |
| 7. | Im E, Choi SH, Suh H, Choi YH, Yoo YH, Kim ND. Synthetic bile acid derivatives induce apoptosis through a c-Jun N- terminal kinase and NF-kappaB-dependent process in human cervical carcinoma cells. Cancer Lett. 2005;229:49-57. [PubMed] [DOI] |
| 8. | Bass BL. Double-stranded RNA as a template for gene silencing. Cell. 2000;101:235-238. [PubMed] [DOI] |
| 9. | Caplen NJ, Parrish S, Imani F, Fire A, Morgan RA. Specific inhibition of gene expression by small double-stranded RNAs in invertebrate and vertebrate systems. Proc Natl Acad Sci U S A. 2001;98:9742-9747. [PubMed] [DOI] |
| 10. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 11. | Takahashi Y, Nishikawa M, Kobayashi N, Takakura Y. Gene silencing in primary and metastatic tumors by small interfering RNA delivery in mice: quantitative analysis using melanoma cells expressing firefly and sea pansy luciferases. J Control Release. 2005;105:332-343. [PubMed] [DOI] |
| 12. | Chen LB, Xu JY, Yang Z, Wang GB. Silencing SMYD3 in hepatoma demethylates RIZI promoter induces apoptosis and inhibits cell proliferation and migration. World J Gastroenterol. 2007;13:5718-5724. [PubMed] |
| 13. | Tschaharganeh D, Ehemann V, Nussbaum T, Schirmacher P, Breuhahn K. Non-specific effects of siRNAs on tumor cells with implications on therapeutic applicability using RNA interference. Pathol Oncol Res. 2007;13:84-90. [PubMed] |
| 17. | Aggarwal BB, Ichikawa H. Molecular targets and anticancer potential of indole-3-carbinol and its derivatives. Cell Cycle. 2005;4:1201-1215. [PubMed] |
| 18. | Girdhani S, Bhosle SM, Thulsidas SA, Kumar A, Mishra KP. Potential of radiosensitizing agents in cancer chemo- radiotherapy. J Cancer Res Ther. 2005;1:129-131. [PubMed] |
| 19. | Fraser CC. Exploring the positive and negative consequences of NF-kappaB inhibition for the treatment of human disease. Cell Cycle. 2006;5:1160-1163. [PubMed] |
| 20. | Luo JL, Kamata H, Karin M. IKK/NF-kappaB signaling: balancing life and death--a new approach to cancer therapy. J Clin Invest. 2005;115:2625-2632. [PubMed] [DOI] |
| 21. | Magné N, Toillon RA, Bottero V, Didelot C, Houtte PV, Gérard JP, Peyron JF. NF-kappaB modulation and ionizing radiation: mechanisms and future directions for cancer treatment. Cancer Lett. 2006;231:158-168. [PubMed] [DOI] |
| 22. | Wang MH, Li YP, Wang XD, Zhang H, Xiong LH, Huang HZ. Correlation between serum p53 antibody and chemosensitivity in patient with esophageal cancer. Ai Zheng. 2004;23:467-470. [PubMed] |
| 23. | van Delft MF, Huang DC. How the Bcl-2 family of proteins interact to regulate apoptosis. Cell Res. 2006;16:203-213. [PubMed] [DOI] |
| 24. | Kock N, Kasmieh R, Weissleder R, Shah K. Tumor therapy mediated by lentiviral expression of shBcl-2 and S-TRAIL. Neoplasia. 2007;9:435-442. [PubMed] [DOI] |
| 25. | Fu GF, Lin XH, Han QW, Fan YR, Xu YF, Guo D, Xu GX, Hou YY. RNA interference remarkably suppresses bcl-2 gene expression in cancer cells in vitro and in vivo. Cancer Biol Ther. 2005;4:822-829. [PubMed] |
| 26. | Huang SL, Wu Y, Yu H, Zhang P, Zhang XQ, Ying L, Zhao HF. Inhibition of Bcl-2 expression by a novel tumor-specific RNA interference system increases chemosensitivity to 5-fluorouracil in Hela cells. Acta Pharmacol Sin. 2006;27:242-248. [PubMed] [DOI] |
| 27. | Pozo-Guisado E, Merino JM, Mulero-Navarro S, Lorenzo-Benayas MJ, Centeno F, Alvarez-Barrientos A, Fernandez- Salguero PM. Resveratrol-induced apoptosis in MCF-7 human breast cancer cells involves a caspase-independent mechanism with downregulation of Bcl-2 and NF-kappaB. Int J Cancer. 2005;115:74-84. [PubMed] [DOI] |
| 28. | Fahy BN, Schlieman MG, Mortenson MM, Virudachalam S, Bold RJ. Targeting BCL-2 overexpression in various human malignancies through NF-kappaB inhibition by the proteasome inhibitor bortezomib. Cancer Chemother Pharmacol. 2005;56:46-54. [PubMed] [DOI] |
| 29. | Dolcet X, Llobet D, Pallares J, Matias-Guiu X. NF-kB in development and progression of human cancer. Virchows Arch. 2005;446:475-482. [PubMed] [DOI] |
| 30. | Lee CH, Jeon YT, Kim SH, Song YS. NF-kappaB as a potential molecular target for cancer therapy. Biofactors. 2007;29:19-35. [PubMed] |