修回日期: 2008-03-17
接受日期: 2008-05-10
在线出版日期: 2008-05-18
目的: 筛查肝纤维化组织相关基因, 探讨肝纤维化发生机制.
方法: 抽提肝纤维化组织和正常肝组织总RNA来制备探针, 经杂交、洗涤后, 通过计算机扫描分析肝纤维化组织和正常肝组织基因表达谱的差异情况, 并用实时荧光定量PCR技术对其中部分差异基因的表达水平变化进行验证.
结果: 筛选出差异表达的基因68个, 其中肝纤维化组织中表达上调的基因35个, 表达下调的基因33个, 这些基因按照功能可以分为调控细胞信号转导、DNA损伤与修复、转录调控因子、代谢相关基因以及未知功能基因. 与正常肝组织比较, 肝纤维化组织中C/EBPβ mRNA表达下调(22.02±4.82 vs 59.13±8.21, P<0.01), MMP-14 mRNA表达上调(257.33±26.58 vs 21.65±4.37, P<0.01), 结果与基因芯片一致.
结论: 多种基因参与肝纤维化的形成过程, 肝纤维化组织与正常肝组织之间存在有明显的基因表达差异.
引文著录: 罗新华, 杨勤, 张权, 程明亮. 应用基因芯片对人肝纤维化相关基因的筛查. 世界华人消化杂志 2008; 16(14): 1525-1529
Revised: March 17, 2008
Accepted: May 10, 2008
Published online: May 18, 2008
AIM: To screen the genes associated with human hepatic fibrosis and explore the mechanism of hepatic fibrosis.
METHODS: Total mRNA was obtained from human hepatic fibrosis tissues and normal liver tissues respectively to prepare probe. After hybridization and cleaning, computer scan technique was used to analyze the gene expression maps of liver fibrosis tissues and normal liver tissue. Real-time fluorescence quantitative polymerase chain reaction (FQ-PCR) was adopted to verify the expression changes of some differential genes.
RESULTS: Sixty-eight differential genes were screened out, of which 35 were up-regulated and 33 were down-regulated. These genes were categorized according to their functions as cell signal transmission-regulating genes, DNA impairment and repair genes, translation-regulating factors, metabolism-related genes and function-unknown genes. As compared with that in normal liver tissues, C/EBPβ mRNA expression was down-regulated (22.02 ± 4.82 vs 59.13 ± 8.21, P < 0.01), while MMP-14 mRNA expression was up-regulated (257.33 ± 26.58 vs 21.65 ± 4.37, P < 0.01). This conformed to the results of cDNA microarray.
CONCLUSION: Multiple genes are involved in the formation of hepatic fibrosis and there is a significant difference in gene expression between normal and fibrotic liver tissues.
- Citation: Luo XH, Yang Q, Zhang Q, Cheng ML. Screening of genes associated with human hepatic fibrosis using cDNA microarray. Shijie Huaren Xiaohua Zazhi 2008; 16(14): 1525-1529
- URL: https://www.wjgnet.com/1009-3079/full/v16/i14/1525.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i14.1525
胃肝纤维化是细胞外基质(extracellular matrix, ECM)合成增多, 降解相对不足, 过多沉积在肝脏的病理结果, 其发生发展过程中涉及到多种细胞、细胞因子及其信号转导通路之间一系列复杂的变化[1]. 近年的研究表明,多基因参与调控肝纤维化的形成, 但这些研究往往只针对单一的或少数几个基因[2], 难以在全基因组水平阐明肝纤维化发病的分子机制. 基因芯片(cDNA microarry)具有高并行性、高通量、准确的特点, 能够在一次实验中同时研究多个基因的表达[3-5]. 我们运用基因芯片技术对人肝纤维化与正常人肝组织进行检测, 从整体上对两者之间差异表达基因进行分析, 可为进一步阐明肝纤维化的发生机制提供科学依据.
贵阳医学院附属医院慢性肝病手术切除的肝脏标本, 病理确诊肝纤维化组织6例, 男4例, 女2例, 年龄38-61岁. 肝外伤手术正常肝组织6例, 男5例, 女1例, 年龄21-50岁. 取得组织后立即置于-80℃冰箱中保存备用. TRIzol(Invitrogen, Carlsbad, CA); 含有480个靶基因点的人类Oligo GEArray(OHS-802, SuperArray Bioscience Corp, Frederick, MD)芯片、β-actin引物、SYBR GreenⅠ, 由美国刘杰博士惠赠; Qiagen Mini kit RNA纯化试剂盒(Qiagen, Valencia, CA); TrueLabeling试剂盒(SuperArray Bioscience Corp, Frederick, MD); 逆转录cDNA第1链合成试剂盒(德国Fermentas公司); 高敏胶片(Amercham Biosciences UK Ltd, Buckinghamshire, UK); C/EBPβ、MMP-14引物委托上海生工公司合成.
操作按说明书进行总RNA的提取和探针标记. 每个正常和肝纤维化组织样本取50 mg分别合并, 应用TRIzol抽提总RNA, 采用消化并以Qiagen Mini kit纯化RNA, 将总RNA 3 mg转化成biotinylated-UTP-labeled的cRNA探针并使用SuperArray公司的TrueLabeling试剂盒纯化. 膜以GEAhyb杂交液60℃预杂交2 h, 再与cRNA探针60℃杂交过夜. 次日膜在2×SSC, 10 g/L SDS溶液中洗涤15 min, 再于60℃下在0.1×SSC, 5 g/L SDS溶液中洗涤15 min, 然后在GEA终止液中终止40 min, 再与碱性磷酸酶结合的链球菌抗生物素蛋白孵育10 min, 以试剂盒附带的F缓冲液洗涤4次, 加CDP-Star化学发光底物后在化学发光高敏感胶片一次曝光. 选取C/EBPβ和MMP-14基因进行RT-PCR验证. 取与芯片实验相同的RNA, 按试剂盒操作说明合成cDNA第1链, 实验过程中严格设立内参照β-actin. C/EBPβ上游引物5'-TGATAAA CTCTCTGCTCTCCC-3', 下游引物: 5'-AAACATCAACAGCAACAAGCC-3'; MMP-14上游引物: 5'-GCTCCGAGGGGAGATGTTTG-3', 下游引物: 5'-CAG CTCCTTAATGTGCTTGGG-3', β-actin上游引物: 5'-ACCACCATGTACCCAGG CAT-3', 下游引物: 5'-CCGGACTCATCGTACTCCTG-3'.real-time PCR扩增条件: 50℃ 2 min, 95℃预变性10 min, 95℃变性15 s , 60℃ 60 s, 共40个循环. 图象以SuperArray Image软件包对信号进行吸光度分析, 基因表达的强度首先过滤背景信噪, 再完整的标准化. 通过计算各杂交点两种吸光度强度的比例, 得知每个克隆在两标本间的表达差异. 其比值0.8-1.2表示无变化, >1.2或<0.8表示有差异, >1.5或<0.7表示有显著差异. Real-time PCR数据分析: 根据扩增结果计算待测基因Ct值与β-actin Ct值之比值, 即为待测基因mRNA的相对表达量.
统计学处理 应用SPSS11.5统计软件处理数据, 组间比较采用t检验, P<0.05为差异有显著性.
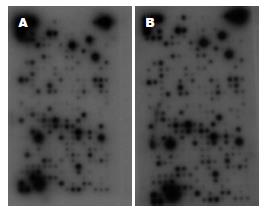
与正常肝组织比较, 肝纤维化组织表达上调的基因基因35条, 其中显著增加的基因33条, 有差异的基因2条(图1, 表1). 与正常肝组织比较, 肝纤维化组织表达下调的基因基因33条, 均呈显著性降低(图1, 表2).
| Refseq No. | Symbol | Description | Control | Fibrosis | F/C |
| NM_004995 | MMP-14 | Matrix metallopeptidase 14 | 204 | 4793 | 23.46 |
| NM_183048 | PRKCBP1 | Protein kinase C BP1 | 2901 | 20 215 | 6.97 |
| NM_002624 | PFDN5 | Prefoldin 5 | 1629 | 11 312 | 6.94 |
| NM_002421 | MMP1 | Matrix metallopeptidase 1 | 101 | 632 | 6.23 |
| NM_002754 | MAPK13 | Mitogen-activated PK 13 | 62 | 261 | 4.22 |
| NM_005356 | LCK | Lymphocyte-specific PTK | 1442 | 5135 | 3.56 |
| NM_005234 | NR2F6 | Nuclear receptor subfamily 2F6 | 264 | 769 | 2.91 |
| NM_016155 | MMP-17 | Matrix metallopeptidase 17 | 1435 | 2821 | 1.97 |
| NM_007312 | HYAL1 | Hyaluronoglucosaminidase 1 | 1372 | 2658 | 1.94 |
| NM_002165 | ID1 | Inhibitor of DNA binding 1 | 4082 | 7816 | 1.91 |
| NM_002343 | LTF | Lactotransferrin | 2552 | 4541 | 1.78 |
| NM_002629 | PGAM1 | Phosphoglycerate mutase 1 | 5175 | 9033 | 1.75 |
| NM_002502 | NFKB2 | Nuclear factor of kappa light | 4761 | 7481 | 1.57 |
| NM_000545 | TCF1 | Transcription factor 1, hepatic | 6530 | 10 047 | 1.54 |
| NM_000224 | KRT18 | Keratin 18 | 2807 | 4172 | 1.49 |
| Refseq No. | Symbol | Description | Control | Fibrosis | F/C |
| NM_001812 | CENPC1 | Centromere protein C 1 | 5159 | 508 | 0.1 |
| NM_006568 | CGRRF1 | Cell growth regulator | 5634 | 808 | 0.14 |
| NM_005211 | CSF1R | Colony stimulating factor 1R | 3147 | 533 | 0.17 |
| NM_000964 | RARA | Retinoic acid receptor, alpha | 6005 | 1379 | 0.23 |
| NM_005845 | ABCC4 | ATP-binding cassetteC4 | 7384 | 1701 | 0.23 |
| NM_001806 | CEBPB | (C/EBP), beta | 3154 | 822 | 0.26 |
| NM_001789 | CDC25A | Cell division cycle 25A | 12 598 | 3945 | 0.31 |
| NM_000051 | ATM | Ataxia telangiectasia mutated | 13 336 | 4333 | 0.32 |
| NM_145904 | HMGA1 | High mobility AT-hook 1 | 3157 | 1090 | 0.35 |
| NM_000965 | RARB | Retinoic acid receptor, beta | 6240 | 2162 | 0.35 |
| NM_004358 | CDC25B | Cell division cycle 25B | 13 381 | 4759 | 0.36 |
| NM_004071 | CLK1 | CDC-like kinase 1 | 2476 | 962 | 0.39 |
| NM_020990 | CKMT1B | Creatine kinase 1B | 3113 | 1240 | 0.4 |
| NM_001686 | ATP5B | ATP synthase | 11 049 | 4403 | 0.4 |
肝纤维化是各种慢性肝病的共同病理结果, 其发生发展是一个多基因参与的分子生物学过程. 研究肝纤维化发生发展过程中相关基因的变化, 有助于阐明其发生机制, 同时也为特异性治疗包括基因治疗提供有效的靶点[6-7]. 我们采用基因芯片技术, 从整体上研究肝纤维化发生的相关基因, 发现有68个基因出现表达差异, 其中表达上调的基因35条, 表达出现下调的基因33 条. 这些基因按照功能可以分为调控细胞信号转导、DNA损伤与修复、转录调控因子、代谢相关基因以及未知功能基因, 表明肝纤维化的发生与上述基因的表达变化有关, 是多个基因共同调控的结果.
基质金属蛋白酶(matrix metalloproteinases, MMPs)是参与ECM降解的主要酶家族[8], 目前已发现25个成员. MMPs以酶原形式分泌, 为钙离子和锌离子活性依赖性, 主要分为间质性胶原酶、明胶酶、溶基质素、膜型MMPs、金属弹力蛋白酶5个亚型[9]. MMP-1的功能主要是降解Ⅰ, Ⅲ型胶原[10]. 研究表明, MMP-1在正常肝组织中可见少量表达, 肝纤维化形成过程中表达逐渐增加[11]. 我们发现, 在肝纤维化组织中MMP-1表达增加, 结合我们前期的研究推测肝纤维化形成的主要原因不是因为MMP-1表达减少, 而是由于其特异性抑制剂TIMP-1进行性升高, 使MMP-1活性受到抑制, TIMP-1/MMP-1比值逐渐上升, 导致ECM的过度沉积所致[12]. 我们在本实验中同时发现MMP-14即膜型-1基质金属蛋白酶在肝纤维化组织中表达上调. 目前有关MMP-14文献报道主要集中在他与肿瘤侵袭和转移的关系[13-14], 而与肝纤维化形成关系的报道较少. 研究发现, MMP-14在肝脏主要表达于活化的HSC中, 与TIMP-2、MMP-2共同调节胶原的代谢[15]. 我们进一步采用Real-time PCR方法对比研究了MMP-14 mRNA在肝纤维化及正常肝组织中的表达, 发现在肝纤维化组织中MMP-14 mRNA的表达较正常肝组织明显增加(P<0.01), 与Zhou et al[16]研究结果一致, 提示MMP-14参与了肝纤维化的病理发生过程. MMP-17为膜型-4基质金属蛋白酶[17], 我们发现其在肝纤维化组织中表达上调, 其机制尚不清楚.
视黄酸受体属于类固醇/甲状腺激素核内受体超家族成员, 包括RAR(retinoic acid receptor) 类和RXR(retinoic acid X receptor)类, 每类各有α, β, γ 3个亚型. 视黄酸、视黄酸受体、视黄酸反应元件等组成视黄酸信号传递系统, 激活或抑制相应功能性靶基因的表达, 参与调控细胞的增殖、分化和凋亡等重要生命过程. 近年来, 视黄酸受体在肝纤维化中的作用日益受到重视, HSC激活时维生素A信号转导大大减弱, RAR和RXR表达明显下降[18-22]. Li et al[23]用Western blot证实新鲜分离的HSC内有丰富的RARβ, 在PDGF激活的HSC中RARβ表达明显降低, 进一步将RARβ表达质粒转入已激活的HSC中, 可抑制活化HSC的增生、下调α-SMA的表达. Hellemans et al[24]也证实了RAR以负性调节方式调节HSC的增殖, 提示RAR类受体表达变化是HSC激活的重要机制.实验证实, RAR与组成转录因子激活蛋白-1(AP-1)的c-Jun蛋白形成无效的异二聚体, 使AP-1的活性降低[25]. 我们发现, 与正常人肝组织相比, RARα、β在肝纤维化组织中表达下调, 推测可能RAR表达下降, 引起AP-1的活性增强, TGFβ表达增加, 导致肝纤维化的发生.
CCAAT增强子结合蛋白(CCAAT enhancer binding protein, C/EBP)家族属于碱性亮氨酸拉链(basic leucine zipper, bZIP)类转录因子, 主要存在于脂肪细胞、肝细胞及造血细胞中. 目前已发现并成功克隆了C/EBPα, β, γ, δ, ε, ζ 6种亚型. 他们均能以同源或异源二聚体的形式识别并结合目的基因调节元件, 对下游基因进行转录调控.研究表明: C/EBPβ在脂肪代谢、炎症反应、信号转导过程和细胞增生的基因表达调控中具有非常重要的地位和作用[26-28]. She et al[29]研究大鼠体外培养的HSC活化前后C/EBPβ的表达变化时, 发现C/EBPβ在静止的HSC中表达增加, 而在活化的HSC中表达下降, 提示C/EBPβ对维持HSC的静息状态具有重要作用. 我们的基因芯片结果显示, 在肝纤维化组织中, C/EBPβ表达较正常肝组织明显下降, 进一步用Real-time PCR方法研究发现, 肝纤维化组织中C/EBPβ mRNA表达量较正常肝组织下降2.5倍, 与基因芯片结果一致. C/EBPβ在肝纤维化中的作用推测可能为C/EBPβ减少引起HSC内脂滴丢失、HSC活化, 导致细胞外基质合成增加. Kang et al[30]报道, Oltipraz可通过增加C/EBPβ的表达, 介导HSC的失活, 显著减轻二甲基亚硝胺诱导的大鼠肝纤维化, 提示通过刺激C/EBPβ的表达有望成为治疗肝纤维化的新途径.
总之, 基因芯片是研究肝纤维化基因表达谱的一种有效手段, 本实验获得的差异表达的相关基因可为今后的研究提供线索. 对这些基因的验证和深入分析, 将为进一步阐明肝纤维化发生机制及基因治疗提供更丰富的资料.
肝纤维化是各种慢性肝病的共同病理结果, 其发生发展是一个多基因参与的分子生物学过程. 基因芯片具有高并行性、高通量、准确的特点, 能够在一次实验中同时研究多个基因的表达.
高泽立, 副教授, 上海交通大学医学院附属第三人民医院感染科
近年的研究表明,多基因参与调控肝纤维化的形成, 但这些研究往往只针对单一的或少数几个基因, 难以在全基因组水平阐明肝纤维化发病的分子机制.
Li et al用Western blot证实新鲜分离的HSC内有丰富的RARβ, 在PDGF激活的HSC中RARβ表达明显降低, 进一步将RARβ表达质粒转入已激活的HSC中, 可抑制活化HSC的增生、下调α-SMA的表达.
本研究运用基因芯片技术对人肝纤维化与正常人肝组织进行检测, 从整体上对两者之间差异表达基因进行分析, 进一步阐明了肝纤维化的发生机制.
本研究有助于进一步阐明肝纤维化的发生机制, 同时也为肝纤维的特异性治疗包括基因治疗提供有效的靶点.
本文选题紧扣肝纤维化研究热点前沿, 方法先进可靠, 讨论充分, 条理分明, 具有较好的学术价值.
编辑: 师忠芳 电编:郭海丽
| 1. | Cheng ML, Yang CQ. Hepatic Fibrosis. 1sted. Beijing: People's Medicial Publishing House 2007; 36-53. |
| 2. | Cheng ML, Geng XX. Signal transduction in hepatic stellate cell activation and intervention of liver fibrosis. Zhonghua Yixue Zazhi. 2005;85:719-720. [PubMed] |
| 3. | Shoemaker DD, Schadt EE, Armour CD, He YD, Garrett-Engele P, McDonagh PD, Loerch PM, Leonardson A, Lum PY, Cavet G. Experimental annotation of the human genome using microarray technology. Nature. 2001;409:922-927. [PubMed] [DOI] |
| 4. | Magic Z, Radulovic S, Brankovic-Magic M. cDNA microarrays: identification of gene signatures and their application in clinical practice. J BUON. 2007;12 Suppl 1:S39-S44. [PubMed] |
| 5. | Pan Q, Zhang ZB, Zhang X, Shi J, Chen YX, Han ZG, Xie WF. Gene expression profile analysis of the spontaneous reversal of rat hepatic fibrosis by cDNA microarray. Dig Dis Sci. 2007;52:2591-2600. [PubMed] [DOI] |
| 6. | Yang R, Gao J. Progress in gene therapy of liver cirrhosis. Sheng Li Ke Xue Jin Zhan. 2004;35:30-34. [PubMed] |
| 7. | Prosser CC, Yen RD, Wu J. Molecular therapy for hepatic injury and fibrosis: where are we? World J Gastroenterol. 2006;12:509-515. [PubMed] |
| 8. | Sentoes-Gamez MD, Gelvez-Gastilum FJ, Meza-Garcia E, Armendariz-Borunda J. Hepatic fibrosis: role of matrix metalloproteases and TGFbeta. Gac Med Mex. 2005;141:315-322. [PubMed] |
| 9. | Lombard C, Saulnier J, Wallach J. Assays of matrix metalloproteinases (MMPs) activities: a review. Biochimie. 2005;87:265-272. [PubMed] [DOI] |
| 10. | Yin SS, Li XM, Wang BE, Wang TL, Jia JD, Qian LX. The relationship of serum metalloproteinase with the severity of liver fibrosis and inflammation. Zhonghua Ganzangbing Zazhi. 2004;12:666-668. [PubMed] |
| 11. | Roderfeld M, Hemmann S, Roeb E. Mechanisms of fibrinolysis in chronic liver injury (with special emphasis on MMPs and TIMPs). Z Gastroenterol. 2007;45:25-33. [PubMed] [DOI] |
| 12. | Yang Q, Xie RJ, Geng XX, Luo XH, Han B, Cheng ML. Effect of Danshao Huaxian capsule on expression of matrix metalloproteinase-1 and tissue inhibitor of metalloproteinase-1 in fibrotic liver of rats. World J Gastroenterol. 2005;11:4953-4956. [PubMed] |
| 13. | Cao J, Chiarelli C, Kozarekar P, Adler HL. Membrane type 1-matrix metalloproteinase promotes human prostate cancer invasion and metastasis. Thromb Haemost. 2005;93:770-778. [PubMed] |
| 14. | Zhang W, Matrisian LM, Holmbeck K, Vick CC, Rosenthal EL. Fibroblast-derived MT1-MMP promotes tumor progression in vitro and in vivo. BMC Cancer. 2006;6:52. [PubMed] [DOI] |
| 15. | Hemmann S, Graf J, Roderfeld M, Roeb E. Expression of MMPs and TIMPs in liver fibrosis - a systematic review with special emphasis on anti-fibrotic strategies. J Hepatol. 2007;46:955-975. [PubMed] [DOI] |
| 16. | Zhou X, Hovell CJ, Pawley S, Hutchings MI, Arthur MJ, Iredale JP, Benyon RC. Expression of matrix metalloproteinase-2 and -14 persists during early resolution of experimental liver fibrosis and might contribute to fibrolysis. Liver Int. 2004;24:492-501. [PubMed] [DOI] |
| 17. | Chabottaux V, Sounni NE, Pennington CJ, English WR, van den Brule F, Blacher S, Gilles C, Munaut C, Maquoi E, Lopez-Otin C. Membrane-type 4 matrix metalloproteinase promotes breast cancer growth and metastases. Cancer Res. 2006;66:5165-5172. [PubMed] [DOI] |
| 18. | Kakizuka A. Structure of the retinoic acid receptor and its functional analysis using a mutated receptor. Nippon Rinsho. 1998;56:1711-1716. [PubMed] |
| 19. | Dejean A. Retinoic acid nuclear receptors: a common molecular basis for liver cancer and acute promyelocytic leukemia. Bull Acad Natl Med. 2002;186:751-757. [PubMed] |
| 20. | Schug TT, Berry DC, Shaw NS, Travis SN, Noy N. Opposing effects of retinoic acid on cell growth result from alternate activation of two different nuclear receptors. Cell. 2007;129:723-733. [PubMed] [DOI] |
| 21. | Chen C, Zhang J, Li J, Huang J, Yang C, Huang G, Shi J. Hydrodynamic-based in vivo transfection of retinoic X receptor-alpha gene can enhance vitamin A-induced attenuation of liver fibrosis in mice. Liver Int. 2004;24:679-686. [PubMed] [DOI] |
| 22. | Mezaki Y, Yoshikawa K, Yamaguchi N, Miura M, Imai K, Kato S, Senoo H. Rat hepatic stellate cells acquire retinoid responsiveness after activation in vitro by post-transcriptional regulation of retinoic acid receptor alpha gene expression. Arch Biochem Biophys. 2007;465:370-379. [PubMed] [DOI] |
| 23. | Li H, Zhang JS, Huang GC, Zhang N, Chen Q, Zhang XR. Effect of RAR-beta transfection on the proliferation and phenotype of rat hepatic stellate cells. Zhonghua Ganzangbing Zazhi. 2002;10:297-300. [PubMed] |
| 24. | Hellemans K, Verbuyst P, Quartier E, Schuit F, Rombouts K, Chandraratna RA, Schuppan D, Geerts A. Differential modulation of rat hepatic stellate phenotype by natural and synthetic retinoids. Hepatology. 2004;39:97-108. [PubMed] [DOI] |
| 25. | Salbert G, Fanjul A, Piedrafita FJ, Lu XP, Kim SJ, Tran P, Pfahl M. Retinoic acid receptors and retinoid X receptor-alpha down-regulate the transforming growth factor-beta 1 promoter by antagonizing AP-1 activity. Mol Endocrinol. 1993;7:1347-1356. [PubMed] [DOI] |
| 26. | Umek RM, Friedman AD, McKnight SL. CCAAT-enhancer binding protein: a component of a differentiation switch. Science. 1991;251:288-292. [PubMed] [DOI] |
| 27. | Ramji DP, Foka P. CCAAT/enhancer-binding proteins: structure, function and regulation. Biochem J. 2002;365:561-575. [PubMed] |
| 28. | Buck M, Chojkier M. Signal transduction in the liver: C/EBPbeta modulates cell proliferation and survival. Hepatology. 2003;37:731-738. [PubMed] [DOI] |
| 29. | She H, Xiong S, Hazra S, Tsukamoto H. Adipogenic transcriptional regulation of hepatic stellate cells. J Biol Chem. 2005;280:4959-4967. [PubMed] [DOI] |