修回日期: 2008-03-03
接受日期: 2008-05-02
在线出版日期: 2008-05-08
目的: 研究外源性胰岛素样生长因子-Ⅰ(insulin-like growth factor-Ⅰ, IGF-Ⅰ)对重症急性胰腺炎(severe acute pancreatitis, SAP)大鼠小肠黏膜上皮细胞凋亡及凋亡相关基因bax、bcl-2 mRNA表达的影响, 探讨其对肠道屏障保护作用的机制.
方法: 72只♂Wistar大鼠按照随机数字表法分为假手术组(SO组, n = 24)、重症急性胰腺炎组(SAP组, n = 24)、IGF-Ⅰ治疗组(IGF-Ⅰ组, n = 24). 各组动物分别于术后6、12、24 h各处死8只, 检测血浆淀粉酶, 观察小肠组织病理学变化, TUNEL法检测小肠黏膜上皮细胞凋亡, RT-PCR检测小肠上皮细胞中bax和bcl-2 mRNA的表达.
结果: 与SAP组各时相点相比, IGF-Ⅰ治疗组大鼠小肠黏膜上皮细胞凋亡指数显著降低(6 h: 13.88±1.73 vs 19.00±2.78; 12 h: 10.13±1.55 vs 17.63±1.60; 24 h: 9.50±1.07 vs 17.25±2.76; 均P<0.05), 小肠组织病理变化明显改善; 小肠组织中bax mRNA的表达在IGF-Ⅰ组的各时相点较SAP组明显减弱(6 h: 1.10±0.02 vs 1.19±0.04; 12 h: 0.97±0.04 vs 1.16±0.02; 24 h: 0.87±0.03 vs 1.14±0.03, 均P<0.05); bcl-2 mRNA的表达在IGF-Ⅰ组各时相点与SAP组相比明显增强(6 h: 0.65±0.02 vs 0.57±0.02; 12 h: 0.69±0.04 vs 0.57±0.01; 24 h: 0.72±0.02 vs 0.58±0.01, 均P<0.05).
结论: 外源性IGF-Ⅰ可以减轻SAP时肠黏膜的损伤.
引文著录: 王映珍, 王世文, 李培杰, 党登峰, 孙志江, 王先坤, 徐庆杰. 胰岛素样生长因子-Ⅰ对重症急性胰腺炎大鼠小肠黏膜上皮细胞bax和bcl-2 mRNA表达的影响. 世界华人消化杂志 2008; 16(13): 1396-1401
Revised: March 3, 2008
Accepted: May 2, 2008
Published online: May 8, 2008
AIM: To investigate the effects of exogenous insulin-like growth factor-Ⅰ (IGF-Ⅰ) on the intestinal mucosal epithelial cell apoptosis and the associated genes bax and bcl-2 in rats with severe acute pancreatitis (SAP), and to explore the protective effect of IGF-Ⅰ on intestinal mucosal barrier function and its possible mechanisms.
METHODS: Seventy-two male Wistar rats were randomly divided into 3 groups: sham operation (SO) group, SAP group and IGF-Ⅰ treatment group. Eight rats were killed in each group at 6, 12, and 24 h, respectively. Serum amylase level was detected by iodine-starch colorimetry. Pathological changes in the small intestine were observed. Apoptosis of mucosal cells was detected by TUNEL methods, and the variation of the bax and bcl-2 gene expression in small intestinal tissue was detected by reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: In the IGF-Ⅰ treatment group, the apoptosis index of intestinal epithelial cells was decreased significantly as compared with that in the SAP group (6 h: 13.88 ± 1.73 vs 19.00 ± 2.78; 12 h: 10.13 ± 1.55 vs 17.63 ± 1.60; 24 h: 9.50 ± 1.07 vs 17.25 ± 2.76; all P < 0.05), and the pathological changes in intestinal tissues were obviously improved. Compared with that in the SAP group, the bax mRNA expression was notably reduced in the IGF-Ⅰ treatment group (6 h: 1.10 ± 0.02 vs 1.19 ± 0.04; 12 h: 0.97 ± 0.04 vs 1.16 ± 0.02; 24 h, 0.87 ± 0.03 vs 1.14 ± 0.03; all P < 0.05), while, the bcl-2 mRNA expression was increased significantly in the IGF-Ⅰ treatment group (6 h: 0.65 ± 0.02 vs 0.57 ± 0.02; 12 h: 0.69 ± 0.04 vs 0.57 ± 0.01; 24 h: 0.72 ± 0.02 vs 0.58 ± 0.01; all P < 0.05).
CONCLUSION: Exogenous IGF-Ⅰ may alleviate SAP-induced injury of intestinal mucosa by altering the transcription of bax and bcl-2 genes.
- Citation: Wang YZ, Wang SW, Li PJ, Dang DF, Sun ZJ, Wang XK, Xu QJ. Effects of insulin-like growth factor -Ⅰ on bax and bcl-2 mRNA expression in intestinal mucosal epithelial cells of rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2008; 16(13): 1396-1401
- URL: https://www.wjgnet.com/1009-3079/full/v16/i13/1396.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i13.1396
重症急性胰腺炎(severe acute pancreatitis, SAP)时多种因素造成的肠黏膜屏障功能障碍是细菌和内毒素大量移位的前提条件, 也是胰腺炎发生感染的主要来源. 肠道细菌移位, 造成内毒素血症或菌血症, 加重全身炎症反应, 最终发展为多器官功能障碍, 这也是SAP死亡率居高不下的主要原因[1-2]. 细胞凋亡在维持肠黏膜上皮细胞稳态中起着重要作用, 研究表明肠黏膜上皮细胞过度凋亡参与了SAP时肠黏膜屏障功能障碍的发生, 是造成肠黏膜屏障损伤的原因之一[3]. 胰岛素样生长因子-Ⅰ(insulin-like growth factor-Ⅰ, IGF-Ⅰ)通过调节bcl-2家族基因表达而具有明显的抗凋亡作用[4-6]. 我们应用外源性IGF-Ⅰ对大鼠实验性SAP进行干预治疗, 以期了解IGF-Ⅰ对SAP大鼠小肠黏膜上皮细胞凋亡和凋亡相关基因表达的影响及对SAP大鼠肠屏障功能保护作用的机制.
健康♂Wistar大鼠72只, 体质量200±20 g, 购自兰州大学医学实验动物中心. 牛磺胆酸钠购自Sigma公司, 用生理盐水配制成浓度为50 g/L的溶液. TGF-Ⅰ(Biovision公司), 用生理盐水配制成浓度20 mg/L, 且分装后-20℃保存待用. TRIzol试剂及RT-PCR相关试剂购自大连宝生物公司. 细胞凋亡原位检测(TUNEL)试剂盒购自德国Roche公司. bcl-2和bax引物由大连宝生物公司合成. PCR扩增仪(Elmper perkin 2004).
1.2.1 分组: 将大鼠按照随机数字表法分为假手术组(SO组)、重症急性胰腺炎组(SAP组)和IGF-Ⅰ治疗组(IGF-Ⅰ组), 每组24只; 各组再分为3个时相点(6, 12, 24 h), 每个时相点8只. 动物术前禁食12 h, 自由饮水. 采用20 g/L戊巴比妥钠溶液腹腔内注射麻醉(0.25 mL/100 g体质量). 常规消毒, 沿腹白线切开入腹, 采用胰胆管逆行注射法制作动物模型, SAP组和IGF-Ⅰ治疗组向胰胆管内逆行推注50 g/L牛磺胆酸钠溶液, SO组推注生理盐水, 剂量均为0.1 mL/100 g体质量(推注速度为0.2 mL/min), 注射完毕后, 停留4 min. 观察SAP组和IGF-Ⅰ治疗组胰腺出现水肿伴出血灶后, 缝合腹壁各层. IGF-Ⅰ治疗组分别于术前30 min和术后3 h经后肢内侧皮下注射IGF-Ⅰ生理盐水溶液50 mg/kg体质量(浓度20 mg/L), 即2.5 mL/kg体质量, 而SO组和SAP组则于相同时间点经上述途径注射生理盐水2.5 mL/kg体质量. 术后禁食,自由饮水.
1.2.2 标本采集及预处理: 各组动物分别于术后6、12、24 h 3个时相点各取8只用20 g/L戊巴比妥钠溶液腹腔内注射麻醉(0.25 mL/100 g体质量)后, 无菌条件下取右心室血5 mL加入灭热源的肝素抗凝管, 分离血浆后保存于-70℃待检. 开腹取距回盲部2 cm处回肠组织, 置于冰冷的生理盐水中, 沿纵轴剪开肠管, 冲洗干净肠内容物, 用滤纸吸干水后, 分别用100 g/L中性甲醛和25 g/L戊二醛固定做病理形态学检查, 另一部分装入用DEPC处理过的冻存管后即刻投入液氮内保存待检. 用全自动生化分析仪测定检测血浆淀粉酶.
1.2.3 小肠组织病理形态学观察: 小肠组织石蜡切片行HE染色, 由专一病理医师光镜下观察组织损伤程度. 采用Chiu氏6级评分法[7]评估损伤程度. 用25 g/L戊二醛溶液固定的小肠组织, 经脱水、包埋、超薄切片后于JEM-1230型透射电镜上观察.
1.2.4 肠黏膜上皮细胞凋亡检测: 采用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)法, 检测小肠组织切片中凋亡细胞的核酸断裂片断并计算凋亡指数(AI). 结果判断: 以肠上皮细胞核内发现棕色颗粒为阳性. 光镜下计数每100个上皮细胞中凋亡细胞个数, 每张切片任选5个视野, 求其平均值, 即凋亡指数.
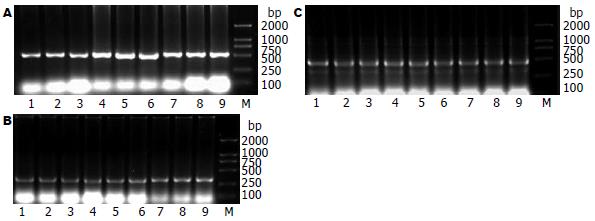
1.2.5 凋亡相关基因bax、bcl-2 mRNA表达的检测: 从液氮内取出小肠组织样本放入用DEPC预处理过的研钵, 迅速加入液氮研磨成粉末, 采用TRIzol试剂提取总RNA, 在20 mL体系中分别用目的引物(下游引物)反转录合成cDNA后应用聚合酶链式反应(PCR)检测bax、bcl-2 mRNA表达, 以β-actin为内参, 取10 mL PCR产物在10 g/L琼脂糖凝胶上电泳. 引物序列(Primer Premier 5.0设计, 大连宝生物公司合成)及反应条件分别为: bax, 上游引物: 5'-GAAGCTGAGCGAGTGTCTCCG-3', 下游引物: 5'-TGGTCACTGTCTGCCATGTGG-3'(扩增产物524 bp); bcl-2, 上游引物: 5'-CGGGCTGGGGATGACTTCTCT-3', 下游引物: 5'-GCATCCCAGCCTCCGTTATCC-3'(扩增产物296 bp); β-actin, 上游引物: 5'-ATGGATGACGTATCGCTG-3', 下游引物: 5'-ATGAGGTAGTTGTCAGGT-3'(扩增产物445 bp); 反应条件: 变性94℃、退火为bax 57℃, bcl-2为60℃, β-actin为54℃, 延伸72℃, 循环次数34. 取10 μL PCR产物在10 g/L琼脂糖凝胶上电泳, 用DNA半定量扫描仪测定电泳带面积和光密度值, bax、bcl-2与内参照基因β-actin的比值,代表组织bax, bcl-2相对表达量.
统计学处理 计量资料以mean±SD表示, 采用SPSS11.0进行统计学处理, 多组间比较采用单因素方差分析, 组间两两比较采用Bonferroni或Tamhane法, 以P<0.05为差异有统计学意义.
SAP组血浆淀粉酶在各时相点较SO组显著升高(P<0.05), 虽然在6 h相点IGF-Ⅰ组与SAP组血浆淀粉酶无显著差异, 但在12和24 h两组差异显著(P<0.05), IGF-Ⅰ组与SO组比较各时相点均无明显差异(表1).
| 分组 | 血浆淀粉酶(U/L) | 小肠组织病理学评分 | 凋亡指数 | ||||||
| 6 h | 12 h | 24 h | 6 h | 12 h | 24 h | 6 h | 12 h | 24 h | |
| SO组 | 1287.50± | 1290.63± | 1091.50± | 0.63± | 0.75± | 0.63± | 8.00± | 8.13± | 8.13± |
| 109.11 | 155.72 | 178.05 | 0.53 | 0.46 | 0.52 | 1.31 | 2.03 | 2.03 | |
| SAP组 | 3063.38± | 2777.00± | 2336.38± | 2.38± | 2.88± | 2.75± | 19.00± | 17.63± | 17.25± |
| 676.33a | 262.25b | 279.92b | 1.06b | 0.99b | 0.71b | 2.78b | 1.60b | 2.76b | |
| IGF-Ⅰ组 | 2262.38± | 1572.50± | 1322.75± | 1.63± | 1.38± | 1.25± | 13.88± | 10.13± | 9.50± |
| 760.19 | 635.90c | 334.64d | 0.52 | 0.52d | 0.46c | 1.73d | 1.55d | 1.07d | |
光镜示SO组小肠黏膜结构基本正常; SAP组6 h时即有小肠壁充血、水肿、伴少量炎症细胞浸润, 少部分绒毛融合、脱落、缺损, 此后上述改变更明显; IGF-Ⅰ组上述病理变化明显减轻. 肠组织病理学评分显示SAP组较SO组各相应时相点明显增高(均P<0.05), 而IGF-Ⅰ组则较SAP组各相应时相点明显降低(P<0.05, 表1).
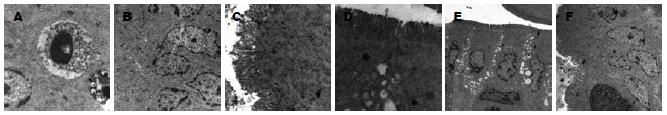
电镜示SO组小肠上皮细胞间连接结构完整, 偶见凋亡细胞; SAP组肠上皮细胞间紧密连接基本正常, 吸收细胞肿胀明显, 微绒毛紊乱, 稀疏、长短不一, 同时可见明显细胞凋亡及凋亡后坏死现象, 表现为核沿细胞膜浓缩、染色质凝集等核边界现象, 12 h后微绒毛稀疏、脱落及线粒体肿胀更加明显. 经IGF-Ⅰ治疗后微绒毛虽较稀疏, 但无明显缺损, 吸收细胞肿胀明显减轻, 凋亡细胞数量亦明显减少(图1).
TUNEL法显示SAP组各时相点即可见较多的凋亡上皮细胞, 凋亡指数较SO组和IGF-Ⅰ组明显增高, 以6 h达高峰(P<0.01). IGF-Ⅰ组各时相点凋亡细胞明显减少, 凋亡指数虽高于SO组, 但两组各时相点间均没有明显的统计学差异(表1).
bax mRNA在SAP组表达强于其他各组, 术后6 h即达峰值, 且变化与细胞凋亡指数呈显著的正相关(r = 0.56, P<0.05), 而在IGF-Ⅰ组则呈明显下降, 与SAP组各时相点相比差异均有统计学意义(P<0.01); bcl-2 mRNA的表达在SO组较弱, SAP组表达虽有所增强, 但与SO组差别无统计学意义, 而在IGF-Ⅰ组的表达则明显增强均(均P<0.05), 以24 h最明显(P<0.01), 且与SO组和SAP组各相应时相点的差异均有统计学意义(均P<0.05). bax, bcl-2 mRNA表达的比值在SAP组明显高于SO组, 在IGF-Ⅰ组明显低于SAP组, 差异均有统计学意义, 而IGF-Ⅰ组与SO组相比, 比值虽然均低于各相应时相点, 但只在24 h差异有统计学意义(表2, 图2).
| 分组 | bax | bcl-2 | bax/bcl-2 | ||||||
| 6 h | 12 h | 24 h | 6 h | 12 h | 24 h | 6 h | 12 h | 24 h | |
| SO组 | 0.85± | 0.86± | 0.83± | 0.54± | 0.56± | 0.54± | 1.59± | 1.55± | 1.55± |
| 0.04 | 0.03 | 0.03 | 0.04 | 0.05 | 0.03 | 0.14 | 0.15 | 0.11 | |
| SAP组 | 1.19± | 1.16± | 1.14± | 0.57± | 0.57± | 0.58± | 2.24± | 2.10± | 2.06± |
| 0.04b | 0.02b | 0.03b | 0.02 | 0.01 | 0.01 | 0.11a | 0.10a | 0.16a | |
| IGF-Ⅰ组 | 1.10± | 0.97± | 0.87± | 0.65± | 0.69± | 0.72± | 1.69± | 1.41± | 1.21± |
| 0.02d | 0.04d | 0.03d | 0.02d | 0.04c | 0.02d | 0.08d | 0.11d | 0.07d | |
既往对于细胞凋亡和凋亡相关基因的研究表明, 凋亡失调参与了病理状态下肠黏膜的病变过程. 王兴鹏 et al[3]研究发现, 肠黏膜上皮细胞凋亡参与了SAP时肠屏障功能障碍的发生, 肠上皮细胞过度凋亡是损伤黏膜屏障的原因之一. 肠黏膜屏障功能受损, 通透性增加, 其为SAP时肠道细菌移位及内毒素血症的形态学基础[8]. 另外许多基因参与细胞凋亡的调控, bcl-2基因家族就是最主要的凋亡调控基因, 包括两大类: 抑制凋亡的基因如bcl-2、bcl-xl、bcl-w等和促进凋亡的基因如bax、bad、bak等. Bcl-2蛋白作用于线粒体膜通透转运孔(permeability transition pore, PTP)复合体, 阻止PTP的开放, 维持内膜跨膜电位及线粒体膜的稳定性, 同时抑制细胞色素C自线粒体释放至胞质, 阻止胞质细胞色素C对caspase蛋白酶的激活, 阻止凋亡诱导因子等, 从而发挥抑制细胞凋亡的作用. 而Bax是个可溶性蛋白质, 当受到凋亡刺激时构象发生变化, 从细胞浆转位于线粒体并与线粒体外膜结合, 直接降低线粒体外膜稳定性或与bcl-2结合形成异源二聚体的结构, 阻断bcl-2的抑制细胞凋亡功能, 或者通过促进caspase、细胞色素C等的释放而发挥促进细胞凋亡的作用. 既然肠黏膜上皮细胞的过度凋亡是造成SAP早期肠黏膜屏障功能损害并发生内毒素和肠道细菌移位的原因之一[9], 是SAP早期肠屏障功能障碍的一个重要的分子生物学基础[10], 因此如果能够阻断这种过度凋亡, 则有助于保护肠黏膜屏障功能.
IGF-Ⅰ是对机体生长发育起着重要调节作用的单链多肽. 有人研究了SAP状态下回肠IGF-Ⅰ mRNA表达的变化, 发现肠道局部IGF-Ⅰ水平的降低与肠黏膜屏障受损有关. 对放射性肠炎、小肠切除、烧伤等所致的肠黏膜损伤实验研究发现, 给予外源性IGF-Ⅰ恢复循环中IGF-Ⅰ水平后, 肠上皮细胞DNA、蛋白合成增加, 肠黏膜结构和功能均得到不同程度恢复[11]. 另外有研究表明IGF-Ⅰ对多种细胞凋亡均有一定的抑制作用[12-15]. 本研究发现, SAP时肠黏膜上皮细胞存在着明显的凋亡, 并且凋亡指数与肠损伤病理评分呈正相关, 另外SAP组bax mRNA表达明显增强, 在6 h达峰值, 与小肠黏膜上皮细胞凋亡指数和病理评分的变化相一致. bcl-2 mRNA在SO组呈低表达, 在SAP组表达虽然有所增强, 但与SO组各时间段间差异无统计学意义, 这说明机体可能存在某种调节机制, 当某种因素致使肠黏膜上皮细胞过度凋亡时, 机体通过这种自身的调节作用使凋亡抑制基因表达增强来抑制过度凋亡, 但这种作用还不足以对抗严重损伤所致的过度凋亡. 经IGF-Ⅰ治疗后, 大鼠小肠黏膜细胞凋亡率明显下降, 小肠组织结构显著改善, bax mRNA表达明显减弱, 而bcl-2 mRNA表达则明显增强. 相应bax, bcl-2 mRNA表达的比值在SAP组也明显增高, 而在IGF-I组则明显下降且低于对照组, 这说明经IGF-I治疗后, 在bax mRNA下降的同时也存在bcl-2 mRNA表达的增强. 提示外源性IGF-Ⅰ对SAP时小肠黏膜上皮细胞凋亡的抑制作用部分是与其对bcl-2与bax双方的调节相关, 即通过上调凋亡抑制基因的表达, 同时抑制促凋亡基因的表达, 从而抑制SAP时肠黏膜上皮细胞的过度凋亡, 对肠黏膜屏障起到保护作用. 另外, bax, bcl-2 mRNA表达的比值能更好地反映在凋亡促进基因与凋亡抑制基因双方力量的抗衡中机体组织细胞的凋亡状态, 即上调意味着促进凋亡, 下调意味着抑制凋亡. Pugazhenthi et al[16]发现IGF-Ⅰ能通过激活核转录因子cAMP反应元件结合蛋白在转录水平上调bcl-2, 并增强bcl-2启动子活性. Metsuzaki et al[17]认为IGF-Ⅰ可能通过PI3激酶/Akt信号途径来抑制凋亡. 那么IGF-Ⅰ到底通过何种途径对SAP时小肠黏膜上皮细胞bcl-2与bax的表达起调节作用, 还有待于进一步的探讨.
总之, 使用外源性IGF-Ⅰ能够减轻SAP大鼠小肠组织的损伤, 但本研究只是从外源性IGF-Ⅰ对凋亡相关基因bax和bcl-2 mRNA水平的影响一个侧面来了解他对肠黏膜屏障的保护作用机制, 但他对bax与bcl-2蛋白水平的影响以及他对其他凋亡相关基因(如bcl-xl、bcl-w、bad、bak等)的影响, 同时对GH-IGF-Ⅰ轴、胰岛素及血糖水平的影响及最佳剂量、副作用等方面的问题也有待于进一步探讨.
重症急性胰腺炎(SAP)是临床上常见的急腹症之一, 其起病急、进展快、病情危重、并发症多、治疗棘手、医疗费用昂贵, 死亡率高达20%-30%. 大量的证据表明, 多种因素造成的肠屏障功能不全是细菌和内毒素大量易位的前提条件, 而肠道细菌易位也是胰腺炎发生感染的主要来源, 同时加重SIRS, 导致MODS甚至MOF的发生. 本文应用外源性IGF-Ⅰ对SAP大鼠进行干预治疗, 观察IGF-Ⅰ对SAP大鼠小肠黏膜上皮细胞凋亡和凋亡相关基因表达的影响, 以期了解其对肠屏障保护作用的机制.
刘改芳, 主任医师, 河北医科大学第三医院消化内科
国内外关于IGF-Ⅰ在SAP中的作用的研究内容主要是SAP时IGF-Ⅰ在各组织器官中的表达以及外源性IGF-Ⅰ在改善胰腺微循环、对相关细胞因子的相互影响等方面, 然而外源性IGF-Ⅰ对重症急性胰腺炎时肠黏膜屏障功能及肠黏膜上皮细胞凋亡的研究较少.
Pugazhenthi et al发现IGF-Ⅰ能通过激活核转录因子cAMP反应元件结合蛋白在转录水平上调bcl-2, 并增强bcl-2启动子活性; Metsuzaki et al认为IGF-Ⅰ可能通过PI3激酶/Akt信号途径来抑制凋亡.
本研究通过在大鼠SAP早期使用外源性IGF-Ⅰ, 探讨其对肠黏膜上皮细胞凋亡、凋亡相关基因的影响, 以期为SAP的治疗寻找新的途径并提供理论依据.
IGF-Ⅰ可通过调节bcl-2家族基因的表达而明显减轻氧化应激和缺血再灌注等原因所致的肠黏膜细胞的过度凋亡, 而对肠黏膜屏障功能具有保护效应.
本文条理清楚, 逻辑性强, 结果可信, 具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Xu GF, Lu Z, Gao J, Li ZS, Gong YF. Effect of ecoimmunonutrition supports on maintenance of integrity of intestinal mucosal barrier in severe acute pancreatitis in dogs. Chin Med J (Engl). 2006;119:656-661. [PubMed] |
| 2. | Assimakopoulos SF, Alexandris IH, Scopa CD, Mylonas PG, Thomopoulos KC, Georgiou CD, Nikolopoulou VN, Vagianos CE. Effect of bombesin and neurotensin on gut barrier function in partially hepatectomized rats. World J Gastroenterol. 2005;11:6757-6764. [PubMed] |
| 4. | Baregamian N, Song J, Jeschke MG, Evers BM, Chung DH. IGF-1 protects intestinal epithelial cells from oxidative stress-induced apoptosis. J Surg Res. 2006;136:31-37. [PubMed] [DOI] |
| 5. | Chrysis D, Calikoglu AS, Ye P, D'Ercole AJ. Insulin-like growth factor-I overexpression attenuates cerebellar apoptosis by altering the expression of Bcl family proteins in a developmentally specific manner. J Neurosci. 2001;21:1481-1489. [PubMed] |
| 7. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] |
| 9. | Wang X, Wang B, Wu J, Wang G. Beneficial effects of growth hormone on bacterial translocation during the course of acute necrotizing pancreatitis in rats. Pancreas. 2001;23:148-156. [PubMed] [DOI] |
| 11. | Gillingham MB, Dahly EM, Murali SG, Ney DM. IGF-I treatment facilitates transition from parenteral to enteral nutrition in rats with short bowel syndrome. Am J Physiol Regul Integr Comp Physiol. 2003;284:R363-R371. [PubMed] |
| 12. | Sheen-Chen SM, Ho HT, Chia-Pei L, Hung KS, Eng HL. The effect of insulin-like growth factor-I on hepatocyte apoptosis after bile duct ligation in rat. Dig Dis Sci. 2006;51:2220-2224. [PubMed] [DOI] |
| 13. | Ozen S, Akisu M, Baka M, Yalaz M, Sozmen EY, Berdeli A, Kultursay N. Insulin-like growth factor attenuates apoptosis and mucosal damage in hypoxia/reoxygenation-induced intestinal injury. Biol Neonate. 2005;87:91-96. [PubMed] [DOI] |
| 16. | Pugazhenthi S, Miller E, Sable C, Young P, Heidenreich KA, Boxer LM, Reusch JE. Insulin-like growth factor-I induces bcl-2 promoter through the transcription factor cAMP-response element-binding protein. J Biol Chem. 1999;274:27529-27535. [PubMed] [DOI] |
| 17. | Matsuzaki H, Tamatani M, Mitsuda N, Namikawa K, Kiyama H, Miyake S, Tohyama M. Activation of Akt kinase inhibits apoptosis and changes in Bcl-2 and Bax expression induced by nitric oxide in primary hippocampal neurons. J Neurochem. 1999;73:2037-2046. [PubMed] |