修回日期: 2008-03-12
接受日期: 2008-04-21
在线出版日期: 2008-04-28
目的: 研究HBsAg负载的慢性乙肝患者外周血树突状细胞(dendritic cells, DCs)对自身Th1细胞分化的诱导作用.
方法: Ficoll密度梯度离心和贴壁法分离慢性乙肝患者外周血单核细胞, 以含rhIL-4+rhGM-CSF的完全培养基诱导DCs. 流式细胞术检测各组DC表面CD80, CD86, CD40和HLA-DR分子的表达, CCK-8法检测各组DCs刺激同种异体淋巴细胞增殖的能力, ELISA法检测各组DCs培养液上清中IL-12的水平. 免疫磁珠分选慢性乙肝患者外周血CD4+ T细胞, 分别与患者自身的DCs共培养, 细胞内细胞因子染色, 流式细胞仪检测共培养后CD4+ T细胞内特征性细胞因子IFN-γ和IL-4, ELISA法检测共培养上清中IFN-γ/IL-4的水平.
结果: 与对照组相比, HBsAg、IFN-γ和HBsAg+IFN-γ组DCs表面表达CD80, CD86, CD40和HLA-DR分子水平较高; 刺激同种异体淋巴细胞增殖的能力较强; DCs分泌的上清液中, IL-12水平也较高. 与对照组相比, HBsAg、IFN-γ和HBsAg+IFN-γ组DCs与自身Th细胞共培养后, Th1细胞占CD4+ T细胞的百分比升高(10.76%±3.98%, 11.43%±4.32%, 15.28%±4.73% vs 7.84%±3.10%, P<0.01), Th2细胞占CD4+ T细胞的百分比降低(1.43%±0.96%, 1.68%±0.16%, 0.92%±0.21% vs 2.61%±1.27%, P<0.01), 共培养上清中IFN-γ的水平增高(578±47 mg/L, 496±92 mg/L, 784±97 mg/L vs 342±34 mg/L, P<0.05), IL-4的水平降低(187±52 mg/L, 169±38 mg/L, 89±37 mg/L vs 226±48 mg/L, P<0.05), 以HBsAg+IFN-γ组最为明显.
结论: 经HBsAg负载的DCs可以改善患者体内因DCs功能低下而引起的Th1细胞分化不足的状态.
引文著录: 吴琼, 汪晓莺, 周晓荣, 汤伟, 苏丽. HBsAg负载的慢性乙肝患者DCs诱导特异性Th1细胞分化的作用. 世界华人消化杂志 2008; 16(12): 1344-1349
Revised: March 12, 2008
Accepted: April 21, 2008
Published online: April 28, 2008
AIM: To investigate the influence of dendritic cells (DCs) loaded with HBsAg from peripheral blood monocytes of patients with chronic hepatitis B (CHB) on the differentiation of autologous T helper 1 (Th1).
METHODS: Mononuclear cells were isolated from CHB patients using the methods of density gradient centrifugation (Ficoll-Hypaque) and adherence. The adherent monocytes were incubated with recombinant human GM-CSF and interleukin-4 (IL-4) to induce DC generation. The phenotypes on DCs including CD80, CD86, CD40 and HLA-DR were determined by flow cytometry (FCM). DCs' ability to stimulate allogenic mixed lymphocyte reaction (AMLR) was detected by CCK-8 assay. The concentration of IL-12 in DC supernate was tested by enzyme linked immunosorbent assay (ELISA). CD4+ Th cell subpopulation in peripheral blood of CHB patients was isolated and purified by immunomagnetic beads. Subsequently, purified CD4+ Th cells were co-cultured with autologous mature DCs. The differentiation of Th1/Th2 was detected by FCM using intracellular staining of interferon-γ (IFN-γ) and IL-4. ELISA assay was also used to quantify the IFN-γ and IL-4 in co-culture supernate.
RESULTS: In comparison with those in the control group, the expression levels of CD80, CD86, CD40 and HLA-DR and the concentration of IL-12 in DC supernate of the IFN-γ group, HBsAg group and HBsAg + IFN-γ group were higher, and the capability of DCs to stimulate allogenic lymphocytes to proliferate in the three groups was also stronger. Meanwhile, the percentages of Th1 cells in CD4+ T cells and the level of IFN-γ in co-culture supernate of the IFN-γ group, HBsAg group and HBsAg + IFN-γ group were higher (Th1 cells: 10.76% ± 3.98%, 11.43% ± 4.32%, 15.28% ± 4.73% vs 7.84% ± 3.10%, P < 0.01; IFN-γ: 578 ± 47 mg/L, 496 ± 92 mg/L, 784 ± 97 mg/L vs 342 ± 34 mg/L, P < 0.05). However, the percentages of Th2 cells in CD4+ T cells and the level of IL-4 in the three groups were lower (Th2 cells: 1.43% ± 0.96%, 1.68% ± 0.16%, 0.92% ± 0.21% vs 2.61% ± 1.27%, P < 0.01; IL-4: 187 ± 52 mg/L, 169 ± 38 mg/L, 89 ± 37 mg/L vs 226 ± 48 mg/L, P < 0.05). The most significant effect was observed in the HBsAg + IFN-γ group.
CONCLUSION: DCs loaded with HBsAg can improve the insufficient differentiation of Th1 cells resulted from dysfunction of DCs in vivo in CHB patients.
- Citation: Wu Q, Wang XY, Zhou XR, Tang W, Su L. Effect of dendritic cells loaded with HBsAg on the differentiation of HBsAg-specific T helper 1 cells in patients with chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2008; 16(12): 1344-1349
- URL: https://www.wjgnet.com/1009-3079/full/v16/i12/1344.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i12.1344
慢性乙型肝炎(简称慢性乙肝)是由乙肝病毒(hepatitis B virus, HBV)持续感染引起的. 目前, T细胞免疫应答被认为是机体清除HBV的基本机制, 急性自限性HBV感染者体内存在高效, 多克隆, 特异性CD4+ T和CD8+ T淋巴细胞反应, 可以彻底清除体内的病毒, 并可抵抗病毒的再次入侵. 然而, 慢性乙肝患者体内, 这种免疫应答程度较弱甚至检测不到[1-2]. 以往的研究主要集中在细胞毒性T细胞, 近年来的研究表明CD4+ T细胞和树突状细胞也扮演了非常重要的角色. Bocher et al[3]研究表明慢性乙肝患者体内Th1反应不足和HBV的持续感染密切相关.
研究表明, 多种因素会影响机体外周血Th1/Th2的分化, 其中DC作为目前发现的功能最强的抗原呈递细胞(antigen presenting cells, APC), 也是唯一能激活初始T细胞的APC, 被认为是影响Th1/Th2分化的最重要因素. 研究发现, 慢性乙肝患者DCs存在功能缺陷, 可能进而导致患者体内Th1反应不足[4-5]. 因此, 我们研究HBsAg负载的慢性乙肝患者外周血单核细胞来源的DC对自身Th1细胞分化的诱导作用, 为DC将来作为疫苗应用于治疗HBV持续感染提供实验依据.
rhGM-CSF(北京宝赛生物技术有限公司), rhIL-4(R&D Systems, Inc.), rhIL-2(南京军事科学医学院), rhIFN-γ(PROMEGA), CD80鼠抗人mAb(BioLegend), CD86鼠抗人mAb、CD40鼠抗人mAb(晶美生物工程有限公司), HLA-DR鼠抗人mAb(Caltag Laboratories), IL-4鼠抗人mAb、IFN-γ鼠抗人mAb(R&D Sysems, Inc.), FITC羊抗鼠mAb、PE或FITC鼠IgG(SABC). RPMI 1640培养液(Gibco公司), 小牛血清(杭州四季青生物工程有限公司), 淋巴细胞分离液(上海恒信化学试剂有限公司), HBsAg(南京军事科学医学院), CCK-8 kit(北京同仁科技有限公司), IL-12 ELISA kit(晶美生物工程有限公司), Dynal CD4+ positive isolation kit(Dynal), PMA、Monensin(晶美生物工程有限公司), Fix&Prem kit(Caltag), Ionomycin(ALEX), IL-4检测试剂盒、IFN-γ检测试剂盒(上海森雄科技有限公司进口分装), 倒置相差显微镜(Leica), DG5031酶标仪(南京华东电子集团有限公司), 流式细胞仪(Becton Dickinson).
南通大学附属医院肝炎门诊患者28例, 男15例, 女13例, 年龄22-56(平均38.9±11.4)岁, 根据2000年西安会议修订的病毒性肝炎诊断标准临床确诊为慢性乙型肝炎患者[6], HBVM均为HBsAg(+), HBeAg(+), 抗-HBcIgM(+)及HBV DNA(+). 实验分4组: 对照组、HBsAg组、IFN-γ组和HBsAg+IFN-γ组. Ficoll密度梯度离心法分离慢性乙肝患者外周血单个核细胞(peripheral blood mononuclear cells, PBMC), 贴壁2 h去除悬浮细胞获得单核细胞. 分4组进行诱导, 对照组每孔加入含rhIL-4(50 μg/L)、rhGM-CSF(100 μg/L)的DC培养液1 mL; IFN-γ组和HBsAg+IFN-γ组在DC培养液的基础上第1天加入rhIFN-γ(10 μg/L); HBsAg组和HBsAg+IFN-γ组在培养的第4天加入HBsAg(10 μg/L), 各组均置37℃, 50 mL/L CO2温箱中培养7 d, 每3 d换液补充细胞因子.
1.2.1 DC的表型分析: DC培养的第8天收集细胞, 调整细胞密度为1×109/L, 离心, 100 μL流式缓冲液重悬沉淀细胞, 分别加入PE标记的鼠抗人CD86, HLA-DR mAb和FITC标记的鼠抗人CD40、CD80 mAb, 同时用PE或FITC标记的小鼠IgG抗体为对照. 4℃暗处标记30 min, 洗涤2次, 24 h内流式细胞仪(FACS)检测.
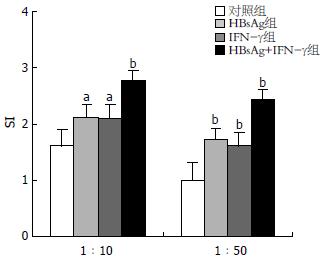
1.2.2 同种异体混合淋巴细胞反应(AMLR): 取同一健康人外周血常规分离获得PBMC, 调整细胞浓度, 以1×10/孔接种于96孔板. DC分别按1×104/孔(DC:PBMC = 1:10), 2×103/孔(DC:PBMC = 1:50)加入, 每孔设3个复孔. 37℃, 50 mL/L CO2孵育箱中孵育96 h, CCK-8 kit检测各孔吸光度. 计算刺激指数(stimulating index, SI)表示增殖情况. SI = 实验孔A490/阴性对照孔A490.
1.2.3 IL-12的水平: 收集对照组、IFN-γ组、HBsAg组和HBsAg+IFN-γ组培养第8天的DC上清, -20℃保存, 一并按IL-12 ELISA kit操作说明检测.
1.2.4 慢性乙肝患者DCs与自身Th细胞共培养: Dynal免疫磁珠阳性分离慢性乙肝患者外周血CD4+ T细胞, 按Dynal CD4+ positive isolation kit操作说明进行. 用此方法分离CD4+ T细胞, 纯度达96.5%±2.6%, 得率在80%以上. 体外诱导第8天的慢性乙肝患者DC与自身纯化的Th细胞以1:10的比例混合培养, 96孔板每孔含2×105个Th细胞, 终体积为200 μL. 在37℃、50 mL/L CO2培养箱中培养5 d后, 再添加IL-2(100 U/mL), 继续培养2 d. 慢性乙肝患者DC与自身Th细胞共培养的第7天, 每孔中加入PMA(40 μg/L)、Ionomycin(1 mg/L)、Monensin(0.25 mg/L), 37℃、50 mL/L CO2培养5 h. 收集各孔细胞按Fix&Prem kit说明进行胞内染色, 流式细胞仪检测Th1/Th2.
1.2.5 IFN-γ和IL-4的含量: 收集慢性乙肝患者DC与自身Th细胞共培养第7天的上清, -20℃保存, ELISA法一并检测, 按IL-4检测试剂盒、IFN-γ检测试剂盒说明进行操作.
统计学处理 使用Stata7.0软件, 进行方差分析, 若有统计学意义再进行两两比较, 多个实验组与对照组比较用q'检验, P<0.05为有统计学意义.
IFN-γ组、HBsAg组、HBsAg+IFN-γ组DC表面分子CD80, CD86, CD40, HLA-DR的表达率均高于对照组(P<0.01), 而且HBsAg+IFN-γ组DCs表面分子的表达率最高(P<0.01), HBsAg组与IFN-γ组比较无差异(P>0.05, 表1).
在DC:T分别为1:10和1:50混合比例的实验中, IFN-γ组、HBsAg组、HBsAg+IFN-γ组DCs刺激同种异体淋巴细胞增殖的能力均比对照组强(P<0.05), 而且HBsAg+IFN-γ组DCs的刺激能力最强(P<0.05), HBsAg组与IFN-γ组比较无差异(P>0.05, 图1).
结果表明: 培养第8天, IFN-γ组(145.5±47.4 ng/L)、HBsAg组(168.4±56.3 ng/L)、HBsAg+IFN-γ组(232.4±67.2 ng/L)上清液中IL-12的水平均高于对照组(95.6±23.3 ng/L)(P<0.01), HBsAg+IFN-γ组DCs的分泌的IL-12的水平最高(P<0.05), IFN-γ组、HBsAg组比较无差异(P>0.05).
以不加DC, 单独培养的Th细胞作为空白组的Th1为4.57%±1.80%, Th2为1.78%±0.91%. Th1细胞占CD4+ T细胞的百分比均比其他4组低(P<0.05, 表2).
HBsAg组、IFN-γ组和HBsAg+IFN-γ组培养第8天成熟DC分别与纯化后的自身Th细胞共培养后的上清, 用ELISA法检测其中IFN-γ和IL-4含量增加(表1).
CD4+ Th细胞主要可分化为Th1和Th2细胞. Th1和Th2细胞分别介导2种不同的免疫应答产生不同的免疫效应, 机体通过产生不同的Th1/Th2模式应答来抵御不同种类的病原体感染, Th1/Th2的平衡决定了机体能否有效和安全地清除体内的病原体. 研究表明, 在抗HBV感染的免疫应答过程中, Th1处于中心地位, 产生高效特异性的Th1反应是机体清除体内病毒的关键. 然而在对慢性乙肝的研究发现, 患者外周血中Th1、Th2亚型的比例失调, Th2亚型占优势, 细胞因子模式为Th2型[7]. Livingston et al[8]研究HBsAg脂质体的免疫效果时发现, 慢性乙肝患者体内不能有效的激发CTL反应与其Th1反应低下有关. 这些研究提示HBV特异性Th1细胞反应低下或Th1/Th2分化失衡是慢性乙肝患者体内HBV持续感染的重要原因.
初始型Th细胞选择性向Th1/Th2分化的机制一直是免疫学界的研究热点, 研究表明有多种因素影响着Th1/Th2的分化. 其中, DC作为目前已知的体内功能最强的专职APC, 其对Th1/Th2分化的影响在现今受到了最广泛的关注, 甚至Rissoan et al[9]提出主要是由APC了决定T细胞是向Th1还是Th2分化. 因此, 在抗HBV的感染免疫中, DC的功能状态可能决定了机体能否产生高效的病毒特异性Th1反应, 从而有效清除体内的病毒. DC膜上免疫分子的高表达、维持一定的细胞数和分泌一些重要的细胞因子是DC诱导出高效的病毒特异性Th1反应的物质基础, 然而许多研究均发现, 慢性乙肝患者外周血单核细胞来源的DC存在着多种异常, 具体表现为DC的增殖数量较正常人明显降低, 其表达免疫分子(HLA-DR、CD80、CD86、CD40)的水平明显低于正常人, 刺激T细胞增殖的能力低于正常人, 分泌IL-12的能力亦下降[4]. IL-12是DC分泌的促进Th1分化的最重要的一个细胞因子[10], 慢性乙肝患者DC分泌IL-12低, 这也可能导致了Th1分化不足. 总之, 慢性乙肝患者DCs功能的缺陷可以从多反面抑制Th的活化和增殖及Th1的分化.
虽然慢性乙肝患者DC存在表型及功能的改变, 但Tavakoli et al[11]指出慢性乙肝患者DC的这种改变并不是永久的, 是可以通过在培养环境中加入适当的细胞因子来改善甚至逆转的. Löhr et al[12]用磁珠分选出CD34+造血干细胞, 体外诱导生成DC, 将重组IL-12与之共孵育, 结果与之共培养的T细胞的增殖能力提高了2倍. 这些都提醒我们是否可以通过改善慢性乙肝患者DC的功能进而促进Th1的分化, 达到利于清除患者体内病毒的目的. 那么如何有效纠正慢性乙肝患者的DC的功能缺陷呢? 有资料显示, 用特异性抗原冲击DC可以提高DC的成熟度, 增强DC抗原提呈的能力[13]. 本研究中, 我们在DC通用培养体系(含IL-4和CSF-GM)中加入了HBsAg共孵育, 使DC成为负载HBsAg的DC. 鉴于我们以往的研究发现INF-γ能促进DC的成熟和增强其功能[14], 我们又联合应用了IFN-γ, 观察其是否可以使DC的功能进一步改善. 我们观察到, HBsAg组、INF-γ组和HBsAg+INF-γ组DC的协同刺激分子CD40、CD80、CD86及MHC-Ⅱ分子的表达量增加, 刺激同种异体淋巴细胞增殖的能力提高, IL-12的分泌量也提高, 而且以HBsAg+INF-γ联合作用改善更明显. 说明HBsAg负载有提高慢性乙肝DC功能的作用, 尤其是联合INF-γ应用时能产生协同作用而获得更好的效果. 这一结果与国内外的研究也相一致.
在DC的培养体系中加入HBsAg确实能够有效改善慢性乙肝患者DC的功能, 但DC功能的改善能否有效促进Th1的分化呢? 于是, 我们将各组DC在培养7 d后与自身用免疫磁珠法纯化的CD4+ T细胞共培养, 并且以不加DC单独培养的Th细胞作为空白对照, 观察不同培养条件下DC对Th1/Th2分化的影响. 慢性乙肝患者病毒特异性的Th1反应不足, 可能由于数量少于正常, 也有可能是由于分泌细胞因子的功能低下所导致, 或者两者皆有, Alheim et al[15]就提出, Th细胞分泌到上清中各种细胞因子的水平与具有分泌能力的Th细胞的数量并无必然的关系. 这提醒我们, 要全面了解Th1/Th2分化的情况, 按照目前的条件, 可能需要结合多种检测方法. 在本实验中, 采用流式细胞仪来探测细胞内细胞因子的信号, 结果可以客观地判断具有分泌IL-4和分泌INF-γ能力的细胞的数量, 但却不能分析分泌到细胞外并发挥活性的细胞因子的含量, 于是同时我们又采用了检测共培养上清中细胞因子的量来弥补这一点, 这两种方法的结合能够更准确地反映Th1/Th2的分化情况. 我们发现不加DC单独培养的患者Th细胞中Th1细胞所占比例最低. 加入DC共培养后, Th1细胞所占比例增高, 培养上清中INF-γ这一Th1细胞分泌的特征性的细胞因子的量增加, 而且以HBsAg+INF-γ组增高的最为明显. 这一结果表明加入HBsAg和联合应用INF-γ培养的功能改善的慢性乙肝患者DC能够有效诱导病毒特异性Th1的分化, 有助于患者清除体内的HBV. 我们的实验为HBsAg负载的DC疫苗应用于慢性乙型肝炎提供了一个实验依据.
慢性乙肝是由乙肝病毒(HBV)持续感染引起的. 目前, T细胞免疫应答被认为是机体清除HBV的基本机制, 急性自限性HBV感染者体内存在高效, 多克隆, 特异性CD4+ T和CD8+ T淋巴细胞反应, 可以彻底清除体内的病毒, 并可抵抗病毒的再次入侵.
张占卿, 主任医师, 上海市(复旦大学)公共卫生中心.
初始型Th细胞选择性向Th1/Th2分化的机制一直是免疫学界的研究热点.
研究表明, 多种因素会影响机体外周血Th1/Th2的分化, 其中DC作为目前发现的功能最强的抗原呈递细胞, 也是唯一能激活初始T细胞的APC.
本研究在DC通用培养体系中加入了HBsAg共孵育, 使DC成为负载HBsAg的DC.
经HBsAg负载的DCs可以改善患者体内因DCs功能低下而引起的Th1细胞分化不足的状态.
本研究设计合理, 有较强的科学性和潜在的应用价值, 但病例数较少.
编辑: 潘伯荣 电编:何基才
| 1. | Maini MK, Boni C, Ogg GS, King AS, Reignat S, Lee CK, Larrubia JR, Webster GJ, McMichael AJ, Ferrari C. Direct ex vivo analysis of hepatitis B virus-specific CD8(+) T cells associated with the control of infection. Gastroenterology. 1999;117:1386-1396. [PubMed] [DOI] |
| 2. | Webster GJ, Reignat S, Maini MK, Whalley SA, Ogg GS, King A, Brown D, Amlot PL, Williams R, Vergani D. Incubation phase of acute hepatitis B in man: dynamic of cellular immune mechanisms. Hepatology. 2000;32:1117-1124. [PubMed] [DOI] |
| 3. | Bocher WO, Galun E, Marcus H, Daudi N, Terkieltaub D, Shouval D, Lohr HF, Reisner Y. Reduced hepatitis B virus surface antigen-specific Th1 helper cell frequency of chronic HBV carriers is associated with a failure to produce antigen-specific antibodies in the trimera mouse. Hepatology. 2000;31:480-487. [PubMed] [DOI] |
| 4. | Wang FS, Xing LH, Liu MX, Zhu CL, Liu HG, Wang HF, Lei ZY. Dysfunction of peripheral blood dendritic cells from patients with chronic hepatitis B virus infection. World J Gastroenterol. 2001;7:537-541. [PubMed] |
| 8. | Livingston BD, Alexander J, Crimi C, Oseroff C, Celis E, Daly K, Guidotti LG, Chisari FV, Fikes J, Chesnut RW. Altered helper T lymphocyte function associated with chronic hepatitis B virus infection and its role in response to therapeutic vaccination in humans. J Immunol. 1999;162:3088-3095. [PubMed] |
| 9. | Rissoan MC, Soumelis V, Kadowaki N, Grouard G, Briere F, de Waal Malefyt R, Liu YJ. Reciprocal control of T helper cell and dendritic cell differentiation. Science. 1999;283:1183-1186. [PubMed] [DOI] |
| 10. | Scott P, Trinchieri G. The role of natural killer cells in host-parasite interactions. Curr Opin Immunol. 1995;7:34-40. [PubMed] [DOI] |
| 11. | Tavakoli S, Schwerin W, Rohwer A, Hoffmann S, Weyer S, Weth R, Meisel H, Diepolder H, Geissler M, Galle PR. Phenotype and function of monocyte derived dendritic cells in chronic hepatitis B virus infection. J Gen Virol. 2004;85:2829-2836. [PubMed] [DOI] |
| 12. | Löhr HF, Pingel S, Böcher WO, Bernhard H, Herzog-Hauff S, Rose-John S, Galle PR. Reduced virus specific T helper cell induction by autologous dendritic cells in patients with chronic hepatitis B - restoration by exogenous interleukin-12. Clin Exp Immunol. 2002;130:107-114. [PubMed] [DOI] |
| 15. | Alheim M, Lazdina U, Milich DR, Sällberg M. Flow cytometric determination of cytokine production and proliferation in hepatitis B core antigen specific murine CD4 cells: lack of correlation between number of cytokine producing cells and cytokine levels in supernatant. J Immunol Methods. 2001;258:157-167. [PubMed] [DOI] |