修回日期: 2008-03-18
接受日期: 2008-04-21
在线出版日期: 2008-04-28
目的: 应用酵母双杂交(yeast two hybrid, Y2H)和GST-Pull down技术鉴定肝细胞生成素205(hepatopoietin 205, HPO205)与细胞色素C(cytochrome c, Cytc)间的相互作用.
方法: 采用PCR技术扩增HPO205和Cytc编码基因, 分别将其构建Y2H质粒pDBLeu和pPC86的重组载体. 应用Y2H技术将二者的重组质粒共转染酵母MaV203进行鉴定, 同时用GST-Pull down方法对其验证.
结果: 成功克隆HPO205和Cytc编码基因至Y2H载体和相应表达载体, 包括pDBLeu-GRER、pDBLeu-CYCS、pPC86-GRER、pPC86-CYCS. 经过Y2H鉴定发现, pDBLeu-GRER+pPC86-CYCS共转后能激活Ura和His两个报告基因, 而pDBLeu-CYCS+pPC86-GRER共转则不能激活任何一个报告基因. GST-Pull down实验显示, GST-CYCS能将HPO205沉淀下来,而GST空蛋白不能沉淀HPO205, 证实HPO205与Cytc存在相互作用.
结论: HPO205可能通过Cytc参与电子传递或/和细胞凋亡过程.
引文著录: 储著朗, 王建, 杨永升, 唐刘君, 陈慧, 杨晓明, 汪思应. 肝细胞生成素205与细胞色素C的相互作用. 世界华人消化杂志 2008; 16(12): 1281-1286
Revised: March 18, 2008
Accepted: April 21, 2008
Published online: April 28, 2008
AIM: To identify the interaction between hepatopoietin 205 (HPO205) and cytochrome C (Cytc).
METHODS: The coding genes of HPO205 and Cytc, amplified by polymerase chain reaction, were cloned into pDBLeu and pPC86 vector respectively. The interaction was confirmed by co-transformation with the recombinant plasmids into MaV203 of yeast two-hybrid system (Y2H), and verified by GST-Pull down assay simultaneously.
RESULTS: The coding genes of HPO205 and Cytc were successfully cloned into relevant vectors, and the obtained vectors were named as pDBLeu-GRER, pDBLeu-CYCS, pPC86-GFER and pPC86-CYCS. After Y2H identification, we found that co-transformation of pDBLeu-GFER pPC86-CYCS activated reporter genes Ura and His, but co-transformation of pDBLeu-CYCS and pPC86-GFER activated no reporter genes. GST-Pull down assay showed that HPO205 was deposited by GST-CYCS, but not by GST, verifying the interaction between HPO205 and Cytc.
CONCLUSION: The interaction between HPO205 and Cytc suggests that HPO205 participates in the biology processes of electron transfer or (and) apoptosis via Cytc.
- Citation: Chu ZL, Wang J, Yang YS, Tang LJ, Chen H, Yang XM, Wang SY. Identification of interaction between hepatopoietin 205 and cytochrome C. Shijie Huaren Xiaohua Zazhi 2008; 16(12): 1281-1286
- URL: https://www.wjgnet.com/1009-3079/full/v16/i12/1281.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i12.1281
人源肝细胞生成素(hepatopoietin, HPO/ALR)是一种能特异性刺激肝脏再生的细胞因子, 他含有125个氨基酸(15 kDa), 并具有巯基氧化酶活性, 参与MAPK以及转录因子AP-1通路的激活, 存在于细胞核中[1-3]; HPO205是HPO/ALR编码基因另一转录本的编码蛋白, 在其N端比HPO多80个氨基酸(23 kDa), 存在于胞质和线粒体膜间隙(intermembrane space of mitochondria, IMS)中[3-5]. HPO属于Erv1p/Alrp蛋白家族, 该家族成员广泛存在于从酵母到人的各种低等和高等真核生物以及一些双链DNA病毒中[6]. 前期研究表明, 人HPO的酵母同源分子Erv1p参与线粒体膜间隙蛋白的转运[7-8], 定位于IMS中的人Alrp在胞质中铁硫蛋白的生物发生过程中起重要作用[5]; 正常条件下Cytc也定位于IMS参与呼吸链电子传递以及细胞凋亡, 而在以二硫苏糖醇(DTT)作为还原底物时, Cytc接受来自于人HPO/ALR电子的能力是氧分子的100倍[9], 推测Cytc可能是HPO电子的接收者. 因此, HPO205和Cytc可能存在相互作用.
目前关于HPO/ALR的功能研究较多, 但对定位在IMS的HPO205的功能还知之甚少, 为了证实HPO205和Cytc的相互作用、探讨HPO205在IMS中的其他功能, 本研究利用Y2H和GST-Pull down技术对HPO205和Cytc间相互作用进行鉴定, 试图为揭示HPO205的新功能提供线索.
ProQuestTM酵母双杂交系统、成人肝cDNA文库购于美国Invitrogen公司; Yeast Nitrogen Base(YNB)、Bacto-yeast extract、Bacto-Peptone购于美国BD公司; 各种氨基酸购于北京百灵克生物科技公司; 3AT、PMSF、PEG3350、LiAc、玻璃珠购自美国Sigma公司; IPTG、X-gal、PCR及酶切产物纯化试剂盒、细菌质粒小量提取试剂盒购于美国Promega公司; Taq酶、dNTP、DNA分子量标记、DNA限制性内切酶购于大连宝生物工程(TaKaRa)有限公司. T4 DNA连接酶、预染蛋白Marker购于纽英伦生物技术(北京)有限公司; DMEM粉末、胰酶购自Gibco公司, 胎牛血清购自四季青公司; 其他所有试剂为国产分析纯以上产品; GST标签抗体、c-Myc标签抗体, HRP-羊抗小鼠IgG、蛋白A/G偶联琼脂糖珠及谷胱甘肽琼脂糖珠购自北京中杉金桥公司; JM109和BL21感受态、pCMV-Myc(MCS经改构)真核表达载体, pGEX-4T-2原核表达载体、HEK293细胞为实验室保存.
1.2.1 酵母双杂交载体的构建: 利用PCR扩增的方法从成人肝cDNA文库中获得HPO205和Cytc编码基因的DNA序列, 通过相应限制性内切酶酶切后, 与同样酶切后的含DNA结合结构域(DNA binding domain, DB)的pDBLeu空载体和含转录激活结构域(activation domain, AD)的pPC86空载体连接, 连接产物转化E.coli. JM109感受态, 相应抗性筛选(pDBLeu: 卡那抗性; pPC86: 氨苄抗性)并挑取阳性菌落提取质粒进行PCR和酶切鉴定, 送北京奥科公司测序.
1.2.2 融合蛋白自激活检测、3AT浓度的确定: 参考ProQuestTM酵母双杂交系统操作手册操作进行细菌质粒的酵母菌MaV203转化, 分别共转下列质粒组合: 用于自激活检测-pDBLeu-GFER+pPC86、pDBLeu-CYCS+pPC86、pDBLeu+pPC86-GFER、pDBLeu+pPC86-CYCS, 用于相互作用鉴定-pDBLeu-GFER+pPC86-CYCS和pDBLeu-CYCS+pPC86-GFER(每种质粒均加入约200 ng)分别涂布于SC-Leu-Trp营养缺陷平板上, 30℃培养48-72 h后将平板上所生长酵母挑取4个单克隆/转化, 对照菌A-E各2个接种划线到SC-Leu-Trp平板(用于自激活检测和相互作用筛选的酵母克隆分开划线). 将自激活检测的SC-Leu-Trp平板30℃培养24 h后用绒布复制到一系列3AT浓度梯度(10、25、50、75、100 mmol/L)的SC-Leu-Trp-His营养缺陷平板上并同时用绒布清除, 30℃培养24 h后再清除1次, 30℃继续培养24-48 h观察结果, 抑制转化子细胞生长(基础His表达)的最低的3AT浓度就是鉴定相互作用阳性克隆所需加入的3AT浓度.
1.2.3 Y2H鉴定相互作用: 将1.2.2中转化平板上生长的酵母菌落均划线SC-Leu-Trp平板上(4个单克隆/转化和对照菌A-E各2个), 30℃培养24 h后, 用绒布分别复制到SC-Leu-Trp-Ura-His +3AT(3AT浓度即为1.2.2所确定的浓度)及覆盖有灭菌Whatman滤纸的YPAD平板上, 进行His、Ura、LacZ 3个报告基因的鉴定.
1.2.4 真核表达载体pCMV-Myc-GFER(GFER: HPO205编码基因)的构建及表达: 将构建成功的pPC86-GFER和pCMV-Myc空载体用EcoRⅠ、SpeⅠ双酶切, 回收后连接, 转化JM109感受态并经PCR鉴定后获得pCMV-Myc-GFER阳性克隆.接种HEK293细胞, 待生长至80%-90%融合时, 利用Invitrogen公司的LipofectamineTM 2000将pCMV-Myc-GFER转染293细胞, 24 h后裂解细胞提取蛋白, 离心收集上清并加入SDS-PAGE样品缓冲液, 煮沸后进行Western blot, 以抗Myc抗体(1:2000稀释)为一抗,羊抗小鼠IgG(1:2000稀释)为二抗检测表达.
1.2.5 原核表达载体pGEX-4T-2-CYCS(CYCS: Cytc编码基因)的构建及表达: 将构建成功的pDBLeu-CYCS和GST表达空载体pGEX-4T-2用Sal I、NotⅠ双酶切, 回收后连接, 转化JM109感受态并经PCR鉴定后获得pGEX-4T-2-CYCS阳性克隆. 摇菌提取pGEX-4T-2-CYCS质粒转化BL21感受态, 以30℃、120 r/min、0.5 mmol/L IPTG诱导4 h后离心收集菌体, 以1×PBS重悬后超声破菌, 10 000 g离心10 min分离上清和沉淀, 分别取适量上清和沉淀重悬液(1×PBS重悬)加SDS-PAGE样品缓冲液沸水煮5-10 min, 冰上冷却后离心收集进行SDS-PAGE电泳后, 考染, 脱色, 观察蛋白在上清和沉淀中的表达情况. 并依此条件, 各用200 mL LB大量诱导表达.
1.2.6 GST-Pull down验证相互作用: 将诱导表达的GST空蛋白和融合蛋白用谷胱甘肽-琼脂糖珠纯化(具体操作参考谷胱甘肽琼脂糖珠使用说明书). 同时以1.2.4的方法将pCMV-Myc-GFER转染293细胞, 24 h后裂解细胞提取蛋白; 离心收集上清加入到含有纯化GST空蛋白的谷胱甘肽琼脂糖珠的离心管中(预清除), 4℃旋转混合7 h以上, 4℃, 13 000 r/min离心2 min, 再次收集上清取45 μL做蛋白表达对照, 其余平均转移至含有纯化pGEX-4T-2-CYCS融合蛋白和GST空蛋白的谷光甘肽琼脂糖珠的EP管中, 混合8 h或过夜后离心弃上清并用裂解液洗4次, 离心弃上清沉淀加入50 μL的SDS-PAGE样品缓冲液重悬, 煮沸后离心收集上清液, 进行Western blot, 分别以抗Myc抗体(1:2000稀释)、抗GST抗体(1:1000稀释)为一抗, 羊抗小鼠IgG(1:2000稀释)为二抗进行检测.
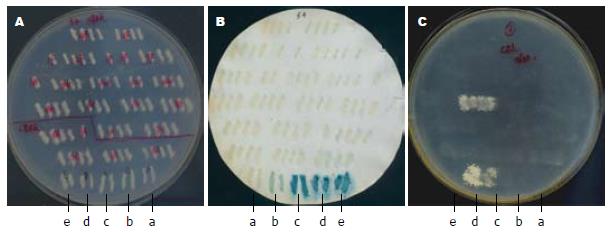
通过http://www.ncbi.nlm.nih.gov/网站查找出HPO205和Cytc基因编码序列, 针对基因的全长设计引物, 从成人肝cDNA文库中成功扩增出相应的编码基因, 经酶切、连接、转化、鉴定后送测序, 结果表明pDBLeu-GRER、pDBLeu-CYCS、pPC86-GFER、pPC86-CYCS载体构建正确, 这样成功构建出HPO205和Cytc酵母双杂交载体(表1, 图1).
| 蛋白名称 | 编码基因(NCBI_AC) | 靶向载体 | 酶切位点 | 引物序列1 |
| HPO205 | GFER (NM_005262) | pDBLeu | StuI | 5'-gaaggccttgatggcggcgcccggcgag-3' |
| SpeI | 5'-ggactagtctagtcacaggagccatc-3 | |||
| pPC86 | EcoRI | 5'-gggaattcagatggcggcgcccggcgag-3' | ||
| SpeI | 5'-ggactagtctagtcacaggagccatc-3 | |||
| Cytc | CYCS (NM_018947) | pDBLeu | SalI | 5'-acgcgtcgaccatgggtgatgttgagaaaggcaag-3' |
| 和pPC86 | NotI | 5'-ataagaatgcggccgcttactcattagtagcttttttgag-3' |
根据加入不同浓度3AT的SC-Leu-Trp-His营养缺陷平板上的菌落生长情况, 可以观察到所有自激活的质粒组合(见1.2.2)共转酵母MaV203后的转化子在3AT浓度为25、50、75、100 mmol/L的平板均不能生长, 表明所构建的诱饵和猎物均无自激活作用, 可用于酵母双杂交系统进行相互作用筛选. 因此采用25 mmol/L的3AT浓度作为鉴定相互作用阳性克隆的浓度.
将pDBLeu-GFER+pPC86-CYCS、pDBLeu-CYCS+pPC86-GFER共转MaV203后生长的酵母划线4个转化至新的SC-Leu-Trp平板, 进行His、Ura、LacZ表型分析. 发现pDBLeu-GFER+pPC86-CYCS共转后能激活Ura和His两个报告基因, 而pDBLeu-CYCS+pPC86-GFER共转则不能激活任何一个报告基因(图2).
亚克隆成功构建pCMV-Myc-GFER后, 将其质粒瞬时转染HEK293细胞, 24 h后裂解细胞提取蛋白进行Western blot检测, 发现pCMV-Myc-GFER在293细胞中正常表达.
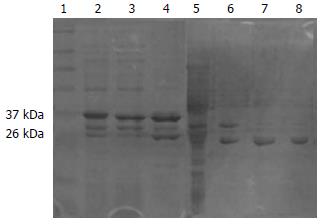
亚克隆成功构建pGEX-4T-2-CYCS后, 以0.5 mmol/L IPTG诱导后超声破菌, 离心分离上清和沉淀, 取上清和沉淀重悬液进行SDS-PAGE电泳后, 考染, 脱色. 发现GST空载体以及pGEX-4T-2-CYCS(GST-CYCS)在上清中均有表达(图3).
谷胱甘肽琼脂糖珠纯化GST融合蛋白和GST空蛋白后与转染了pCMV-Myc-GFER的HEK293细胞裂解液(预清除后)混合孵育, 离心、洗涤后加入SDS-PAGE样品缓冲液进行Western blot. 实验结果表明: GST-CYCS能将HPO205沉淀下来, 而GST空蛋白不能沉淀HPO205, 进一步证明了酵母双杂交筛鉴定HPO205与Cytc相互作用的可靠性(图4).
蛋白质-蛋白质相互作用是一切生命活动的基础, 作为研究蛋白质相互作用的技术平台, 近年来酵母双杂交(Y2H)技术已经成功用于各种模式生物以及人类大规模相互作用组的研究[10-13], 但该技术自身的局限性造成结果存在假阳性和假阴性. 为了减少假阳性, 本研究采用可信度高的ProQuestTM酵母双杂交系统(低拷贝载体、3个独立的报告基因及严格对照)并应用GST-Pull down对相互作用进行验证, HPO205和Cytc间相互作用经Y2H和GST-Pull down鉴定均为阳性, 表明该对相互作用结果比较可靠; 而且本研究在应用Y2H技术时采取诱饵和猎物互换形式(即DB-HPO205对AD-Cytc和AD-HPO205对DB-Cytc)鉴定以减少假阴性, 发现Y2H阳性结果是通过HPO205和Cytc特定载体的融合获得的, 而反向鉴定时为阴性结果, 这可能由于不同载体造成融合蛋白的折叠形式差异所致[14].
Erv1p/Alrp蛋白家族成员广泛存在于从酵母到人的各种低等和高等真核生物以及一些双链DNA病毒中, HPO和HPO205是该家族人Alrp蛋白成员[6]. 人ALR与酵母Erv1p分子在结构和功能上具有一定的同源性[6], 他们C-末端都具有保守的CXXC模序、都具有巯基氧化酶功能[1,15]. Erv1p以二聚体形式定位于IMS中, 参与胞质中铁硫蛋白的生物发生[5]. 在酵母IMS中Erv1p和Mia40分子共同形成二硫键的接力系统, 通过氧化折叠机制参与IMS中小Tims蛋白的转运, 电子也由小Tims前体蛋白经Mia40分子传递给Erv1p[8,16-18]. 最近研究发现, 通过电子传递Erv1p将二硫键的接力系统和呼吸链联系起来[19-20], 该途径中Cytc和Cytc过氧化物酶(cytochrome c peroxidase, Ccp1)发挥Erv1p依赖性的电子受体作用: Erv1p通过和Cytc形成复合物直接将电子传递给细胞色素, 或将电子传递给分子氧、通过Ccp1将产生的过氧化氢还原为水[21]; 前期应用酵母双杂交技术以人HPO为诱饵筛选肝脏cDNA文库, 也曾经得到呼吸链上的多种相互作用蛋白, 如NADH脱氢酶等[22], 而且, 以DTT作为还原底物时, Cytc接受来自于人HPO/ALR电子的能力远高于氧分子[9], 因此, 人的HPO205和Cytc间的相互作用提示HPO205可能作为电子传递载体发挥电子传递功能从而影响能量代谢.
此外, 对哺乳动物Alrp的研究发现, Alrp能促进肝源性细胞线粒体基因的表达, 提高细胞内细胞色素含量, 增强线粒体氧化磷酸化能力[23]. 巯基氧化酶在维持线粒体膜结构完整性和功能上具有重要作用: 他可以催化底物蛋白形成新的二硫键改变蛋白构象, 从而影响膜的功能[24]; 另一方面巯基氧化酶可以调节线粒体的氧化还原电势[25]. 而线粒体维持恰当的膜电位是进行氧化磷酸化的前提. 线粒体途径凋亡的早期事件涉及线粒体膜通透性增加引起的膜电位丧失和Cytc从IMS中释放. 前期研究表明HPO和凋亡相关蛋白BNIPL间存在相互作用[26]. 本研究发现HPO205和Cytc存在相互作用, 提示在IMS中HPO205作为巯基氧化酶[1]可能通过调控Cytc的释放影响细胞凋亡.
总之, 本研究应用Y2H和GST-Pull down技术鉴定出HPO205和Cytc间的相互作用, 提示HPO205可能通过Cytc发挥电子传递功能或/和影响细胞凋亡, 但这些假设只是基于相互作用的初步设想, 对于HPO205发挥功能的精确机制则需要更进一步研究.
感谢北京蛋白质组研究中心蛋白质相互作用研究室原艳芝、金超智等老师和同事在课题研究过程中的帮助; 感谢安徽医科大学病理生理学教研室郑红、李菲菲等老师对本课题的支持.
人源肝细胞生成素(HPO/ALR)是一种能特异性刺激肝脏再生的细胞因子, 存在于细胞核中; HPO205是其编码基因另一转录本的产物, 存在于胞质和线粒体膜间隙(IMS)中. 目前, 关于HPO的功能研究较多, 但对定位在IMS的HPO205的功能还知之甚少.
同行评价者
姚登福, 教授, 南通大学附属医院分子医学中心.
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
近些年有报道细胞色素C(Cytc)是人HPO酵母同源分子Erv1p的电子受体, 并且以DTT作为还原底物时, Cytc接受来自于人HPO/ALR电子的能力远高于氧分子.
本研究应用酵母双杂交和GST-Pull down技术, 首次证实HPO205与Cytc存在相互作用.
本文为研究HPO205在IMS中的功能以及可能机制提供了线索.
本研究方法和技术有特色, 证据充分, 结论明确, 具有一定的科学性, 创新性和可读性.
编辑: 李军亮 电编:吴鹏朕
| 1. | Lisowsky T, Lee JE, Polimeno L, Francavilla A, Hofhaus G. Mammalian augmenter of liver regeneration protein is a sulfhydryl oxidase. Dig Liver Dis. 2001;33:173-180. [PubMed] [DOI] |
| 2. | Lu C, Li Y, Zhao Y, Xing G, Tang F, Wang Q, Sun Y, Wei H, Yang X, Wu C. Intracrine hepatopoietin potentiates AP-1 activity through JAB1 independent of MAPK pathway. FASEB J. 2002;16:90-92. [PubMed] |
| 3. | Li Y, Wei K, Lu C, Li Y, Li M, Xing G, Wei H, Wang Q, Chen J, Wu C. Identification of hepatopoietin dimerization, its interacting regions and alternative splicing of its transcription. Eur J Biochem. 2002;269:3888-3893. [PubMed] [DOI] |
| 4. | Lu J, Xu WX, Zhan YQ, Cui XL, Cai WM, He FC, Yang XM. Identification and characterization of a novel isoform of hepatopoietin. World J Gastroenterol. 2002;8:353-356. [PubMed] |
| 5. | Lange H, Lisowsky T, Gerber J, Mühlenhoff U, Kispal G, Lill R. An essential function of the mitochondrial sulfhydryl oxidase Erv1p/ALR in the maturation of cytosolic Fe/S proteins. EMBO Rep. 2001;2:715-720. [PubMed] [DOI] |
| 6. | Gatzidou E, Kouraklis G, Theocharis S. Insights on augmenter of liver regeneration cloning and function. World J Gastroenterol. 2006;12:4951-4958. [PubMed] |
| 7. | Rissler M, Wiedemann N, Pfannschmidt S, Gabriel K, Guiard B, Pfanner N, Chacinska A. The essential mitochondrial protein Erv1 cooperates with Mia40 in biogenesis of intermembrane space proteins. J Mol Biol. 2005;353:485-492. [PubMed] [DOI] |
| 8. | Mesecke N, Terziyska N, Kozany C, Baumann F, Neupert W, Hell K, Herrmann JM. A disulfide relay system in the intermembrane space of mitochondria that mediates protein import. Cell. 2005;121:1059-1069. [PubMed] [DOI] |
| 9. | Farrell SR, Thorpe C. Augmenter of liver regeneration: a flavin-dependent sulfhydryl oxidase with cytochrome c reductase activity. Biochemistry. 2005;44:1532-1541. [PubMed] [DOI] |
| 10. | Giot L, Bader JS, Brouwer C, Chaudhuri A, Kuang B, Li Y, Hao YL, Ooi CE, Godwin B, Vitols E. A protein interaction map of Drosophila melanogaster. Science. 2003;302:1727-1736. [PubMed] [DOI] |
| 11. | Li S, Armstrong CM, Bertin N, Ge H, Milstein S, Boxem M, Vidalain PO, Han JD, Chesneau A, Hao T. A map of the interactome network of the metazoan C. elegans. Science. 2004;303:540-543. [PubMed] [DOI] |
| 12. | Stelzl U, Worm U, Lalowski M, Haenig C, Brembeck FH, Goehler H, Stroedicke M, Zenkner M, Schoenherr A, Koeppen S. A human protein-protein interaction network: a resource for annotating the proteome. Cell. 2005;122:957-968. [PubMed] [DOI] |
| 13. | Rual JF, Venkatesan K, Hao T, Hirozane-Kishikawa T, Dricot A, Li N, Berriz GF, Gibbons FD, Dreze M, Ayivi-Guedehoussou N. Towards a proteome-scale map of the human protein-protein interaction network. Nature. 2005;437:1173-1178. [PubMed] [DOI] |
| 14. | Lim J, Hao T, Shaw C, Patel AJ, Szabó G, Rual JF, Fisk CJ, Li N, Smolyar A, Hill DE. A protein-protein interaction network for human inherited ataxias and disorders of Purkinje cell degeneration. Cell. 2006;125:801-814. [PubMed] [DOI] |
| 15. | Lee J, Hofhaus G, Lisowsky T. Erv1p from Saccharomyces cerevisiae is a FAD-linked sulfhydryl oxidase. FEBS Lett. 2000;477:62-66. [PubMed] [DOI] |
| 17. | Grumbt B, Stroobant V, Terziyska N, Israel L, Hell K. Functional characterization of Mia40p, the central component of the disulfide relay system of the mitochondrial intermembrane space. J Biol Chem. 2007;282:37461-37470. [PubMed] [DOI] |
| 18. | Müller JM, Milenkovic D, Guiard B, Pfanner N, Chacinska A. Precursor oxidation by mia40 and erv1 promotes vectorial transport of proteins into the mitochondrial intermembrane space. Mol Biol Cell. 2008;19:226-236. [PubMed] [DOI] |
| 19. | Bihlmaier K, Mesecke N, Terziyska N, Bien M, Hell K, Herrmann JM. The disulfide relay system of mitochondria is connected to the respiratory chain. J Cell Biol. 2007;179:389-395. [PubMed] [DOI] |
| 20. | Allen S, Balabanidou V, Sideris DP, Lisowsky T, Tokatlidis K. Erv1 mediates the Mia40-dependent protein import pathway and provides a functional link to the respiratory chain by shuttling electrons to cytochrome c. J Mol Biol. 2005;353:937-944. [PubMed] [DOI] |
| 21. | Dabir DV, Leverich EP, Kim SK, Tsai FD, Hirasawa M, Knaff DB, Koehler CM. A role for cytochrome c and cytochrome c peroxidase in electron shuttling from Erv1. EMBO J. 2007;26:4801-4811. [PubMed] [DOI] |
| 22. | Cheng J, Wang L, Li K, Lu YY, Wang G, Liu Y, Zhong YW, Duan HJ, Hong Y, Li L. Screening of augmenter of liver regeneration-binding proteins by yeast-two hybrid technique. Hepatobiliary Pancreat Dis Int. 2003;2:81-84. [PubMed] |
| 23. | Polimeno L, Capuano F, Marangi LC, Margiotta M, Lisowsky T, Ierardi E, Francavilla R, Francavilla A. The augmenter of liver regeneration induces mitochondrial gene expression in rat liver and enhances oxidative phosphorylation capacity of liver mitochondria. Dig Liver Dis. 2000;32:510-517. [PubMed] [DOI] |
| 24. | Wittke I, Wiedemeyer R, Pillmann A, Savelyeva L, Westermann F, Schwab M. Neuroblastoma-derived sulfhydryl oxidase, a new member of the sulfhydryl oxidase/Quiescin6 family, regulates sensitization to interferon gamma-induced cell death in human neuroblastoma cells. Cancer Res. 2003;63:7742-7752. [PubMed] |
| 25. | Balmer Y, Vensel WH, Tanaka CK, Hurkman WJ, Gelhaye E, Rouhier N, Jacquot JP, Manieri W, Schürmann P, Droux M. Thioredoxin links redox to the regulation of fundamental processes of plant mitochondria. Proc Natl Acad Sci U S A. 2004;101:2642-2647. [PubMed] [DOI] |