修回日期: 2007-12-17
接受日期: 2007-12-25
在线出版日期: 2008-01-08
目的: 探讨黄芪多糖(APS)在内毒素-脂多糖(LPS)损伤小肠上皮细胞(IEC-6)中的作用机制及对细胞因子和核因子-κB(NF-κB)表达的影响.
方法: 以小肠上皮细胞株IEC-6为研究对象, 将培养的细胞分为6组: 对照组、LPS组、LPS+APS 50 mg/L组、LPS+APS 100 mg/L组、LPS+APS 200 mg/L组和LPS+APS 500 mg/L组. 采用RT-PCR法检测细胞因子TNF-α和IL-8 mRNA的表达, 采用凝胶电泳迁移率法分析NF-κB蛋白活性.
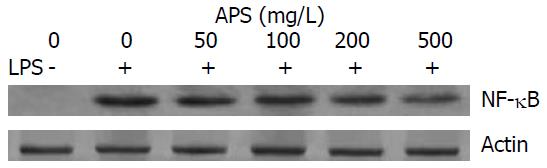
结果: LPS损伤IEC-6细胞后, TNF-α, IL-8 mRNA水平和NF-κB蛋白定量表达均升高, 均显著高于对照组(TNF-a: 1.26±0.06 vs 0.65±0.05, IL-8 mRNA: 1.19±0.05 vs 0.57±0.06, NF-κB: 2.76±0.07 vs 0.07±0.03, P均<0.01). 而黄芪多糖呈浓度和时间依赖性地抑制LPS诱导IEC-6细胞分泌的TNF-α, IL-8等细胞因子的mRNA的表达水平(P<0.01), 并能降低NF-κB的表达活性(P<0.01).
结论: APS具有抑制LPS刺激IEC-6细胞产生的TNF-α, IL-8炎性因子的作用, 并能降低NF-κB的表达活性, 其对LPS所致的肠道损伤具有保护作用.
引文著录: 袁媛, 孙梅. 黄芪多糖对LPS损伤小肠上皮细胞的保护作用. 世界华人消化杂志 2008; 16(1): 15-19
Revised: December 17, 2007
Accepted: December 25, 2007
Published online: January 8, 2008
AIM: To explore the mechanism of the action and impact of Astragalus mongholicus polysaccharides (APS) on lipopolysaccharide (LPS)-induced inflammatory factors gene expression and nuclear factor (NF)-κB transcriptional activity in intestinal epithelial cells (IEC-6).
METHODS: Intestinal epithelial cells (IEC-6) were divided into six groups: controls, LPS, LPS + APS 50 mg/L, LPS + APS 100 mg/L, LPS + APS 200 mg/L, LPS + APS 500 mg/L. Expression of tumor necrosis factor (TNF)-α and interleukin (IL)-8 mRNA was determined by RT-PCR. Expression of NF-κB protein was determined by electrophoretic mobility shift assay.
RESULTS: The levels of TNF-α, IL-8 mRNA and NF-κB protein were significantly higher in the LPS-damaged group than those in the control group (TNF-α: 1.26 ± 0.06 vs 0.65 ± 0.05, IL-8 mRNA: 1.19 ± 0.05 vs 0.57 ± 0.06, NF-κB: 2.76 ± 0.07 vs 0.07 ± 0.03, P < 0.01). Moreover, APS significantly inhibited LPS-induced TNF-α and IL-8 at the mRNA level and reduced the production of NF-κB protein in a concentration- and time-dependent manner (P < 0.01).
CONCLUSION: APS can inhibit LPS-induced production of TNF-α and IL-8 mRNA, perhaps via suppression of the NF-κB signaling pathway. Modulation of bacterial product-mediated NF-κB signaling by APS may represent an attractive strategy for the prevention and treatment of intestinal inflammation.
- Citation: Yuan Y, Sun M. Mechanism of impact of Astragalus mongholicus polysaccharides on lipopolysaccharide-induced damage in intestinal epithelial cells. Shijie Huaren Xiaohua Zazhi 2008; 16(1): 15-19
- URL: https://www.wjgnet.com/1009-3079/full/v16/i1/15.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i1.15
肠上皮细胞是肠道黏膜屏障的重要组成部分, 是宿主与病原微生物双向联系的第一道防御. 各种病理因素(如创伤、休克和严重感染等)重症应激状态时, 全身免疫功能低下, 大量肠道内细菌和内毒素侵入体循环, 造成细菌移位和肠源性内毒素血症, 可加剧肠上皮细胞的损伤, 导致一些炎症介质(如TNF-α, IL-6, IL-8和血小板激活因子等)大量的产生和释放, 引起全身炎症反应综合征(SIRS), 启动并加速多系统器官功能衰竭(MSOF). 这说明肠功能障碍在危重病发展过程中起着非常重要的作用. 长期以来, 人们仅仅依赖抗菌药物直接杀灭或抑制微生物的生长繁殖, 并未对免疫紊乱状态进行调理治疗. 随着人们对疾病认识的提高, 目前开始重视免疫治疗方案, 着重于阻断炎症瀑布反应和保护细胞介导免疫功能, 其中具体治疗方法包括中医中草药治疗. 黄芪以其"活血化瘀""清热解毒"之功效成为目前研究较多的一种中草药. 黄芪多糖(APS)是黄芪很重要的一种单体成分. 国内多项研究证实APS具有免疫调节[1]、刺激造血功能[2]和神经系统保护[3]等多种功效. 我们利用体外培养小肠上皮细胞系, 研究APS对内毒素-脂多糖(LPS)刺激小肠上皮细胞产生细胞因子TNF-α, IL-8和NF-κB的调节作用. 探讨APS对LPS所致的肠上皮细胞损伤的免疫保护作用机制, 为临床治疗及阻止SIRS和MSOF的发生提供一种手段.
IEC-6细胞系由中国医学科学院肿瘤医院生物检测中心提供, TRIzol, RT-PCR试剂盒, DMEM培养基和胎牛血清购于Gibco公司, LPS购自Sigma公司, APS由美国泛美医药公司Pharmagenesis提供, TNF-α和IL-8上下游引物由上海生物工程公司设计合成. 培养液每1000 mL由900 mL DMEM, 100 mL胎牛血清, 配以0.01 g/L的胰岛素组成. APS 250 mg用DMEM稀释成50 mg/L, 100 mg/L, 200 mg/L, 500 mg/L的溶液.
1.2.1 细胞培养: IEC-6细胞在37℃, 50 mL/L CO2培养箱中培养, 次日换液, 接近80%融合时, 2.5 g/L胰酶消化传代. 5 d传代1次, 传代5次后的细胞用于实验.
1.2.2 细胞分组: 将培养的细胞分为6组: 1组: 对照组, 以PBS为对照; 2组: LPS组; 3组: LPS+APS 50 mg/L; 4组: LPS+APS 100 mg/L; 5组: LPS+APS 200 mg/L; 6组: LPS+APS 500 mg/L.
1.2.3 RT-PCR分析: 细胞以每孔4×108/L的密度接种于培养板内, 孵育24 h, 然后加入不同剂量APS溶液100 mL使其终浓度分别为50 mg/L, 100 mg/L, 200 mg/L, 500 mg/L, 再孵育1 h, 然后给予LPS继续孵育1-4 h后收集细胞检测TNF-α和IL-8 mRNA水平. TNF-α的扩增PCR条件: 95℃ 2 min, 94℃ 1 min, 58℃ 45 s, 72℃ 45 s, 25个循环后74℃延伸10 min. TNF-α的引物序列: 上游引物5'-TTCGGGGTGATCGGTCCCAA-3', 下游引物5'-AGCATCTCGTGTGTTTCTGA-3'. IL-8的扩增PCR条件: 94℃ 1 min, 94℃ 40 s, 51℃ 1 min, 72℃ 1 min, 25个循环后72℃延伸5 min. IL-8的引物序列: 上游引物5'-CCTG AAGACCCTACCAAG-3', 下游引物5'-AGGCTCCATAAATGAAAGA-3'. 内参GAPDH的扩增: PCR条件: 95℃ 5 min, 94℃ 1 min, 55℃ 1 min, 74℃ 1 min, 25个循环后74℃延伸10 min. GAPDH的引物序列: 上游引物5'-ATCACTGCCACTCAGAAGAC-3'. 下游引物5'-TGAGGGAGATGCTCAGTGTT-3'. 15 g/L琼脂糖凝胶电泳: 1.5 g琼脂糖+0.5×TBE至终体积100 mL, 加入溴化乙锭(EB)至终浓度0.5 mg/L. (以DL2000为DNA Marker)每孔加样10 μL, 90 V电泳50 min左右, 紫外透射灯下观察结果, 用凝胶图像扫描分析系统扫描凝胶得到内参对照GAPDH与目的基因的电泳条带光密度, 通过目的基因/GAPDH的光密度比值做相对定量分析.
1.2.4 凝胶电泳迁移率实验: 参照文献[4]方法经g-32P-dATP标记、乙醇沉淀纯化的NF-κB寡核苷酸探针与核蛋白作用后, 行6%非变性聚丙烯酰胺凝胶电泳, 电泳结束后小心取出凝胶在干燥仪烘干, -70℃放射自显影24 h, 经凝胶扫描分析系统进行吸光度扫描, 计算其活性值.
统计学处理 采用SPSS软件包t检验.
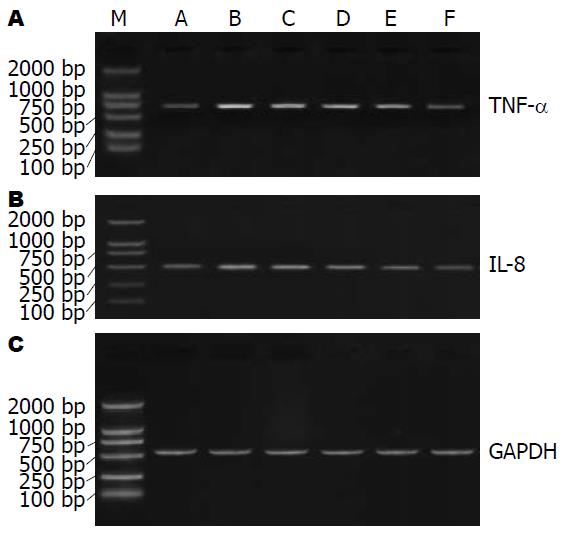
LPS刺激IEC-6细胞可导致其分泌的炎性因子增多. 我们检测APS对LPS所致的IEC-6细胞分泌TNF-α和IL-8在mRNA水平上的影响. RT-PCR分析方法检测显示, 当LPS刺激IEC-6细胞时, TNF-α和IL-8 mRNA被诱导分泌具有显著意义的增加(P<0.01), APS可以抑制这种分泌的增加, 并具有剂量依赖性. APS 50 mg/L可部分抑制, 200 mg/L, 500 mg/L随着浓度的增加, 其抑制水平逐渐增加(P<0.01)(图1, 表1).
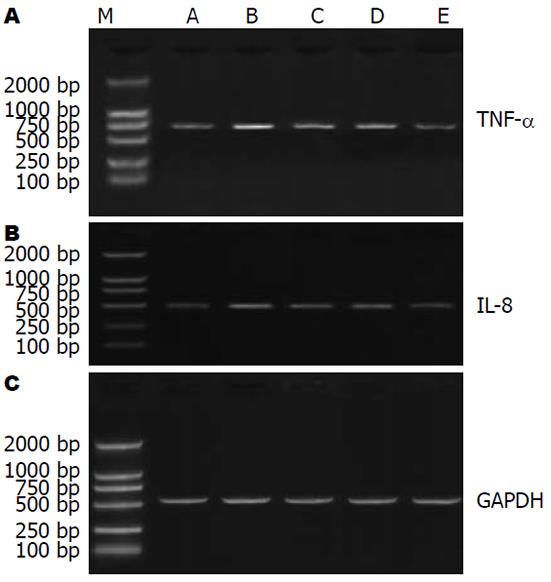
我们采用了将IEC-6细胞用500 mg/L APS预处理1 h, 然后用LPS(10 mg/L)刺激达4 h, 采用RT-PCR方法进行TNF-α和IL-8 mRNA分析. 如图2所示, LPS诱导TNF-α mRNA和IL-8 mRNA表达均被ASP有效的抑制(1 h与4 h的抑制率分别为21.7%与22.2%, 33.3%与36.2%)(表2).
| 对照组 | LPS | ||||
| 1 h | 4 h | ||||
| - | APS | - | APS | ||
| TNF-α | 0.65±0.04 | 0.92±0.07 | 0.72±0.02 | 0.81±0.05 | 0.63±0.04 |
| IL-8 | 0.61±0.07 | 1.17±0.06 | 0.78±0.03 | 0.91±0.04 | 0.58±0.05 |
小肠上皮细胞(IEC)在消化中起着吸收和交换营养及黏膜屏障作用, 同时在宿主黏膜表面的天然及获得性免疫系统中起调节作用, 是对抗肠道细菌、毒素的第一道防线[5,6], 在IEC的潜在刺激因素中, 细菌和细菌产物(如LPS)都是非常重要的因素, 因为他们在肠道内的浓度非常高[5,7]. 虽然IEC对LPS的反应较单核巨噬细胞弱, 但是大量实验表明内毒素可以引发IEC前炎性因子的基因转录[8-13], 这其中也包括IEC-6[5,14,15]. 肠腔内毒素具有引发IEC复杂的细胞因子基因转录的作用, 目前认为IEC参与了多种小肠炎症紊乱过程并具有重要意义.
黄芪是常用的益气健脾中药之一. 国内对其药理作用的研究较为深入, 涉及免疫、胃肠运动、促进胃肠黏膜细胞增殖、分化、移行等[1,16,17]. APS是黄芪的单体成分, 其具有的免疫保护作用越来越多的得到重视. 国内路景涛等[18]研究证实了复方黄芪提取物能够抑制细菌脂多糖诱导大鼠腹腔巨噬细胞释放的肿瘤坏死因子, 白细胞介素和一氧化氮的分泌, 说明黄芪可以通过抑制炎症因子的分泌从而减少组织细胞的损伤来发挥其对机体的免疫保护作用.
我们采用体外培养的IEC-6为模型, 观察APS是否可以对LPS诱导的IEC-6释放TNF-α, IL-8等细胞因子有所影响. 结果发现APS能够抑制LPS刺激IEC-6细胞分泌产生的TNF-α mRNA及IL-8 mRNA的表达, 且这种抑制作用具有对黄芪多糖的浓度依赖性. 同时还发现NF-κB作为一种调控多种炎性因子基因表达的核因子, 当LPS刺激IEC-6时, NF-κB蛋白表达增加, 而APS能够有效的抑制NF-κB蛋白表达的增长, 且随着APS浓度的增加, 抑制NF-κB的作用逐渐增强. 故我们认为, APS对小肠上皮细胞具有免疫保护作用, 这种免疫保护作用可能是通过抑制小肠上皮细胞内核因子NF-κB的表达从而抑制细胞因子TNF-α、IL-8等的表达来实现的.
通过研究, 我们首次提出APS发挥肠道免疫调节作用的可能机制, 同时也为临床上使用APS治疗肠道功能障碍等疾病提供了理论依据, 为临床上治疗及阻止MSOF的发生提供一种新的治疗手段.
肠功能障碍可引发全身炎症反应综合征(SIRS)并加速多系统器官功能衰竭(MSOF), 故在危重病中起着非常重要的作用. 如何治疗及阻止肠功能障碍的发生具有重要意义.
以往治疗严重感染等重症应激状态导致的肠道黏膜损伤仅依赖抗菌药治疗, 目前人们开始重视中医中草药对肠道的免疫紊乱状态的调理治疗. 黄芪以其"活血化瘀""清热解毒"之功效成为目前研究较多的一种中草药. 国内研究多集中在其促进胃肠黏膜细胞增殖、分化、移行作用, 对心脏的免疫保护调节等, 而鲜有对肠功能障碍的免疫保护作用机制研究.
国内路景涛 et al研究指出: 复方黄芪提取物能够抑制细菌脂多糖诱导大鼠腹腔巨噬细胞释放的肿瘤坏死因子, 白细胞介素和一氧化氮的分泌, 他的研究证实黄芪可以通过抑制炎症因子的分泌从而减少组织细胞的损伤而发挥免疫保护作用.
本文以体外培养小肠上皮细胞为研究模型, 从细胞水平直接研究黄芪的免疫调节作用, 首次提出黄芪多糖发挥肠道免疫保护作用可能通过抑制小肠上皮细胞内核因子NF-κB的表达从而抑制细胞因子TNF-α和IL-8等的表达来实现的.
本文研究方法设计合理, 结果可靠, 对临床工作具有很强的指导意义.
编辑: 李军亮 电编:何基才
| 4. | Peng HB, Libby P, Liao JK. Induction and stabilization of I kappa B alpha by nitric oxide mediates inhibition of NF-kappa B. J Biol Chem. 1995;270:14214-14219. [PubMed] |
| 5. | Haller D, Jobin C. Interaction between resident luminal bacteria and the host: can a healthy relationship turn sour? J Pediatr Gastroenterol Nutr. 2004;38:123-136. [PubMed] |
| 6. | Rolfe RD. The role of probiotic cultures in the control of gastrointestinal health. J Nutr. 2000;130:396S-402S. [PubMed] |
| 7. | Kraehenbuhl JP, Corbett M. Immunology. Keeping the gut microflora at bay. Science. 2004;303:1624-1625. [PubMed] |
| 8. | Cario E, Rosenberg IM, Brandwein SL, Beck PL, Reinecker HC, Podolsky DK. Lipopolysaccharide activates distinct signaling pathways in intestinal epithelial cell lines expressing Toll-like receptors. J Immunol. 2000;164:966-972. [PubMed] |
| 9. | Cetin S, Dunklebarger J, Li J, Boyle P, Ergun O, Qureshi F, Ford H, Upperman J, Watkins S, Hackam DJ. Endotoxin differentially modulates the basolateral and apical sodium/proton exchangers (NHE) in enterocytes. Surgery. 2004;136:375-383. [PubMed] |
| 10. | Haller D, Holt L, Parlesak A, Zanga J, Bauerlein A, Sartor RB, Jobin C. Differential effect of immune cells on non- pathogenic Gram-negative bacteria-induced nuclear factor-kappaB activation and pro-inflammatory gene expression in intestinal epithelial cells. Immunology. 2004;112:310-320. [PubMed] |
| 11. | Kim YS, Kim JS, Jung HC, Song IS. The effects of thalidomide on the stimulation of NF-kappaB activity and TNF-alpha production by lipopolysaccharide in a human colonic epithelial cell line. Mol Cells. 2004;17:210-216. [PubMed] |
| 12. | Kojima K, Musch MW, Ropeleski MJ, Boone DL, Ma A, Chang EB. Escherichia coli LPS induces heat shock protein 25 in intestinal epithelial cells through MAP kinase activation. Am J Physiol Gastrointest Liver Physiol. 2004;286:G645-G652. [PubMed] |
| 13. | Vora P, Youdim A, Thomas LS, Fukata M, Tesfay SY, Lukasek K, Michelsen KS, Wada A, Hirayama T, Arditi M. Beta-defensin-2 expression is regulated by TLR signaling in intestinal epithelial cells. J Immunol. 2004;173:5398-5405. [PubMed] |
| 14. | Haller D, Holt L, Kim SC, Schwabe RF, Sartor RB, Jobin C. Transforming growth factor-beta 1 inhibits non-pathogenic Gram negative bacteria-induced NF-kappa B recruitment to the interleukin-6 gene promoter in intestinal epithelial cells through modulation of histone acetylation. J Biol Chem. 2003;278:23851-23860. [PubMed] |
| 15. | Haller D, Russo MP, Sartor RB, Jobin C. IKK beta and phosphatidylinositol 3-kinase/Akt participate in non-pathogenic Gram- negative enteric bacteria-induced RelA phosphorylation and NF-kappa B activation in both primary and intestinal epithelial cell lines. J Biol Chem. 2002;277:38168-38178. [PubMed] |