修回日期: 2006-12-11
接受日期: 2006-12-18
在线出版日期: 2007-03-18
目的: 检测浆膜腔积液脱落细胞P21 ras蛋白表达状况, 探讨其对恶性浆膜腔积液的诊断价值.
方法: 将新鲜浆膜腔积液离心后收集脱落细胞, 取部分细胞涂片进行常规细胞学诊断, 据此将积液分为良性与恶性两组. 对余下脱落细胞作"标准化"处理, 包括去除红细胞、多聚甲醛固定、调整细胞浓度、制备细胞涂片, 然后进行P21 ras蛋白免疫化学染色(SP法).
结果: 共108例浆膜腔积液, 恶性53例, 良性55例. 39例恶性积液P21 ras蛋白免疫化学染色阳性(73.6%), 且多为强阳性或阳性; 12例良性积液P21 ras蛋白染色阳性(21.8%), 且多为弱阳性或阳性, 两组间阳性率(χ2 = 29.02, P<0.001)及阳性强度(Uc = 6.786, P<0.001)的差异均有显著性统计学意义. P21 ras蛋白免疫化学染色诊断恶性积液的敏感度为73.6%, 特异度为78.2%, 诊断符合率达75.9%.
结论: 浆膜腔积液中脱落细胞P21 ras蛋白免疫化学染色在肿瘤细胞多为阳性, 良性细胞多为阴性, 对恶性体腔积液的诊断有较大的价值.
引文著录: 宋荣峰, 张焜和, 靳文剑, 陈江, 祝金泉, 吕农华. 恶性浆膜腔积液脱落细胞中P21 ras蛋白表达状况及其意义. 世界华人消化杂志 2007; 15(8): 893-896
Revised: December 11, 2006
Accepted: December 18, 2006
Published online: March 18, 2007
AIM: To investigate the expression of P21 ras protein in the exfoliative cells from malignant serous cavity effusions and its diagnostic value.
METHODS: Exfoliative cells in fresh specimens of serous cavity effusions were collected after centrifugation, and cell smears were prepared for cytological diagnosis, by which the specimens were divided into benign or malignant groups. The remained exfoliative cells were processed with a "standardized" procedure: removing red cells, fixing in paraformaldehyde, adjusting the cell concentration, and finally, cell smears were prepared and P21 ras immunocytochemistry were performed (SP method).
RESULTS: A total of 108 effusion specimens were collected, including 53 malignant and 55 benign one. In the immunocytochemical staining of P21 ras, 39 of 53 malignant effusions were positive (73.6%), and most of them were strongly positive. The positive results were observed in 12 of 55 (21.8%) benign effusions, most of which were weakly positive. The positive rates (χ2 = 29.02, P < 0.001) and expression intensity (Uc = 6.786, P < 0.001) of P21 ras were significantly different between malignant and benign effusions. The sensitivity, specificity and diagnostic accordance rate of P21 ras immunocytochemistry in the diagnosis of malignant effusions were 73.6%, 78.2% and 75.9%, respectively.
CONCLUSION: P21 ras immunocytochemical staining of exfoliative cells is positive in most malignant effusions, but negative in most benign ones, implicating that it is valuable for the diagnosis of malignant effusions.
- Citation: Song RF, Zhang KH, Jin WJ, Chen J, Zhu JQ, Lv NH. Expression of P21 ras protein in malignant serous cavity effusions and its significance. Shijie Huaren Xiaohua Zazhi 2007; 15(8): 893-896
- URL: https://www.wjgnet.com/1009-3079/full/v15/i8/893.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i8.893
浆膜腔积液是常见的临床病症, 按病因可分为良性与恶性两大类. 随着恶性肿瘤发病率的升高, 恶性浆膜腔积液不断增多, 在老年性积液中高达70%左右. 细胞学检查一直是恶性浆膜腔积液的主要诊断手段, 但其敏感性低、经验性强, 难以满足临床需要[1]. 因此, 恶性积液诊断及其与良性积液的鉴别常困扰临床医务人员. 近年来, 通过体腔积液脱落细胞免疫化学染色辅助细胞学诊断倍受关注[2], 人们试图通过检测肿瘤相关蛋白的表达, 为恶性细胞的诊断提供帮助. 恶性积液中转移癌细胞可来源于全身各种肿瘤, 必须针对"通用"的肿瘤相关抗原进行免疫化学染色, 才有可能取得良好的诊断效果. ras基因是迄今为止研究最多的原癌基因之一, 其突变普遍存在于各种恶性肿瘤, 并与肿瘤的发生、进展和转移密切相关[3], 他所编码的P21 ras蛋白在多种肿瘤中有较高的阳性表达率[4], 因而是恶性肿瘤的一个广谱标志物. 因此, 对P21 ras蛋白进行免疫化学染色可能在恶性积液的诊断及其与良性积液的鉴别中具有较大的价值. 迄今为止, 我们未检索到P21 ras蛋白在恶性浆膜腔积液的诊断应用研究报道, 其具体价值如何尚不清楚. 为此, 我们采用ras蛋白的mAb对浆膜腔积液脱落细胞进行免疫细胞化学染色, 探讨其对恶性浆膜腔积液的诊断价值.
108例浆膜腔积液标本来自108例不同患者, 其中胸水71例, 腹水32例, 心包积液4例, 盆腔灌洗液1例. 所有病例均为2001-10/2002-10在南昌大学第一附属医院的住院患者. 根据细胞学诊断结果将标本分为良性与恶性积液两组.
取新鲜标本50-100 mL, 常规离心收集细胞沉淀. 如为血性积液, 用氯化铵溶液破坏红细胞. 取部分细胞沉淀涂片, 由本院细胞室高年资医师作出细胞学诊断. 余下的细胞沉淀进行"标准化"处理[5], 包括10 g/L多聚甲醛-PBS固定、用1 g/L BSA-PBS洗涤、调整细胞浓度为2×106/mL, 然后涂片, 干燥后置-85 ℃冰箱保存备用.
1.2.1 免疫细胞化学染色: 采用SP酶标法(试剂盒购于北京中山生物技术有限公司), 一抗为鼠抗人P21 ras单克隆抗体(Santa Cruz公司产品), 二抗为通用型生物素标记的羊抗鼠IgG, 酶系统为辣根过氧化物酶标记的链霉卵白素, DAB显色. PBS代替一抗作为阴性对照. 操作按试剂盒说明书进行.
1.2.2 结果判断: (1)阳性细胞的判断: P21 ras蛋白免疫化学染色呈棕黄色颗粒样着色, 以胞膜明显, 也见于胞质. 将染色强度分为Ⅲ级: Ⅰ级无着色, 计为阴性; Ⅱ级为浅黄色, Ⅲ级为棕黄色, 均计为阳性; (2)阳性标本的判断: 高倍视野下, 计数100个细胞, 计算出阳性细胞百分比. 阳性细胞≥80%计为强阳性+++, 20%-79%计为阳性++, 6%-19%计为弱阳性+, 0%-5%计为阴性-. +~+++均计为阳性标本, -计为阴性标本.
统计学处理 计数资料采用卡方检验, 等级资料采用秩和检验, P<0.05有统计学意义. 并计算P21 ras蛋白免疫化学染色诊断恶性体腔积液的敏感度、特异度、阳性预测值、阴性预测值及诊断符合率.
108例浆膜腔积液的患者中, 男57例, 女51例, 年龄14-78(平均51.2)岁. 细胞学检查诊断为恶性积液者53例, 良性积液55例. 恶性积液中, 胸腔积液33例, 腹腔积液17例, 心包积液3例. 良性积液中, 胸腔积液38例, 腹腔积液15例, 心包积液1例, 腹腔灌洗液1例.
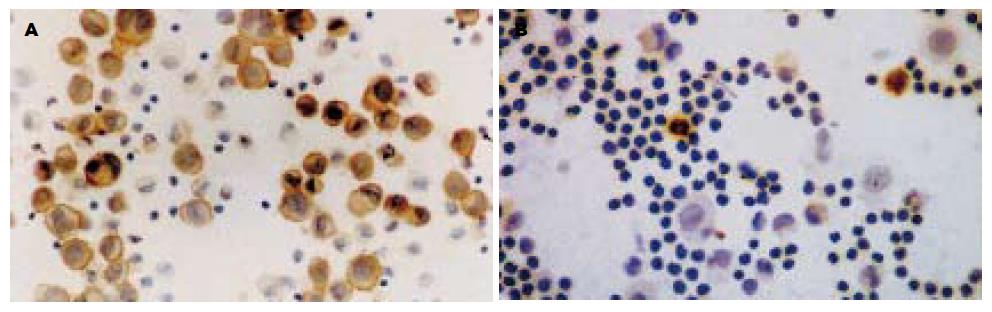
ras蛋白免疫化学染色结果 肿瘤细胞以胞膜着色为主, 有时细胞核及核周也着色, 呈棕黄色颗粒沉淀样; 间皮细胞、淋巴细胞不明显(图1A, 1B). 在53例恶性积液中, 有39例染色呈阳性, 阳性率73.6%, 且其中36例呈阳性或强阳性++~+++, 占92.3%. 55例良性积液中, 12例染色阳性, 阳性率21.8%, 且多为阳性或弱阳性+~ ++(表1). 经卡方检验, 良性与恶性积液脱落细胞免疫化学染色阳性率差异有显著性意义(χ2 = 29.02, P<0.001). 经秩和检验, 良性与恶性标本脱落细胞免疫化学染色的阳性强度差异也有显著性意义(Uc = 6.786, P<0.001).
| 积液类型 | n | 阳性例数(%) | 阳性强度 | |||
| - | + | ++ | +++ | |||
| 恶性 | 53 | 39(73.6) | 14 | 3 | 25 | 11 |
| 良性 | 55 | 12(21.8) | 43 | 5 | 7 | 0 |
浆膜腔积液脱落细胞P21 ras蛋白免疫化学染色对恶性积液具有较好的诊断价值, 敏感度为73.6%, 特异度为78.2%, 阳性预测值为76.5%, 阴性预测值为75.4%, 诊断符合率为75.9%.
恶性浆膜腔积液一直是临床诊断难题, 人们不断寻求有效的实验诊断方法[6-9]. 将免疫细胞化学染色应用于浆膜腔积液脱落细胞的各种肿瘤相关抗原表达的检测, 有助于提高恶性积液诊断的准确性[10-11]. Nomoto et al[12]比较了常规细胞学检查、免疫细胞化学染色及PCR-RFLP检测K-ras基因突变3种方法对胰腺癌腹膜转移的检出率, 其中脱落细胞免疫细胞化学染色敏感性最高. 目前, 在常规细胞检查的基础上应用免疫细胞化学染色技术已成为良恶性体腔积液鉴别诊断中一项重要的辅助手段[2,13]. ras基因家族突变是人类肿瘤最常见的癌基因事件之一, 并认为是肿瘤发生、发展中的一个共同通路[3], 但ras基因突变在人类肿瘤的阳性检出率较低, 尚不具有临床实用价值, 而其表达产物的阳性检出率高, 对肿瘤有较大的诊断价值[14]. 我们对108例浆膜腔积液脱落细胞进行P21 ras蛋白免疫细胞化学染色, 肿瘤细胞着色大多呈阳性或强阳性, 而良性脱落细胞染色大多为阴性, 如为阳性也多为弱阳性, 细胞着色浅淡, 阳性强度在恶性与良性积液之间的差异有极显著性意义(P<0.001). 恶性标本脱落细胞P21 ras蛋白免疫化学染色的阳性率为73.6%, 明显高于良性积液(P<0.001), 对诊断恶性积液的敏感度、特异度、诊断符合率等5项诊断效率指标均达75%左右. 因此, P21 ras蛋白免疫细胞化学染色对恶性积液的诊断有较大的价值.
浆膜腔积液中的部分肿瘤细胞不表达P21 ras蛋白, 而部分良性脱落细胞有较弱表达, 近年来对P21 ras蛋白在细胞信号转导中的作用机制的深入了解可对此作出解释. P21 ras是细胞内信号转导通路的开关分子, 当其定位于细胞膜时与GTP结合形成P21 ras-GTP复合体即被激活, 使细胞内信号转导系统开放; 因P21 ras具有GTP酶活性, 可将GTP水解为GDP后便失活, 使信号转导系统关闭. P21 ras并不是一直位于细胞膜上, 当他在蛋白激酶C(PKC)的作用下发生磷酸化时, 与细胞膜的结合减弱而移至内质网、高尔基体和粒线体等细胞器内[15]. ras基因突变后所表达的突变型P21 ras蛋白其GTP酶活性减弱以致持续与GTP结合而使信号转导系统一直开放, 细胞无休止地分裂和增殖而发生恶性转化. 因此, 正常细胞与肿瘤细胞相比, 只是P21 ras蛋白在细胞膜内侧的表达量存在差异, 在良性细胞检出P21 ras蛋白也就不奇怪, 同样, 因肿瘤细胞ras基因并非均存在突变, 部分肿瘤细胞不能检查P21 ras也属正常.
随着恶性肿瘤发病率的升高, 恶性胸/腹水不断增多. 细胞学检查是目前诊断恶性胸/腹水的主要手段, 但其敏感性低、经验性强, 难以满足临床需要, 人们一直在寻找有效的诊断新技术.
免疫化学染色可辅助常规细胞病理学诊断. 对胸/腹水脱落细胞进行免疫细胞化学染色, 检测肿瘤相关蛋白的表达, 对恶性脱落细胞的诊断及其与良性脱落细胞的鉴别有较大的价值, 成为近年来恶性胸/腹水诊断研究的热点.
目前, 利用P21ras蛋白进行免疫化学染色对恶性肿瘤积液的诊断尚未达成共识意见, 探索其对恶性浆膜腔积液的诊断价值具有较大的临床意义. 该文立意新颖, 材料与方法设计合理, 临床资料与结果可信, 统计学处理正确, 是一篇具有较高水平的论文.
编辑: 王晓瑜 电编:李琪
| 1. | Motherby H, Nadjari B, Friegel P, Kohaus J, Ramp U, Bocking A. Diagnostic accuracy of effusion cytology. Diagn Cytopathol. 1999;20:350-357. [PubMed] [DOI] |
| 2. | Politi E, Kandaraki C, Apostolopoulou C, Kyritsi T, Koutselini H. Immunocytochemical panel for distinguishing between carcinoma and reactive mesothelial cells in body cavity fluids. Diagn Cytopathol. 2005;32:151-155. [PubMed] [DOI] |
| 3. | Giehl K. Oncogenic Ras in tumour progression and metastasis. Biol Chem. 2005;386:193-205. [PubMed] [DOI] |
| 4. | Gulbis B, Galand P. Immunodetection of the p21-ras products in human normal and preneoplastic tissues and solid tumors: a review. Hum Pathol. 1993;24:1271-1285. [PubMed] [DOI] |
| 5. | Kuenen-Boumeester V, van Loenen P, de Bruijn EM, Henzen-Logmans SC. Quality control of immunocytochemical staining of effusions using a standardized method of cell processing. Acta Cytol. 1996;40:475-479. [PubMed] [DOI] |
| 10. | Comin CE, Novelli L, Boddi V, Paglierani M, Dini S. Calretinin, thrombomodulin, CEA, and CD15: a useful combination of immunohistochemical markers for differentiating pleural epithelial mesothelioma from peripheral pulmonary adenocarcinoma. Hum Pathol. 2001;32:529-536. [PubMed] [DOI] |
| 11. | Carella R, Deleonardi G, D'Errico A, Salerno A, Egarter-Vigl E, Seebacher C, Donazzan G, Grigioni WF. Immunohistochemical panels for differentiating epithelial malignant mesothelioma from lung adenocarcinoma: a study with logistic regression analysis. Am J Surg Pathol. 2001;25:43-50. [PubMed] [DOI] |
| 12. | Nomoto S, Nakao A, Kasai Y, Inoue S, Harada A, Nonami T, Takagi H. Peritoneal washing cytology combined with immunocytochemical staining and detecting mutant K-ras in pancreatic cancer: comparison of the sensitivity and availability of various methods. Pancreas. 1997;14:126-132. [PubMed] [DOI] |
| 13. | Chhieng DC, Yee H, Schaefer D, Cangiarella JF, Jagirdar J, Chiriboga LA, Jagirdar J, Chiriboga LA, Cohen JM. Calretinin staining pattern aids in the differentiation of mesothelioma from adenocarcinoma in serous effusions. Cancer. 2000;90:194-200. [PubMed] [DOI] |
| 14. | Ruíz-Godoy R LM, Garcia-Cuellar CM, Herrera González NE, Suchil BL, Pérez-Cárdenas E, Sácnchez-Pérez Y, Suárez-Roa ML, Meneses A. Mutational analysis of K-ras and Ras protein expression in larynx squamous cell carcinoma. J Exp Clin Cancer Res. 2006;25:73-78. [PubMed] |