修回日期: 2006-12-25
接受日期: 2007-01-04
在线出版日期: 2007-03-18
目的: 研究活血化瘀注射液I号(HHI-I)预处理与缺血预处理(ischemic preconditioning, IP)对大鼠肝脏缺血再灌注(ischemia and reperfusion, I/R)损伤的改善作用, 并比较两者的作用效果.
方法: 健康♂SD大鼠80只, 随机分为假手术对照组(Sham组)、缺血再灌注组 (I/R组)、缺血预处理组(IP组)、HHI-I预处理组(HHI-I组), 每组20只. 建立大鼠部分肝缺血模型, 各组在I/R后1、3、6、24 h分别取材, 测血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、乳酸脱氢酶(LDH)的水平; 取左肝测组织丙二醛(MDA)、超氧化物歧化酶(SOD)的含量. I/R后1 h RT-PCR检测肝组织中肿瘤坏死因子-α(TNF-α)和细胞间黏附分子-1(ICAM-1)mRNA的表达, I/R后3 h行组织学观察.
结果: I/R组、IP组、HHI-I组的ALT, AST, LDH活性、MDA值和TNF-α, ICAM-1 mRNA表达水平均明显高于Sham组. IP组、HHI-I组低于I/R组. HHI-I组所有时间点ALT, AST, LDH明显低于IP组(ALT: 2378.8±303.4 nkat/L vs 2840.6±248.4 nkat/L; AST: 2887.2±270.1 nkat/L vs 4567.6±275.1 nkat/L; LDH: 10550.4±710.1 nkat/L vs 12164.1±735.1 nkat/L; P均<0.05). HHI-I组MDA值明显低于IP组(17.35±1.39 nmol/g vs 21.66±1.84 nmol/g, P<0.05). HHI-I组TNF-α, ICAM-1 mRNA表达水平低于IP组(TNF-α: 0.54±0.06 vs 0.78±0.08; ICAM-1: 0.43±0.03 vs 0.69±0.11, P均<0.01). 各组SOD值均低于Sham组(P<0.05), IP组、HHI-I组均高于I/R组(P<0.05), HHI-I组SOD(1、3、6 h)明显高于IP组(136.00±12.50 nmol/g vs 124.70±9.32 nmol/g, P<0.05). Sham组光镜下肝小叶结构正常; I/R组肝小叶结构紊乱, 肝细胞水肿变性; IP组肝细胞水肿明显, 部分肝细胞变性; HHI-I组肝小叶结构基本正常, 肝细胞无明显水肿.
结论: HHI-I预处理与IP均可改善I/R对肝脏造成的损伤, 前者的效果优于后者. HHI-I的保护机制可能在于改善肝脏微循环, 减轻组织缺氧状态, 并通过抑制TNF-α和ICAM-1等细胞因子和细胞黏附分子的转录表达, 减少肝组织中中性粒细胞的浸润.
引文著录: 毕旭东, 郭伟, 赵晶, 赵连根, 付晓光. 活血化瘀注射液I号预处理与缺血预处理改善肝缺血再灌注损伤. 世界华人消化杂志 2007; 15(8): 831-837
Revised: December 25, 2006
Accepted: January 4, 2007
Published online: March 18, 2007
AIM: To investigate the effects of Huoxue Huayu injection I (HHI-I) pretreatment and ischemic preconditioning (IP) on hepatic ischemia and reperfusion (I/R) injury in rats and compare their efficacity.
METHODS: Eighty healthy adult male Sprague-Dawley rats were randomly and averagely divided into 4 groups: sham operation (SO) group, I/R group, ischemia preconditioning (IP) group, and HHI-I pretreatment group. After partial hepatic I/R model was made, the rats of each group were sacrificed to determine serum alanine aminotransferase (AST), alanine aminotransferase (ALT), lactate dehydrogenase (LDH), tissue malondialdehyde (MDA) and superoxide dismutase (SOD) level 1、3、6、24 h after reperfusion, respectively. Tissue tumor necrosis factor alpha (TNF-α) and intercellular adhesion molecule-1 (ICAM-1) mRNA levels were determined by reverse transcription-polymerase chain reaction after 1 h of reperfusion. Liver histology was observed after 3 h of reperfusion.
RESULTS: The activities of ALT, AST, LDH, the level of MDA, and the expression of TNF-α, ICAM-1 mRNA in I/R, IP, and HHI-I group were significantly higher than those in SO group, but they were markedly lower in IP and HHI-I group than those in I/R group. The activities of ALT, AST, LDH in HHI-I group were significantly lower than those in IP group (ALT: 2378.8 ± 303.4 nkat/L vs 2840.6 ± 248.4 nkat/L; AST: 2887.2 ± 270.1 nkat/L vs 4567.6 ± 275.1 nkat/L; LDH: 10550.4 ± 710.1 nkat/L vs 12164.1 ± 735.1 nkat/L; all P < 0.05). As compared with that in the IP group, the level of MDA in HHI-I group was decreased at the 3rd and 6th hour (17.35 ± 1.39 nmol/g vs 21.66 ± 1.84 nmol/g, P < 0.05), and the mRNA expression of TNF-α and ICAM-1 were decreased (TNF-α: 0.54 ± 0.06 vs 0.78 ± 0.08; ICAM-1: 0.43 ± 0.03 vs 0.69 ± 0.11, both P < 0.01). The level of SOD in I/R, IP and HHI-I group was markedly lower than that in SO group (P < 0.05), but it was significantly higher in IP and HHI-I group than that in I/R group (P < 0.05). The SOD level in the animals received HHI-I was significantly increased in comparison with that in IP group (136.00 ± 12.50 nmol/g vs 124.70 ± 9.32 nmol/g, P < 0.05). Microscopy showed that liver injury in the HHI-I-treated animals and IP-treated animals were attenuated as compared with that in I/R group.
CONCLUSION: HHI-I and IP pretreatment can alleviate I/R-induced liver injury, and the former is superior to the latter. The protective mechanism of HHI-I may be associated with the improvement of liver microcirculation, elimination of tissue anoxia, transcription inhibition of cytokine and cell adhesion molecule such as TNF-α and ICAM-1, and decrease of neutrophil infiltration.
- Citation: Bi XD, Guo W, Zhao J, Zhao LG, Fu XG. Effects of Huoxue Huayu injection I pretreatment and ischemic preconditioning on liver ischemia and reperfusion injury in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(8): 831-837
- URL: https://www.wjgnet.com/1009-3079/full/v15/i8/831.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i8.831
临床外科实践中常把肝血流暂时阻断以保证手术顺利进行, 当恢复血流再灌注时, 肝脏组织细胞发生了一系列代谢、结构和功能的紊乱, 临床上称之为缺血再灌注(I/R)损伤(IRI). 他直接影响到疾病的预后、手术成功率和患者存活率. 因此, 对肝脏缺血再灌注损伤作用机制及防治措施的研究, 具有重要的临床意义. 目前, 肝脏IRI防护常用的方法有两类, 即缺血预处理(ischemia preconditioning, IP)和药物预处理. IP即在长时间的缺血前行几次短暂的IR过程, 调动机体内源性抗损伤机制, 使肝脏耐受更长时间的缺血. 药物预处理是指利用某些活性物质直接或间接的药理作用来达到类似缺血预处理的保护作用[1], 增强组织或细胞对缺血再灌注损伤的耐受性, 从而减轻损伤[2]. 国内研究证实, 一些活血化瘀中药对脏器缺血再灌注损伤具有保护作用[3]. 活血化瘀注射液Ⅰ号(HHI-Ⅰ)的有效成分是杏仁提取物, 具有很强的活血化瘀作用, 他能改善急性坏死性胰腺炎时胰腺和肠系膜的微循环增加局部血流量[4]. 大鼠肾脏缺血再灌注时应用HHI-Ⅰ亦能改善肾脏微循环, 对造模动物具有保护作用[5]. 本实验研究活血化瘀中药HHI-Ⅰ预处理对于肝脏缺血再灌注损伤的防治的效果, 并与IP的作用相比较, 以探求防治肝脏缺血再灌注损伤的最佳方法, 为将来临床肝脏切除和移植过程中IRI的预防打下坚实的理论基础.
清洁级健康♂ SD大鼠(由辽宁医学院实验动物中心提供)80只, 体质量200-220 g, 随机分成4组, 每组20只. TGLL-18 g型台式高速冷冻离心机, JY92-Ⅱ超声波细胞粉粹机, DY89-Ⅰ型电动玻璃匀浆机, SHZ-88水浴恒温振荡器, UV751GD紫外/可见分光光度仪, 日立7170A型全自动生化分析仪, GeneAmp PCR system 9700, EPS 301 Power Supply电泳仪, 全自动凝胶成像系统, LKB-V超薄切片机, RM-2135组织切片机, OLYMPUS万能显微镜照相机. Taq E, PCR Buffer, MgCl2(Promega), TRIzol、DNA反转录试剂盒(Invitrogen), 丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)试剂盒购于南京建成生物工程研究所. HHI-Ⅰ: 天津市中西医结合急腹症研究所赵连根研究员提供HHI-Ⅰ提取物粉末, 使用前加入无菌生理盐水配成浓度为30 g/L的注射液. DEPC (Sigma). PCR引物用Primer 3.0(http://www-genome.wi.mit.edu/cgi-bin/primer/primer3.cgi)设计, 上海基康公司合成. 本研究所用引物名称、序列及其相关实验见表1.
| 基因 | 基因库序列号 | 位点 | 引物序列 | 产物大小(bp) |
| β-actin | NM_031144 | F | 5'-AGCCATGTACGTAGCCATCC-3' | 228 |
| R | 5'-CTCTCAGCTGTGGTGGTGAA-3' | |||
| ICAM-1 | NM_012967 | F | 5'-GGGGAAAGATCATACGGGTT-3' | 241 |
| R | 5'-TTTAGGCATGGTGGTTGACA-3' | |||
| TNF-α | NM_012675 | F | 5'-CTCTTCAAGGGACAAGGCTG-3' | 185 |
| R | 5'-TGGAAGACTCCTCCCAGGTA-3' |
SD大鼠术前12 h禁食, 自由饮水. 术前100 g/L水合氯醛3.0 mL/kg ip麻醉. I/R组: 腹正中切口, 按Yoshidome et al[6]法, 分离出肝十二指肠韧带, 用无损伤动脉夹将肝中叶和左侧叶的动脉、门静脉和胆管一并阻断, 造成70%肝脏缺血模型, 40 min后移走动脉夹恢复灌流, 缺血前5 min分别自阴茎背静脉缓慢注射生理盐水(10 mL/kg). Sham组: 单纯麻醉和开腹, 分离出肝十二指肠韧带, 仅暴露肝中叶和左侧叶的肝蒂, 不进行阻断, 余同I/R组. IP组: 在实验前先将肝中叶和左侧叶的动脉、门静脉和胆管一并阻断缺血5 min, 然后开放血流5 min, 反复2次, 余同I/R组. HHI-Ⅰ组: 缺血前5 min自阴茎背静脉缓慢注射HHI-Ⅰ(10 mL/kg), 余同I/R组.
1.2.1 肝脏酶学和MDA, SOD实验指标的检测: 各组在1、3、6、24 h分别处死5只动物, 下腔静脉采血约4 mL, 注入离心管, 置于37 ℃温水中20 min, 2500 r/min离心30 min, 提取血清标本-20 ℃保存待测; 取左肝固定部位的组织, 置于-80 ℃冰箱保存. 取血清1 mL全自动生化分析仪测血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、乳酸脱氢酶(LDH)水平. 分别采用硫代巴比妥酸比色法和黄嘌呤氧化酶法测定MDA, SOD.
1.2.2 肝组织肿瘤坏死因子α(TNF-α), 细胞间黏附分子-1(ICAM-1)的RT-PCR检测: (1)总RNA的提取: 1 g组织置入液氮中磨成细粉, 刮入管内, 加10 mL TRIzol. 高速匀浆机打成匀浆. 9900 r/min(12000 g)离心10 min(4 ℃), 倒出上清. 加2 mL氯仿, 剧烈摇荡15 s, 室温2-3 min. 9900 r/min离心15 min(4 ℃), 小心吸出上清. 加5 mL异丙醇, 室温10 min. 8600 rpm(9000 g)离心10 min(4 ℃), 保留沉淀物. 加10 mL 75 mL/L乙醇, 7600 r/min(7000 g)离心5 min(4 ℃), 保留沉淀物. 室温5-10 min, 加适量消毒过的DEPC H2O溶解RNA. 取少量Total RNA进行变性胶电泳. (2)反转录: 经DNase I处理过的组织总RNA 9 mL(4-5 mg)和Oligo dT 1 mL混合, 72 ℃ 5 min, 冰上10 min; 加入8 mL反转录混合液(10×RT Buffer 2 mL, 25 mmol/L MgCl2 2 mL, 10 mmol/L dNTPs 1 mL, 0.1 mmol/L DTT 2 mL, RNase inhibitor 1 mL), PCR仪42 ℃ 5 min, 加入1 mL(50 U)SuperScript Ⅱ反转录酶, 42 ℃反应50 min; 70 ℃ 15 min终止反应, 置于冰上; 加入1 mL RNase H, 37 ℃ 20 min. C: PCR: 取逆转录产物1 mL, 10 mmol/L dNTP 0.5 mL, 25 mmol/L MgCl2 2 mL, 5 U/mL Taq聚合酶0.1 mL, 10×Reaction Buffer 2.5 mL, 6 pmol引物. 反应条件为94 ℃ 4 min; 94 ℃ 30 s, 62 ℃ 30 s, 72 ℃ 30 s, 30个循环; 72 ℃ 3 min. β-actin作为内参照标准. D: PCR产物溴乙锭染色, 2 g/L琼脂糖凝胶电泳, 全自动凝胶成像系统分析.
1.2.3 组织学检查: 取甲醛固定肝组织, 梯度酒精脱水(700, 800, 900, 950 mL/L Ⅰ, Ⅱ, 1000 mL/L Ⅰ, 1000 mL/L Ⅱ), 二甲苯透明、浸腊包埋后切片(5 mm), HE染色, 显微镜下观察.
统计学处理 利用统计软件SPSS11.0处理分析数据: 对各组同一时间点的同一指标采用多个样本均数的两两比较的方差分析, 文中所有数据均用均数±标准差表示(mean±SD).
I/R组各时点AST, ALT和LDH值明显高于Sham组、IP组和HHI-I组, IP组和HHI-I组各时点AST, ALT和LDH值明显高于Sham组, IP组明显高于HHI-Ⅰ组(表2, 表3, 表4).
I/R组、HHI-Ⅰ组和IP组各时间点SOD值均低于Sham组(P<0.05), HHI-Ⅰ组和IP组各时间点均高于I/R组(P<0.05), HHI-Ⅰ组SOD(1、3、6 h)明显高于IP组(P<0.05). 再灌注后MDA值均升高, HHI-Ⅰ组和IP组各时间点均低于I/R组(P<0.05), HHI-Ⅰ组MDA(3, 6 h)明显低于IP组(P<0.05)(表5).
| 分组 | MDA | SOD | ||||||
| 1 h | 3 h | 6 h | 24 h | 1 h | 3 h | 6 h | 24 h | |
| Sham | 7.32±0.53 | 7.58±0.62 | 7.50±0.60 | 7.47±0.73 | 182.50±13.10 | 181.70±10.20 | 183.70±10.20 | 185.5±7.89 |
| I/R | 13.80±1.19b | 20.72±1.34b | 28.70±2.29b | 16.07±1.738b | 144.10±8.03b | 134.50±7.45b | 110.80±9.82b | 129.9±4.98b |
| IP | 11.75±1.22bc | 17.48±1.71bc | 21.66±1.84bc | 12.77±1.45bc | 154.60±8.70b | 140.90±6.35b | 124.70±9.32bc | 141.6±7.74bc |
| HHI-I | 10.45±1.31bc | 14.49±1.89bce | 17.35±1.39bce | 11.58±2.32bc | 169.50±5.60ce | 156.20±9.88bce | 136.00±12.50bce | 149.8±8.98bc |
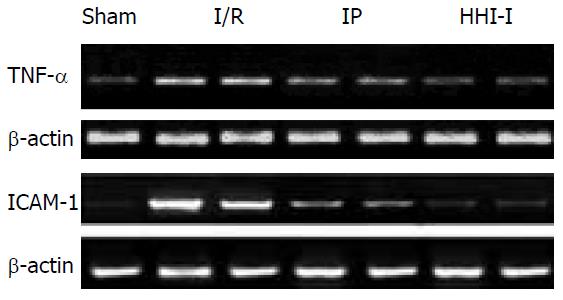
缺血再灌注1 h后大鼠1 g肝组织中提取总RNA, 用RT-PCR的方法进行半定量分析. TNF-α, ICAM-1 mRNA表达量均较Sham组增高, 但IP组、HHI-Ⅰ组均低于I/R组, HHI-Ⅰ组低于IP组(P<0.01, 图1, 表6).
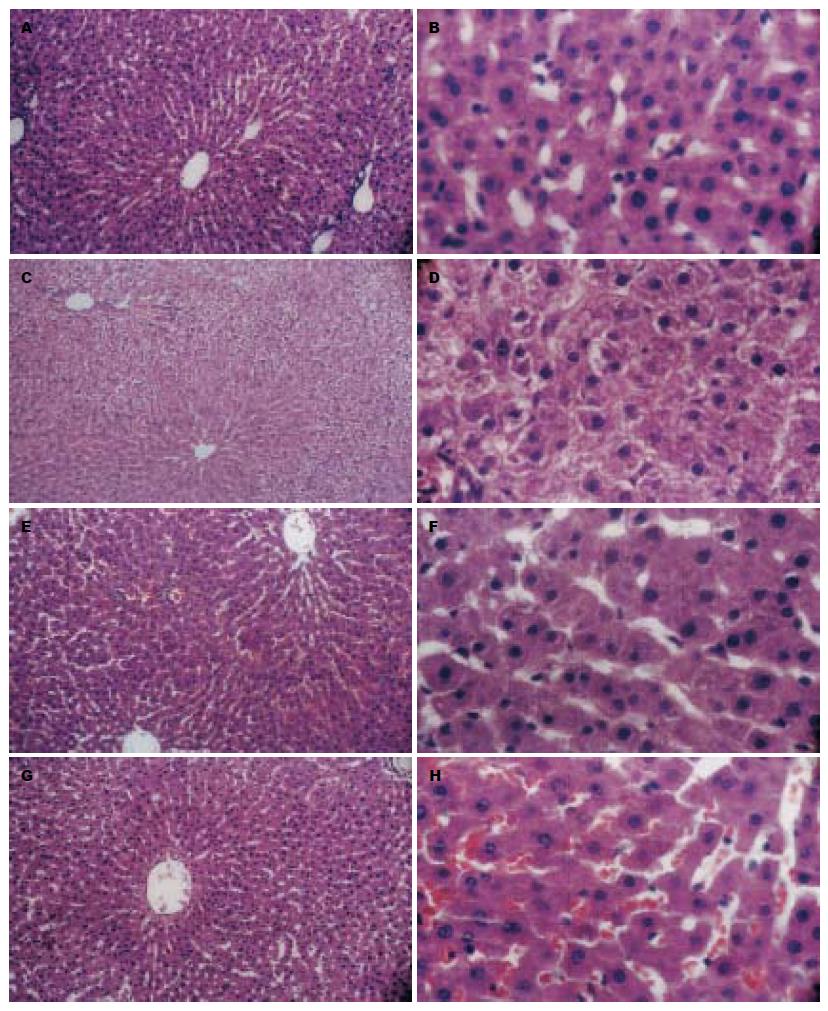
I/R后3 h, 肝组织切片HE染色光镜观察见图2.
肝脏缺血再灌注损伤的发生机制十分复杂[7-8], 大多数学者认为, 再灌注后细胞因子的过表达、钙超载与氧自由基的大量形成是造成肝脏缺血再灌注损伤的主要原因. 缺血缺氧使细胞能量代谢从有氧化转为无氧代谢为主, 利用糖类减少而脂肪酸供能增多, 无氧糖酵解和脂肪酸代谢的产物也对细胞有损害作用[9]. 目前认为, 肝脏缺血再灌注损伤经历两个阶段[10]: 初期是由活化的枯否细胞释放的大量氧自由基和TNF-α、IL-1等细胞因子对肝细胞的直接损害; 后期是中性粒细胞介导的炎性损伤.
缺血再灌注导致氧自由基大量产生, 同时SOD活性降低. 氧自由基对细胞的主要损害是造成脂质过氧化, MDA的产生与脂质过氧化相平行. SOD是机体清除氧自由基的重要酶, 测定其活性高低可反应机体清除自由基的能力, 而测定MDA的高低可间接反映出细胞损伤的程度. 机体在缺氧时无氧代谢加强, 乳酸含量激增, 从而引起LDH反应性增高. 血清ALT和AST水平则是反映肝损伤程度的灵敏指标. 本实验结果证实, 肝脏I/R后肝小叶结构消失, 细胞肿胀水样变性. HHI-Ⅰ预处理和IP对肝脏IRI均具有防治作用, HHI-Ⅰ预处理的效果优于IP.
微循环障碍在肝IRI的发病机制中具有重要作用, 并决定最终肝组织的损伤程度[11]. 再灌注早期阶段, 白细胞流速减缓, 其与内皮细胞及kupffer细胞的接触率上升, 导致白细胞淤滞、肝血窦网中的血流障碍[12]. 缺血区肝脏的低氧期延长, 激活Kupffer细胞和中性粒细胞[13], 合成分泌大量黏附分子、细胞因子及氧自由基, 加重肝脏微循环障碍及肝脏损伤[11,14-16]. 在肝脏缺血早期由于HHI-Ⅰ的活血化瘀功能减少了血小板在血窦内聚集, 减轻了内皮细胞肿胀和血管收缩, 降低了白细胞的附壁率及枯否细胞和中性粒细胞激活率, 从而减少了炎性细胞因子和氧自由基的产生. 因此HHI-Ⅰ可能改善了肝脏微循环、改善了缺氧状态, 从而从源头上减轻了缺血再灌注对肝脏的损伤.
缺血时肝细胞受损, 引起细胞内Ca2+超载, 在再灌注时Ca2+超载加重. Kupffer细胞因Ca2+超载而活化, 分泌释放大量TNF-α[17]. TNF-α的过表达引起大量肝细胞的损害[18], 直接导致肝窦内皮细胞肿胀、肝血窦微循环障碍, 并激发Kupffer细胞产生过氧化物, 引起肝细胞的炎性坏死. 肝I/R时内皮细胞被激活导致ICAM-1表达迅速增加[19], 与中性粒细胞表面b2-整合素受体相结合, 参与白细胞在血管内皮上的滚动、黏附、移行及渗出过程[20-22], 造成中性粒细胞的大量浸润. 抗ICAM-1单抗可显著减少缺血后白细胞与内皮细胞的黏附[23], 显著减轻肝组织损伤. 而ICAM-1表达缺陷的小鼠I/R损伤程度显著轻于普通对照组小鼠[24]. 可见ICAM-1通过介导中性粒细胞和内皮细胞的黏附在IRI中起着重要作用. 肝I/R后TNF-α释放的激增也诱导ICAM-1等细胞黏附分子的表达明显增加[26], 用TNF-α的抗体阻断TNF-α后肝内ICAM-1和中性粒细胞的数量均下降[27]. TNF-α和细胞黏附分子相互作用, 进一步加重了肝脏的损伤. HHI-Ⅰ能够通过抑制上述细胞因子和细胞黏附分子的转录表达, 减轻肝组织中中性粒细胞的浸润, 从而减轻缺血再灌注对大鼠肝脏的损害, 这有可能是HHI-Ⅰ的作用机制所在.
肝组织经短暂的重复缺血能增加对缺血的耐受性, 减轻随后持续长时间缺血造成的损伤. IP涉及的机制尚不完全清楚, 可能是由于前期I/R刺激调动了机体内源性抗损伤保护机制, 使机体对缺血损伤发生主动性适应反应[28]. IP除了即刻出现的保护作用外, 还有IP后12-72 h的延迟保护作用. 本研究证实IP对肝脏缺血再灌注损伤具有保护作用, 抑制ICAM-1和TNF-α mRNA的表达, 但临床实施比较困难.
减轻肝脏缺血再灌注损伤, 可从多方面、多角度着手, 其中药物预处理因操作简单、作用环节多、效果可能优于缺血预处理[29]而具有非常广阔的应用前景. 中药安全范围大, 毒副作用小, 这为临床肝缺血再灌注损伤的防治提供了新的思路[30-31]. 对HHI-Ⅰ进行深入研究, 明确其作用机制及具体环节, 将为临床肝脏切除和移植过程中IRI的防治打下坚实的理论基础, 具有广泛的临床应用前景和价值.
肝脏缺血再灌注损伤是肝脏外科手术和肝移植后常见的病理生理过程, 导致肝脏缺血再灌注损伤的原因众多, 确切机制目前仍不十分清楚. 目前, 人们认为肝脏缺血再灌注损伤是许多不同的机制相互作用的结果, 因此其防护也就有各种不同的方法. 对其机制及防治措施的研究具有重要的临床意义, 已成为肝脏移植领域的研究热点.
HHI-I已制成单体, 并获国家专利保护, 他能明显抑制出血坏死性胰腺炎发病过程中白细胞募集、浸润和黏附, 我们首次将其用于肝脏缺血再灌注损伤的防护.
在经过临床试验后, 将HHI-I申报国家新药, 进行批量生产, 应用于临床肝脏切除和肝脏移植中肝缺血再灌注损伤的防护, 减少术中、术后肝功能障碍的发生, 促进肝切除和肝脏移植患者尽快的康复.
缺血预处理: 肝组织经短暂的重复缺血能增加对缺血的耐受性, 减轻随后持续长时间缺血造成的损伤;
药物预处理: 利用某些活性物质直接或间接的药理作用来达到类似缺血预处理的保护作用, 增强组织或细胞对缺血再灌注损伤的耐受性, 从而减轻损伤.
本文通过观察认为, HHI-I对肝脏缺血再灌注损伤具有保护作用, 具体机制可能与其改善微循环的作用有关, 文章方法可靠, 结果可信, 有一定的指导意义.
编辑: 张焕兰 电编:李琪
| 2. | Yoshizumi T, Yanaga K, Soejima Y, Maeda T, Uchiyama H, Sugimachi K. Amelioration of liver injury by ischaemic preconditioning. Br J Surg. 1998;85:1636-1640. [PubMed] [DOI] |
| 5. | 毕 旭东, 崔 乃强, 赵 晶, 赵 连根. 活血化瘀注射液Ⅰ号对大鼠肾脏低温保存时超微结构及移植肾功能的影响. 中国中西医结合外科杂志. 2002;8:331-334. |
| 6. | Yoshidome H, Kato A, Edwards MJ, Lentsch AB. Interleukin-10 suppresses hepatic ischemia/reperfusion injury in mice: implications of a central role for nuclear factor kappaB. Hepatology. 1999;30:203-208. [PubMed] [DOI] |
| 7. | Morioka D, Kubota T, Sekido H, Matsuo K, Saito S, Ichikawa Y, Endo I, Togo S, Shimada H. Prostaglandin E1 improved the function of transplanted fatty liver in a rat reduced-size-liver transplantation model under conditions of permissible cold preservation. Liver Transpl. 2003;9:79-86. [PubMed] [DOI] |
| 8. | Shah V, Kamath PS. Nitric oxide in liver transplantation: pathobiology and clinical implications. Liver Transpl. 2003;9:1-11. [PubMed] [DOI] |
| 10. | Peralta C, Prats N, Xaus C, Gelpí E, Roselló-Catafau J. Protective effect of liver ischemic preconditioning on liver and lung injury induced by hepatic ischemia-reperfusion in the rat. Hepatology. 1999;30:1481-1489. [PubMed] [DOI] |
| 11. | Uhlmann D, Pietsch UC, Ludwig S, Hess J, Armann B, Gaebel G, Escher E, Schaffranietz L, Tannapfel A, Fiedler M. Assessment of hepatic ischemia-reperfusion injury by simultaneous measurement of tissue pO2, pCO2, and pH. Microvasc Res. 2004;67:38-47. [PubMed] [DOI] |
| 12. | Vollmar B, Richter S, Menger MD. Leukocyte stasis in hepatic sinusoids. Am J Physiol. 1996;270:G798-G803. [PubMed] |
| 14. | Cutrn JC, Perrelli MG, Cavalieri B, Peralta C, Rosell Catafau J, Poli G. Microvascular dysfunction induced by reperfusion injury and protective effect of ischemic preconditioning. Free Radic Biol Med. 2002;33:1200-1208. [PubMed] [DOI] |
| 15. | Serracino-Inglott F, Habib NA, Mathie RT. Hepatic ischemia-reperfusion injury. Am J Surg. 2001;181:160-166. [PubMed] [DOI] |
| 16. | Fondevila C, Busuttil RW, Kupiec-Weglinski JW. Hepatic ischemia/reperfusion injury--a fresh look. Exp Mol Pathol. 2003;74:86-93. [PubMed] [DOI] |
| 19. | Zhou T, Sun GZ, Zhang MJ, Chen JL, Zhang DQ, Hu QS, Chen YY, Chen N. Role of adhesion molecules and dendritic cells in rat hepatic/renal ischemia-reperfusion injury and anti-adhesive intervention with anti-P-selectin lectin-EGF domain monoclonal antibody. World J Gastroenterol. 2005;11:1005-1010. [PubMed] [DOI] |
| 20. | Hess DC, Howard E, Cheng C, Carroll J, Hill WD, Hsu CY. Hypertonic mannitol loading of NF-kappaB transcription factor decoys in human brain microvascular endothelial cells blocks upregulation of ICAM-1. Stroke. 2000;31:1179-1186. [PubMed] [DOI] |
| 21. | El-Wahsh M, Seifalian AM, Fuller BJ, Rolles K, Davidson BR. Induction of adhesion molecule expression in liver ischaemia-reperfusion injury is associated with impaired hepatic parenchymal microcirculation. Br J Surg. 2004;91:1034-1039. [PubMed] [DOI] |
| 22. | Werner J, Z'graggen K, Fernández-del Castillo C, Lewandrowski KB, Compton CC, Warshaw AL. Specific therapy for local and systemic complications of acute pancreatitis with monoclonal antibodies against ICAM-1. Ann Surg. 1999;229:834-840; discussion 841-842. [PubMed] [DOI] |
| 23. | Vollmar B, Glasz J, Menger MD, Messmer K. Leukocytes contribute to hepatic ischemia/reperfusion injury via intercellular adhesion molecule-1-mediated venular adherence. Surgery. 1995;117:195-200. [PubMed] [DOI] |
| 24. | Yadav SS, Howell DN, Gao W, Steeber DA, Harland RC, Clavien PA. L-selectin and ICAM-1 mediate reperfusion injury and neutrophil adhesion in the warm ischemic mouse liver. Am J Physiol. 1998;275:G1341-G1352. [PubMed] |
| 25. | Kobayashi A, Imamura H, Isobe M, Matsuyama Y, Soeda J, Matsunaga K, Kawasaki S. Mac-1 (CD11b/CD18) and intercellular adhesion molecule-1 in ischemia-reperfusion injury of rat liver. Am J Physiol Gastrointest Liver Physiol. 2001;281:G577-G585. [PubMed] |
| 26. | Bumgardner GL, Li J, Apte S, Heininger M, Frankel WL. Effect of tumor necrosis factor alpha and intercellular adhesion molecule-1 expression on immunogenicity of murine liver cells in mice. Hepatology. 1998;28:466-474. [PubMed] [DOI] |
| 27. | Colletti LM, Cortis A, Lukacs N, Kunkel SL, Green M, Strieter RM. Tumor necrosis factor up-regulates intercellular adhesion molecule 1, which is important in the neutrophil-dependent lung and liver injury associated with hepatic ischemia and reperfusion in the rat. Shock. 1998;10:182-191. [PubMed] [DOI] |
| 28. | Yamagami K, Yamamoto Y, Kume M, Kimoto S, Yamamoto H, Ozaki N, Yamamoto M, Shimahara Y, Toyokuni S, Yamaoka Y. Heat shock preconditioning ameliorates liver injury following normothermic ischemia-reperfusion in steatotic rat livers. J Surg Res. 1998;79:47-53. [PubMed] [DOI] |