修回日期: 2007-01-03
接受日期: 2007-01-10
在线出版日期: 2007-03-18
目的: 探讨人血管生成素-1(angiopoietin-1, Ang1)对胃癌细胞MGC-803增殖与凋亡的影响, 研究其生物学作用及其在肿瘤发生中的作用机制.
方法: 以人胚肾293细胞对重组质粒Ad-Ang1和Ad-GFP进行包装、扩增和纯化后转导MGC-803细胞, 应用MTT比色法分析Ang1对该胃癌细胞增殖的影响, 通过流式细胞仪分析血浆Ang1对胃癌细胞凋亡的影响, 并通过免疫组织化学法检测Ang1及其受体Tie-2的表达情况.
结果: 成功包装、扩增及纯化了重组腺病毒Ad-Ang1及对照病毒Ad-GFP, 其感染滴度分别为2.0×1012和1.15×1013 PFU/L. 当感染复数(MOI)为20时转导率即接近100%, 而细胞形态无明显改变. MTT结果显示, 24, 48和72 h时Ad-Ang1组吸光度均明显高于Ad-GFP组及对照组(Ad-GFP vs Ad-Ang1: 24 h, t = 16.32, P<0.0001; 48 h, t = 10.47, P = 0.0005; 72 h, t = 24.59, P<0.0001. 对照组 vs Ad-Ang1: 24 h, t = 10.54, P = 0.0005; 48 h, t = 13.92, P = 0.0002; 72 h, t = 22.46, P<0.0001), Ad-GFP组与对照组相比无差别; 流式细胞仪检测显示, 对照组、Ad-GFP组和Ad-Ang1组的凋亡率(%)分别为: 9.90±0.62, 10.07±1.27和4.17±0.35; 免疫组化显示, 3组细胞均有不同程度Ang-1及其受体Tie-2的表达, 且其阳性表达率在Ang1基因转染组(Ang-1: 99.2±0.8; Tie-2: 85.4±1.8)显著高于对照组(Ang-1: 51.0±2.7; Tie-2: 30.8±1.5)和GFP组(Ang-1: 51.4±1.5; Tie-2: 32.4±2.3)(P<0.0001).
结论: Ang1能显著促进人胃癌细胞MGC-803体外增殖, 抑制血浆饥饿时的凋亡.
引文著录: 颜芳, 欧希龙, 关云艳, 产松苗, 陈国胜, 杨柳, 孙为豪. 血管生成素-1基因对人胃癌细胞增殖与凋亡的影响. 世界华人消化杂志 2007; 15(8): 824-830
Revised: January 3, 2007
Accepted: January 10, 2007
Published online: March 18, 2007
AIM: To explore the effect of angiopoietin-1 (Ang1) gene on the proliferation and apoptosis of human gastric cancer cell line MGC-803.
METHODS: The replication-deficient adenovirus carrying human angiopoietin-1 (Ad-Ang1) and green fluorescent protein (Ad-GFP) were packaged, amplified and purified in human embryonic kidney cells 293 (HEK293). Then gastric cancer cell line MGC-803 was transfected with the resultant adenoviruses. The proliferation and apoptosis of MGC-803 cells were measured by MTT colorimetry and flow cytometry, respectively. The expression of Ang1 and its receptor (Tie-2) were detected by immunohistochemistry.
RESULTS: The recombinant adenovirus vector carrying Ang1 or GFP were amplified and purified successfully with the viral titers of 1.15 ×1013 and 2.0×1012 PFU/L, respectively. The transfection rate almost reached 100% when the multiplicity of infection (MOI) was 20. The proliferation of MGC-803 cells in Ad-Ang1-transfected group was markedly higher than that in Ad-GFP-transfected group (24 h: t = 16.32, P < 0.0001; 48 h: t = 10.47, P = 0.0005; 72 h: t = 24.59, P < 0.0001) and control group (24 h: t = 10.54, P = 0.0005; 48 h: t = 13.92, P = 0.0002; 72 h: t = 22.46, P < 0.0001). The apoptotic rate of Ag-Ang1-transfected MGC-803 cells was obviously lower than that of Ag-GFP-transfected ones (t = 7.73, P = 0.0015), but there was no difference between Ag-GFP group and control group. The positive rates of Ang1 and Tie-2 expression were significantly higher in Ad-Ang1-transfected cells (Ang-1: 99.2 ± 0.8; Tie-2: 85.4 ± 1.8) than those in the control (Ang-1: 51.0 ± 2.7; Tie-2: 30.8 ± 1.5) and Ag-GFP-transfected ones (Ang-1: 51.4 ± 1.5; Tie-2: 32.4 ± 2.3), respectively (P < 0.0001).
CONCLUSION: Ang1 gene may obviously promote the proliferation and inhibit the apoptosis of human gastric cancer cell line MGC-803.
- Citation: Yan F, Ou XL, Guan YY, Chan SM, Chen GS, Yang L, Sun WH. Effect of angiopoietin-1 gene on the proliferation and apoptosis of human gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2007; 15(8): 824-830
- URL: https://www.wjgnet.com/1009-3079/full/v15/i8/824.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i8.824
管生成素(angiopoietin, Ang)及其受体Tie-2是继VEGF后新发现的与肿瘤转移, 血管生成、重塑密切相关的分子[1]. 血管生成素包括Ang1, Ang2, Ang3和Ang4等[2-3], 目前, Ang-1与在肿瘤生长中的作用结果尚有争议. 为研究Ang1对胃癌细胞有无影响, 我们以腺病毒为载体, 将Ang1基因转染至MGC-803细胞, 并研究其对该胃癌细胞株增殖和凋亡的影响.
人胃腺癌细胞株MGC-803购自中科院; 人胚肾293细胞购自Microbix Biosystems公司; 复制缺陷型腺病毒重组体Ad-Ang1及对照病毒Ad-GFP由南京医科大学第一附属医院构建[4]并赠送. PacI, LipofectAmine 2000试剂盒分别购自NEB公司和Gibco公司. Ang1一抗, Tie-2一抗购自北京莱博, 工作浓度分别为1:100和1:50, 免疫组化SP试剂盒及DAB试剂盒购自北京中山公司, Annexin V-FITC/PI试剂盒购自Bender Medsystems公司.
1.2.1 病毒颗粒的包装与扩增: 取对数生长期的293细胞接种于100 mm直径的培养皿中, 以含100 mL/L胎牛血清, 105 U/L青霉素和100 mg/L链霉素的RPMI1640培养基培养. 当细胞生长度达60%-70%时, 换无血清无抗生素的RPMI-1640培养. 将以PacI酶切回收的线性化的Ad-Ang1 1 mg通过Lipofectamine2000转染至293细胞内, 同时以Ad-GFP(编码绿色荧光蛋白的复制缺陷型腺病毒重组体)做平行对照. 观察出现细胞病理反应(cytopathic effect, CPE)后收取细胞上清, 再以细胞上清转染更多的293 细胞. 重组病毒在293细胞中呈几何级数包装扩增, 收集足够多的293细胞备用.
1.2.2 病毒颗粒的纯化: 将收集的293细胞以PBS悬浮, 将其于液氮/37 ℃反复冻融3次, 收集细胞裂解液. 在超速离心管中依次加入CsC l1.4, CsC l1.2及细胞裂解液, 以100000 g离心2 h, 在1.345密度附近可见腺病毒浓缩带, 穿刺离心管侧壁, 将目的条带吸出, 经12000-14000 kDa孔径透析袋透析纯化, 浓缩纯化的病毒颗粒再经0.45 mm孔径滤膜过滤, 分装保存备用.
1.2.3 生物活性滴度测定: 按Quantum公司提供的试剂盒说明书步骤, 采用组织培养半数感染剂量法(TCID50)测定Ad-Ang1的生物活性. 以1×104个/孔接种293细胞于96孔板, 待细胞密度约90%后, 倍比稀释病毒上清、分别以不同稀释浓度 100 mL病毒溶液转染细胞, 以20 mL/L胎牛血清的培养基培养10 d后倒置显微镜下观察, 计算每一排中出现CPE的孔数, 按公式T = 10(S+3.8) PFU/L计算滴度值.
1.2.4 腺病毒体外转导效率的测定(MOI试验): MGC-803细胞以8000个/孔接种于96孔板培养至60%-70%细胞贴壁时, 分别以感染复数(病毒颗粒/细胞数)为10, 20, 30, 50, 100 Ad-GFP 100 mL感染细胞, 8 h后换含100 mL/L胎牛血清的RPMI1640培养液继续培养, 48 h后在荧光显微镜下计数, 随机计算3个表达GFP的细胞数占视野中所有细胞的百分数, 取均值代表转导效率.
1.2.5 MTT法测定Ang1对MGC-803细胞增殖的影响: 实验分对照组(正常细胞组)、Ad-GFP(平行对照组)、Ad-Ang1(Ang1转染组)3组, 每组设3个复孔. 取对数生长期的MGC-803细胞, 以8000个/孔接种细胞于96孔培养板中, 细胞生长度达60%-70%时对Ad-GFP、Ad-Ang1两组予相应的无血清无抗生素培养液稀释的病毒液100 mL感染, 感染8 h后换RPMI1640完全培养液继续培养. 分别于感染后24, 48和72 h定每孔吸光度(A值).
1.2.6 流式细胞仪检测转导Ang1基因对MGC-803凋亡的影响: 根据Harfouche et al[5]的方法进行. 以每孔1.0×108/L的MGC-803接种于6孔板, 实验分组同MTT, 每组设3个复孔, 感染8 h后用无血清培养液继续培养48 h后收集对照组、Ad-GFP及Ad-Ang1组MGC-803细胞1.0×109/L, 1000 r/min, 4 ℃离心10 min, 弃上清, 加入1 mL冷的PBS, 轻轻震荡使细胞悬浮. 1000 r/min, 4 ℃离心10 min, 弃上清. 重复用冷的PBS洗两次. 将细胞重悬于200 μL结合缓冲液. 加入10 μL Annexin V-FITC和5 μL PI, 轻轻混匀, 避光室温反应15 min. 加入300 μL结合缓冲液, 在1 h内上机检测细胞的凋亡率.
1.2.7 应用免疫细胞化学方法检测Tie-2, Ang1在MGC-803细胞中的表达: 取对数生长期的MGC-803细胞, 消化后计数并调整培养液用量, 使细胞悬液终浓度为1.0×108/L, 接种至底部有小玻片的6孔板中, 每孔2 mL细胞悬液, 置孵育箱中培养. 次日, 细胞在小玻片上贴壁生长约60%融合, 分别于两孔中加入Ad-GFP、两孔中加入Ad-Ang1的无血清无抗生素培养液稀释的病毒液1 mL感染, 感染8 h后换RPMI1640完全培养液继续培养. 两孔中不加病毒作为对照组. 再于48 h后取出小玻片用丙酮固定. PBS缓冲液冲洗, 30 mL/L双氧水灭活内源性过氧化酶, 微波抗原热修复后正常山羊血清封闭, 一抗4 ℃过夜孵育, 二抗30 min, DAB显色, 复染核、脱水、透明, 中性树胶封片. 用PBS代替一抗作阴性对照, 已知阳性片作阳性对照. 胞质或胞膜见棕黄色颗粒为阳性. 在200倍显微镜下随机取5个视野细胞计数, 细胞阳性表达率 = 阳性细胞数/总细胞数×100%.
统计学处理 实验结果以均数±标准差(mean±SD)表示, 均数间比较采用t检验. 所有数据均采用SAS8.2统计软件进行分析, P<0.05表示有显著差异.
Ad-GFP的滴度为2.0×1012 PFU/L, Ad-Ang1滴度为3.2×1013 PFU/L.
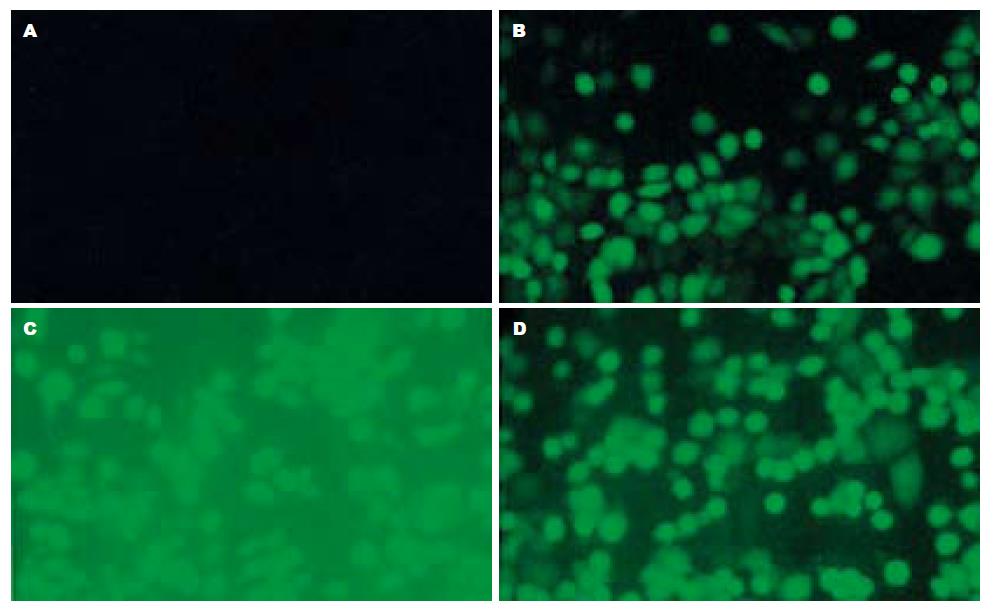
随着MOI值的加大, 腺病毒重组体在MGC-803细胞内转导率逐渐增加, 当MOI为10时, 其转导效率约为92%; 当MOI为50时, 其转导率为100%, 但细胞脱落、变圆, 有半数漂浮, 呈现腺病毒过量中毒状态; 当MOI为20时, 其转导效率接近100%而无明显细胞中毒现象(图1). 本试验均采用MOI = 20进行.
MTT结果如表1所示, 对照组 vs Ad-GFP组: 24 h(t = 1.16, P = 0.3105), 48 h(t = 1.08, P = 0.3908), 72 h(t = 1.09, P = 0.3359); Ad-GFP组vs Ad-Ang1组: 24 h(t = 16.32, P<0.0001), 48 h(t = 10.47, P = 0.0005), 72 h(t = 24.59, P<0.0001); 对照组 vs Ad-Ang1组: 24 h(t = 10.54, P = 0.0005), 48 h(t = 13.92, P = 0.0002), 72 h(t = 22.46, P<0.0001). 以上数据说明GFP对MGC-803细胞的增殖没有影响, 而转染Ang1基因能够显著促进MGC-803细胞的增殖.
| A值 | |||
| 24 h | 48 h | 72 h | |
| 对照组 | 0.758±0.03 | 1.004±0.01 | 1.232±0.03 |
| Ad-GFP组 | 0.781±0.01 | 1.027±0.03 | 1.253±0.02 |
| Ad-Ang1组 | 0.948±0.01 | 1.393±0.03 | 1.753±0.03 |
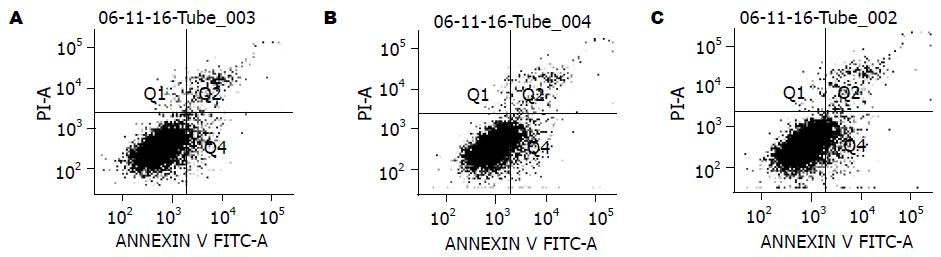
流式细胞仪检测结果表明, 对照组、Ad-GFP组和Ad-Ang1组的凋亡率(%)分别为: 9.90±0.62, 10.07±1.27(vs 对照组, t = 0.02, P = 0.8487), 4.17±0.35(vs Ad-GFP组, t = 7.73, P = 0.0015), 说明转染GFP对MGC-803的凋亡无影响, 而转染Ang1基因可显著抑制血浆饥饿条件下的凋亡(图2).
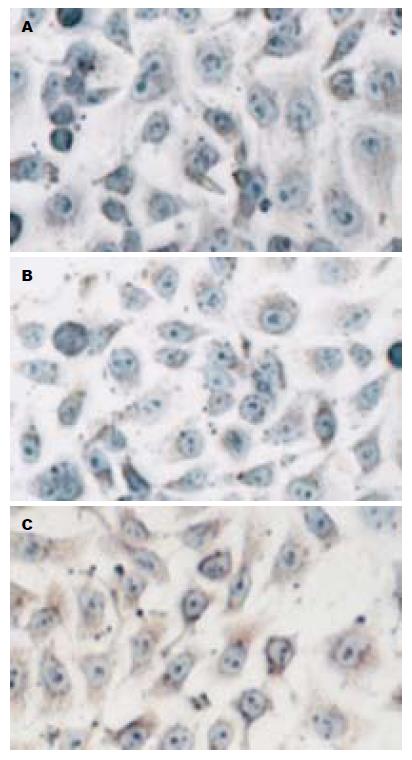
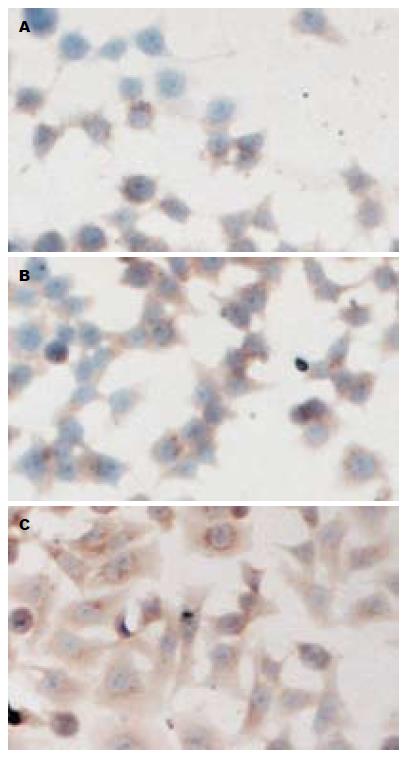
对照组、Ad-GFP组及Ad-Ang1组3组Tie-2阳性率(%)分别为30.8±1.5; 32.4±2.3; 85.4±1.8, 且在Ad-Ang1组的阳性表达率明显高于对照组和Ad-GFP组(P<0.0001, 图3). Ang1在3组细胞中均有表达, 对照组、Ad-GFP组及Ad-Ang1阳性率(%)分别为51.0±2.7; 51.4±1.5; 99.2±0.8, 在Ang1转染组近100%表达, 明显高于对照和Ad-GFP组(P<0.0001, 图4).
血管生长因子如VEGF[6]、bFGF[7]等以及新近发现的Ang[8]的促血管生成作用作为肿瘤研究领域中的热点一直以来受到大家的关注. Ang-1作为一个新发现的血管生长因子, 在肿瘤生长过程中发挥了重要的作用, 在很多实体肿瘤中得到了证实. 如在人胃癌[9]、肝癌[10]、肠癌[11-12]、肺鳞癌[13]和胶质细胞瘤[14-15]等均可见有Ang1及其受体Tie-2的表达增加. 但Ang1在肿瘤发展过程中的作用一直存在争议, 有些学者认为, Ang1可促进肿瘤的生长[16-20], 也有部分研究显示抑制肿瘤的发展[21-23]. Stratmann et al[16]将内皮细胞与胶质瘤细胞共同培养于基质胶(Matrigel)中, 可检测到Ang-1的表达, 并观察到内皮细胞迁移, 形成相互吻合的血管网, 血管成条索状; 反之, 当去除胶质瘤细胞时, 未能检测到Ang-1的表达, 而内皮细胞堆积成团, 血管延伸异常, 推测肿瘤细胞分泌Ang-1, 使内皮细胞迁移、趋化, 从而促进肿瘤血管生成. Wang et al[9]检测53例胃癌组织和23例正常胃黏膜中Ang-1的表达, 结果显示, 有66%胃癌组织中Ang-1明显升高且与胃癌细胞株的分化程度有相关性. 而Stoeltzing et al[22]用重组Ang-1转染人结肠癌细胞并种植到裸鼠身上, 发现转染Ang-1的HT29种植瘤比转染空载体组的体积小, 血管密度低, 肿瘤细胞增殖程度低, 血管周细胞包绕程度高, 血管渗透性低. 推测Ang-1可通过抵抗血管渗漏, 抑制血管新生, 维持血管稳定, 有阻止肿瘤转移的潜能. 不管是促进或是抑制作用, 目前的研究多是从促血管生成、稳定血管角度研究的; 而其血管生成以外的功能学研究甚少. 因此, 我们利用腺病毒作为载体将外源Ang1基因导入人胃癌细胞株MGC-803, 研究血管生长因子Ang1除具有血管生长作用以外, 是否对胃癌细胞本身的增殖和凋亡的有无影响及探讨其可能机制.
基因转染载体分为非病毒载体和病毒载体2大类. 非病毒载体包括质粒、脂质体、基因枪和裸DNA等; 病毒载体包括逆转录病毒、腺病毒、腺相关病毒和慢病毒等, 他们多是高效载体, 其中腺病毒最为常用. 腺病毒载体主要具有以下优点: (1)宿主广泛. 能感染绝大多数处于分裂或不分裂状态的细胞; (2) 安全. 腺病毒是一约36 kb的双股DNA病毒, 有40多种血清型. 本试验采用的是腺病毒5型, 其控制转录复制单位E1基因和编码毒性产物的E3基因已经被剔除, 所以具有不会自身复制和毒性低的特点; (3)转染率高. 腺病毒很容易生长到较高滴度(1012 PFU/L以上), 转染后能表达高丰度的目的蛋白; (4)目的基因不整合到宿主染色体DNA中, 转染细胞表达目的基因数量随细胞分裂增殖而递减, 因而不会带来严重副作用[24-25]. 在实验中我们以绿色荧光蛋白(GFP)做平行对照, 因为GFP是目前已知的唯一能在活细胞中产生自发荧光的蛋白, 并且其基因序列很短, 易于构建质粒, 具有敏感的标记检测率, 而没有放射性的危害[26]. 本实验用复制缺陷型腺病毒将Ang1基因转导入MGC-803进行体外表达实验, 以最适感染复数(MOI = 20)转染MGC-803, 培养瓶中发现细胞死亡现象很少. 转染后48 h, 免疫组化染色可见绝大部分细胞中存在阳性颗粒, 这表明腺病毒载体的瞬时转染效率很高, 我们的结果显示可达99%以上. 而MTT和流式细胞仪检测显示, GFP对MGC-803细胞的增殖和凋亡没有影响, 也进一步证实, GFP是在基因转染实验中较理想的平行对照基因.
我们成功制备了高滴度的Ad-GFP和Ad-Ang1, 在感染复数(MOI)为20时即对胃癌细胞MGC-803有近100%转导效率. MTT结果显示, Ad-Ang1组细胞吸光度明显高于对照组及Ad-GFP组, 说明Ang1能够促进体外培养的MGC-803细胞的增殖. 血浆饥饿诱导的凋亡实验常被用来检测某些物质、因素的抗凋亡效应, 并且认为其诱导的凋亡是Caspase依赖性的[27]. 本研究流式细胞仪检测结果证明, Ang1对胃癌细胞具有抗凋亡作用, 可能是通过与其细胞表面Tie-2受体结合后, 导致后者的磷酸化, 从而激活PI-3K, AKT, 抑制细胞Caspase家族的活化所至. 另外, 我们应用免疫细胞化学方法在该种细胞株上也检测到了Ang1及其受体Tie-2的阳性表达, 且Ad-Ang1组阳性细胞表达率显著高于对照组和Ad-GFP组, 说明Ang1水平的增多可上调其受体的表达, 可能系通过自分泌途径促进肿瘤的增殖. 这些研究结果证明, Ang1基因对肿瘤生长和转移的促进作用除了通过血管机制以外, 对肿瘤细胞本身也有直接的促增殖和抑制凋亡作用.
总之, 以腺病毒为载体, 将外源Ang1基因导入人胃癌细胞, 发现该基因对MGC-803有促进增殖和抑制凋亡作用, Ang1这种促血管生成以外的作用将为其功能学研究和在肿瘤的临床应用开辟新方向.
胃癌是我国常见的恶性肿瘤之一, 全世界每年新增胃癌患者约80万, 死亡约63万, 其死亡率较高, 5年生存率只有约20%, 危害十分严重. 血管生成素及其受体Tie-2是近年新发现的与肿瘤转移, 血管生成、重塑密切相关的分子, 本文研究了血管生成素-1基因对胃癌细胞增殖和凋亡的影响.
Ang在肿瘤生长中发挥了重要的作用, 在很多实体肿瘤中得到了证实, 如在人胃癌、肝癌、乳腺癌和胶质细胞瘤等均可见到有Ang-1及其受体Tie-2表达增加, 但其具体机制尚不完全清楚. 目前的研究结果显示, Ang-1在肿瘤发展过程的作用尚有争议, 故需进一步深入研究.
有研究表明, Ang-1可促进肿瘤生长, 转染Ang-1基因可降低肿瘤细胞的凋亡指数, 但其具体机制不清; 也有部分研究发现, Ang-1抑制肿瘤生长的可能机制是Ang-1减少血管渗漏, 形成稳定的血管.
本文应用基因转染技术将Ang-1导入人胃癌细胞MGC-803, 研究该基因对胃癌细胞增殖和凋亡的影响, 并探讨其可能的作用机制, 具有一定新意.
本文发现, 转染Ang-1基因对人胃癌细胞MGC-803有促进增殖和抑制凋亡作用, 这一研究结果可能为胃癌的临床治疗提供理论依据.
血管生成素-1: 是一种分泌性糖蛋白, 主要由血管旁支持细胞包括周细胞(pericyte)、血管平滑肌细胞和肿瘤细胞等合成, 与肿瘤转移, 血管生成、重塑密切相关.
本文研究了Ang1基因对胃癌生长和转移的促进作用, 思路新颖, 以腺病毒为载体, 将外源Ang1基因导入人胃癌细胞, 发现该基因对MGC-803有促进增殖和抑制凋亡作用, 为我们提供了较充足的有价值的信息. 文章的科学性、创新性和可读性能较好的反映我国胃肠道肿瘤基础研究的先进水平.
编辑: 王晓瑜 电编:李琪
| 1. | Davis S, Aldrich TH, Jones PF, Acheson A, Compton DL, Jain V, Ryan TE, Bruno J, Radziejewski C, Maisonpierre PC. Isolation of angiopoietin-1, a ligand for the TIE2 receptor, by secretion-trap expression cloning. Cell. 1996;87:1161-1169. [PubMed] [DOI] |
| 2. | Maisonpierre PC, Suri C, Jones PF, Bartunkova S, Wiegand SJ, Radziejewski C, Compton D, McClain J, Aldrich TH, Papadopoulos N. Angiopoietin-2, a natural antagonist for Tie2 that disrupts in vivo angiogenesis. Science. 1997;277:55-60. [PubMed] [DOI] |
| 3. | Valenzuela DM, Griffiths JA, Rojas J, Aldrich TH, Jones PF, Zhou H, McClain J, Copeland NG, Gilbert DJ, Jenkins NA. Angiopoietins 3 and 4: diverging gene counterparts in mice and humans. Proc Natl Acad Sci USA. 1999;96:1904-1909. [PubMed] [DOI] |
| 4. | 周 磊, 张 馥敏, 杨 志健, 陆 丽, 丁 兆丰, 丁 必森, 哈 团柱, 李 传富, 高 翔, 马 文珠. 人血管生成素-1和血管内皮生长因子165基因克隆及复制缺陷型腺病毒载体构建. 中华心血管病杂志. 2003;31:699. |
| 5. | Harfouche R, Hasséssian HM, Guo Y, Faivre V, Srikant CB, Yancopoulos GD, Hussain SN. Mechanisms which mediate the antiapoptotic effects of angiopoietin-1 on endothelial cells. Microvasc Res. 2002;64:135-147. [PubMed] [DOI] |
| 6. | Gerber HP, McMurtrey A, Kowalski J, Yan M, Keyt BA, Dixit V, FerRARα N. Vascular endothelial growth factor regulates endothelial cell survival through the phosphatidylinositol 3'-kinase/Akt signal transduction pathway. Requirement for Flk-1/KDR activation. J Biol Chem. 1998;273:30336-30343. [PubMed] [DOI] |
| 7. | Takahashi JC, Saiki M, Miyatake S, Tani S, Kubo H, Goto K, Aoki T, Takahashi JA, Nagata I, Kikuchi H. Adenovirus-mediated gene transfer of basic fibroblast growth factor induces in vitro angiogenesis. Atherosclerosis. 1997;132:199-205. [PubMed] [DOI] |
| 8. | Kim I, Kim HG, Moon SO, Chae SW, So JN, Koh KN, Ahn BC, Koh GY. Angiopoietin-1 induces endothelial cell sprouting through the activation of focal adhesion kinase and plasmin secretion. Circ Res. 2000;86:952-959. [PubMed] [DOI] |
| 9. | Wang J, Wu K, Zhang D, Tang H, Xie H, Hong L, Pan Y, Lan M, Hu S, Ning X. Expressions and clinical significances of angiopoietin-1, -2 and Tie2 in human gastric cancer. Biochem Biophys Res Commun. 2005;337:386-393. [PubMed] [DOI] |
| 10. | Sugimachi K, Tanaka S, Taguchi K, Aishima S, Shimada M, Tsuneyoshi M. Angiopoietin switching regulates angiogenesis and progression of human hepatocellular carcinoma. J Clin Pathol. 2003;56:854-860. [PubMed] [DOI] |
| 11. | Ahmad SA, Liu W, Jung YD, Fan F, Wilson M, Reinmuth N, Shaheen RM, Bucana CD, Ellis LM. The effects of angiopoietin-1 and -2 on tumor growth and angiogenesis in human colon cancer. Cancer Res. 2001;61:1255-1259. [PubMed] |
| 12. | Nakayama T, Hatachi G, Wen CY, Yoshizaki A, Yamazumi K, Niino D, Sekine I. Expression and significance of Tie-1 and Tie-2 receptors, and angiopoietins-1, 2 and 4 in colorectal adenocarcinoma: Immunohistochemical analysis and correlation with clinicopathological factors. World J Gastroenterol. 2005;11:964-969. [PubMed] [DOI] |
| 13. | Takahama M, Tsutsumi M, Tsujiuchi T, Nezu K, Kushibe K, Taniguchi S, Kotake Y, Konishi Y. Enhanced expression of Tie2, its ligand angiopoietin-1, vascular endothelial growth factor, and CD31 in human non-small cell lung carcinomas. Clin Cancer Res. 1999;5:2506-2510. [PubMed] |
| 14. | Machein MR, Knedla A, Knoth R, Wagner S, Neuschl E, Plate KH. Angiopoietin-1 promotes tumor angiogenesis in a rat glioma model. Am J Pathol. 2004;165:1557-1570. [PubMed] [DOI] |
| 15. | Zadeh G, Reti R, Koushan K, Baoping Q, Shannon P, Guha A. Regulation of the pathological vasculature of malignant astrocytomas by angiopoietin-1. Neoplasia. 2005;7:1081-1090. [PubMed] [DOI] |
| 16. | Stratmann A, Risau W, Plate KH. Cell type-specific expression of angiopoietin-1 and angiopoietin-2 suggests a role in glioblastoma angiogenesis. Am J Pathol. 1998;153:1459-1466. [PubMed] [DOI] |
| 17. | Shim WS, Teh M, Bapna A, Kim I, Koh GY, Mack PO, Ge R. Angiopoietin 1 promotes tumor angiogenesis and tumor vessel plasticity of human cervical cancer in mice. Exp Cell Res. 2002;279:299-309. [PubMed] [DOI] |
| 18. | Torimura T, Ueno T, Kin M, Harada R, Taniguchi E, Nakamura T, Sakata R, Hashimoto O, Sakamoto M, Kumashiro R. Overexpression of angiopoietin-1 and angiopoietin-2 in hepatocellular carcinoma. J Hepatol. 2004;40:799-807. [PubMed] [DOI] |
| 19. | Melani C, Stoppacciaro A, Foroni C, Felicetti F, Caré A, Colombo MP. Angiopoietin decoy secreted at tumor site impairs tumor growth and metastases by inducing local inflammation and altering neoangiogenesis. Cancer Immunol Immunother. 2004;53:600-608. [PubMed] [DOI] |
| 20. | Wang J, Wu KC, Zhang DX, Fan DM. Antisense angiopoietin-1 inhibits tumorigenesis and angiogenesis of gastric cancer. World J Gastroenterol. 2006;12:2450-2454. [PubMed] [DOI] |
| 21. | Tian S, Hayes AJ, Metheny-Barlow LJ, Li LY. Stabilization of breast cancer xenograft tumour neovasculature by angiopoietin-1. Br J Cancer. 2002;86:645-651. [PubMed] [DOI] |
| 22. | Stoeltzing O, Ahmad SA, Liu W, McCarty MF, Wey JS, Parikh AA, Fan F, Reinmuth N, Kawaguchi M, Bucana CD. Angiopoietin-1 inhibits vascular permeability, angiogenesis, and growth of hepatic colon cancer tumors. Cancer Res. 2003;63:3370-3377. [PubMed] |
| 23. | Hayes AJ, Huang WQ, Yu J, Maisonpierre PC, Liu A, Kern FG, Lippman ME, McLeskey SW, Li LY. Expression and function of angiopoietin-1 in breast cancer. Br J Cancer. 2000;83:1154-1160. [PubMed] [DOI] |
| 24. | Vorburger SA, Hunt KK. Adenoviral gene therapy. Oncologist. 2002;7:46-59. [PubMed] [DOI] |
| 25. | Zhang C, Liu ZK. Gene therapy for gastric cancer: a review. World J Gastroenterol. 2003;9:2390-2394. [PubMed] |
| 26. | Zimmer M. Green fluorescent protein (GFP): applications, structure, and related photophysical behavior. Chem Rev. 2002;102:759-781. [PubMed] [DOI] |
| 27. | Gu J, Fujibayashi A, Yamada KM, Sekiguchi K. Laminin-10/11 and fibronectin differentially prevent apoptosis induced by serum removal via phosphatidylinositol 3-kinase/Akt- and MEK1/ERK-dependent pathways. J Biol Chem. 2002;277:19922-19928. [PubMed] [DOI] |