修回日期: 2006-11-30
接受日期: 2006-12-27
在线出版日期: 2007-03-08
目的: 构建含人抑瘤素M (human oncostatin M, HOSM)基因的复制缺陷型重组腺病毒载体AD-HOSM, 观察其对人肝癌细胞株HepG2在体外生长抑制情况.
方法: 通过同源重组方法构建含HOSM基因的缺陷型重组腺病毒载体AD-HOSM, 用报告基因AD-GFP检测腺病毒的对人肝癌细胞系的转染效率; 人肝癌细胞株HepG2转染含HOSM基因的缺陷型腺病毒载体AD-HOSM后, 用RT-PCR法检测外源HOSM基因在其中的表达; 台盼蓝染色、细胞计数法检测AD-HOSM对HepG2的体外增殖抑制情况.
结果: 成功构建了重组腺病毒载体AD-HOSM, AD-HOSM对肝癌细胞HepG2有较高的转染效率, 并且转染效率与病毒的剂量呈正相关. AD-HOSM感染HepG2细胞48 h, HOSM基因在转染细胞能有效的表达. 体外试验示, AD-HOSM转染的细胞的增殖却受到明显的抑制.
结论: 重组腺病毒介导HOSM表达能有效抑制HepG2在体外的增殖, 提示重组腺病毒介导的HOSM基因治疗可能成为肝癌治疗的候选方案.
引文著录: 胡朝全, 孙诚谊, 孙连生, 王玉芝. 重组腺病毒载体介导HOSM基因对肝癌细胞体外增殖的抑制作用. 世界华人消化杂志 2007; 15(7): 737-740
Revised: November 30, 2006
Accepted: December 27, 2006
Published online: March 8, 2007
AIM: To construct a replication-deficient recombinant adenoviral vector encoding human oncostatin M (HOSM) gene and evaluate its potential for suppressing the cell growth of hepatic carcinoma cell line HepG2 in vitro.
METHODS: Recombinant replication-deficient adenoviral vector encoding human oncostain M (HOSM) gene was constructed using homologous recombination modality. The transfection efficiency of the recombinant virus in HepG2 cells was examined by reporter gene AD-GFP. The expression of exogenous HOSM gene in adenovirus-infected HepG2 cells was identified by reverse transcription polymerase chain reaction (RT-PCR). The proliferation inhibition of HepG2 cells was determined by trypan blue exclusion assay.
RESULTS: The desired recombinant adenovirus vectors were harvested with high titer and purity. The transfection efficiency of the recombinant virus in HepG2 cells was high, and positively correlated with the doses of AD-HOSM. The efficient expression of HOSM gene was detected in AD-HOSM treated cells at the 48th hour, and in vitro growth assay revealed significant growth retardation following AD-HOSM infection.
CONCLUSION: The expression of HOSM delivered by recombinant adenovirus is able to inhibit the proliferation of HepG2 cells in vitro, suggesting that recombinant adenovirus-mediated HOSM gene therapy might be a candidate method for the treatment of hepatic carcinoma.
- Citation: Hu CQ, Sun CY, Sun LS, Wang YZ. Growth suppression of human hepatic carcinoma cell by induction of human oncostatin M gene via recombinant adenovirus. Shijie Huaren Xiaohua Zazhi 2007; 15(7): 737-740
- URL: https://www.wjgnet.com/1009-3079/full/v15/i7/737.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i7.737
肝癌是常见的消化道恶性肿瘤, 化疗不敏感, 预后较差, 需要对新的治疗模式进行探索来提高肝癌的治疗效果. 抑瘤素M(oncostatin M)是一种能抑制肿瘤细胞增殖和促进正常成纤维细胞生长的多肽, 是迄今报道的具有较强抑制活性的因子, 我们构建了含人抑瘤素M(human oncostatin M, HOSM)基因复制缺陷型重组腺病毒载体, 以之转染肝癌细胞系, 观察外源性HOSM基因在其中的表达, 及体外的抑瘤效应进行检测和分析, 为肝癌的基因治疗提供参考.
肝癌细胞系HepG2购自ATCC, 培养条件为RMPI1640, 100 mL/L胎牛血清, 37℃, 50 mL/L CO2. RPMI1640购自Gibico BRL, 胎牛血清购自北京军医兽医防治中心.
1.2.1 构建含HOSM基因的重组腺病毒载体[1-3]: 用含HOSM基因的穿梭质粒pCA14HOSM(含CMV-HOSMcDNA-SV40polyA)与环状质粒pJM17通过lipofectAMIN介导, 在人胚肾细胞中进行同源重组, 通过嗜斑分析筛选单克隆重组腺病毒, PCR法鉴定所构建的重组腺病毒载体, 在293细胞中扩增病毒, Cscl梯度超速离心纯化病毒, 嗜斑法测定病毒的滴度.
1.2.2 肝癌细胞系对腺病毒感染效率的检验[4]: 将肝癌细胞系HepG2以104接种于24孔板, 12 h后给予不同MOI的AD-GFP感染, MOI分别为5, 10, 20, 30, 40, 50, 以DMEM为对照1-2 h后吸去病毒液, 每孔加入2 mL培养液, 以后每12 h在荧光显微镜下观察GFP的表达情况, 感染48 h后计数GFP表达阳性的细胞数(发绿色荧光), 同时计数该视野的全部细胞数, 计算感染效率. 转染效率 = GFP表达阳性细胞数/总细胞数×100%.
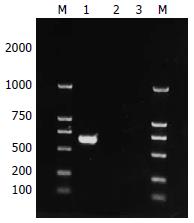
1.2.3 RT-PCR法检测目的基因在肝癌细胞系的表达: 转染50MOI的AD-HOSM 48 h的肝癌细胞, 分别用AD-GFP及PBS作病毒对照及空对照. 用TRIzol试剂(GIBCO BRL)提取细胞的总RNA, 使用TRIzol试剂(GIBCO BRL), 参照说明书操作. 按HOSM CDNA序列合成引物, 上游引物: AGC, TGC, TCG, AAA, GAG, TAC, CG下游引物: CTG, TCC, CCT, GGT, CAT, GAG, TC预计扩增片段长度为660 bp, 使用Promega公司的Reverse Transcription Ststem(cat#A3500)试剂盒, 按说明书操作.
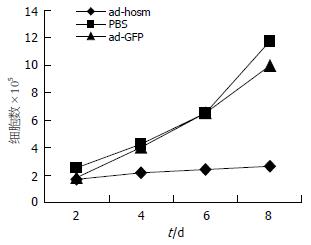
1.2.4 绘制细胞生长曲线[5-6]: 将HepG2 1×105接种于60 mm的平皿, 分别感染50MOI的AD-HOSM, AD-GFP, PBS作对照, 每皿重复3次, 每天观察细胞生长状况, 于感染的2, 4, 6, 8 d, 用2.5 g/L胰蛋酶消化细胞, 离心收集细胞, 台盼蓝染色, 细胞计数, 每皿重复3次, 取平均值, 绘制细胞生长曲线.
肝癌细胞系对重组腺病毒易感, 以AD-GFP转染HepG2, 观察到转染效率与病毒的剂量呈正相关. 随着感染剂量加大, 目的基因的表达水平增加, 产生强绿色的荧光的细胞数量亦增加, 病毒的转染效率提高.
AD-HOSM感染HepG2细胞48 h后, 提取总RNA, 进行反转录PCR, 结果表明外源性HOSM基因能在肝癌细胞中能表达(图1).
AD-GFP感染的细胞的增殖速度和光镜细胞形态与对照组没有明显的差别, 而相同剂量的AD-HOSM转染的细胞的增殖却受到明显的抑制, 光镜下可见细胞的贴壁性降低, 变园, 皱缩, 折光性增强, 部分细胞台盼蓝染色呈阳性, 此结果说明是病毒介导的目的基因而非病毒本身抑制肝癌细胞的增殖, 图2显示感染AD-GFP, AD-OSM及正常HepG2的生长曲线.
抑瘤素M是Zarling et al[7]在1986年分离的一种抑制肿瘤细胞增殖并有多种生物活性的细胞因子, 抑瘤素M能抑制多种肿瘤细胞株的增殖, 包括肝癌、乳腺癌、卵巢癌、神经胶质瘤、肺癌等, 可促进成纤维细胞的生长及Kaposi内瘤细胞的增殖, 可抑制体外培养的造血祖细胞的分化[8]. 病毒介导法转染效率高, 目的基因表达稳定, 在现有的基因治疗的方案中占绝大多数[9-11]. 腺病毒[12]是一种线状双链DNA病毒, 与其他病毒载体相比较而言, 对人致病性小, 且不诱导癌变, 感染后所致的临床症状较轻, 把腺病毒作为载体比较安全, 不整合入细胞基因组, 遗传毒性低; 宿主范围广; 不仅能感染繁殖期的细胞, 而且能感染非分裂期的细胞, 故能达到很高的转染效率; 易于制备, 纯化, 病毒滴度可达1013 pfu/L以上, 能满足于临床基因治疗的要求; ad2, ad5等的启运子功能较强, 可明显提高外源基因的表达水平.
实验中所使用的质粒DNA同源重组构建重组腺病毒载体AD-HOSM的方法, 具有操作简单, 获得重组腺病毒的几率较大的特点; 检测外源HOSM基因在靶细胞表达RT-PCR法简单易行; 台盼蓝染色、细胞计数法简单、易行而直观. 分别以AD-HOSM, AD-GFP, PBS转染肝癌细胞株, 结果显示, HOSM对肿瘤的生长有明显的抑制作用, AD-GFP感染的细胞的增殖速度和光镜细胞形态与对照组没有明显的差别, 而相同剂量的AD-HOSM转染的细胞的增殖却受到明显的抑制, 光镜下可见细胞的贴壁性降低, 变园, 皱缩, 折光性增强, 部分细胞台盼蓝染色呈阳性, 此结果说明, 是病毒介导的目的基因OSM而非病毒本身抑制肝癌细胞的增殖, 但OSM作用机制[13-14]尚不完全清楚, 可能与下述因素有关: OSM和其受体结合后, 通过JAK/STAT信号传导途径, 作用于靶基因, 如CDKIS的P21WAF1/CIPI, P27KLPI等, 使细胞生长阻滞; 或通过下调癌基因如抑制如c-myc的表达而抑制细胞增殖; 或通过免疫效应抑制细胞增殖.
当前对肝癌的基因治疗虽然取得了很多有意义的结果[15], 给肿瘤的治疗带来了新希望, 但仍存在着许多问题: (1)基因转移技术尚不完善; (2)病毒载体的安全性有待观察; (3)导入的基因间是否拮抗; (4)如何使导入的基因只作用于肝癌细胞. 相信随着科学技术进步及对肿瘤的发病机制的深入研究, 对基因转移载体进一步改造, 减轻其副作用, 提高其靶向性及转染效率, 新的功能基因不断被发现, 选择合适的治疗基因, 建立新的治疗模式, 经过长期不懈的努力, 我们相信肝癌的基因治疗将可能成为临床上可行的有效的辅助医疗方案, 基因治疗将会有一个灿烂辉煌的明天.
肝癌是治疗效果较差的消化道恶性肿瘤, 需要对新的治疗模式进行探索. 肿瘤基因治疗是一项新兴而有前途的治疗方式. 人抑瘤素M(HOSM)是一种能抑制肿瘤细胞增殖多肽, 既往有关HOSM体外抑瘤多为直接应用或质粒介导, 本文所使用的质粒 DNA同源重组构建了重组腺病毒载体AD-HOSM的方法, 具有操作简单, 获得重组腺病毒的几率较大的特点; 检测外源HOSM基因在靶细胞表达RT-PCR法简单易行 ; 台盼蓝染色、细胞计数法简单、易行而直观. 实验中AD-HOSM在体外显示了较好的抑制HepG2的的生长的作用, 提示HOSM可能对肝癌细胞有良好的抑制作用, 有着较好的应用前景.
本文研究了重组腺病毒载体介导HOSM基因对肝癌细胞体外增殖的抑制作用, 文章新颖度较好, 结果可信, 有较高的理论和应用价值.
电编: 张敏 编辑:王晓瑜
| 3. | Zhang WW, Fang X, Branch CD, Mazur W, French BA, Roth JA. Generation and identification of recom-binant adenovirus by liposome-mediated transfection and PCR analysis. Biotechniques. 1993;15:868-872. [PubMed] |
| 4. | de Martin R, Raidl M, Hofer E, Binder BR. Adeno-virus-mediated expression of green fluorescent protein. Gene Ther. 1997;4:493-495. [PubMed] |
| 5. | Zhang WW, Fang X, Mazur W, French BA, Georges RN, Roth JA. High-efficiency gene transfer and high-level expression of wild-type p53 in human lung cancer cells mediated by recombinant adenovirus. Cancer Gene Ther. 1994;1:5-13. [PubMed] |
| 6. | Qazilbash MH, Xiao X, Seth P, Cowan KH, Walsh CE. Cancer gene therapy using a novel adeno-associated virus vector expressing human wild-type p53. Gene Ther. 1997;4:675-682. [PubMed] |
| 7. | Zarling JM, Shoyab M, Marquardt H, Hanson MB, Lioubin MN, Todaro GJ. Oncostatin M: a growth regulator produced by differentiated histiocytic lymphoma cells. Proc Natl Acad Sci USA. 1986;83:9739-9743. [PubMed] |
| 8. | Bruce AG, Linsley PS, Rose TM. Oncostatin M. Prog Growth Factor Res. 1992;4:157-170. [PubMed] |
| 9. | Wang CJ, Xue XB, Yi JL, Chen K, Zheng JW, Wang J, Zeng JP, Xu RH. Melanoma differentiation-associated gene-7, MDA-7/IL-24, selectively induces growth suppression, apoptosis in human hepatocellular carcinoma cell line HepG2 by replication-incompetent adenovirus vector. World J Gastroenterol. 2006;12:1774-1779. [PubMed] |
| 10. | Jacob D, Schumacher G, Bahra M, Davis J, Zhu HB, Zhang LD, Teraishi F, Neuhaus P, Fang BL. Fiber-modified adenoviral vector expressing the tumor necrosis factor-related apoptosis-inducing ligand gene from the human telomerase reverse transcriptase promoter induces apoptosis in human hepatocellular carcinoma cells. World J Gastroenterol. 2005;11:2552-2556. [PubMed] |
| 11. | Li L, Huang JL, Liu QC, Wu PH, Liu RY, Zeng YX, Huang WL. Endostatin gene therapy for liver cancer by a recombinant adenovirus delivery. World J Gastroenterol. 2004;10:1867-1871. [PubMed] |
| 12. | Robbins PD, Tahara H, Ghivizzani SC. Viral vectors for gene therapy. Trends Biotechnol. 1998;16:35-40. [PubMed] |
| 13. | Grant SL, Begley CG. The oncostatin M signalling pathway: reversing the neoplastic phenotype? Mol Med Today. 1999;5:406-412. [PubMed] |
| 14. | Tanaka M, Miyajima A. Oncostatin M, a multifunc-tional cytokine. Rev Physiol Biochem Pharmacol. 2003;149:39-52. [PubMed] |
| 15. | Hernandez-Alcoceba R, Sangro B, Prieto J. Gene therapy of liver cancer. World J Gastroenterol. 2006;12:6085-6097. [PubMed] |