修回日期: 2006-08-30
接受日期: 2006-09-20
在线出版日期: 2007-03-08
目的: 探讨培养的小鼠小肠和胃Cajal间质细胞(ICC)起搏电流的特性.
方法: 用二型胶原酶分离ICC并在含有干细胞因子的培养液中培养, 72 h后通过免疫组织化学方法进行鉴定. 利用传统全细胞模式膜片钳技术记录胃窦和小肠ICC的起搏电流. 把电极内液的钙螯合剂EGTA浓度由0.1 mmol/L增加到10 mmol/L, 使游离钙浓度降低, 观察细胞内低钙对起搏电流的影响.
结果: 培养72 h 后的ICC在光镜下表现出自胞体发出2-4条长突起, 并与邻近ICC突起相互连接成网络状; 激光共聚焦显微镜下观察到ICC表面酪氨酸激酶受体c-kit表达呈阳性; 膜电位钳制在-60 mV的条件下, ICC上可以记录到自发而节律性内向电流, 即起搏电流. 在胃和小肠ICC之间以及单个ICC和ICC网络之间, 电流幅度、频率有差异. 在传统的全细胞膜片钳模式下, 通过增加电极内液中EGTA浓度使细胞内游离钙降低时, 可以激活ICC的内向电流; 在细胞外给予钙调蛋白抑制剂W-7时, 可以激活ICC内向电流的同时明显增加起搏电流的幅度.
结论: 小鼠胃和小肠ICC产生的起搏电流频率与小鼠胃和小肠自律运动的频率非常接近; 网络ICC产生的起搏电流比单个ICC稳定、幅度高、频率快; ICC内游离钙浓度的降低是产生起搏电流的重要因素; 钙调蛋白在ICC内参与起搏电流的抑制性调节.
引文著录: 朴莲花, 张扬, 黄旭, 李春晖, 高玲, 许文燮. 培养的小鼠小肠和胃Cajal间质细胞起搏电流的特性. 世界华人消化杂志 2007; 15(7): 677-682
Revised: August 30, 2006
Accepted: September 20, 2006
Published online: March 8, 2007
AIM: To investigate the characteristics of the pacemaker current in cultured interstitial cells of Cajal (ICC) from murine stomach and small intestine.
METHODS: ICC was isolated from murine stomach and small intestine and then cultured in the medium with stem cell factors. After 72 hours, ICC was identified by immunohistochemical technique with monoclonal antibody for c-kit protein labelling and the pacemaker currents in gastric and intestinal ICC were recorded under the conventional whole-cell patch-clamp configuration. When the concentration of calcium-chelating agent EGTA was increased from 0.1 to 10 mmol/L, the effects of low intracellular calcium on the pacemaker currents were observed.
RESULTS: At the 72nd hour, 2 to 4 projections were stacked out from the body of ICC, which interconnected with neighboring cells and formed cell networks under light microscope. Immunohistochemistry showed that c-kit protein was positively expressed on the surface of ICC. Under the conventional whole-cell configuration, the spontaneous and rhythmic inward currents (pacemaker currents) were elicited in cultured gastric and small intestinal ICC, respectively, as the membrane potential was held at -60 mV. There were differences in the amplitudes and frequencies between single ICC and ICC networks or between gastric ICC and small intestinal ICC. Under the conventional whole-cell configuration, an inward current was activated in ICC by increasing the concentration of EGTA in pipette solution W-7, a calmodulin-inhibitor, which activated the inward current and increased the amplitude of pacemaker currents in ICC.
CONCLUSION: The frequencies of the pacemaker currents from gastric and small intestinal ICC are very similar to the frequencies of rhythmic contraction in murine gastric and small intestinal smooth muscles; ICC network generates higher- amplitude, stabler and more rhythmic pacemaker currents than single ICC does; low concentration of intracellular free calcium is an important factor for generating pacemaker current; calmodulin is involved in the inhibitory regulation of the pacemaker current.
- Citation: Piao LH, Zhang Y, Huang X, Li CH, Gao L, Xu WX. Characteristics of the pacemaker current in cultured interstitial cells of Cajal from murine stomach and small intestine. Shijie Huaren Xiaohua Zazhi 2007; 15(7): 677-682
- URL: https://www.wjgnet.com/1009-3079/full/v15/i7/677.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i7.677
消化道平滑肌细胞以静息膜电位为基础可产生节律慢的自发性去极化称为慢波(slow waves)电位, 又称基本电节律(basic electrical rhythm, BER). 胃肠平滑肌具有自动节律性收缩和舒张的特性, 而这种节律性运动由基本电节律(慢波)所控制[1-4]. 关于胃肠平滑肌慢波的起源及其产生的离子通道机制尚不清楚. 长期以来, 认为胃肠平滑肌节律性运动起源于纵行肌, 但近年的研究逐步认为, 引起胃肠平滑肌自动节律性运动的起搏细胞是位于纵行肌和环行肌之间的Cajal间质细胞(interstial cells of cajal, ICC), 他们是一种兼有成纤维细胞和平滑肌细胞特性的间质细胞. 一般认为, ICC可分为ICC-MY(inter-muscular layer ICC)和ICC-IM(intra-mucular ICC)两类, 其中ICC-MY是起搏细胞, 而ICC-IM与两层平滑肌细胞均形成缝隙连接(gap junctions)可将ICC-MY产生的慢波传给平滑肌[3-6]. ICC从食道到肛门内括约肌均有分布并形成网络. 越来越多证据表明, ICC是胃肠平滑肌的起搏细胞, 发动平滑肌的慢波, 控制胃肠平滑肌的节律性运动[7-9]. 国内外关于ICC产生起搏电流的机制、以及起搏电流如何转变成平滑肌细胞的慢波并控制平滑肌的节律性运动等很多问题有待于解决, 尤其国内有关ICC起搏电流的研究报道甚少. 因此, 本研究在培养的小鼠胃和小肠的ICC起搏电流的特性进行了初步探讨.
生后10-15 d的Balb/c小鼠(由中国科学院实验动物中心提供), 雌雄不拘. Kraft-Bruhe液(K-B液)的成分(mmol/L): EGTA 0.5, HEPES 10, MgCl2•6H2O 3, KCl 50, Glucose 10, L-Glutamate 50, Taurine 20, KH2PO4 20, 以KOH调pH值至7.40. Ca2+-free-Hank's的成分(mmol/L): KCl 5.36, NaCl 125, NaOH 0.336, NaHCO3 0.44, Glucose 10, Sucrose 2.9, HEPES 10, 以Tris调pH值至7.40. 培养基: SMGM(Smooth Muscle Growth Medium; Clonetics Corp., San Diego, CA, USA); 抗生素(antibiotic/antimycotic Gibco BRL, Grand Island, NY, USA); SCF(Sigma, St Louis, MO, USA); PSS的成分(mmol/L): NaCl 134.8, KCl 4.5, HEPES 10, CaCl2 10, MgCl2•6H2O 1, Glucose 10, 以Tris调pH值至7.40. 电极内液的成分(mmol/L): CsCl 110, TEA 20, EGTA 0.1, HEPES 5, Na2ATP 3, MgCl2•6H2O 3.5以Tris调pH值至7.30. 配制完成后, 用1 mL的分装瓶分装存放于0℃的冷冻箱中, 实验前解冻使用. W-7配成10 mmol/L母液待用.
实验动物脱臼致死并浸泡在750 mL/L酒精约5 min. 立即剖开腹壁取胃, 沿胃小弯切开, 用K-B液反复漂洗胃内容物, 胃组织用小针固定在特制的盛有K-B液溶液的培养皿(通氧气). 在解剖显微镜下剥离胃黏膜, 将胃组织切成小块, 并在无钙的Hank's溶液中孵育40 min, 然后参照Koh et al[10]的方法用二型胶原酶分离细胞. 分离后的细胞接种于平滑肌生长培养基并在二氧化碳培养箱(37℃, 950 mL/L氧, 50 mL/L二氧化碳)进行培养. 培养24 h后更换无抗生素但含有干细胞因子(stemcell factor, SCF)的平滑肌生长的培养液.
细胞稳定培养3 d后, 进行免疫组织化学鉴定. 倾去培养皿内的培养基, PBS冲洗3次; 在室温下用丙酮固定10 min; 再用PBS冲洗3次每次3 min; 加入羊血清后在室温下封闭30 min; 再加入c-Kit mAb (1:100)4℃过夜; 然后加入羊抗大鼠FIT-C标记的二抗(1:50)在常温下作用1 h; 最后PBS冲洗3次每次3 min, 用500 mL/L甘油封片. 在激光共聚焦显微镜或荧光显微镜下观察细胞.
取出培养72 h的ICC, 在实验前用室温的无钙生理盐水轻轻的反复冲洗, 取1个盖玻片平铺于倒置显微镜(Ⅸ-70 Olympus, Japan)镜台上的灌流槽底部, 进行灌流(2-3 mL/min)灌流. 然后用电阻为2-5 MΩ的玻璃电极进行5-10 GΩ的千兆封接. 膜电位钳制在-60 mV, 全细胞电流是通过膜片钳放大器EPC-10型膜片钳放大器记录分析处理.
统计学处理 所有统计数据用均数±标准差来表示. 实验结果采用同体对照的t检验, 具有显著性差异的标准为P<0.01.
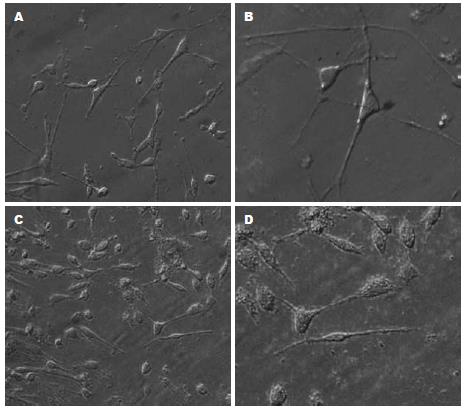
ICC培养24 h后在倒置显微镜下观察, 可见ICC已贴壁, 胞体呈三角形或梭形, 有少量突起. 核大、胞质内有许多黑色糖原颗粒. 培养72 h后可见自胞体发出2-4条长突起, 并与邻近细胞胞体及ICC突起相互连接成网络状(图1).
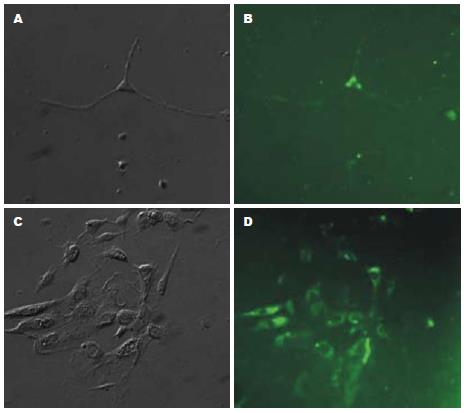
ICC培养72 h后, 进行免疫组织化学鉴定. 免疫荧光染色后, 在荧光显微镜下观察, ICC表面酪氨酸激酶受c-Kit表达呈阳性, 胞体和突起均明显着色, 部分细胞发出长的凸起(图2).
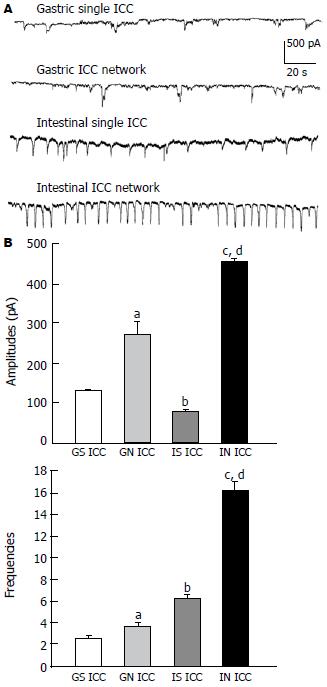
在传统的全细胞膜片钳模式下, 将膜电位钳制在-60 mV, 记录胃和小肠ICC的起搏电流. 结果表明, 在胃和小肠ICC均可以记录到自发并具有节律的内向电流, 而胃和小肠ICC以及单一ICC与网络ICC之间起搏电流幅度、频率均有差异(图3A). 图3B结果显示: 胃单一ICC和网络状ICC的起搏电流振幅分别为130.8±9.6 pA和226.9±28.3 pA, 频率分别为2.6±0.2次/min和3.6±0.5次/min, 两者比较振幅和频率均有显著性差异(P<0.001, n = 6); 小肠单一ICC和网络状ICC的起搏电流振幅分别为79.7±11.2 pA和272.3±38.8 pA, 频率分别为6.5±0.4次/min和16.3±1.0次/min, 两者比较振幅和频率均有显著性差异(P<0.001, n = 6); 胃和小肠单一ICC与网络状ICC之间振幅和频率相比较也有显著性差异(P<0.001, n = 6).
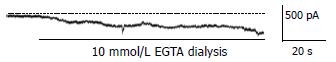
在传统的全细胞膜片钳模式下, 将膜电位钳制在-60 mV记录胃ICC起搏电流. 为了观察细胞内低钙对起搏电流的影响, 把电极内液的钙螯合剂EGTA浓度由0.1 mmol/L增加到10 mmol/L, 使游离钙浓度降低. 结果表明, 随着含有高浓度EGTA的电极内液向细胞内扩散, 逐步激活一种内向电流(图4), 其钳制电流的幅度平均增加219.93 pA.
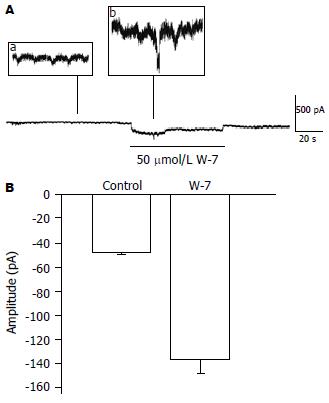
在传统的全细胞膜片钳模式下, 将膜电位钳制在-60 mV记录起搏电流. 为了探讨钙调蛋白对起搏电流的影响, 观察了钙调蛋白抑制剂W-7(50 µmol/L)对起搏电流及钳制电流的影响. 结果表明, W-7明显增加ICC钳制电流的同时增加其起搏电流幅度(图5A). W-7增加起搏电流振幅由原来的48.5±9.9 pA增加到142.3±25.4 pA(图5B, P<0.001, n = 4), 并使钳制电流平均增加93.8 pA.
基本电节律是消化道平滑肌细胞以静息膜电位为基础可产生节律缓慢的自发性去极化, 又称为慢波(slow waves)电位. 关于胃肠平滑肌慢波的起源及其产生的离子通道机制, 长期以来的观点认为, 胃肠平滑肌节律性运动起源于纵行肌. 但是, 近年的研究逐步认为, 引起胃肠平滑肌自动节律性运动的起搏细胞是位于纵行肌和环行肌之间的ICC[11-12], 他们是一种兼有成纤维细胞和平滑肌细胞特性的间质细胞, 可分为ICC-MY(inter-muscular layer ICC)和ICC-IM (intra-muscular ICC)两类, 其中ICC-MY是起搏细胞, 其自发性产生的节律性电活动, 称为起搏电流(pacemaker current). 因此, ICC作为一类特殊的细胞, 已成为胃肠动力学领域的一个新的研究方向. 然而, 关于起搏电流的电生理特性、产生机制还存在一些分歧有待于进一步研究.
在本研究中我们参照Koh et al[7]方法培养了小鼠小肠和胃的ICC, 并比较观察了胃和小肠以及单个ICC和ICC网络起搏电流的特性. 关于ICC鉴定, 目前国际上惯用的方法是用c-Kit蛋白免疫组织化学染色法. c-Kit受体是Ⅲ型酪氨酸激酶受体家族中的重要成员, c-Kit对于黑色素细胞、生殖细胞、造血干细胞及肥大细胞的发育是必要的, c-Kit与配体相互作用在这些细胞的分化与增殖中具有重要的作用. 研究发现, 几乎所有ICC均c-Kit阳性表达, 而胃肠道内表达c-Kit的细胞绝大多数为ICC, 从而将c-Kit作为ICC的标志物为鉴定ICC开辟了新纪元[13-14]. 我们把培养的ICC进行c-Kit免疫组化鉴定, 结果表明, 在显微镜下ICC以细胞团为中心向四周放射状成长, 细胞的形态多样, 如三角、星星状、不规则形态等, 但共同点是细胞体各角伸出突起就象神经元的树突, 而这些细胞c-Kit蛋白表达均为阳性. 这些结果与其他研究者报道的结果相似[7-8].
近年来的单细胞记录和分子水平的研究证明, 胃肠道无论是纵形肌还是环形肌均不具有发动SW的能力, 慢波是由存在于纵形肌和环形肌之间的Cajal间质细胞产生. 在本实验中我们通过免疫组织化学鉴定ICC后, 进一步采用膜片钳技术确认了培养的胃、肠ICC是否产生起搏电流. 结果表明, 在传统全细胞模式下把膜电位钳制在-60 mV, 可以记录到自发并节律性内向电流, 其幅度与胃、肠自律性运动频率非常接近. 在正常生理条件下胃的自发性运动频率明显低于小肠, 因此, 我们比较了胃和小肠ICC起搏电流频率. 我们结果显示, 小肠ICC起搏电流频率远高于胃ICC起搏电流频率. 既然在胃肠道ICC形成网络共同完成起搏功能, 而不是以单个细胞来完成起搏功能. 因此, 我们也比较了单个ICC和网络ICC的起搏电流. 结果表明, 单个ICC起搏电流的节律不如网络ICC规则、幅度和频率明显低于网络ICC. 这些结果说明, 尽管ICC是形成胃肠平滑肌节律性运动的起搏细胞, 但是当他们形成网络才能完成起搏功能.
有关ICC产生起搏电流机制的研究, 正逐步成为本领域的热点问题[15]. 已有的研究表明, ICC内由IP3介导的钙库、线粒体和细胞膜上的非选择性阳离子通道(nonselective cation channel, NSCC)这三个要素共同构成的起搏单位(pacemaker unit), 产生起搏电流[16-17]. 其具体过程是, 首先IP3介导的钙库释放钙, 胞内游离钙增加启动线粒体钙吸收, 当线粒体吸收钙使胞内游离明显降低时, 细胞膜上的NSCC被激活, 产生一种内向电流即起搏电流. 细胞内的高浓度游离钙和Ca2+-钙调蛋白(calmodulin, CM)依赖的蛋白激酶抑制起搏电流. 因此, 把产生起搏电流的非选择性阳离子电流也称为低钙敏感内向电流(low calcium sensitive inward current)[18-19]. 在本实验中我们首先提高电极内液中的钙螯合剂EGTA的浓度, 使细胞内游离钙最大限度地降低情况下观察了ICC钳制电流的影响. 结果表明, 当形成全细胞模式后随着EGTA向细胞内扩散逐步激活非常明显内向电流. 此外, 细胞外给予钙调蛋白抑制剂W-7后不仅同样激活内向电流, 起搏电流的幅度也明显增加. 以上结果提示, 胃肠ICC产生起搏电流的过程中细胞内游离钙水平和钙调蛋白起着重要的作用.
ICC是胃肠自律性运动的起搏细胞, 因此ICC生理学功能以及ICC与胃肠动力相关性疾病的关系研究已经成为国内外学者关注的研究热点. 关于ICC起搏电流的产生机制还存在分歧, 如以加拿大学者Huizinga为代表的学者们认为ICC起搏电流的产生与钙敏感氯电流有关[20]; 而以Sanders为代表的美国学者们认为ICC起搏电流与非选择阳离子电流有关[13]. 因此, 在培养的ICC上研究他的起搏电流的特性, 探讨起搏电流的机制不仅对消化生理学具有重要的理论意义, 也对临床研究胃肠动力性疾病的发病机制具有重要的意义.
众所周知, 胃肠平滑肌具有自动节律性收缩和舒张的特性, 而这种节律性运动由基本电节律(慢波) 所控制. 长期以来, 认为胃肠平滑肌节律性运动起源于纵行肌, 但近年的研究逐步认为, 引起胃肠平滑肌自动节律性运动的起搏细胞是位于纵行肌和环行肌之间的Cajal间质细胞(简称ICC),他们是一种兼有成纤维细胞和平滑肌细胞特性的间质细胞. 本研究利用电生理学方法在培养的小鼠 和小肠ICC上比较观察了起搏电流的特性.
胃肠动力障碍性疾病在临床上非常常见, 尤其功能性胃肠动力障碍疾病的发病原因不清楚, 因此没有理想的治疗方法. 因为ICC是控制胃肠平滑肌自律性运动的起搏细胞, 因此了解和掌握ICC电生理特性是非常重要的课题.
本文利用膜片钳技术比较观察了小鼠小肠和胃培养的ICC起搏电流的特征, 发现IC C内游离钙浓度的降低是产生起搏电流的重要因素; 钙调蛋白在IC C内参与起搏电流的抑制性调节.
本文结果显示, 在小肠和胃ICC上能够记录起搏电流而这种起搏电流频率基本符合小鼠胃和小肠运动频率. 因此通过记录ICC起搏电流以及ICC形态学观察的方法, 可以深入研究胃肠动力障碍疾病与 ICC之间关系.
c-Kit受体: 是Ⅲ型酪氨酸激酶受体家族中的重要成员. c-Kit对于黑色素细胞、生殖细胞、造血干细胞及肥大细胞的发育是必要的, c-Kit与配体相互作用在这些细胞的分化与增殖中具有重要的作用. 研究发现, 几乎所有ICC均表达c-kit,胃肠道内表达 c-kit的细胞绝大多数为ICC, 因此将c-Kit作为鉴定ICC的标志物.
本文对临床研究胃肠动力性疾病的发病机制和药物治疗的研究具有一定的价值, 方法先进, 结论明确, 有较高的可读性.
电编: 张敏 编辑:张焕兰
| 1. | Hashitani H, Garcia-Londono AP, Hirst GD, Edwards FR. Atypical slow waves generated in gastric corpus provide dominant pacemaker activity in guinea pig stomach. J Physiol. 2005;569:459-465. [PubMed] |
| 2. | Dickens EJ, Hirst GD, Tomita T. Identification of rhythmically active cells in guinea-pig stomach. J Physiol. 1999;514:515-531. [PubMed] |
| 4. | 李 宇航, 王 庆国, 陈 萌, 杨 美娟, 赵 丽云, 李 丽娜, 张 冬梅, 王 丹. 大鼠胃电节律失常模型胃肌间Cajal间质细胞含量的变化. 世界华人消化杂志. 2004;12:639-641. [DOI] |
| 5. | Camborova P, Hubka P, Sulkova I, Hulin I. The pacemaker activity of interstitial cells of Cajal and gastric electrical activity. Physiol Res. 2003;52:275-284. [PubMed] |
| 6. | Hirst GD, Beckett EA, Sanders KM, Ward SM. Regional variation in contribution of myenteric and intramuscular interstitial cells of Cajal to generation of slow waves in mouse gastric antrum. J Physiol. 2002;540:1003-1012. [PubMed] |
| 7. | Koh SD, Sanders KM, Ward SM. Spontaneous electrical rhythmicity in cultured interstitial cells of cajal from the murine small intestine. J Physiol. 1998;513:203-213. [PubMed] |
| 8. | Huizinga JD, Robinson TL, Thomsen L. The search for the origin of rhythmicity in intestinal contraction; from tissue to single cells. Neurogastroenterol Motil. 2000;12:3-9. [PubMed] |
| 10. | Koh SD, Kim TW, Jun JY, Glasgow NJ, Ward SM, Sanders KM. Regulation of pacemaker currents in interstitial cells of Cajal from murine small intestine by cyclic nucleotides. J Physiol. 2000;527 Pt 1:149-162. [PubMed] |
| 11. | Edwards FR, Hirst GD. An electrical description of the generation of slow waves in the antrum of the guinea-pig. J Physiol. 2005;564:213-232. [PubMed] |
| 12. | Kito Y, Ward SM, Sanders KM. Pacemaker potentials generated by interstitial cells of Cajal in the murine intestine. Am J Physiol Cell Physiol. 2005;288:C710-720. [PubMed] |
| 13. | Rich A, Miller SM, Gibbons SJ, Malysz J, Szurszewski JH, Farrugia G. Local presentation of Steel factor increases expression of c-kit immunoreactive interstitial cells of Cajal in culture. Am J Physiol Gastrointest Liver Physiol. 2003;284:G313-320. [PubMed] |
| 14. | Daigo Y, Takayama I, Ponder BA, Caldas C, Ward SM, Sanders KM, Fujino MA. Differential gene expression profile in the small intestines of mice lacking pacemaker interstitial cells of Cajal. BMC Gastroenterol. 2003;3:17. [PubMed] |
| 15. | Sanders KM, Koh SD, Ward SM. Interstitial cells of cajal as pacemakers in the gastrointestinal tract. Annu Rev Physiol. 2006;68:307-343. [PubMed] |
| 16. | Liu HN, Ohya S, Furuzono S, Wang J, Imaizumi Y, Nakayama S. Co-contribution of IP3R and Ca2+ influx pathways to pacemaker Ca2+ activity in stomach ICC. J Biol Rhythms. 2005;20:15-26. [PubMed] |
| 17. | Ward SM, Ordog T, Koh SD, Baker SA, Jun JY, Amberg G, Monaghan K, Sanders KM. Pacemaking in interstitial cells of Cajal depends upon calcium handling by endoplasmic reticulum and mitochondria. J Physiol. 2000;525 Pt 2:355-361. [PubMed] |
| 18. | Koh SD, Jun JY, Kim TW, Sanders KM. A Ca(2+)-inhibited non-selective cation conductance contributes to pacemaker currents in mouse interstitial cell of Cajal. J Physiol. 2002;540:803-814. [PubMed] |
| 19. | Suzuki H, Takano H, Yamamoto Y, Komuro T, Saito M, Kato K, Mikoshiba K. Properties of gastric smooth muscles obtained from mice which lack inositol trisphosphate receptor. J Physiol. 2000;525 Pt 1:105-111. [PubMed] |
| 20. | Zhu Y, Mucci A, Huizinga JD. Inwardly rectifying chloride channel activity in intestinal pacemaker cells. Am J Physiol Gastrointest Liver Physiol. 2005;288:G809-821. [PubMed] |