修回日期: 2006-12-01
接受日期: 2006-12-18
在线出版日期: 2007-02-28
目的: 寻求增强CIK细胞的细胞毒活性的有效方法.
方法: 从健康人外周血中提取出单个核细胞, 第1天加入IFN-γ, 第2天加入IL-1, CD3 mAb, IL-2诱导CIK细胞, 另一组与IL-1, CD3 mAb, IL-2同时加入IL-24. 杀伤分为4组: 未加IL-24培养组、单独IL-24杀伤组、加IL-24培养组、未加IL-24的CIK细胞培养组在杀伤时加入IL-24. 细胞计数法测定细胞的增殖、MTT法测定细胞杀伤活性和流式细胞术分析细胞表型. 扫描电镜和透射电镜观察CIK细胞对肿瘤细胞的杀伤和肿瘤细胞的改变.
结果: 未加IL-24培养组CIK细胞增殖高于加IL-24培养组, 两者比较有明显差异(126.34±2.14 vs 108.87±1.29, P<0.05). 加IL-24培养组细胞各个效靶比杀伤活性均达到90%以上, 明显高于其他各组(效靶比为10:1时95.58%±2.21% vs 27.31%±2.69%, 8.74%±2.41%, 38.65%±21.30%, P<0.05; 效靶比为20:1时 91.97%±4.21% vs 34.27%±0.85%, 11.54%±2.78%, 48.32%±11.72%, P<0.05; 效靶比为40:1时91.84%±9.28% vs 50.67%±1.30%, 23.73%±11.07%, 52.89%±12.26%, P<0.05). 不同时间加IL-24培养组各个细胞表型与未加IL-24培养组相比没有差别. 透射电镜下观察加IL-24培养组凋亡和坏死肿瘤细胞比未加IL-24培养组明显增多.
结论: CIK细胞诱导过程中加入IL-24能明显增强其杀伤活性.
引文著录: 袁玉涛, 王志华, 秦莉, 张春艳, 马玉彦, 孙喜文. IL-24对细胞因子诱导的杀伤细胞的作用. 世界华人消化杂志 2007; 15(6): 548-553
Revised: December 1, 2006
Accepted: December 18, 2006
Published online: February 28, 2007
AIM: To find a new method to enhance the cytotoxic activity of cytokine-induced killer (CIK) cells for clinical immunotherapy.
METHODS: Mononuclear cells were extracted from the peripheral blood of health adults. One group was treated with interferon-γ (IFN-γ) at the 1st day and interleukin-1 (IL-1), CD3 mAb, IL-2 at the 2nd day, and the other group was disposed with IL-24 besides IL-1, CD3 mAb, and IL-2. Cell counting method was used to determine the proliferation of CIK cells, and the cytotoxic activity was detected by MTT assay. Cell phenotype was examined by flow cytometry. The scanning electron microscopy and transmission electron microscopy were used to observe the killing effects of CIK cells on tumor cells as well as the changes of tumor cells.
RESULTS: The proliferation of CIK cells without IL-24 treatment was higher than that with IL-24 treatment (126.34 ± 2.14 vs 108.87 ± 1.29, P < 0.05). The cytotoxic activities of CIK cells co-cultured with IL-24 were above 90% at different effector-target ratios (10:1, 20:1, 40:1), which were significantly higher than those in the other groups (10:1: 95.58% ± 2.21% vs 27.31% ± 2.69%, 8.74% ± 2.41%, 38.65% ± 21.30%, all P < 0.05; 20:1: 91.97% ± 4.21% vs 34.27% ± 0.85%, 11.54% ± 2.78%, 48.32% ± 11.72%, all P < 0.05; 40:1: 91.84% ± 9.28% vs 50.67% ± 1.30%, 23.73% ± 11.07%, 52.89% ± 12.26%, all P < 0.05). Cell phenotypes were not significantly different between the CIK cells with and without IL-24 treatment (P > 0.05). Apoptotic and necrotic cells were obviously increased in after IL-24 treatment under transmission electron microscope.
CONCLUSION: IL-24 can obviously enhance the cytotoxic activity of CIK cell.
- Citation: Yuan YT, Wang ZH, Li-Qin, Zhang CY, Ma YY, Sun XW. Effects of interleukin-24 on the cytotoxic activity of cytokine-induced killer cells. Shijie Huaren Xiaohua Zazhi 2007; 15(6): 548-553
- URL: https://www.wjgnet.com/1009-3079/full/v15/i6/548.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i6.548
CIK(cytokine-induced killer)细胞是一种非MHC限制性的高效溶肿瘤细胞毒性T淋巴细胞, 其在外周血淋巴细胞中的比例为1%-5%. 1991年Schmidt-Wolf et al[1]首先报道了一类由多种细胞因子诱导的杀伤细胞, 即CIK细胞. 正常人或患者外周血、骨髓单个核细胞中加入细胞因子IFN-γ, IL-1, CD3 mAb, IL-2经2-4 wk的诱导可获得大量的肿瘤杀伤细胞, 他是非MHC限制性的一群异质性细胞, 具有强大的杀瘤活性.
mda-7基因(melanoma differentiation-associated gene 7)是用活跃增生的人HO-1黑色素瘤细胞cDNA文库与β-IFN和MEZ处理过的HO-1细胞cDNA文库差减杂交发现一个新的与黑色素瘤分化相关基因, 即mda-7, 并初步实验证明了MDA-7具有抑制黑色素瘤增生特性和在黑色素瘤进程中促进终末分化的能力. 随后MDA-7一直作为肿瘤抑制物被研究, 直到2002年, Caudell et al[2]用一系列的实验证实了MDA-7的细胞因子属性, 命名为白细胞介素-24(interleukin-24, IL-24), 归于IL-10家族. 由于IL-24本身对肿瘤细胞具有杀伤力, 本实验旨在研究在CIK诱导过程中加入IL-24对CIK的杀伤肿瘤细胞的活性是否有增强作用.
HepG2肿瘤细胞株由本所提供, IFN-γ, IL-1均为美国Peprotech公司产品, CD3 mAb为北京天广实生物技术有限公司产品, IL-2购自江苏金丝利药业有限公司, IL-24购自R&D systems, Percp结合的鼠抗人CD3、FITC结合的鼠抗人CD4、PE结合的鼠抗人CD8, CD56, CD3均为美国BD公司产品, 胎牛血清为杭州四季青生物责任有限公司产品, RPMI 1640干粉为美国Gibco BRL产品, 健康人外周血由哈尔滨红十字中心血站提供, 淋巴细胞分离液为天津市灏洋生物制品科技有限责任公司产品, MTT为北京索莱宝科技有限公司产品, 流式细胞仪为美国BD公司产品, 酶标分光光度计为BioRAU, 450型, 美国制造. 荧光倒置显微镜为日本OLYMPUS公司产品.
1.2.1 CIK细胞的诱导: 参考文献[3]方法. 细胞计数, 稀释成浓度为1×109/L于六孔板中培养, 每孔5 mL培养液, 按1000 kU/L加IFN-γ. 24 h后分别按600 kU/L和100 kU/L加IL-2和IL-1, CD3 mAb加75 μg/L. 另外一组与IL-2, IL-1, CD3 mAb同时加入IL-24 1000 kU/L, 2-3 d后补充新鲜培养液和细胞因子IL-2, CD3 mAb, 以后每2-3 d补充新鲜培养液和IL-2.
1.2.2 光镜下细胞形态观察: 在诱导过程中每天于光镜下观察细胞形态变化. 与肿瘤细胞共同培养, 观察两者形态上的差别.
1.2.3 CIK细胞增殖活性的测定: 将1 mL用两种方法培养的CIK细胞以1×109/L铺于24孔板中, 各铺三个平行孔, 每3 d补充新鲜培养液和细胞因子并用台盼蓝计数细胞总数计算平均值, 根据细胞增殖倍数绘制生长曲线.
1.2.4 CIK细胞毒活性的测定: 取对数生长期的肿瘤细胞, 调整细胞浓度分别为1×108/L、5×107/L、2.5×107/L, 每孔100 μL铺于96孔板中, 每组设4个复孔, 置37℃, 50 mL/L CO2孵箱内培养, 24 h后将效应细胞CIK, 浓度调整为1×109/L与靶细胞浓度分别为10:1, 20:1, 40:1加入96孔板中, 另设单独靶细胞组(靶细胞+培养液)和单独效应细胞组(效应细胞+培养液)为阴性对照组, 作用48 h后每孔加入MTT 20 μL/孔, 继续培养4-6 h, 倾斜96孔板吸取上清液, 然后每孔加入100 μL DMSO, 震荡几分钟, 等沉淀全部溶解后用酶标仪(波长570 nm)测定吸光度A值, 计算杀伤率(%)={1-[A(效+靶)-A(效)]/A(靶)}×100%.
杀伤分为四组: 未加IL-24培养组; 单独IL-24杀伤组; 加IL-24培养组; 未加IL-24的CIK细胞培养组在杀伤时加入IL-24. IL-24加入浓度均为1000 kU/L.
1.2.5 CIK细胞表型测定: 取2×109/L细胞于流式专用管中, 相应抗体混匀避光放置20 min, 用PBS洗2遍, 1500 r/min离心5 min, 10 g/L甲醛固定后待上机测定. 两组细胞未加IL-24培养组和加IL-24培养组分别于8, 15, 20 d时测CD3+, CD4+, CD8+, CD3+CD56+.
1.2.6 扫描电镜和透射电镜标本的制备: 扫描电镜标本的制备在六孔板中放置灭菌载玻片, 在紫外线下照射, 在六孔板中铺种CIK细胞和HepG2的混合液, 细胞比例大约为10:1, 并作单独肿瘤细胞对照组. 第2天, 用吸管吸出培养液, 添加部分生理盐水冲洗细胞, 动作要轻柔, 然后加戊二醛(25 g/L)固定以漫过玻片为宜, 取出玻片, 常规HE染色和25 g/L戊二醛脱水、临界点干燥、喷金、扫描电镜观察、照相. 透射电镜标本的制备: 取CIK细胞和HepG2细胞的混合液于培养瓶中, 细胞比例大约为10:1, 其中一组加1000 kU/L的IL-24. 第2天用细胞刮刀刮取细胞, 1000 r/min离心5 min, 倒出离心管中培养液, 用盐水吹打细胞然后转移到Eppendorf管中, 1000 r/min离心5 min, 弃去生理盐水, 用戊二醛(25 g/L)及10 g/L锷酸固定, 经乙醇梯度脱水, 超薄切片铅铀染色后置投射电镜下观察、照相, 参考文献[4]方法.
统计学处理 采用SPSS10.0数据分析软件, 所有数据用mean±SD表示, 采用方差分析和配对t检验统计学分析, P<0.05为有统计学意义.
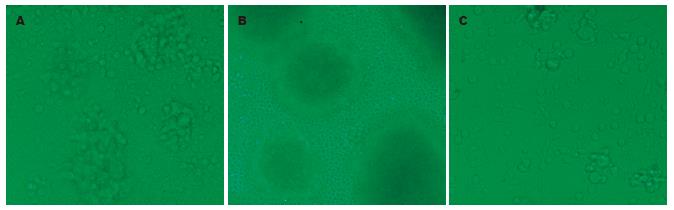
刚提取的单个核细胞大小较均一, 折光性较一致, 而经3 d培养诱导后的活化细胞中, 部分细胞明显增大, 可见很多小集落开始生成, 胞核密度加强, 细胞异型性较明显, 胞核中可见多量颗粒, 为大颗粒淋巴细胞(LGL)(图1A). 第6天观察细胞集落明显增多而且增大, 在肉眼下即可以看到白色的斑点集落, 镜下大集落成黑团, 看不清细胞, 但围绕集落周围有很多的细胞游出, 细胞饱满折光性好, 大小形态各异(图1B). 观察与肿瘤细胞HepG2共培养的CIK细胞, CIK细胞明显小于HepG2(图1C).
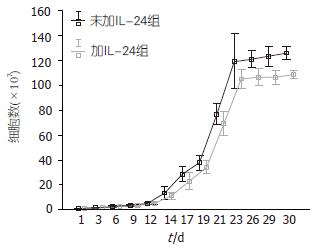
加IL-24培养组和未加IL-24培养组均在培养3 d时开始增殖, 在培养14 d时进入快速增殖期, 26 d以后增殖趋于缓慢进入平台期, 未加IL-24培养组增殖略快于加IL-24培养组(表1, 图2), 经统计学配对t检验分析, 两者有显著差异(t>3.055, P<0.05), 所以未加IL-24培养组增殖快于加IL-24培养组.
| 时间(d) | 未加IL-24组 | 加IL-24组 |
| 1 | 1.00±0.00 | 1.00±0.00 |
| 3 | 1.60±0.15 | 1.52±0.03 |
| 6 | 2.47±0.20 | 2.57±0.12 |
| 9 | 3.25±0.37 | 3.25±0.27 |
| 12 | 4.93±0.45 | 4.87±0.34 |
| 14 | 13.42±2.23 | 11.41±1.12 |
| 17 | 28.31±2.42 | 23.05±2.69 |
| 19 | 38.04±2.42 | 34.09±2.17 |
| 21 | 76.79±3.33 | 69.31±4.06 |
| 23 | 119.36±8.95 | 105.22±3.29 |
| 26 | 121.21±2.80 | 106.74±2.77 |
| 29 | 123.37±3.10 | 106.58±2.18 |
| 30 | 126.34±2.14 | 108.87±1.29 |
IL-24培养组在效靶比相同时杀伤率均明显高于其他组, 方差分析统计分析与不加IL-24培养组和未加IL-24的CIK细胞培养组在杀伤时加入IL-24相比均有明显差别(P<0.05), 但不加IL-24培养组和未加IL-24的CIK细胞培养组在杀伤时加入IL-24组相比没有明显差别. 不加IL-24培养组不同效靶比之间抑制率有显著差异(P<0.05), 但加IL-24培养组不同效靶比之间没有明显差异, 加IL-24培养组各个不同效靶比对肿瘤细胞均具有很高的抑制率(表2).
| 细胞分组 | 10∶1 | 20∶1 | 40∶1 |
| 不加IL-24培养组 | 27.31±2.69 | 34.27±0.85 | 50.67±1.30 |
| 单独IL-24杀伤组 | 8.74±2.41 | 11.54±2.78 | 23.73±11.07 |
| 加IL-24培养组 | 95.58±2.21 | 91.97±4.21 | 91.84±9.28 |
| 未加IL-24的CIK细胞培养组在杀伤时加入IL-24 | 38.65±21.30 | 48.32±11.72 | 52.89±12.26 |
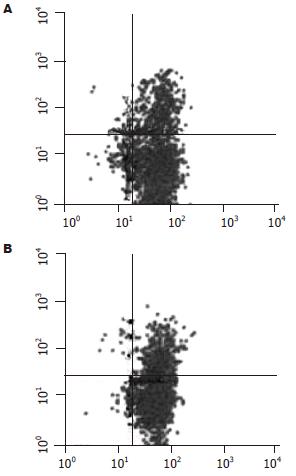
随着诱导时间的延长CD3+CD56+双阳性细胞所占百分比大幅度升高, 加IL-24培养组和未加IL-24培养组在诱导8, 15, 20 d时分别是6.52%±0.7%, 15.8%±0.4%, 19.85%±1.3%和4.78%±0.9%, 14.58%±1.6%, 20.18%±1.3%. 两组不同诱导时间之间表型均具有显著差异(P<0.05). 但两组在相同时间下细胞表型没有明显差异(图3).
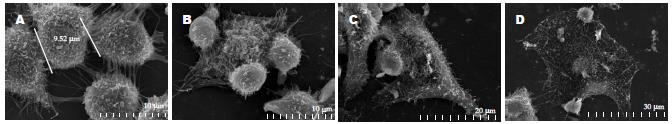
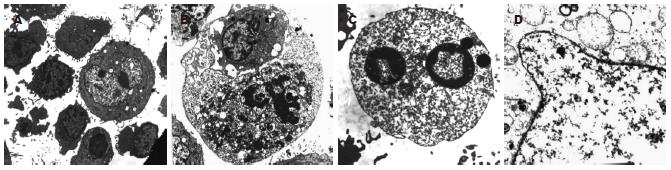
扫描电镜下观察可以看到正常的肿瘤细胞呈不规则形状, 表面微绒毛丰富而且细长(图4A), 杀伤状态下CIK细胞围绕HepG2, CIK细胞与肿瘤细胞接触, 肿瘤细胞明显变小(图4B), 有的CIK细胞进入肿瘤细胞被肿瘤细胞的微绒毛包裹(图4C), 有的肿瘤细胞已经坏死崩解(图4D). 透射电镜下可以看到肿瘤细胞周围有很多活性淋巴细胞的包围(图5A), 可以看到凋亡肿瘤细胞, 有的肿瘤细胞已进入肿瘤细胞内(图5B). 加IL-24组坏死肿瘤细胞明显增多, 核完全固缩(图5C), 胞质中充满了大量的脂滴颗粒, 线粒体嵴性肿胀, 空泡变性, 部分细胞核完全固缩, 核膜结构不清, 细胞内膜结构完全溶解(图5D).
CIK细胞表面既有T细胞标志细胞标志(CD3), 也有NK细胞的表面标志(CD56), 因而兼有T淋巴细胞抗肿瘤活性和NK细胞非MHC限制性杀瘤的特点. 用传统的手术、化疗、放疗等方法常不能彻底治愈肿瘤. 作为免疫治疗的方法之一, 应用细胞因子诱导的杀伤细胞因其可大量扩增, 细胞毒活性强, 可杀伤自体和异体多种肿瘤细胞[5-11], 与免疫细胞TIL, LAK比较有很多的优点, 回输体内后可继续分裂增生且无需外源细胞因子的维持, 副作用少显示了很好的发展前景[12-16]. 目前, 研究者都在致力于提高CIK杀伤肿瘤细胞的活性[17-21], 迄今为止已有许多实验证明IL-24具有显著的抑制肿瘤的作用, 能选择性地抑制多种肿瘤的生长, 诱导肿瘤细胞凋亡, 包括黑色素瘤、神经胶质母细胞瘤、骨肉瘤、乳腺癌、宫颈癌、结肠癌、肺癌、胃癌、鼻咽癌、前列腺癌等. 这种抑制作用不依赖p53, Rb和p16等抑癌基因, 且对正常细胞没有影响. IL-24选择性抑制肿瘤机制尚未完全清楚, 目前认为他通过多种途径发挥抑制肿瘤的作用. IL-24抗肿瘤效果十分显著, 成为肿瘤特异治疗药物的研究开发热点[22]. 本实验中在CIK诱导的过程中加入了IL-24, 两抗肿瘤因素联合作用于肿瘤细胞, 起到了很好的抑瘤作用. IL-24刺激的外周血单个核细胞48 h后有IL-6, TNF-α和IFN-γ的高表达同时IL-1β, IL-12和GM-CSF也有一定水平的表达, 这可能是两者联合应用提高抗肿瘤活性的原因.
目前诱导CIK细胞的方案有多种, 其中CD3 mAb和IFN-γ是每个方案的必选, 前者起到丝裂原活性作用, 可与T细胞表面CD3交联, 诱导其活化, 后者可诱导IL-1等因子的合成. 不同方案的主要差别在于白介素的不同, 常用的有IL-1, IL-2, IL-7, IL-12等. 本实验中除加入CD3 mAb, IFN-γ, IL-1, IL-2外又加入了IL-24. 在细胞表型上与常规诱导方法并没有差别.
本实验中在诱导CIK过程中加入了IL-24虽然对增殖活性有一定的影响, 但并不影响临床的需要. 对细胞表型并无影响而且明显增加了CIK细胞的杀伤活性, 10:1, 20:1和40:1效靶比对肿瘤细胞杀伤率均达到90%以上. 这可能与IL-24对肿瘤细胞具有杀伤力而且IL-24刺激的外周血单个核细胞48 h后有IL-6, TNF-α和IFN-γ的高表达同时IL-1β, IL-12和GM-CSF也有一定水平的表达有关.
mda-7/IL-24在人体内的生理水平表达主要限定于一些具有免疫功能的细胞, 包括正常的未受刺激的或受LPS刺激的单核细胞、抗CD3抗体刺激的T细胞和正常人的黑色素细胞[2]. 当超过生理水平表达时, mda-7/IL-24具有抑制多种肿瘤细胞生长的作用, 可诱导多种肿瘤细胞株的生长抑制和凋亡, 而对正常细胞却无作用[23,25].
总之, 在CIK诱导过程中加入IL-24能明显增强其杀伤活性, 诱导14-21 d时, CIK细胞增殖率和CD3+CD56+阳性细胞比例均达到高峰, 这一时相的CIK细胞在增殖表型与细胞活力两方面均达到动态平衡, 适合于临床应用.
肿瘤生物治疗已有 1 0 0 多年的历史. 19世纪末, 国外的一些医生观察到肿瘤患者合并严重的感染, 在感染被控制后肿瘤也明显缩小, 甚至完全消退从而认识到肿瘤和免疫的密切关系, 对免疫治疗寄予厚望并表现出极大的兴趣. 目前在过继免疫治疗中用于治疗肿瘤的细胞主要有LAK, TIL, CIK, A-NK等. CIK细胞增殖活性 高, 在肿瘤杀伤活性上具有CTL, LAK, TIL细胞所无法比拟的优越特性, 在肿瘤生物治疗上具有巨大的应用潜能, 因此日益受到人们的重视.
CIK在肿瘤生物治疗上具有巨大的应用潜能,IL-2 4 具有显著的抑制肿瘤的作用, 能选择性地抑制多种肿瘤的生长, 诱导肿瘤细胞凋亡, 包括 黑 色素瘤、神经胶质母细胞瘤、骨肉瘤、乳腺癌、宫颈癌、结肠癌、肺癌、胃癌、鼻 咽癌、前列腺癌等, 同时对正常细胞没有影响. IL-24选择性抑制肿瘤机制尚未完全清楚, 目前认为他通过多种途径发挥抑制肿瘤的作用. IL-24抗肿瘤效果十分显著, 成为肿瘤特异治疗药物的研究开发热点. 如何提高CI K细胞的杀伤活性和大批量的增殖, 是现在亟待解决的问题.
关于如何提高CIK细胞的杀伤活性国内外有很多相关的报道Marten et al将CIK 和源于自体外周血单个核细胞的DC共同培养, 在与CIK细胞共同培养的DC培养液中, 独特型DC及抗原递呈分子的数量明显增加, Finke et al应用腺病毒增强增强的CD3受体介导的基因转染方法成功的将IL-7基因转染入CIK细胞内, 并证明转染后的CIK细胞增殖活性和细胞毒活性明显增强. 另有文献报道双特异性抗体能增强 CIK的细胞毒活性.
国内外单独报道CIK细胞和IL-24的文章很多, 但尚未见CIK细胞和IL-24联合应用的相关报道. 本实验 中两者联合应用对肿瘤细胞有很高的杀伤力.
电编: 李琪 编辑:张焕兰
| 1. | Schmidt-Wolf IG, Negrin RS, Kiem HP, Blume KG, Weissman IL. Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity. J Exp Med. 1991;174:139-149. [PubMed] |
| 2. | Caudell EG, Mumm JB, Poindexter N, Ekmekcioglu S, Mhashilkar AM, Yang XH, Retter MW, Hill P, Chada S, Grimm EA. The protein product of the tumor suppressor gene, melanoma differentiation-associated gene 7, exhibits immunostimulatory activity and is designated IL-24. J Immunol. 2002;168:6041-6046. [PubMed] |
| 3. | Shi M, Zhang B, Tang ZR, Lei ZY, Wang HF, Feng YY, Fan ZP, Xu DP, Wang FS. Autologous cytokine-induced killer cell therapy in clinical trial phase I is safe in patients with primary hepatocellular carcinoma. World J Gastroenterol. 2004;10:1146-1151. [PubMed] |
| 4. | Wang ZH, Wang HY, Zhang Y, Wu CY. The improvement in culture and activation of A-NK cells. Chin Jour of Immunol. 2005;21:431-434. |
| 5. | Chen BA, Li M, Sun ZY, Li CP, Gao C, Sun YY, Wang J, Fu Q, Chen J. Effect of dendritic cells co-cultured with cytokine induced killer cells on cytotoxicity against drug resistant K562 cells. Zhonghua Xue Ye Xue Za Zhi. 2005;26:355-358. [PubMed] |
| 6. | Chan JK, Hamilton CA, Cheung MK, Karimi M, Baker J, Gall JM, Schulz S, Thorne SH, Teng NN, Contag CH. Enhanced killing of primary ovarian cancer by retargeting autologous cytokine-induced killer cells with bispecific antibodies: a preclinical study. Clin Cancer Res. 2006;12:1859-1867. [PubMed] |
| 7. | Jiang J, Xu N, Wu C, Deng H, Lu M, Li M, Xu B, Wu J, Wang R, Xu J. Treatment of advanced gastric cancer by chemotherapy combined with autologous cytokine-induced killer cells. Anticancer Res. 2006;26:2237-2242. [PubMed] |
| 8. | Wang FS, Liu MX, Zhang B, Shi M, Lei ZY, Sun WB, Du QY, Chen JM. Antitumor activities of human autologous cytokine-induced killer (CIK) cells against hepatocellular carcinoma cells in vitro and in vivo. World J Gastroenterol. 2002;8:464-468. [PubMed] |
| 9. | Sun S, Li XM, Li XD, Yang WS. Studies on inducing apoptosis effects and mechanism of CIK cells for MGC-803 gastric cancer cell lines. Cancer Biother Radiopharm. 2005;20:173-180. [PubMed] |
| 10. | Leemhuis T, Wells S, Scheffold C, Edinger M, Negrin RS. A phase I trial of autologous cytokine-induced killer cells for the treatment of relapsed Hodgkin disease and non-Hodgkin lymphoma. Biol Blood Marrow Transplant. 2005;11:181-187. [PubMed] |
| 11. | Shi M, Yao L, Wang FS, Lei ZY, Zhang B, Li WL, Liu JC, Tang ZR, Zhou GD. Growth inhibition of human hepatocellular carcinoma xenograft in nude mice by combined treatment with human cytokine-induced killer cells and chemotherapy. Zhonghua Zhong Liu Za Zhi. 2004;26:465-468. [PubMed] |
| 12. | Hongeng S, Petvises S, Worapongpaiboon S, Rerkamnuaychoke B, Pakakasama S, Jootar S. Generation of CD3+ CD56+ cytokine-induced killer cells and their in vitro cytotoxicity against pediatric cancer cells. Int J Hematol. 2003;77:175-179. [PubMed] |
| 13. | Linn YC, Hui KM. Cytokine-induced killer cells: NK-like T cells with cytotolytic specificity against leukemia. Leuk Lymphoma. 2003;44:1457-1462. [PubMed] |
| 14. | Alvarnas JC, Linn YC, Hope EG, Negrin RS. Expansion of cytotoxic CD3+ CD56+ cells from peripheral blood progenitor cells of patients undergoing autologous hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2001;7:216-222. [PubMed] |
| 15. | Maki G. Ex vivo purging of stem cell autografts using cytotoxic cells. J Hematother Stem Cell Res. 2001;10:545-551. [PubMed] |
| 16. | Linn YC, Lau LC, Hui KM. Generation of cytokine-induced killer cells from leukaemic samples with in vitro cytotoxicity against autologous and allogeneic leukaemic blasts. Br J Haematol. 2002;116:78-86. [PubMed] |
| 17. | Marten A, Ziske C, Schottker B, Renoth S, Weineck S, Buttgereit P, Schakowski F, von Rucker A, Sauerbruch T, Schmidt-Wolf IG. Interactions between dendritic cells and cytokine-induced killer cells lead to an activation of both populations. J Immunother. 2001;24:502-510. [PubMed] |
| 18. | Zhang S, Wang EZ, Bai CX, Xu YH. The proliferation profile in vitro and anti-tumor effects of dendritic cells co-culturing with CIK cells. Shi Yan Sheng Wu Xue Bao. 2003;36:375-380. [PubMed] |
| 19. | Finke S, Trojaneck B, Lefterova P, Csipai M, Wagner E, Kircheis R, Neubauer A, Huhn D, Wittig B, Schmidt-Wolf IG. Increase of proliferation rate and enhancement of antitumor cytotoxicity of expanded human CD3+ CD56+ immunologic effector cells by receptor-mediated transfection with the interleukin-7 gene. Gene Ther. 1998;5:31-39. [PubMed] |
| 20. | Kornacker M, Verneris M, Kornacker B, Ganten T, Scheffold C, Negrin R. The apoptotic and proliferative fate of cytokine-induced killer cells after redirection to tumor cells with bispecific Ab. Cytotherapy. 2006;8:13-23. [PubMed] |
| 21. | Zhang YS, Yuan FJ, Jia GF, Zhang JF, Hu LY, Huang L, Wang J, Dai ZQ. CIK cells from patients with HCC possess strong cytotoxicity to multidrug-resistant cell line Bel-7402/R. World J Gastroenterol. 2005;11:3339-3345. [PubMed] |
| 22. | Chada S, Mhashilkar AM, Ramesh R, Mumm JB, Sutton RB, Bocangel D, Zheng M, Grimm EA, Ekmekcioglu S. Bystander activity of Ad-mda7: human MDA-7 protein kills melanoma cells via an IL-20 receptor-dependent but STAT3-independent mechanism. Mol Ther. 2004;10:1085-1095. [PubMed] |
| 23. | Fisher PB, Gopalkrishnan RV, Chada S, Ramesh R, Grimm EA, Rosenfeld MR, Curiel DT, Dent P. mda-7/IL-24, a novel cancer selective apoptosis inducing cytokine gene: from the laboratory into the clinic. Cancer Biol Ther. 2003;2:S23-S37. [PubMed] |
| 24. | Wang CJ, Xue XB, Yi JL, Chen K, Zheng JW, Wang J, Zeng JP, Xu RH. Melanoma differentiation-associated gene-7, MDA-7/IL-24, selectively induces growth suppression, apoptosis in human hepatocellular carcinoma cell line HepG2 by replication-incompetent adenovirus vector. World J Gastroenterol. 2006;12:1774-1779. [PubMed] |