修回日期: 2006-01-01
接受日期: 2006-01-25
在线出版日期: 2007-02-18
目的: 制备高效价的抗Nap蛋黄抗体(IgY).
方法: 大量诱导、培养重组菌pQE30-NapA-DH5α获得重组蛋白Nap, 经Ni2+-NTA树脂纯化后, Bradford法测定蛋白浓度. 用纯化的Nap蛋白免疫鸡, 水稀释结合氯仿有机沉淀法提取IgY. ELISA法测定抗体产生的时间-效价变化. 将效价高的Nap-IgY用硫酸铵沉淀法纯化浓缩, 间接ELISA法检测效价, Bradford法测定蛋白含量. Western blot检测制备的Nap-IgY的抗体活性.
结果: Nap重组蛋白主要以包涵体形式表达, 蛋白含量为0.37 g/L. 免疫鸡的蛋黄提取物可与Nap发生特异性反应, IgY效价随免疫时间增加而升高, 在110 d达最高效价. 经纯化浓缩后, Nap-IgY的效价为1:12800, 蛋白浓度为23.67 g/L.
结论: 成功制备了高浓度、高效价的Nap特异性IgY.
引文著录: 邓颖, 杨致邦, 黄伟, 林珊珊, 黄进, 叶翠莲. 幽门螺杆菌重组中性粒细胞激活蛋白蛋黄抗体的制备. 世界华人消化杂志 2007; 15(5): 471-475
Revised: January 1, 2006
Accepted: January 25, 2006
Published online: February 18, 2007
AIM: To prepare a highly specific and efficient egg yolk immunoglobulin (IgY) against recombinant neutrophil activating protein (Nap) of Helicobacter pylori from the yolk of hen's eggs.
METHODS: Recombinant bacteria of pQE30-NapA-DH5α were cultured in large numbers to collect Nap protein. The recombinant protein was purified by Ni2+-NAT chromatography, and its protein concentration was detected by Bradford method. After laying hens were immunized with recombinant Nap, IgY was isolated by water-dilution (WD) combined chloroform precipitation method. The relationship between IgY titer and immune time was assessed by enzyme-linked immunosorbent assay (ELISA). High-titer IgY was purified and concentrated by ammonium sulphate precipitation. The Nap-IgY titer and protein concentration were measured by indirect ELISA and Bradford method, respevtively, and the activity of Nap-IgY was identified by Western blot.
RESULTS: SDS-PAGE result showed that the recombinant protein was mainly expressed as inclusion bodies. After purification, the protein concentration was 0.37 g/L. The recombinant protein could be recognized by egg yolk extraction. The antibody titer became higher as the increase of immune time, and reached the highest value on the 110th day. The titer and protein concentration were 1:12800 and 23.67 g/L, respectively.
CONCLUSION: Nap-IgY with high concentration, purity and specificity is successfully prepared.
- Citation: Deng Y, Yang ZB, Huang W, Lin SS, Huang J, Ye CL. Preparation of egg yolk immunoglobulin against recombinant neutrophil activating protein in Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2007; 15(5): 471-475
- URL: https://www.wjgnet.com/1009-3079/full/v15/i5/471.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i5.471
幽门螺杆菌(Helicobacter pylori, H. pylori)在全球范围内流行, 是引起人类慢性活动性胃炎、消化性溃疡的重要致病因子, 并与胃腺癌和胃淋巴瘤的发生密切相关[1-2]. H. pylori是一种多致病物质引起病理损伤的细菌, 该菌的致病物质主要有细胞空泡毒素(vacuolating cytotoxin A,VacA)、细胞毒素相关蛋白(cytotoxin-associated proteinA, CagA)、尿素酶、过氧化氢酶、黏附素(Helicobacter pylori adhesin A, HpaA)、中性粒细胞激活蛋白(neutrophil activating protein, Nap)等. H. pylori感染引起的胃黏膜损伤是以中性粒细胞和单核细胞浸润为特征, 其损害程度与中性粒细胞浸润密切相关. 近年的研究表明, Nap在H. pylori引发的炎性细胞浸润所造成的胃黏膜损伤及其转归中起重要的作用,已被认为是H. pylori导致损伤的新的致病因子[3]. 被免疫的鸡蛋黄中含大量来源于血清的IgG, 远高于血清中的浓度, 因该抗体从蛋黄中提取, 故名蛋黄抗体(egg yolk immunoglubilin, IgY). 蛋黄抗体具有化学性质稳定、产量高、成本低等优势, 适合工业化生产特异性抗体, 可以用于抗病毒和细菌性疾病, 具有开发功能性食品和新药的潜能[4]. 现在已有许多学者将其制成口服制剂以防治龋齿、轮状病毒引起的腹泻和其他胃肠道感染性疾病, 并取得满意效果[5-9]. 本研究旨在制备高效价的抗Nap蛋黄抗体(IgY)为研制幽门螺杆菌防治性抗体制剂奠定基础.
DH5α菌株和pQE30质粒, 源于重庆医科大学病毒性肝炎研究所, 本室保存. 重组菌pQE30-Nap-DH5α, 本室研究生构建并保存[10]. 206日龄立克次体产蛋母鸡, 西南大学荣昌分校生物中心提供. HRP标记羊抗鸡IgY为Promega公司产品. 蛋白质Marker为晶美公司产品. Ni2+-NTA亲合层析柱为QIAGEN公司产品. 琼脂粉为日本公司产品. IPTG、SDS、DTT、EDTA、丙烯酰胺、N, N'-亚甲丙烯酰胺、考马斯亮蓝R250、考马斯亮蓝G250均为Sigma公司产品. 胰蛋白胨、酵母抽提物均为Ddifco公司产品. NC膜与DAB显色试剂盒为武汉博士德公司产品.
1.2.1 重组蛋白Nap的表达、纯化和蛋白定量: 挑取一个含有重组质粒pQE30-Nap的阳性克隆DH5α菌落接种于5 mL LA培养基中, 同时以含空pQE30质粒的DH5α为对照, 37℃ 150 r/min振摇过夜培养. 按1:20比例, 吸取菌液转种于盛有100 mL LA培养基的培养瓶中, 于37℃培养至A = 0.6时, pQE30-Nap加入终浓度为0.5 mmol/L的IPTG, 诱导表达5 h; 收集菌液, 4℃, 5000 r/min离心10 min, 弃上清, 沉淀物按3 mL/g湿菌的比例加入超声破碎缓冲液(50 mmol/L NaH2PO4, 300 mmol/L NaCl)碎菌. 然后4℃ 10 000 g离心20 min, 分别收集沉淀与上清. 120 g/L SDS-PAGE分析重组蛋白的表达形式. 在细菌破碎物的沉淀中加入包涵体裂解液(50 mmol/L NaH2PO4, 300 mmol/L NaCl, 8 mol/L尿素), 4℃过夜裂解, 然后4℃, 12 000 g离心15 min, 收集上清, 用Ni2+-NTA树脂亲和层析进行纯化. 120 g/L SDS-PAGE分析纯度, Bradford法测定蛋白含量.
1.2.2 母鸡免疫和IgY的分离: 用纯化的重组Nap和等量完全弗氏佐剂混合, 并充分研磨乳化作为抗原免疫206日龄立克次体产蛋母鸡, 第1次免疫剂量为100 μg/只; 15 d后进行第2次免疫, 剂量为200 μg/只; 之后每隔1 mo进行第3次免疫和加强免疫, 剂量均为300 μg/只. 免疫方式均为胸部肌肉多点注射. 第2次免疫后1 wk开始收集鸡蛋于4℃保存备用. 采用水稀释法结合氯仿有机沉淀法. 基本步骤为: 取出蛋黄液, 加入等体积生理盐水稀释, 加入适量的氯仿然后离心留上清, 上清即含有IgY, 4℃保存备用.
1.2.3 检测Nap-IgY的间接ELISA法: 用重组蛋白Nap作为抗原进行包被. 用包被液稀释为6.0, 8.0, 10.0, 15.0, 20.0, 30.0 mg/L, 每孔100 μL包被聚苯乙烯反应板; 酶标羊抗鸡IgY用酶稀释液作1:5000, 1:10000, 1:20000, 1:40000稀释; Nap-IgY用样品稀释液作1:20, 1:50, 1:100, 1:200稀释. 方阵滴定法确定最佳抗原包被浓度, 酶标二抗工作浓度和一抗的工作浓度. 测定5份免疫前的鸡蛋提取的IgY的A450值, 并计算平均值作为阴性对照. 测定免疫后提取的IgY, 以免疫后与免疫前IgY的A450值之比大于2.1判为阳性. 将未免疫和第一次免疫后不同时间提取的IgY用样品稀释液稀释成一定浓度, 用所建立的ELISA法测定其效价. 将免疫后效价较高的IgY分别混合, 用常规饱和硫酸铵法纯化. 用已建立的检测IgY的ELISA法测定IgY效价; Bradford法测定蛋白含量.
1.2.4 Nap-IgY抗原性的Western blot鉴定: 以诱导表达的全菌进行150 g/L SDS-PAGE电泳, 将凝胶上的蛋白质点转移到硝酸纤维素(NC)膜上. 用封闭液作用2 h封闭非特异性位点. PBS洗膜后分别加上1:200的Nap-IgY作为一抗, 室温转摇2 h, 再用PBS洗膜. 然后加入1:5000稀释的HRP标记羊抗鸡IgY, 室温作用2 h, 去出后再用PBS洗膜, 最后用DAB显色.
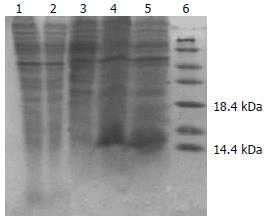
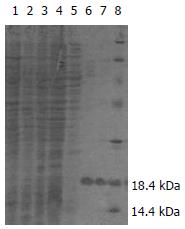
SDS-PAGE分析表明破碎菌的沉淀物可见明显特异蛋白表达带, 占96%, 上清液中无明显表达带(图1). 将收集的破碎菌的沉淀洗涤后变性溶解, 以NI2+-NTA柱纯化, 经SDS-PAGE和图像分析表明, 纯化产物主要存在于前2管洗脱液中, 纯度为92.8%(图2). Bradford法测定蛋白含量为0.37 g/L.
方阵滴定法确定的最佳工作浓度是; 抗原包被浓度为15 mg/ L, 样品稀释度为1:50, 酶标羊抗鸡IgY的稀释度为1:10000. 阴性IgY平均值为0.112. 在上述实验条件下, A450>0.235时, 判为阳性, A450≤0.235判为阴性. ELISA法检测结果发现, 免疫时间和抗体效价的变化总体上呈现上升趋势. 在第一次免疫重组蛋白Nap后30 d(PID30)左右抗体效价达到1:800, 随后虽A值呈现出一定的升降变化, 但抗体效价基本维持在1:1600, 在第一次免疫后75 d(即PID75)时效价则上升到1:3200, 第1次免疫后110 d左右(PID110)达到1:6400, 并可维持一定时间(表1). Nap-IgY纯化浓缩后的效价为1:12800, 蛋白浓度为23.67 g/L.
| 免疫时间(d) | IgY 在不同稀释浓度下的A450 值 | IgY滴度 | ||||
| 1∶400 | 1∶800 | 1∶1600 | 1∶3200 | 1∶6400 | ||
| PID30 | 0.389 | 0.246 | 0.215 | 0.167 | 0.103 | 1∶800 |
| PID45 | 0.439 | 0.392 | 0.245 | 0.125 | 0.120 | 1∶1600 |
| PID60 | 0.578 | 0.451 | 0.256 | 0.202 | 0.098 | 1∶1600 |
| PID75 | 0.598 | 0.426 | 0.401 | 0.269 | 0.158 | 1∶3200 |
| PID100 | 0.857 | 0.802 | 0.567 | 0.427 | 0.235 | 1∶6400 |
| PID110 | 0.908 | 0.725 | 0.513 | 0.402 | 0.240 | 1∶6400 |
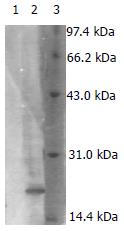
NC膜显色后在相对分子量约17 000处出现相应的条带, 大小和预期的一致(图3), 说明Nap-IgY具有良好的抗原性.
大量研究表明, H. pylori与慢性、活动性胃炎和消化性溃疡密切相关, 同时也是胃肿廇的危险因素. 我国普通人群中的感染率为50%-60%, 并以每年1%-2%的速度增加[11]. 预防H. pylori感染具有重要的现实意义. 对已感染者的大量研究表明, 多种抗生素和铋剂的联合应用是清除H. pylori的有效方法, 但10%-15%的病例由于细菌产生耐药性而治疗失败. 而且随着抗生素的应用, 耐药菌株不断增加. 随着对H. pylori致病机制和基因组结构与功能认识的逐步深入, 免疫疗法被认为是防治H. pylori感染最有效最有前景的方法之一[12-17].
H. pylori感染的胃黏膜损伤主要表现为炎症反应[18], 而H. pylori的中性粒细胞激活蛋白NAP可以诱导中性粒细胞黏附于内皮细胞上, 这种黏附作用与中性粒细胞表面的CDb/CD18整合素的表达量呈正相关. Satin以纯化重组的H. pylori -Nap口服免疫10只小鼠, 结果80%个体获得了保护性免疫, 高于CagA(70%), 低于H. pylori超声裂解物(90%), 此结果也提示Nap作为H. pylori主要的毒力因子, 可以作为有效的保护性抗原用于H. pylori感染的疫苗防治.
IgY是抗胃肠道感染的有效制剂. Mine et al [19]总结了IgY的治疗作用后表明口服特异性IgY抗体的被动免疫替代抗生素可以成功的治疗许多胃肠道感染性疾病. 故本实验选择Nap作为抗原来免疫产蛋母鸡获得特异性的IgY. H. pylori培养物制备的IgY的抗感染作用虽有报道[9], 但用重组Nap制备的IgY国内外尚未见报道. IgY是一种免疫球蛋白(Ig), 提纯方法与提纯IgG相似, 纯化的方法很多, 采用浓度为25%-40%的硫酸铵来沉淀IgY, 可得到较纯的IgY, 费用也低, 适合于标准化的大规模生产IgY, 这也是现在大量粗提IgY最常用的方法. 当然, 进一步纯化IgY的最好的方法是亲和层析, 得到的IgY纯度更高, 但在洗脱过程中可能会造成IgY变性, 产率也低. 本实验用水稀释法结合氯仿有机沉淀法提取IgY, 用不同浓度硫酸铵沉淀法纯化并浓缩IgY, 取得了良好的效果: 纯度较高; ELISA和Western的结果显示制备的IgY能与Nap发生反应, 表明其具有相应的抗原性; 而且保证了其抗体活性, 可满足本实验要求.
IgY抗体不仅安全性好, 而且鸡蛋来源丰富、抗体含量高、稳定性好、提取方法简便, 作为口服药物防治H. pylori感染将具有广阔的前景. 本实验成功制备了高浓度、高效价的特异性IgY, 为进一步制备抗H. pylori感染的口服IgY制剂和食品添加剂奠定了基础.
随着研究的深入,幽门螺杆菌已被确定为慢性胃炎的一个重要的致病因素, 同时又是消化性溃疡及胃癌发生的危险因素, 1994年国际癌症研究机构已将其列为 1 类致癌原, 蛋黄抗体应用研究十分活跃, 其最基本又最重要的生物学功能与IgG相似, 具有中和病毒、抑杀细菌和中和毒素等抗病防御作用, 是消化道传染病的有效治疗和预防药物.
近年来蛋黄抗体用于人类疾病防治的研究经开始, 用于防治人HIV和HCV感染的IgY由Kobilk e和 Tsolkas(1996)报道, 国内郭立君et al(1997)报道了抗轮状病毒IgY的免疫保护作用, 常山et al(2001)报道了抗白色念珠菌IgY的应用研究, 王忠泽et al(2002)报道了抗大肠杆菌O157:H7鸡蛋黄 抗体的制备及被动保护作用.
制备H. pylori融合蛋白的IgY, 可成为集预防、治疗为一体的口服特异抗体制剂, 也可制成冲剂和加入饮料中服用, 具有广泛的应用前景和重大的经济效益.
IgY: 蛋黄抗体即蛋黄中的免疫球蛋白, 是母禽血清中的IgG经受体介导主动转运到卵黄中富积形成.
根据蛋黄抗体的特点, 制备的抗H. pylori IgY更能有效的防治H. pylori感染, H. pylori的IgY将为H. pylori感染的防治开辟新的途径. 国内已有研究H. pylori-Nap基因重组减毒鼠伤寒沙门菌口服DNA疫苗, 但用重组Nap制备的IgY国内外尚未见报道. 本研究具有创新性及良好的应用前景.
电编: 李琪 编辑:张焕兰
| 1. | Christian Prinz, Susanne Schwendy, Petra Voland. H. pylori and gastric cancer:shifting the global burden. World J Gastroenterol. 2006;12:5458-5464. |
| 2. | Karolin Trautmann, Manfred Stolte, Stephan Miehlke. Eradication of H. pylori for the prevention of gastric cancer. World J Gastroenterol. 2006;12:5101-5107. |
| 3. | Barbara S, Giuseppe DG, Vittorina DB, Stefano D, Carlo L, Fiorella , T , Dermot , K , Rino R. The Neutrophil-activating Protein(Hp-NAP) of Hp is a Protective Antigen and a Major Virulence Factor. J.Exp. 2000;1467-1476. |
| 5. | Nomura S, Suzuki H, Masaoka T, Kurabayashi K, Ishii H, Kitajima M, Nomoto K, Hibi T. Effect of dietary anti-urease immunoglobulin Y on Helicobacter pylori infection in Mongolian gerbils. Helicobacter. 2005;10:43-52. [PubMed] |
| 6. | Suzuki H, Nomura S, Masaoka T, Goshima H, Kamata N, Kodama Y, Ishii H, Kitajima M, Nomoto K, Hibi T. Effect of dietary anti-Helicobacter pylori-urease immunoglobulin Y on Helicobacter pylori infection. Aliment Pharmacol Ther. 2004;20:185-192. [PubMed] |
| 7. | Shin JH, Nam SW, Kim JT, Yoon JB, Bang WG, Roe IH. Identification of immunodominant Helicobacter pylori proteins with reactivity to H. pylori-specific egg-yolk immunoglobulin. J Med Microbiol. 2003;52:217-222. [PubMed] |
| 8. | Horie K, Horie N, Abdou AM, Yang JO, Yun SS, Chun HN, Park CK, Kim M, Hatta H. Suppressive effect of functional drinking yogurt containing specific egg yolk immunoglobulin on Helicobacter pylori in humans. J Dairy Sci. 2004;87:4073-4079. [PubMed] |
| 9. | 陈 翠萍, 杨 朝晖, 王 永谦. IgY抗体在体外和体内对幽门螺杆菌作用的研究. 中华微生物和免疫学杂志. 2002;22:37-40. |
| 11. | Pounder RE, Ng D. The prevalence of Helicobacter Pylori infection in different countries. science. 1995;267:17. |
| 12. | Micbetti P. Oral Immunization against Helicobacter pylori-a future concept. J Gastroenterol. 1998;33:66-72. |
| 14. | Andreas Leodolter, Matthias P Ebert, Ulrich Peitz, Kathlen Wolle, Stefan Kahl, Michael Vieth, Peter Malfertheiner. Prevalence of H. pylori associated "high risk gastritis" for development of gastric cancer in patients with normal endoscopic findings. World J Gastroenterol. 2006;12:5509-5512. |
| 16. | 米 宏杰, 王 瑞华, 徐 冰. 幽门螺杆菌菌苗及免疫相关问题研究进展. 中华临床医学研究杂志. 2006;12:2383-2383. |
| 18. | Bourke, Billy MD; Jones, Nicola L. MD, PhD.Pathogenesis of Helicobacter pylori infection. Gastrointestinal infections. 2001;17:24-29. |
| 19. | Mine Y, Kovacs-Nolan J. Chicken egg yolk antibodies as therapeutics in enteric infectious disease:a review. J Med Food. 2002;5:159-69. |