修回日期: 2006-11-01
接受日期: 2006-11-16
在线出版日期: 2007-02-08
目的: 探讨消化系统神经内分泌癌(NEC)发生部位、临床表现、内镜及影像学特点、病理特征、诊断和鉴别诊断、治疗及预后.
方法: 将我院2000-2005年收治的7例NEC病例和文献检索的202例病例分为A、B两组, 分别探讨消化系统NEC临床特点, 治疗和预后.
结果: 消化系统NEC临床表现多为无功能NEC, 以局部占位及消耗症状为主, 壶腹周围NEC可以急性胰腺炎发作为首发表现; 有功能的NEC例数约占2.4%. 大小在0.5-13.0 cm, 分为典型类癌、不典型类癌和小细胞癌, 确诊需要进行突触素(Syn)、细胞角蛋白(CK)、神经特异性烯醇化酶(NSE)、嗜铬素A(CgA)、上皮膜抗原(EMA)等的免疫组化检查和(或)电镜检查发现神经内分泌颗粒(NSG). 以手术治疗为主, 辅以化疗、放疗, 必要时栓塞化疗, 也可以辅以生物治疗. 对于有功能的NEC, 首先需要控制因激素分泌过多所致的相关类癌综合征. 小细胞癌预后最差, 不典型类癌次之, 类癌预后较好, 5 年生存率可达70%. 肿瘤的大小、转移与否、手术切除是否彻底等等亦是影响预后的重要因素.
结论: 消化系统NEC发生部位以胃、胰腺、直肠等部位多见, 临床表现多样, 少数可有类癌综合征表现, 治疗方法以手术为主, 辅以放化疗及生物治疗或介入治疗, 根据病理类型判断其恶性程度和预后.
引文著录: 蒋建霞, 施瑞华, 林琳. 消化系神经内分泌癌及文献分析209例. 世界华人消化杂志 2007; 15(4): 421-426
Revised: November 1, 2006
Accepted: November 16, 2006
Published online: February 8, 2007
AIM: To analyze the originating sites, clinical manifestations, endoscopic and imaging features, pathologic findings, treatments and prognosis of patients suffered from neuroendocrine carcinoma (NEC) in digestive system.
METHODS: A total of 209 cases, of which 7 cases were from our hospital and the other 202 cases were reported in literatures from 1994 to 2005, were classified as group A and B, respectively. Clinical presentation, therapy and prognosis of NEC arising from digestive system were discussed.
RESULTS: NEC mainly occurred in stomach, pancreas, rectum, esophagus, small intestine, Vater ampullae of duodenum, liver and so on, and it had a wide spectrum of clinical presentations such as abdominal pain, epigastric distention, symptoms of wasting. Periampullary NEC might cause (recurrent) acute pancreatitis, and most of them were non-functioning neoplasms. Only about 2.4% of NEC cases presented an endocrine syndrome. NEC was classified as typical carcinoid, atypical carcinoid and small cell carcinoma, and its masses varied from 0.5 to 13.0 cm in diameter, and the diagnosis of NEC depended on the features of endoscopic examination, B-ultrasound (BUS), computed tomography (CT), endoscopic retrograde cholangiopancreatography (ERCP), endoscopic ultrasonography (EUS) and pathologic findings, especially immunohistochemical markers such as synaptophysin (Syn), cytokeratin (CK), neuro-specific enolase (NSE), chromogranin A (CgA), epithelial membrane antigen (EMA) and (or) neurosecretory granules (NSG) observed through electronic microscopy. Operation was the dominant strategy in the treatment of NEC, assisted by post-operative chemotherapy, radiotherapy, chemoembolization or biotherapy. The initial treatment of functioning NEC was to control the symptoms caused by excessive hormonal production. Typical carcinoid had a better prognosis than atyptical carcinoid or small cell carcinoma, and the 5-year survival rate was as high as 70%. Other important prognostic factors consisted of the size of the mass, metastasis, and the type of surgical resection.
CONCLUSION: NEC in digestive system often originates from stomach, pancreas, rectum, etc. It has miscellaneous clinical manifestations and rare cases have carcinoid syndrome. The diagnosis of NEC mainly depends on pathologic findings and operation is the first-line treatment. The prognosis of NEC is also correlated with the pathologic classifications.
- Citation: Jiang JX, Shi RH, Lin L. Neuroendocrine carcinoma in digestive system: case analysis and literature review. Shijie Huaren Xiaohua Zazhi 2007; 15(4): 421-426
- URL: https://www.wjgnet.com/1009-3079/full/v15/i4/421.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i4.421
消化系统神经内分泌癌(NEC)较罕见, 文献报道约占消化系统恶性肿瘤0.4%-1.8%, 其生物学特性、恶性程度、病理学特征及预后差异很大, 临床表现不典型, 病理诊断标准也不统一, 以致影响临床治疗及预后判断. 本文通过总结209例消化系统NEC病例, 对其发生部位、临床表现、内镜及影像学特点、病理学特征、诊断和鉴别诊断、治疗及预后作了相应的总结.
我院2000/2006收治的7例NEC患者发病年龄37-78 (平均48)岁, 其中男4例, 女3例. 检索出符合条件的NEC患者202例(国内142例, 国外60例), 年龄19-83(平均51)岁, 其中男113例, 女89例. 对中国学术期刊网(CNKI)和PUBMED进行文献检索(文献时间为1994/2005, 检索词为神经内分泌癌及消化系统脏器如食管、胃、小肠、结肠、肝、胆、胰等等, 将发生于消化系统的NEC逐一检出并按发生部位归类), 检索出符合要求并且资料完整的消化系统NEC文献74篇并予以统计.
将209例消化系统NEC分为A、B两组, A组为7例NEC患者, B组为检索出的符合要求的202例病例. 分析消化系统NEC的发生部位、临床表现、内镜及影像学检查、病理特点及免疫组化、诊断和鉴别诊断、治疗及预后.
A、B组NEC的发生部位见表1. 国内统计的文献尚未有胰腺和壶腹部NEC的报道, 但有1例脾脏NEC的报道.
A组临床表现以上腹痛、黄疸、消瘦、发热为主, 亦有体检发现(1/7例), 病程1 d-1 年. B组病程15 d-3 年. 食管NEC表现为进行性吞咽困难(15/20), 吞咽疼痛(5/20), 2例食管NEC发生脑转移后以头痛为首发表现; 胃NEC多为上腹部不适, 隐痛或胀痛, 或出现幽门梗阻症状, 1例胃NEC起源于胃的异位胰腺, 表现为消化不良及腹泻; 肝脏NEC表现为上腹胀、隐痛不适、纳差等; 胆囊NEC多表现为右上腹不适、疼痛、发热等; 胰腺NEC的主要表现为发热、黄疸、上腹部不适及疼痛、腰背部痛、消瘦等, 亦有仅通过体检发现, 1例表现为急性复发性胰腺炎3年后确诊[1], 1例由肺部小细胞癌转移到胰腺, 以左锁骨上淋巴结肿大及重症急性胰腺炎为首发表现[2]; 脾脏肿瘤罕见, NEC更为少见, 缺乏特异的症状体征, 经术前普通B型超声B-US等影像检查发现, 确诊依赖于术后病理[3]; 小肠NEC主要表现为肠梗阻症状; 十二指肠NEC主要表现为皮肤巩膜黄染, 尿黄及肠梗阻症状; 阑尾NEC多以急性阑尾炎的发作为首发表现, 术前诊断非常困难, 确诊依赖于手术后病理; 结肠NEC主要表现为血便、大便习惯改变、下腹包块; 直肠NEC除出现血便, 大便习惯改变外, 可有肛门坠胀, 直肠肿块. 文献报道, 极少数患者(1.6%)的胃肠道类癌患者会出现类癌综合征症状, 且往往提示有类癌的扩散, 如肝转移, 应高度重视. 本文仅2.4%的病例(5/209例)出现了类癌综合症. 1例肝脏原发NEC表现为异位ACTH综合征. 1例原发灶不明, 转移到肝脏的NEC表现为WDHA (watery-diarrhea-hypokalemia-achlorhydria, 水样泻、低血钾、胃酸缺乏)综合征[4]. 1例表现为胃泌素分泌过多致腹痛、腹泻. 1例因生长抑素(SS)过多分泌表现为糖尿病、脂肪泻、胆囊炎. 1例表现为血管活性肠肽(VIP)分泌过多所致的WDHA综合征.
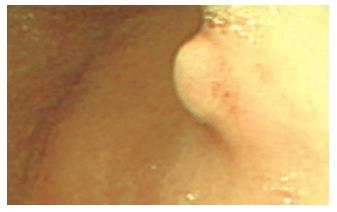
胃及肠道NEC内镜下可表现为糜烂型、斑块型、溃疡型、息肉型(图1)、结节型、隆起型、蕈伞型, 与腺癌及一些良性病变如息肉、腺瘤等不易区分, 内镜活检常出现假阴性诊断, 小组织活检常因取材表浅发生漏诊或误诊, 因此取材时应尽量深取; 胆囊NEC表现为胆囊壁隆起性病变, 无论B超、CT或MRI, 与胆囊腺癌及其他少见组织学类型的肿瘤鉴别均较困难, 确诊需要病理检查, 影像学检查的意义在于早期发现胆囊占位及周围浸润情况, 以便确定治疗方案; 结合文献认为原发肝脏NEC具有以下影像特征: (1)肝脏肿瘤超声表现: 肝内不均匀强回声或低回声肿块, 内常有小坏死液化区, 肿瘤血供丰富, 动脉血流为低阻力型频谱, 肿瘤广泛出血坏死时则形成巨大囊实性肿块; (2)CT表现: 肝脏内不均匀低密度肿块, 内常有小坏死液化区, 肿瘤广泛出血坏死时则形成巨大囊实性肿块, 动态增强CT扫描早期肿瘤为不均匀增强, 晚期肿瘤逐步转变为等密度及低密度; (3)MRI表现: TwI为不均匀低信号, TwII为不均匀强信号; (4)肝动脉造影: 显示肿瘤血管丰富, 肿瘤明显染色, 当肿瘤坏死、出血及囊性变时, 血管造影表现为瘤体内无血管, 瘤周血管受压移位征象[5]. 符合以上影像特征, 患者无肝硬化病史时, 应想到该病可能性, 但仍需和其他肝脏肿瘤以及炎性肉芽肿等鉴别; 胰腺NEC, B-US可能提示为低回声占位, 伴随胰、胆管扩张, CT平扫提示低密度软组织占位征象, 增强扫描可被强化, 及发现肿大的淋巴结, 另外可通过ERCP检查及细针穿刺确诊, MRI、经内镜超声检查也是诊断胰腺、壶腹周围NEC的重要检查方法; 食管NEC脑转移MRI表现为囊性损害及周围薄层强化灶[6]; 核素显像对于诊断NEC同样有重要价值; 国外还报道通过直肠内MRI (EMRI)和内镜超声检查术(EUS)诊断直肠NEC.
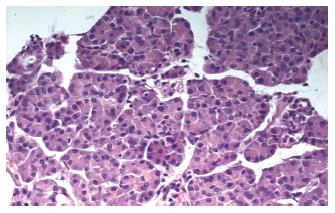
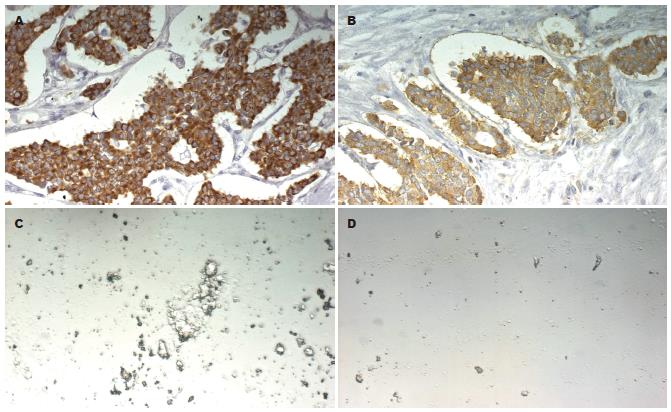
巨检肿瘤大小, A组为0.5-3.5 cm, B组1.0-13.0 cm, 其中能分泌生长抑素(SS)的NEC直径多小于4 cm[7]. 1例肝脏NEC发生肝内转移及横结肠系膜转移, 大小达10 cm×8 cm×8 cm. NEC多为单发, 可呈早期糜烂型、斑块型、溃疡型、隆起型、息肉型、结节型. 国外报道1例发生于胰腺体部的NEC, 直径为3.0 cm, 肿瘤内含3个独立的结节, 分别为0.4 cm, 0.9 cm和2.4 cm, 每个结节周围均有纤维样包膜, 结节由大量纤维间质分隔, 我院同样发现1例胰腺NEC表现为多发独立结节. 分期可分为早期和中晚期癌. 早期癌(65/209例)浸润深度不超过黏膜下层, 可有包膜, 体积多小于2.0 cm×2.0 cm×0.5 cm; 中晚期癌(144/209)可浸润肌层、浆膜层甚至邻近脏器, 表面多无包膜, 边界不清, 切面呈灰白色, 质地硬, 可有出血. 分型则根据Ackerman外科病理学和 Tahara分类标准分为3型[8-9], 即I型: 典型类癌(79/209例), 镜下特点为癌细胞形态较一致, 中等大小, 胞质较丰富, 呈淡嗜伊红色或透亮, 核呈圆形、卵圆形, 居中, 核分裂相罕见, 癌组织排列较规则, 形成巢状、岛屿状、梁索状或腺泡状、小管状结构, 无坏死(图2). 其中胃类癌多发生于胃底及胃体部, 极少发生在胃窦部[10]. Ⅱ型: 不典型类癌(55/209例), 镜下特点为癌细胞形态不一, 大小不等, 呈圆形、卵圆形或短梭形, 胞质中等量, 核呈圆形或卵圆形, 染色质颗粒粗, 核分裂易见, 癌细胞排列成巢或片块状、腺管状及菊形团样结构, 坏死多见, 此型类癌易误诊为低分化腺癌, 但是与腺癌比较起来, 瘤细胞总体形态较一致, 常排列呈巢、条索或小梁状, 具有器官样或菊形团样结构等, 有助于鉴别, 另外可借助于免疫组化染色, 腺癌突触素(Syn), 细胞角蛋白(CK), 神经特异性烯醇化酶(NSE), 嗜铬粒蛋白(CgA), 细胞膜抗原(EMA)均呈阴性表达, 不典型类癌则呈阳性; Ⅲ型: 小细胞癌(75/209例), 镜下特点为癌细胞体积小, 较一致, 胞质稀少或呈裸核状, 核呈圆形、卵圆形或短梭形, 深染, 细胞界限不清, 弥漫排列成片或呈巢团状, 并可见大片坏死, 有的还可见菊形团样结构, 易与恶性淋巴瘤、胚胎型横纹肌肉瘤、小细胞性恶性黑色素瘤等小细胞肿瘤混淆, 需根据免疫组化相关标记物确诊[11]. NEC电镜下可见神经内分泌颗粒(NSG)及张力原纤维、桥粒等结构, 其中NSG是电镜诊断NEC的依据. 其中16/209例为复合型癌, 即癌细胞为混合性, 鳞状细胞和(或)腺细胞和NEC细胞共存, 根据Tahara标准诊断为NEC并且予以分类[9]. Syn, CK, NSE, CgA, EMA是目前公认的神经内分泌标记(图3), 阳性颗粒见于胞质内, 2-3种标记同时阳性较有说服力.
食管、胃及肠道NEC的临床表现与普通胃肠道腺癌并无显著差异, 极少数可有典型的类癌综合征, 而十二指肠NEC更为罕见, 确诊主要经内镜活检及EUS引导下细针穿刺活检; 阑尾NEC术前诊断非常困难, 绝大多数通过术后经病理证实; 肝脏NEC常位于肝右叶, 多为l-2个结节, 少数为多个结节, 病程长, 进展慢, 宜经B-US或CT引导下穿刺活检以诊断; 胆囊、胰腺NEC早期临床表现及影像学检查与常见胆囊病变及胰腺癌不易鉴别, 但发生于壶腹部或壶腹周围的NEC会出现胰胆管梗阻表现甚至急性胰腺炎, ERCP和EUS对诊断壶腹及其周围NEC更有价值; 转移到肝脏、胰腺等的NEC可能会出现肝脏组织的坏死、(重症)急性胰腺炎, 通过影像学检查B-US, CT, MRI, 支气管镜等寻找原发灶. NEC的诊断除了综合临床表现、内镜及影像学检查结果外, 确诊依赖内镜下组织活检, 或经B-US, CT, EUS引导下的细针穿刺及手术标本的病理检查, 而且病理诊断时应综合光镜、组织化学及免疫组化染色甚至电镜技术结果. Ryschich et al[12]报道转铁蛋白受体是诊断胰腺NEC和胰腺癌的有价值的指标之一, 有待进一步研究证实. 总结本研究病例, 胃肠道NEC转移, 多见于肝脏, 另外可转移至腹膜、淋巴结、骨骼等.
2.6 治疗及预后 手术仍为治疗的首选方法, 部分病例经手术可以治愈, 如1例发生于胃内异位胰腺的NEC 85岁男性患者, 因一般情况较差, 仅进行了病灶的楔形切除, 患者恢复良好[13]. 另外术后辅以化疗及放疗, 可提高生存率, 1例63岁男性患者, 食管小细胞癌累及贲门及纵隔淋巴结, 经CDDP(顺铂)和VP-16(依托泊苷)化疗6个疗程后长期生存[14]. 肝动脉栓塞化疗术对部分不能手术肝NEC病例有一定疗效. 对于肝脏转移性NEC, 可在手术切除原发灶、化疗、生物治疗(生长抑素类似物奥曲肽、干扰素治疗)基础上, 进行肝内转移病灶的手术治疗及肝脏移植[15-16]. 需要强调的是, 尽管发生类癌综合征致类癌危象的病例非常罕见, 预防发生类癌危象及对类癌危象及时而正确的治疗尤为重要. 小细胞癌属于高度恶性, 早期即呈弥漫性浸润性生长, 难以发现, 淋巴结转移早, 预后差, 不典型类癌预后亦较差, 只有类癌预后较好, 5 年生存率可达70%, 不典型类癌次之, 但仍优于低分化腺癌, 小细胞癌预后最差. 影响患者预后的因素还包括(1)肿瘤的直径大小, 若大于2 cm, 转移率高, 预后也较差; (2)肿瘤局部侵袭和转移情况, 是否存在肝转移对预后亦有重要影响; (3)对原发和转移病灶行根治性清除者预后较好; (4)有类癌综合征表现者一般预后较差. 本研究3种类型1 年生存率分别为73.1%, 63.4%和61.7%. 对于消化系统NEC要争取早发现, 早治疗, 选择手术、放疗、化疗等综合治疗措施, 以提高生存率.
消化系统NEC起源于胺前体摄取和脱羧 (APUD)细胞, APUD细胞系统是指能摄取胺和胺前体并在细胞内脱羧产生胺和(或)肽类激素的内分泌细胞总称. 近年来随着APUD细胞类型和分布的不断扩展, 发现神经系统内的许多神经元也具有与APUD细胞相同内分泌功能, 称分泌性神经元(secretory neuron), 因此提出了弥散神经内分泌系统(diffuse neuroendocrine system, DNES)这一概念, DNES把神经系统和内分泌系统统一起来构成一个整体, 共同调节机体生理活动的平衡. DNES分中枢和周围两大部分, 中枢部分包括下丘脑-垂体轴的细胞和松果体细胞; 周围部分包括分布在消化系统胃、胰、肝脏、胆、阑尾、结、直肠及呼吸、泌尿生殖道等的内分泌细胞.
近年来, 多数学者认为DNES细胞来源于全能干细胞, 在致癌因素作用下全能干细胞活化并转化为恶性细胞, 他既可转变为鳞癌, 也可转变为腺癌[17], 在少数情况下, 他保持其小细胞形态, 因此具有向鳞癌、腺癌和(或)NEC三相分化的潜能. 消化系统NEC发生率据文献报道及文献复习, 远低于其他类型的恶性肿瘤. 但Waldum et al[18]通过前瞻性研究胃癌组织的组织化学、免疫组化、电镜表现证实约10%为NEC, 远比报道的高. Tezel et al[19]通过对44例胰腺癌患者标本分析, 发现有20例具有NED特点, 由于胰腺NEC较一般的胰腺腺癌预后要好, 所以对胰腺癌病理标本要深入分析有无神经内分泌分化倾向及能否确诊NEC, 以指导治疗和判断预后. Yang et al[20]成功建立了转基因斑马鱼发生胰腺NEC的模型, 将对研究NEC的发生、发展、治疗及预后具有重要价值. 对其他消化系统恶性肿瘤标本有必要深入探讨有无NEC分化倾向, 为指导治疗和判断预后, 目前此方面的工作开展尚不足.
消化系统神经内分泌癌(NEC) 较罕见, 其生物学特性、恶性程度、病理学特征及预后差异很大, 临床表现不典型, 病理诊断标准也不统一, 以致影响临床治疗及预后判断. 本文对消化系神经内分泌癌的发生部位、临床表现、内镜及影像学特点、病理学特征、诊断和鉴别诊断、治疗及预后作了相应的总结.
消化系统NEC起源于弥散神经内分泌系统(DNES)的周围部分, DNES细胞来源于全能干细胞, 在致癌因素作用下全能干细胞活化并转化为恶性细胞,具有向鳞癌、腺癌和(或)NEC三相分化的潜能.
本文相当系统的总结了消化系的神经内分泌癌的临床特点、治疗及预后, 不只局限于消化系统的某个脏器神经内分泌癌.
临床医生通过对消化系统神经内分泌癌系统的全面了解, 会更清楚的认识到这一罕见疾病, 减少漏诊或误诊, 同时提醒临床医生, 对消化系统常见的肿瘤有必要进一步研究是否存在神经内分泌分化倾向, 从而指导治疗、判断预后.
神经内分泌癌: 源于神经嵴的弥散分布在全身各器官的神经内分泌细胞具有摄取胺的前身物质经脱羧而形成多肽激素的功能, 称为APU D细胞. APUD细胞与分泌性神经元(secretory neuron)合称为弥散神经内分泌系统(DNES), 发生于DNES肿瘤称为神经内分泌肿瘤, 恶性的即称为神经内分泌癌. 此类肿瘤常同时分泌多种激素或激素样物质, 如甲状腺的 髓样癌除分泌降钙素外, 还可分泌生长抑素、前列腺素、5-羟色胺等, 从而引起多种复杂的症状, 甚至引起内分泌障碍.
本文通过7例病例报告合并文献检索, 探讨了消化系统神经内分泌癌发生部位、临床表现、内镜及影像学特点、病理特征、诊断和鉴别诊断、治疗及预后, 内容很好,有临床指导价值.
电编: 李琪 编辑:王晓瑜
| 1. | Jukemura J, Montagnini AL, Perini MV, de Almeida JL, Rodrigues JJ, da Cunha JE. Acute pancreatitis associated with neuroendocrine tumor of the pancreas. JOP. 2006;7:56-61. [PubMed] |
| 2. | Papagiannis A, Zarogoulidis K, Delis D, Patakas D. A 52-year-old man with a lung mass and acute abdominal pain. Chest. 2000;117:894-896. [PubMed] |
| 4. | Rammer M, Kirchgatterer A, Hobling W, Stockhammer M, Knoflach P. W.D.H.A. Syndrome due to occult neuroendocrine malignancy with concomitant liver metastases. Z Gastroenterol. 2003;41:185-189. [PubMed] |
| 6. | Takeshima H, Kuratsu J, Nishi T, Soyama N, Miura M, Masumitsu T, Ushio Y. Metastatic brain tumours from oesophageal carcinoma: neuro-imaging and clinicopathological characteristics in Japanese patients. Acta Neurochir (Wien). 2001;143:31-35, discussion 35-36. [PubMed] |
| 7. | Delcore R, Friesen SR. Gastrointestinal neuroendocrine tumors. J Am Coll Surg. 1994;178:187-211. [PubMed] |
| 9. | Tahara E, Haizuka S, Kodama T, Yamada A. The relationship of gastrointestinal endocrine cells to gastric epithelial changes with special reference to gastric cancer. Acta Pathol Jpn. 1975;25:161-177. [PubMed] |
| 12. | Ryschich E, Huszty G, Knaebel HP, Hartel M, Buchler MW, Schmidt J. Transferrin receptor is a marker of malignant phenotype in human pancreatic cancer and in neuroendocrine carcinoma of the pancreas. Eur J Cancer. 2004;40:1418-1422. [PubMed] |
| 13. | Chetty R, Weinreb I. Gastric neuroendocrine carcinoma arising from heterotopic pancreatic tissue. J Clin Pathol. 2004;57:314-317. [PubMed] |
| 14. | Ohmura Y, Takiyama W, Mandai K, Doi T, Nishikawa Y. Small cell carcinoma of the esophagus: a case report. Jpn J Clin Oncol. 1997;27:95-100. [PubMed] |
| 15. | Norton JA, Warren RS, Kelly MG, Zuraek MB, Jensen RT. Aggressive surgery for metastatic liver neuroendocrine tumors. Surgery. 2003;134:1057-63; discussion 1063-1065. [PubMed] |
| 16. | Hengst K, Nashan B, Avenhaus W, Ullerich H, Schlitt HJ, Flemming P, Pichlmayr R, Domschke W. Metastatic pancreatic VIPoma: deteriorating clinical course and successful treatment by liver transplantation. Z Gastroenterol. 1998;36:239-245. [PubMed] |
| 18. | Waldum HL, Aase S, Kvetnoi I, Brenna E, Sandvik AK, Syversen U, Johnsen G, Vatten L, Polak JM. Neuroendocrine differentiation in human gastric carcinoma. Cancer. 1998;83:435-444. [PubMed] |
| 19. | Tezel E, Nagasaka T, Nomoto S, Sugimoto H, Nakao A. Neuroendocrine-like differentiation in patients with pancreatic carcinoma. Cancer. 2000;89:2230-2236. [PubMed] |
| 20. | Yang HW, Kutok JL, Lee NH, Piao HY, Fletcher CD, Kanki JP, Look AT. Targeted expression of human MYCN selectively causes pancreatic neuroendocrine tumors in transgenic zebrafish. Cancer Res. 2004;64:7256-7262. [PubMed] |