修回日期: 2006-11-01
接受日期: 2006-11-16
在线出版日期: 2007-02-08
目的: 在大鼠结肠炎的模型中, 研究表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)的治疗作用及其抗氧化损伤作用的机制.
方法: SD大鼠60只, 随机分为正常对照组(n = 10)、模型安慰剂组(n = 20)、EGCG治疗组(n = 15)、柳氮磺吡啶(SASP)治疗组(n = 15). 正常组常规饲养, 模型安慰剂组、EGCG组、SASP组80 g/L乙酸造模后分别予以生理盐水2 mL/d、EGCG 50 mg/(kg•d)、SASP 0.25 g/(kg•d)灌胃治疗7 d, 观察大鼠活动状态, 进食量, 体质量, 大便性状, 大便出血情况, 计算疾病活动指数(DAI), 判断疗效. 第8天处死大鼠并进行结肠黏膜损伤指数(CMDI)评分, 组织学评级, 测定组织一氧化氮自由基(NO)、脂质过氧化产物丙二醛(MDA)以及超氧化物歧化酶(SOD)含量.
结果: 与模型安慰剂组相比, EGCG显著改善DAI(1.1±0.9 vs 3.9±0.4, P<0.01)、CMDI(1.5±0.9 vs 3.3±0.6, P<0.05)和组织学评级(4.6±3.1 vs 9.3±2.8, P<0.01). 与SASP组相比, EGCG显著改善DAI(1.1±0.9 vs 3.0±1.2, P<0.01)、CMDI(1.5±0.9 vs 2.3±0.9, P<0.05)和组织学评级(4.6±3.1 vs 7.9±4.0, P<0.05). 与模型安慰剂组相比, EGCG组NO含量显著下降(9.1±5.6 μmol/g vs 15.4±5.0 μmol/g, P<0.05), MDA含量也显著下降(0.9±0.6 μmol/g vs 1.5±0.6 μmol/g, P<0.05), SOD含量显著提高(3090.6±568.4 nkat/mg vs 1373.6±410.1 nkat/mg, P<0.05). 与SASP组相比, EGCG组SOD含量显著提高(3090.6±568.4 nkat/mg vs 1268.6±431.8 nkat/mg, P<0.05).
结论: EGCG可通过抑制氧化损伤减轻结肠炎症反应, 且疗效优于传统药物SASP.
引文著录: 冉志华, 陈迟, 萧树东. EGCG对乙酸诱导大鼠结肠炎的治疗作用及抗氧化机制. 世界华人消化杂志 2007; 15(4): 359-364
Revised: November 1, 2006
Accepted: November 16, 2006
Published online: February 8, 2007
AIM: To investigate the therapeutic effect and antioxidation mechanism of epigallocatechin-3-gallate (EGCG) in rats with acetic acid-induced colitis.
METHODS: Sixty male rats were randomly assigned into 4 groups: normal control (n = 10), model placebo (n = 20), EGCG (n = 15), sulfasalazine (SASP, n = 15). The rats in normal group were treated with regular feeding, while those in the other three groups were treated orally with normal saline (2 mL/d), EGCG [50 mg/(kg•d)], and SASP [0.25 g(kg•d)] respectively for 7 days after the colitis model was induced by 80 g/L acetic acid. The general condition, food intake, weight, stool consistency, and bloody stool were observed, and then the disease activity index (DAI) and the therapeutic effects were evaluated. All the rats were sacrificed on day 8. The colon mucosal damage index (CMDI), and histological scores were evaluated and the tissue contents of nitric oxide (NO), malondialdehyde (MDA), superoxide dismutase (SOD) were measured as well.
RESULTS: As compared with the placebo and SASP, EGCG notably improved the DAI (1.1 ± 0.9 vs 3.9 ± 0.4, 3.0 ± 1.2, P < 0.01), CMDI (1.5 ± 0.9 vs 3.3 ± 0.6, 2.3 ± 0.9, P < 0.05) and histological scores (4.6 ± 3.1 vs 9.3 ± 2.8, 7.9 ± 4.0, P < 0.01). In comparison with those in model placebo group, the levels of NO and MDA in EGCG group were significantly reduced (NO: 9.1 ± 5.6 mmol/g vs 15.4 ± 5.0 mmol/g, P < 0.05; MDA: 0.9 ± 0.6 mmol/g vs 1.5 ± 0.6 mmol/g, P < 0.05), while the level of SOD was increased remarkably (3090.6 ± 568.4 nkat/mg vs 1373.6 ± 410.1 nkat/mg, P < 0.05). Besides, the level of SOD was remarkably higher in EGCG group than that in SASP group (3090.6 ± 568.4 nkat/mg vs 1268.6 ± 431.8 nkat/mg, P < 0.05).
CONCLUSION: EGCG may ameliorate the inflammatory reactions in colitis by its antioxidative activity, and its therapeutic effect is superior to that of the conventional medicine SASP.
- Citation: Ran ZH, Chen C, Xiao SD. Therapeutic effect and antioxidation mechanism of epigallocatechin-3-gallate in rats with colitis induced by acetic acid. Shijie Huaren Xiaohua Zazhi 2007; 15(4): 359-364
- URL: https://www.wjgnet.com/1009-3079/full/v15/i4/359.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i4.359
溃疡性结肠炎(ulcerative colitis, UC)是病因尚未确定的慢性非特异性肠道炎症性疾病, 近年来有迹象表明我国UC的发生率正逐年增高. 由于该疾病自然病程的复杂特殊及对患者生活质量的严重影响, UC的治疗现已成为消化系统疾病中的难点, 日益受到关注[1]. 由于目前国内外尚未找到特异性治疗药物, 寻找其他疗效显著且副作用小的药物以替代目前的常规药物已成为全世界研究的热点和主要方向. 表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)是绿茶中茶多酚的主要成分, 为全天然提取, 无毒无害, 具抗氧化、免疫调节及抗肿瘤等多种生物学活性. 本实验将EGCG作为保护剂应用于乙酸诱导的大鼠结肠炎模型, 观察其治疗作用并探讨其抗氧化损伤的机制.
♂SD大鼠, 体质量235±4 g, 60只, 由中国科学院上海实验动物中心提供. 饲养环境: 清洁级, 温度为20-27ºC, 湿度为40%-70%, 人工照明, 12 h暗12 h明, 全价颗粒料(Co60辐照), 饮纯净水. 80 g/L乙酸(分析纯 500 mL中国振亚化工厂, 苏州), EGCG(罗氏公司, 纯度99%), 柳氮磺吡啶(SASP, 0.25 g/片, 上海三维制药公司). NO, MDA, SOD试剂盒均购自南京建成生物工程研究所.
1.2.1 分组造模治疗与标本采集: 大鼠造模前称其体质量, 随机分组. 正常对照组10只, 常规饲养. 模型安慰剂组20只、EGCG治疗组和SASP治疗组各15只造模. 按经典方法造模[2], 禁食不禁水24 h, 予以乙醚麻醉后, 取仰卧位, 5 g/L肥皂水灌肠, 插入直径3 mm的聚乙烯纤维导管至直肠内, 注入80 g/L乙酸溶液1.5-2 mL, 保留15 s后再注入生理盐水3-5 mL冲洗两次. 造模24 h后开始治疗, 3组分别予以生理盐水2 mL、EGCG 50 mg/kg, SASP 0.25 g/kg灌胃治疗, 每日一次, 连续7 d. 第8天处死大鼠, 分离结肠, 沿肠系膜纵轴剪开, 冷生理盐水冲洗干净, 立即进行肉眼大体损伤评分及结肠长度测量. 在远端结肠或横结肠取一块组织(5 mm×10 mm), 另于炎症或溃疡处至少取1块组织, 置40 g/L甲醛中固定, 常规石蜡包埋、切片(4 μm)、HE染色, 组织学评级. 另于远端结肠或炎症明显处取适量结肠新鲜标本, 置于液氮中冻存.
1.2.2 观察指标: (1)疾病活动指数(DAI): 体质量下降的百分率(体质量不变为0分, 下降1%-5%为1分, 下降5%-10%为2分, 下降10%-15%为3分, >15%为4分)、大便黏稠度(正常为0分, 松散但不附着于肛周为2分, 腹泻为4分)和大便出血(正常0分, 隐血阳性为2分, 显性出血为4分)的均数即为DAI. DAI综合评分介于0-4分之间, 0分代表正常, 4分代表炎症最大活动度[3]; (2)结肠黏膜损伤指数(CMDI): 为大体标本评价, 评分标准: 无损伤为0分, 轻度充血, 水肿, 表面光滑, 无糜烂或溃疡为1分, 充血水肿, 黏膜粗糙呈颗粒状, 有糜烂或肠黏连为2分, 高度充血水肿, 黏膜表面有坏死及溃疡形成, 溃疡最大纵径<1.0 cm, 肠壁增厚或表面有坏死及炎症为3分, 在3分基础上溃疡最大纵径>1.0 cm, 或全肠壁坏死为4分[4].
1.2.3 组织学评级: 切片15个高倍视野的平均评分. 指标为溃疡、炎症、肉芽肿、上皮细胞异型增生、病变深度, 按有无及轻中重程度分别计为0, 1, 2和3, 病变深度达黏膜下层、肌层、浆膜层分别计为1, 2和3, 以上各项相加得总分. 实验过程中死亡的动物疾病活动指数(DAI)计为4分, 但由于死亡原因与结肠炎并不一定相关, 因此死后的各项评分如组织学评级等不计入统计分析.
1.2.4 氧化损伤指标测定: 将液氮冻存的组织标本研磨, 加入试剂盒提供的匀浆液, 制成的组织匀浆, 吸取上清液待测抗氧化指标, NO自由基、MDA、SOD测定分别根据试剂盒说明操作. NO自由基采用硝酸还原酶法, MDA采用硫代巴比妥酸法(TBA), SOD采用黄嘌呤氧化酶法.
统计学处理 统计软件为SAS6.12, 结果用均数±标准差表示, 各组总体比较采用单因素方差分析, 组间均数比较采用t检验, P<0.05为统计学差异.
各组造模后大鼠24 h即出现腹泻、肉眼血便、体质量下降, 伴神萎、少动、毛松, 进食减少. EGCG组和SASP组治疗3, 4 d后症状好转, 血便逐渐消失, 大便性状改善, 体质量增加. 实验终点时, 模型安慰剂组死亡9只, 4只肠穿孔, 3只肠出血, 2只巨结肠; EGCG组2只死于肠穿孔; SASP组死亡2只, 1只肠穿孔, 1只巨结肠.
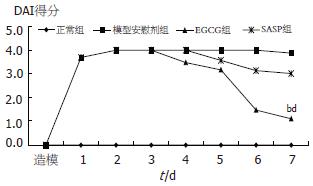
DAI是评判疾病活动情况和治疗效果的重要临床指标, DAI>0.5即代表疾病发生. 模型安慰剂组、EGCG组、SASP组在造模第2天即出现疾病发作. 安慰剂组在整个实验过程中炎症活动持续, 无自愈倾向. EGCG组和SASP组分别在治疗后第3天和第4天开始出现DAI下降趋势, 实验终点时均有好转, EGCG组DAI(1.1±0.9)低于SASP(3.0±1.2)和安慰剂(3.9±0.4), 具统计学显著差异(P<0.01, 图1). 提示EGCG可减轻临床症状, 且疗效优于传统药物SASP.
正常组黏膜光滑、完整, 未见病变. 造模各组结肠均见明显肉眼病变, 结肠缩短变宽、水肿增厚、充血出血及溃疡. 模型安慰剂组病变最重, 黏膜广泛糜烂坏死, 出血严重, 多发性溃疡, 并发肠黏连. EGCG及SASP组病变稍轻, EGCG组以水肿、充血、片状出血为主, 散在溃疡, 但面积小. SASP组充血出血较明显, 溃疡多, 无肠黏连. CMDI指数EGCG组(1.5±0.9)明显低于模型安慰剂组(3.3±0.6)(P<0.01), 亦低于SASP组(2.3±0.9)(P<0.05).
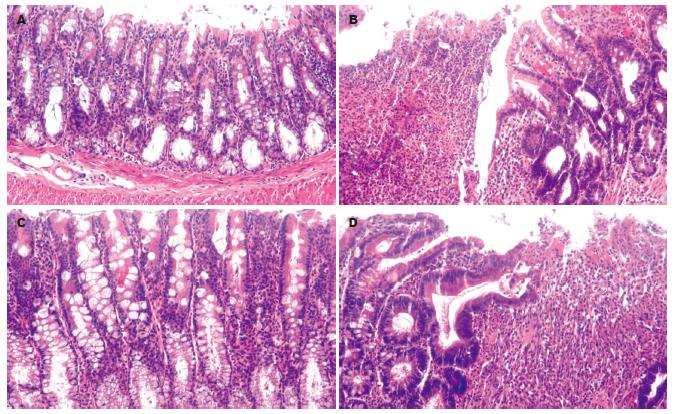
光镜下见正常组黏膜上皮完整, 细胞形态正常, 杯状细胞可见, 腺体排列整齐, 黏膜下层、肌层、浆膜层结构清晰. 模型安慰剂组黏膜上皮坏死脱落, 炎症渗出, 肉芽组织增生, 典型溃疡形成, 多且广泛, 溃疡周边上皮细胞异型增生明显, 黏膜下层及肌层水肿, 大量炎性细胞浸润, 可见出血性坏死, 系膜炎. EGCG组上皮细胞坏死轻, 溃疡小而浅, 大部分腺体结构保持完整, 排列稍紊乱, 炎性细胞浸润. 肠壁各层结构基本完整. SASP组黏膜上皮细胞坏死脱落, 溃疡较多, 溃疡周边上皮细胞异型增生, 腺体结构破坏, 炎症细胞浸润(图2). 组织学评级EGCG组(4.6±3.1)低于模型安慰剂组(9.3±2.8)和SASP组(7.9±4.0), P值分别小于0.01和0.05.
模型安慰剂组中NO自由基、MDA含量显著升高, SOD含量显著下降, EGCG组可降低组织内NO, MDA含量, 提高SOD含量, 具统计学差异; SASP抗氧化作用弱, 只能降低NO含量, 对降低MDA、提高SOD无作用(表1).
由于UC病因和发病机制目前尚未完全阐明, 因此治疗缺乏特异性, 常用药物由于疗效的不肯定以及副作用带来的并发症并不能缩短UC的实际病程, 对如何减少复发以及提高难治性患者的疗效仍然是一个难题. 因此, 目前在UC高发的欧美地区, 辅助及替代治疗成为重要的治疗手段之一, 其方法多种多样, 主要包括纯天然制剂、中草药、营养学治疗(饮食及静脉营养)、复合维生素、肠益生菌、按摩针灸等[5-9]. 大规模问卷调查显示欧美大约50% UC患者使用这些治疗, 尤其在青少年UC患者中已取得很好的疗效[10-11]. 为发掘新药并了解其作用机制, 各种模拟人类疾病的动物模型应运而生. 乙酸刺激法是实验性结肠炎的成熟经典动物模型[12-13], 主要机制是利用乙酸的化学刺激造成结肠黏膜屏障结构破坏, 使血管通透性增加, 炎症介质增多, 激活激肽, 促进纤维蛋白水解及干扰凝血过程等作用引起炎症. 该法简单易行、稳定可靠、周期短、成功率高、重复性好, 适合用于新药的开发和疗效评估.
近年来大量研究证实, EGCG是一种具有高效生物活性、全天然提取、无毒无害的化合物, 在医学及生物学上有着广泛的应用前景, 其药理作用主要有消除自由基、抗氧化; 调节免疫、治疗免疫系统疾病; 抑菌、抗病毒; 抑制肿瘤; 防治心血管疾病; 防辐射; 抗衰老等[14-17]. 因此, 我们选择了EGCG作为保护剂. 在动物实验中, 根据体质量、大便性状、大便隐血、DAI指数、CMDI、组织学评级初步判断EGCG能显著改善乙酸所致大鼠结肠炎的临床症状, 且疗效优于传统药物SASP. 在EGCG药理机制的研究中发现EGCG可降低组织内NO, MDA含量, 提高SOD含量, 这正符合UC的发病机制. 近年来国内外大量的研究证实氧化损伤是UC发病的重要机制, NO自由基、脂质过氧化产物丙二醛MDA增多, 以及SOD抗氧化酶系活性降低都已被证明参与炎症的始动和发展. NO在体内参与诸多的病理生理过程, 在UC早期, NO通过增加靶细胞内5-环磷酸鸟苷(5-cGMP)浓度及抑制P-选择素基因表达维持微循环的完整性, 抑制血小板、白细胞在内皮细胞表面的黏附、积聚, 防止血栓形成和内皮细胞与中性粒细胞、单核细胞的相互作用. 而在UC中晚期, NO转变为氧化能力更强的氧化亚硝酸(OONO-), 后者通过自由基链式反应导致含巯基蛋白和脂质的细胞膜、细胞器过氧化, 从而使组织细胞损伤[18]. 除NO自由基外, 中性粒细胞还产生其他超氧化合物和过氧化物破坏肠上皮[19-21], 这些活性氧产物通过触发细胞膜上的多链不饱和脂肪酸发生脂质过氧化反应并产生MDA等脂质过氧化物, 引起细胞膜结构受损和细胞死亡[22-23]. 活性氧产物和NO衍生物一起还可以造成细胞再生过程中的DNA损伤, 从而使上皮发生异型增生, 研究已证明这是导致UC癌变的重要原因[24]. 另外, 机体的抗氧化系统功能削弱也加重了氧化损伤. SOD是存在于生物体内的重要的抗氧化酶系, 能有效清除氧自由基, 催化O2-分解成H2O2, 进而在过氧化氢酶的作用下分解成水和氧分子, 从而抑制肠组织中的脂质过氧化反应[25-26]. 许多学者认为UC体内, 特别是肠黏膜组织局部SOD活性降低, 清除氧自由基能力降低是导致自由基堆积造成肠黏膜损伤的重要机制之一[27-28]. 因此, NO, MDA水平及SOD活性可间接反映机体的脂质过氧化反应强度和抗脂质过氧化反应的能力. 而EGCG分子结构中含有多个游离酚羟基, 能够提供氢质子参与还原反应, 有很强的还原能力, 因此能抑制组织的氧化损伤[29]. 国外一些实验表明EGCG通过调节SOD发挥抗氧化损伤作用[30-31], 为应用EGCG开展UC治疗提供了有力的理论支持.
总之, 我们对EGCG治疗乙酸所致大鼠结肠炎的疗效做了评估, 并发现其疗效优于传统药物SASP, 机制为通过抑制氧化损伤从而减轻炎症反应, 对EGCG的开发和临床应用提供了一定的理论意义和实践价值.
溃疡性结肠炎是一种发生于结肠 黏膜的慢性、炎症性及溃疡性疾病, 病因未明, 可能与免疫、感染、遗传和精神因素有关, 主要症状是腹泻、黏液脓血便、腹痛, 并且病情轻重不一, 常反复发作, 病程漫长. 本病好发于青、中年, 我国发病率较欧、美低, 且轻型病例多见, 但近20 a来本病的发病率有上升趋势. 本病虽有药物控制病情, 但由于反复迁延, 常常出现并发症, 甚至癌变. 近年来, 应用中药及天然植物有效成分治疗溃疡性结肠炎取得一定进展, 但是, 其治疗的作用机制多不明确.
溃疡性结肠炎虽有5-ASA类药物控制病情, 但病程反复迁延, 目国内外尚未找到特异性治疗药物, 寻找其他疗效显著且副作用小的药物以替代目的常规药物已成为全世界研究的热点和主要方向. 而表没食子儿茶素没食子酸酯 (EGCG)是从中国绿茶中提取的一种成份, 他是绿茶主要的活性和水溶性成份, 占绿茶毛重的9%-13%,因为具有特殊的立体化学结构,EGCG具有非常强的抗氧化活性, 在抗癌和心血管疾病方面担当了重要的角色. 进一步开发其药用价值, 尤其在溃疡性结肠炎治疗中的价值是当前的一大热点.
Peng et al的研究明EGC G有很强的还原能力, 因此能抑制组织的氧化损伤. Itoh和 Basini et al的研究明EGC G通过调节SOD发挥抗氧化损伤作用, 而氧化应激正是溃疡性结肠炎的发病原因之一, 他们的研究为应用EGC G开展溃疡性结肠炎治疗提供了有力的理论支持.
目前针对结肠炎的治疗药物研究, 很多仅局限于临床症状的观察, 同时缺乏对天然植物有效成分及作用机制的探讨, 本文在上述方面作了较大改进, 对天然植物-茶叶的有效成分治疗结肠炎的效果和机制做了深入的研究.
表没食子儿茶素没食子酸酯(EGCG) 是从中国绿茶中提取的一种成份, 他是绿茶主要的活性和水溶性成份, 具有非常强的抗氧化活性, 本研究探讨了EGCG对大鼠结肠炎的治疗作用, 为使用EGCG治疗结肠炎提供了实验室的理论支持.
溃疡性结肠炎: 是一种发生于结肠黏膜的慢性、炎症性及溃疡性疾病, 主要症状是腹泻、黏液脓血便、腹痛. 病因未明, 可能与免疫、感染、遗传和精神因素有关. 表没食子儿茶素没 食 子酸酯 (EGCG): 是从中国绿茶中提取的一种成份, 他是绿茶主要的活性和水溶性成份,占绿茶毛重的9%-13%, 具有非常强的抗氧化活性, 在抗肿瘤和心血管疾病方面担当了重要的角色.
本文研究了EGCG对乙酸诱导大鼠 结肠炎的治疗作用及抗氧化机制, 总体设计清楚, 方法严谨, 有较高的理论价值.
电编: 张敏 编辑:王晓瑜
| 1. | Podolsky DK. Inflammatory bowel disease. N Engl J Med. 2002;347:417-429. [PubMed] |
| 2. | Millar AD, Rampton DS, Chander CL, Claxson AW, Blades S, Coumbe A, Panetta J, Morris CJ, Blake DR. Evaluating the antioxidant potential of new treatments for inflammatory bowel disease using a rat model of colitis. Gut. 1996;39:407-415. [PubMed] |
| 3. | Steidler L, Hans W, Schotte L, Neirynck S, Obermeier F, Falk W, Fiers W, Remaut E. Treatment of murine colitis by Lactococcus lactis secreting interleukin-10. Science. 2000;289:1352-1355. [PubMed] |
| 4. | Myers KJ, Murthy S, Flanigan A, Witchell DR, Butler M, Murray S, Siwkowski A, Goodfellow D, Madsen K, Baker B. Antisense oligonucleotide blockade of tumor necrosis factor-alpha in two murine models of colitis. J Pharmacol Exp Ther. 2003;304:411-424. [PubMed] |
| 5. | Ewaschuk JB, Dieleman LA. Probiotics and prebiotics in chronic inflammatory bowel diseases. World J Gastroenterol. 2006;12:5941-5950. [PubMed] |
| 6. | Joos S, Wildau N, Kohnen R, Szecsenyi J, Schuppan D, Willich SN, Hahn EG, Brinkhaus B. Acupuncture and moxibustion in the treatment of ulcerative colitis: a randomized controlled study. Scand J Gastroenterol. 2006;41:1056-1063. [PubMed] |
| 7. | Joos S, Rosemann T, Szecsenyi J, Hahn EG, Willich SN, Brinkhaus B. Use of complementary and alternative medicine in Germany - a survey of patients with inflammatory bowel disease. BMC Complement Altern Med. 2006;6:19. [PubMed] |
| 8. | Ockenga J, Borchert K, Stuber E, Lochs H, Manns MP, Bischoff SC. Glutamine-enriched total parenteral nutrition in patients with inflammatory bowel disease. Eur J Clin Nutr. 2005;59:1302-1309. [PubMed] |
| 9. | Brown AC, Valiere A. Probiotics and medical nutrition therapy. Nutr Clin Care. 2004;7:56-68. [PubMed] |
| 10. | Day AS, Whitten KE, Bohane TD. Use of comple-mentary and alternative medicines by children and adolescents with inflammatory bowel disease. J Paediatr Child Health. 2004;40:681-684. [PubMed] |
| 11. | Langhorst J, Anthonisen IB, Steder-Neukamm U, Ludtke R, Spahn G, Michalsen A, Dobos GJ. Amount of systemic steroid medication is a strong predictor for the use of complementary and alternative medicine in patients with inflammatory bowel disease: results from a German national survey. Inflamm Bowel Dis. 2005;11:287-295. [PubMed] |
| 12. | Mustafa A, El-Medany A, Hagar HH, El-Medany G. Ginkgo biloba attenuates mucosal damage in a rat model of ulcerative colitis. Pharmacol Res. 2006;53:324-330. [PubMed] |
| 13. | Fan H, Qiu MY, Mei JJ, Shen GX, Liu SL, Chen R. Effects of four regulating-intestine prescriptions on pathology and ultrastructure of colon tissue in rats with ulcerative colitis. World J Gastroenterol. 2005;11:4800-4806. [PubMed] |
| 14. | Frei B, Higdon JV. Antioxidant activity of tea polyphenols in vivo: evidence from animal studies. J Nutr. 2003;133:3275S-3284S. [PubMed] |
| 15. | Katiyar SK, Challa A, McCormick TS, Cooper KD, Mukhtar H. Prevention of UVB-induced immunosuppression in mice by the green tea polyphenol (-)-epigallocatechin-3-gallate may be associated with alterations in IL-10 and IL-12 production. Carcinogenesis. 1999;20:2117-2124. [PubMed] |
| 16. | Yang F, Oz HS, Barve S, de Villiers WJ, McClain CJ, Varilek GW. The green tea polyphenol (-)-epigallocatechin-3-gallate blocks nuclear factor-kappa B activation by inhibiting I kappa B kinase activity in the intestinal epithelial cell line IEC-6. Mol Pharmacol. 2001;60:528-533. [PubMed] |
| 17. | Miura Y, Chiba T, Tomita I, Koizumi H, Miura S, Umegaki K, Hara Y, Ikeda M, Tomita T. Tea catechins prevent the development of atherosclerosis in apoprotein E-deficient mice. J Nutr. 2001;131:27-32. [PubMed] |
| 19. | Cao W, Vrees MD, Potenti FM, Harnett KM, Fiocchi C, Pricolo VE. Interleukin 1beta-induced production of H2O2 contributes to reduced sigmoid colonic circular smooth muscle contractility in ulcerative colitis. J Pharmacol Exp Ther. 2004;311:60-70. [PubMed] |
| 20. | Cao W, Fiocchi C, Pricolo VE. Production of IL-1beta, hydrogen peroxide, and nitric oxide by colonic mucosa decreases sigmoid smooth muscle contractility in ulcerative colitis. Am J Physiol Cell Physiol. 2005;289:C1408-1416. [PubMed] |
| 21. | Sasaki K, Iizuka M, Konno S, Shindo K, Sato A, Horie Y, Watanabe S. Ecabet sodium prevents the delay of wound repair in intestinal epithelial cells induced by hydrogen peroxide. J Gastroenterol. 2005;40:474-482. [PubMed] |
| 22. | Bartsch H, Nair J. Accumulation of lipid peroxidation-derived DNA lesions: potential lead markers for chemoprevention of inflammation-driven malignancies. Mutat Res. 2005;591:34-44. [PubMed] |
| 23. | Gulec B, Yasar M, Yildiz S, Oter S, Akay C, Deveci S, Sen D. Effect of hyperbaric oxygen on experimental acute distal colitis. Physiol Res. 2004;53:493-499. [PubMed] |
| 24. | Seril DN, Liao J, Yang GY, Yang CS. Oxidative stress and ulcerative colitis-associated carcino-genesis: studies in humans and animal models. Carcinogenesis. 2003;24:353-362. [PubMed] |
| 25. | Liu LN, Mei QB, Liu L, Zhang F, Liu ZG, Wang ZP, Wang RT. Protective effects of Rheum tanguticum polysaccharide against hydrogen peroxide-induced intestinal epithelial cell injury. World J Gastroenterol. 2005;11:1503-1507. [PubMed] |
| 26. | Jubeh TT, Nadler-Milbauer M, Barenholz Y, Rubinstein A. Local treatment of experimental colitis in the rat by negatively charged liposomes of catalase, TMN and SOD. J Drug Target. 2006;14:155-163. [PubMed] |
| 27. | Barazzone C, White CW. Mechanisms of cell injury and death in hyperoxia: role of cytokines and Bcl-2 family proteins. Am J Respir Cell Mol Biol. 2000;22:517-519. [PubMed] |
| 28. | Krieglstein CF, Cerwinka WH, Laroux FS, Salter JW, Russell JM, Schuermann G, Grisham MB, Ross CR, Granger DN. Regulation of murine intestinal inflammation by reactive metabolites of oxygen and nitrogen: divergent roles of superoxide and nitric oxide. J Exp Med. 2001;194:1207-1218. [PubMed] |
| 29. | Peng IW, Kuo SM. Flavonoid structure affects the inhibition of lipid peroxidation in Caco-2 intestinal cells at physiological concentrations. J Nutr. 2003;133:2184-2187. [PubMed] |
| 30. | Itoh Y, Yasui T, Okada A, Tozawa K, Hayashi Y, Kohri K. Examination of the anti-oxidative effect in renal tubular cells and apoptosis by oxidative stress. Urol Res. 2005;33:261-266. [PubMed] |
| 31. | Basini G, Bianco F, Grasselli F. Epigallocatechin-3-gallate from green tea negatively affects swine granulosa cell function. Domest Anim Endocrinol. 2005;28:243-256. [PubMed] |