修回日期: 2006-12-01
接受日期: 2006-12-01
在线出版日期: 2007-02-08
目的: 筛选胃溃疡复发相关的蛋白质, 进一步揭示胃溃疡复发的分子机制.
方法: 以乙酸制备胃溃疡模型, 并用IL-1β诱导复发. 采用二维凝胶电泳(2-DE)技术分离胃溃疡复发大鼠胃溃疡处组织及正常大鼠相应处胃组织的总蛋白质, 图像分析识别差异表达的蛋白质点, 基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)得到相应的肽质量指纹图(PMF), 搜索数据库鉴定蛋白质.
结果: 获得分辨率较高、重复性较好的胃溃疡复发大鼠和正常大鼠胃组织的2-DE图谱, 质谱分析共鉴定了12个差异蛋白质点, 其中7个表达上调, 含热休克蛋白27(HSP27)、葡萄糖调节蛋白(GRP78)、L-乳酸脱氢酶轻链、磷酸甘油醛脱氢酶、血红蛋白β链、过氧化物酶2、过氧化物酶1; 5个表达下调, 含膜联蛋白A2、热休克蛋白60、氯离子通道蛋白1、黏着斑蛋白、凝溶胶蛋白. 随即采用免疫组化法检测差异蛋白质HSP27和GRP78在两类组织中的表达, 结果显示胃溃疡复发组HSP27和GRP78阳性细胞百分率均显著高于正常对照组(HSP27: 27.90%±5.34% vs 22.10%±3.67%, P<0.05; GRP78: 43.00%±4.52% vs 26.30%±3.95%, P<0.01).
结论: 差异蛋白如HSP27和GRP78等可能以不同的方式参与了胃溃疡的复发过程, 为揭示胃溃疡复发的机制提供了线索.
引文著录: 申定珠, 李家邦, 叶川, 凌江红, 马国添, 叶仁群, 黄国栋, 蒋荣鑫. IL-1β致乙酸性胃溃疡复发大鼠的比较蛋白质组学分析. 世界华人消化杂志 2007; 15(4): 332-339
Revised: December 1, 2006
Accepted: December 1, 2006
Published online: February 8, 2007
AIM: To screen the proteins related to gastric ulcer recurrence and find out the mechanism of gastric ulcer recurrence through proteomic tools.
METHODS: Acetic acid was used to prepare the model of gastric ulcer, whose occurrence was induced by interleukin-1b (IL-1β). Two-dimensional gel electrophoresis (2-DE) was performed to separate the total proteins of ulcerative tissues and normal tissues. PDQuest software was applied to analyze the obtained 2-DE images. The differential protein spots between the two groups were identified by peptide mass fingerprint (PMF) based on matrix-assisted laser desorption/ionization time of flight mass spectrometry (MALDI-TOF-MS) and database searching.
RESULTS: The well-resolution and reproducible 2-DE patterns of rat gastric ulcerative and normal tissues were established. A total of 12 differentially expressed proteins were identified, of which 7 proteins were up-regulated, including heat shock protein 27 (HSP27), 78-kDa glucose-regulated protein (GRP78), L-lactate dehydrogenase B chain, glyceraldehyde-3-phosphate dehydrogenase (GAPDH), hemoglobin beta chain, peroxiredoxin-2, peroxiredoxin-1, and 5 ones were down-regulated, including annexin A2, heat shock protein 60 (HSP60), chloride intracellular channel protein 1, vinculin, gelsolin. The subsequent immunohistochemical analysis of HSP27 and GRP78 in gastric ulcerative and normal tissues also showed a similar expression pattern HSP27: 27.90% ± 5.34% vs 22.10% ± 3.67%, P < 0.05; GRP78: 43.00% ± 4.52% vs 26.30% ± 3.95%, P < 0.01).
CONCLUSION: The proteins such as HSP27 and GRP78 may be involved in the occurrence of gastric ulcer, and this may help to further elucidate the mechanism of gastric ulcer recurrence.
- Citation: Shen DZ, Li JB, Ye C, Ling JH, Ma GT, Ye RQ, Huang GD, Jiang RX. Comparative proteomics analysis on acetic acid-induced gastric ulcer recurrence caused by interleukin-1β. Shijie Huaren Xiaohua Zazhi 2007; 15(4): 332-339
- URL: https://www.wjgnet.com/1009-3079/full/v15/i4/332.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i4.332
胃溃疡(gastric ulcer, GU)是一多因素、多步骤参与的全球多发性疾病, 随着溃疡病治疗药物的进展, GU的近期愈合已不成问题, 但常规抗酸治疗愈合的溃疡, 停药后一年复发率可接近60%[1], 深入研究GU复发无疑有着重要的理论和临床意义. 以往的研究[2-5]虽然揭示了GU复发的某些机制, 但是这些研究多数是从某个或某几个基因出发, 而且多半集中在DNA和RNA水平, 而DNA和RNA水平的变化并不能完全反映蛋白质水平的变化[6], 可见GU复发的分子机制远未阐明. 因此, 有必要从蛋白质整体水平对GU复发的产生机制进行研究. 蛋白质组学的出现及其研究技术的发展和完善使得从蛋白质组整体水平上研究GU复发的产生机制成为可能. 为此, 我们以乙酸性GU复发大鼠胃组织及正常大鼠胃组织为研究对象, 采用二维凝胶电泳、质谱技术及免疫组化技术筛选与GU复发相关的蛋白质, 以揭示GU复发的产生机制, 为其复发的防治提供新的靶点.
清洁级SD大鼠80只, ♂♀各半, 体质量为150-200 g, 由中南大学医学实验动物中心提供, 许可证号: SYXK(湘)2005-0005. 合成人Interliukin1-β(IL-1β)系英国Peprotech公司产品; 丙烯酰胺、甲叉双丙烯酰胺、三羟甲基氨基甲烷、甘氨酸、十二烷基磺酸钠(SDS)、尿素(urea)、3-[3-(胆酰胺基丙基)二甲氨基]丙磺酸盐(3-(cholamidopropyl)dimethylammonio-1-propanesulphonate, CHAPS)、IPG缓冲液 (pH3-10)、24 cm固相化pH梯度干胶条、两性电解质(pharmalyte, pH3-10)、覆盖液、双向凝胶电泳标准蛋白质均购自Amershan Pharmacia公司; 二硫苏糖醇(DTT)、碘乙酰胺、甲苯磺酰苯丙氨酰氯甲-酮-胰蛋白酶(TPCK-Trypsin)、铁氰化钾[K3Fe(CN)6]、三氟乙酸(TFA)、碳酸氢铵(NH4HCO3)、硫代硫酸钠(Na2S2O3)、乙睛、基质α-氰基-4-羟基肉桂酸(CHCA)均购自Sigma公司; 作用于HSP27、GRP78的山羊抗鼠多克隆一抗及辣根过氧化物酶(HRP)标记的兔抗山羊IgG均系Santa Cruz Biotechnology公司产品; 封闭用血清、DAB显色液、SP即用型试剂盒均由北京中山生物技术有限公司提供. 甲醛、二甲苯、石蜡、伊红、苏木素等均为国产分析纯; 低温高速离心机(Eppendorf)、IPGphor等电聚焦仪、Ettan DALTⅡ垂直电泳槽、Imagescanner扫描仪均为Amersham Biosciences公司产品, Voyager-DE STR 4307 MALDI-TOF-MS质谱仪为Applied Biosystem公司产品, Elx800自动酶标仪系Bio-Tek Instruments公司产品, PDQuest 7.0凝胶图像分析软件为Bio-Rad公司产品, 采用motic3.0型图像处理分析系统对免疫组化结果进行分析.
1.2.1 组织标本的处理: 将大鼠随机分为正常对照组和模型复发组, 采用改良的Okabe乙酸涂抹法[7]制作大鼠实验性GU模型. 术后24 h开始正常喂养, 连续90 d后据文献[8], 采用IL-1β复制GU复发大鼠模型, 48 h后颈椎脱臼法处死(处死前禁食24 h)所有大鼠, 经病理组织学指标确定GU及GU复发大鼠模型成立. 于GU复发模型成功后24 h禁食所有大鼠, 48 h后颈椎脱臼法处死所有大鼠, 分别取出溃疡复发模型组大鼠GU处胃组织和正常组大鼠相应处胃组织, 予冰盐水反复清洗干净, 以去除血液, 并尽可能剪去多余的其他组织, 滤纸吸去多余的液体, 立即一分为二, 一部分予40 g/L多聚甲醛保存, 留作石蜡切片, 另一部分则立即置液氮中速冻, 后移至-80℃低温冰箱保存.
1.2.2 胃组织总蛋白质的提取: 将已处理过的标本从-80℃冰箱中取出, 称取GU复发组大鼠胃溃疡处组织及正常大鼠相应部位胃组织, 置于研磨管, 按照1:10比例加入组织裂解液(7 mol/L urea, 2 mol/L硫脲(thiourea), 2 mL/L 乙基苯基聚乙二醇(NP-40), 1 mL/L曲拉通X-100(Triton X-100), 100 mmol/L DTT, 5 mmol/L苯甲基磺酰氟(PMSF), 40 g/L CHAPS, 0.5 mmol/L乙二胺四醋酸(EDTA), 40 mmol/L三(羟甲基)氨基甲烷(Tris), 2 g/L pharmalyte, 1 g/L DNaseⅠ, 0.25 g/L RNase A)1.0 mL, 充分涡旋混匀, 置于37 ℃孵育1 h, 取出后再充分涡旋, 15000 r/min、4 ℃离心30 min[9], 吸取上清液即为组织的总蛋白质. 蛋白质定量试剂盒2D Quantificatoin Kit(Amersham Biosciences)测定蛋白质浓度, -80℃冻存备用.
1.2.3 二维凝胶电泳: 主要按IPGphor等电聚焦系统指南和Gorg et al[10]的方法进行. 第一向固相pH梯度等电聚焦凝胶电泳, 采用低电压胶内泡胀法. 1000 μg总蛋白质与水化液(8 mmol/L urea, 4 g/L CHAPS, 40 mmol/L Tris-HCL, 18 mmol/L DTT, 0.5 mL/L IPG (pH3-10)缓冲液, 痕量溴酚蓝) 混合至总体积为450 μL. 蛋白质样本于IPGphor等电聚焦仪按如下条件: 30 V水化16 h后经500 V 1 h、1000 V 1 h、8000 V 8.5 h进行等电聚焦. 等电聚焦结束后分别于10 mL平衡A液(50 mol/L Tris-HCL, pH 8.8, 6 mol/L urea, 300 mL/L甘油, 0.2 g/L DTT, 痕量溴酚蓝)和10 mL平衡B液(50 mol/L Tris-HCL, pH 8.8, 6 mol/L urea, 300 mL/L甘油, 3 g/L碘乙酰胺, 痕量溴酚蓝)各平衡15 min. 平衡后的IPG胶条转移至12.5 g/L的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)胶上端, 在Ettan DALTⅡ垂直电泳槽(Amersham Biosciences)上进行第二向垂直电泳. 电泳结束后, 参照"Blue Silver"染色方法[11]对2-D进行考马斯亮蓝染色, 二维凝胶电泳分析重复3次.
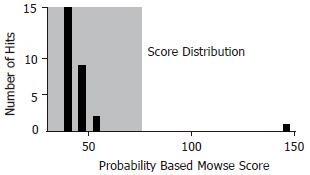
1.2.4 凝胶图像分析: 应用Imagescanner扫描仪扫描染色的2-D胶, PDQuest 2-DE图像分析软件比较分析GU复发大鼠胃组织与正常大鼠胃组织二维电泳图谱的差异, 随机选取表达水平相差2倍以上的12个蛋白质点进行质谱分析. 所有数据的统计分析(Student t-test)在SPSS11.5软件上进行, 数据以mean±SD表示.
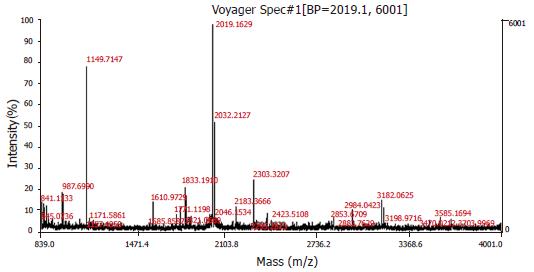
1.2.5 质谱分析: 将蛋白质点从凝胶上切割下来后置于1.5 mL Eppendorf管中, 经脱色工作液(100 mmol/L Na2S2O3和30 mmol/L K3Fe(CN)6以1:1用前混合)脱色, 再用水洗数遍直至干燥仪抽干, 乙腈脱水直至胶块变为白色, 冷冻真空干燥仪抽干, 加入TPCK-Trypsin(100 ng/蛋白质点)37℃酶解12 h, 然后吸取上清至另一0.5 mL Eppendorf管中, 剩下胶块再用萃取液(50 g/L乙睛+2.5 mL/L TFA)萃取2次, 合并上清及2次萃取液, 冷冻真空干燥仪浓缩样品至5 μL. 取0.5 μL样品与等体积饱和的CHCA基质液混合, 点样于不锈钢电样板上, 空气中干燥, 然后用0.1 mL/L的TFA于板上脱盐, 制备好的样品在Voyager-DE STR 4307 MALDE-TOF-MS质谱仪上分析, 采用反射模式, 正离子谱测定, 真空度4×10-7 Torr, 离子源加速电压为20 000 V, 反射电压比为1.12, N2激光波长为377 nm, 脉冲宽度为3 ns, 离子延迟提取100 ns, 质谱信号单次扫描累加50次, 使用ACTH作为外部标准, 胰蛋白酶自切降解峰作为内部标准校正, 获得肽质量指纹图谱(PMF).
1.2.6 数据库查询: 获得的PMF图谱用Mascot Distiller软件(Matrixscience)识别单同位素峰, 获得的肽段质荷比(m/z)数值输入Mascot软件(Matrixscience, http://www.matrixscience.com)进行检索. 搜索数据库为SWISS-PROT和NCBI蛋白质数据库, 其他检索条件为: 肽片断质量最大允许误差为100 ppm, 允许的漏切胰酶酶切位点数为1个, 物种来源为大鼠, 离子种类选择[M+H]+和单同位素峰(monoisotopic), 固定修饰为半胱胺酸碘乙酰胺化(carbamidomethy l).
1.2.7 免疫组化方法: 10 mL/L的多聚赖氨酸处理玻片, 烘干; 按SP免疫组化试剂盒要求将石蜡切片常规脱腊(二甲苯Ⅰ、二甲苯Ⅱ分别脱腊)至水, PBS洗3 min, 3次, 加3 mL/L过氧化氢(H2O2)处理20 min; PBS洗3 min, 3次, 98℃ 20 min进行抗原修复, 室温冷却, PBS洗3 min, 3次, 加一抗山羊抗鼠HSP27(1:100)、山羊抗鼠GRP78(1:50), 4℃孵育过夜. PBS洗3 min, 3次, 加入生物素化的二抗兔抗山羊(1:200), 37℃ 30 min, PBS洗3 min, 3次, 加抗生物素蛋白链菌素辣根过氧化物酶(streptavidin-HRP)(1:200) 37℃ 30 min, PBS洗3 min, 3次. 0.04 mL/L DAB+0.03 mL/L H2O2溶液显色8-12 min, 水洗, 苏木素复染1 min, 水洗, 常规树脂封片, 显微镜下观察.
1.2.8 免疫组化结果判断: 设阳性对照及同时用PBS代替一抗为空白对照, 具体为: 已知HSP27和GRP78阳性的GU复发胃组织切片分别作为HSP27和GRP78蛋白免疫组织化学染色的阳性对照, 同时予PBS代替一抗为阴性对照. 在清晰的背景上出现特异性棕黄色颗粒者为阳性, 阴性对照无特异性着色. 采用motic3.0型图像处理分析系统对免疫组化结果进行分析, 每组各取6只大鼠, 每只大鼠观察3张切片, 每例随机选出5个不重复、不重叠的高倍视野(10×40), 计数阳性细胞数及所有细胞数, 计算阳性细胞率 = 阳性细胞总数/视野所有细胞总数×100%.
统计学处理 应用统计软件SPSS11.5进行统计学分析, 计量资料以数据均值加减标准差(mean±SD)表示, 组间均值的比较采用单因素方差分析, 组间均值的比较采用独立样本t检验, 检验水准α = 0.05.
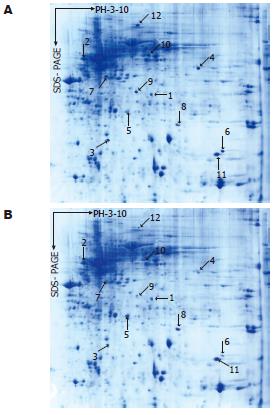
建立了分辨率较高、重复性较好的胃溃疡复发大鼠胃组织及正常大鼠胃组织蛋白质二维电泳图谱, 应用PDQuest 2DE软件分析GU复发大鼠与正常大鼠胃组织二维电泳图谱, 分别可检测到大约1000个蛋白质点, 质谱鉴定了每组3张2-D胶的平均胶比较(组间比较)后的12个差异表达的蛋白质点. GU复发大鼠与正常大鼠胃组织典型的二维电泳图谱见图1, 图2为局部放大的部分差异表达的蛋白质点.
从胶中切取12个差异蛋白质点, 胶内酶解后进行MALDI-TOF-MS, 获取肽质量指纹图谱, 数据库搜寻鉴定蛋白质, 1号蛋白质点鉴定结果见图3、图4. 该差异蛋白的肽质量指纹图谱经检索SWISSPROT数据库显示为热休克蛋白27(heat shock protein 27, HSP27). 共有12个差异蛋白质点得到鉴定, 其详细信息见表1. 与正常大鼠胃组织比较, 7个蛋白质即HSP27, 葡萄糖调节蛋白(78 kDa glucose-regulated protein), L-乳酸脱氢酶轻链(L-lactate dehydrogenase B chain), 磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH), 血红蛋白β链(hemoglobin beta chain), 过氧化物酶2(peroxiredoxin2), 过氧化物酶1(peroxiredoxin 1)在胃溃疡复发大鼠胃组织中表达上调, 5个蛋白质即膜联蛋白A2(annexin A2), 热休克蛋白60(heat shock protein-60, HSP60), 氯离子通道蛋白1(chloride intracellular channel protein 1), 黏着斑蛋白(vinculin), 凝溶胶蛋白(gelsolin)在胃溃疡复发大鼠胃组织中表达下调. 基于数据库查询结果, 这些蛋白质按功能大致可以分为5类: 分子伴侣, 细胞信号传导相关蛋白质, 细胞骨架蛋白, 参与物质代谢或能量产生相关生物酶类, 抗氧化蛋白.
| 编号 | Swissprot登录号 | 蛋白质名称 | 分子量 | 等电点 | 在胃溃疡复发大鼠胃组织中的表达 | 功能分类 |
| 1 | P09621 | Heat shock protein 27 | 22865 | 6.12 | ↑ | Chaperone |
| 2 | P06761 | GRP78 | 72428 | 5.12 | ↑ | Chaperone |
| 3 | P35704 | Peroxiredoxin2 | 21955 | 5.34 | ↑ | Antioxinant |
| 4 | Q07936 | Annexin A2 | 33808 | 7.53 | ↓ | Singal transduction |
| 5 | P42123 | L-Lactate dehydrogenase B Chain | 36481 | 5.68 | ↑ | Metablism |
| 6 | Q63716 | Peroxiredoxin 1 | 22323 | 8.27 | ↑ | Antioxinant |
| 7 | P63039 | Heat shock protein 60 GlyceRaldehyde 3- | 57868 | 6.19 | ↓ | Chaperone |
| 8 | Q8K4T7 | phosphatedehydrogenase (GAPDH) | 36098 | 8.43 | ↑ | Metablism |
| 9 | Q9Z0W7 | Chloride intracellular channel protein1 | 28502 | 5.13 | ↓ | Channel |
| 10 | Q68FP1 | Gelsolin | 86413 | 5.76 | ↓ | Structural Protein |
| 11 | P04443 | Hemoglobin beta chain | 15952 | 7.98 | ↑ | blood |
| 12 | Q64727 | Vinculin | 117083 | 5.77 | ↓ | Structural Protein |
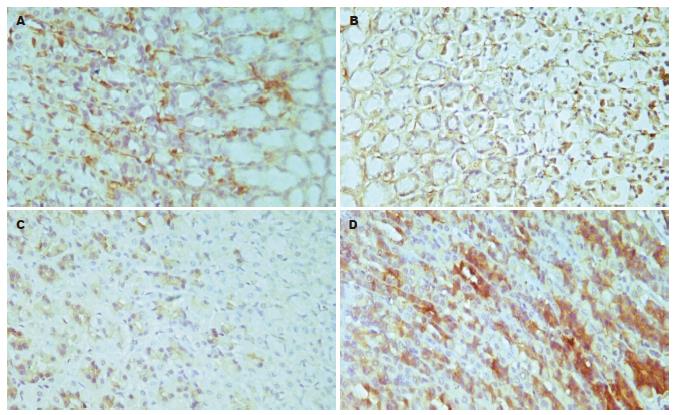
HSP27, GRP78阳性表达主要位于胞质内, 表现为在清晰的背景上, 胞质内出现棕黄色颗粒者为阳性, 阴性对照无特异性着色. 通过motic3.0型图像处理分析系统对免疫组化结果进行分析, 每组各取6只大鼠, 每只大鼠观察3张切片, 每张切片在400倍光镜下选取5个互不重叠视野, 测量每个视野中所有阳性细胞百分率, 各取均值为一只大鼠的结果, 然后进行统计分析. 研究结果表明, GU复发组HSP27和GRP78阳性细胞百分率均显著高于正常对照组(P<0.05或P<0.01, 表2, 图5).
GU乃至整个消化性溃疡治疗的核心问题是如何提高溃疡愈合质量(QOUH). Tarnawski et al[12-13]第一次提出溃疡愈合质量(Quality of Ulcer healing, QOUH)的概念, 认为溃疡完全愈合的概念是指修复再生的黏膜上皮组织使之具有完整的黏膜防御能力, 从而使人们对溃疡复发和控制复发的认识发生了变化, 因此溃疡愈合质量理论也逐渐受到重视并被采用. 近年的研究发现, 中药治疗溃疡通过整体调整来实现对局部病理的修复, 最大限度地调动了机体祛邪的能力, 故不仅能有效地调节攻击因子和保护因子之间的失衡, 而且在治愈溃疡的同时, 还能对紊乱的消化功能进行调整而提高其愈合的质量[14-15]. 临床中我们当以提高QOUH为依据, 筛选出与溃疡复发相关的蛋白质, 进而针对性的开发研制能提高QOUH的药物, 尽可能地防治胃溃疡的复发.
蛋白质组学是后基因组时代的一门新学科, 其目的是从整体角度分析细胞或组织内动态变化的蛋白质组成成分, 了解蛋白质之间的相互作用和相互联系, 揭示蛋白质功能和生命活动规律. 蛋白质组学作为一门应用大规模蛋白质分离和识别技术研究蛋白质组的学科, 是对基因组所表达的整套蛋白质的分析. 其内容包括识别各种蛋白质, 确定他们在细胞内外的定位、修饰、相互反应、活性以及功能, 并对由此获取的数据进行数据库构建, 以及进行相关分析技术的研究[16]. 蛋白质组学研究涉及蛋白质表达模式研究和功能模式研究, 目前以前者研究较为集中[17]. 本研究以乙酸性胃溃疡复发大鼠和正常大鼠胃组织为对象, 采用蛋白质组学技术比较两不同组别大鼠胃组织蛋白质表达谱的差异, 寻找与胃溃疡复发相关的蛋白质, 这些蛋白质按其功能大致可分为5类: 分子伴侣, 细胞信号传导相关蛋白质, 细胞骨架蛋白, 参与物质代谢或能量产生相关生物酶类, 抗氧化蛋白.
有研究[18]认为, 应激性溃疡在其发生、发展过程中, 细胞凋亡所起作用不可忽视. 热休克蛋白(HSP)存在于人及动物的胃黏膜, 而胃黏膜是热休克反应的代表场所, 在热应激、水束缚、乙醇等条件下可产生各种HS, 在急性胃黏膜损害过程中起到胃黏膜保护作用, 且健脾益气中药能引起HSP27、HSP70表达增加, 从而促进溃疡的愈合[19]. 热休克蛋白可提高胃黏膜细胞对应激原的耐受力, 如果热休克蛋白缺乏可降低胃黏膜对攻击因子的防御功能, 易形成溃疡[20].
HSP27、GRP78均属于热休克蛋白家族成员, 热休克蛋白(HSPs)是一种古老的、进化上高度保守的蛋白, 具有保护细胞、抵御外来损伤的能力, 参与细胞信息的传递和基因的调控, 被认为对促进溃疡组织修复、提高QOUH有积极意义[21]. HSP27是HSP家族中小分子量热休克蛋白(sHSP)亚家族中的一员, 相对分子质量为27 kDa[22]. 他是热休克基因编码的功能蛋白质, 具有可溶性, 能阻止应激状态的肌动蛋白和微丝的分裂, 有利于细胞骨架的稳定, 他不仅对单个细胞产生应激耐受起重要作用, 而且通过内皮和上皮的屏障作用, 对组成整个有机体起必要的保护作用[23]. 在急性炎症期, HSP27阳性表达增高,可能是由于非磷酸化HSP27a早期提供及时基础保护作用. HSP27细胞中含量, 减少刺激HSP27的表达增强, 这种表达是在转录水平上调节[24], 可能是由HSP27磷酸化水平决定的. 中性粒细胞和活化的巨噬细胞可以释放白细胞介素1(IL-1), 肿瘤坏死因子(TNF)等细胞因子, 调节免疫, 介导炎症反应. 同时, 炎症因子增强HSP27磷酸化, 调节HSP27的表达. GRP78, 又名免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein, Bip), 与热休克蛋白70(HSP70)家族具有高度同源性, 被认为是HSP70家族的成员之一[25]. GRP78的功能很多, 他作为一种分子伴侣参与蛋白质的折叠和转运, 也是内质网上的一种应激蛋白, 在低糖、低氧、低Ca2+等应激状态下大量表达以维持内质网的稳定, 保护细胞. 由于内质网对内外环境的变化极为敏感, GRP78既是内质网上的伴侣蛋白, 也是内质网应激的标志物, 可促进内质网中未折叠蛋白的正确折叠、修饰, 具有保护内质网功能的作用. 最近研究显示, 组织器官在缺血、缺氧情况下, 大量分泌型蛋白多肽在内质网内由于折叠错误而分泌障碍, 导致GRP78大量表达[26]. 免疫组化结果表明, HSP27和GRP78在GU复发大鼠胃组织中的表达均明显高于正常组大鼠, 这同2-DE及质谱结果基本上是一致的. 说明热休克蛋白在正常细胞中也能以低水平持续表达, 应激后会明显增加, 对维持和恢复细胞正常生理功能有重要的作用. 与文献[27-28]对于HSP家族介导了胃黏膜的细胞保护机制的论述具有一致性. 我们分析, 胃组织中热休克蛋白表达增加的可能机制: 当胃黏膜细胞受到内源性刺激因素(如缺氧、酸碱度改变等)时, 细胞内蛋白质构型发生改变, 产生变性聚集的蛋白, 激发细胞的应激反应, 激活热休克基因, 编码热休克蛋白. 诱导合成的热休克蛋白又能促进细胞内蛋白质的合成、折叠、装配、转位, 并促使细胞从应激中恢复, 从而减少了黏膜细胞的损伤, 保护细胞膜. 同时, 我们亦推测, HSP表达增高可引起环氧合酶-1和氧化合成酶的表达上调, 而氧化合酶-1又使具有保护胃黏膜作用的前列腺素E2产生增加, 而氧化合成酶的催化产物一氧化氮可增加胃黏膜的血流量, 也是一种对胃黏膜具有保护作用的物质. 据报道, HSP还可以抑制胃黏膜细胞的凋亡以及多种因素引起的细胞损伤等, 对于低浓度与高浓度的乙醇引起的凋亡, HSP同样具有抑制作用[29-30].
此外,本研究所识别的与GU复发相关的蛋白质还有抗氧化蛋白如过氧化物酶1(peroxiredoxin 1, PDX1)、过氧化物酶2(peroxiredoxin 2, PDX2); 信号转导蛋白如annexin A; 代谢相关蛋白如L-乳酸脱氢酶轻链、GAPDH, 以及细胞结构相关蛋白等, 这些蛋白质与GU复发的关系有待进一步的研究. 总之, 在本研究中, 我们建立了GU复发大鼠与正常大鼠胃组织的二维电泳图谱, 识别并鉴定了两不同组别胃组织之间的12个差异蛋白质, 并应用免疫组化验证了部分差异蛋白质的表达水平, 说明新兴的蛋白质组学技术与免疫组化等经典的生物学技术相结合, 有利于寻找胃溃疡复发过程中的相关蛋白质. 同时, 本文的结果有助于理解胃溃疡复发这一病变进展的生物学行为, 并为最终防治胃溃疡复发提供新的思路和线索.
本课题承中南大学湘雅医院卫生部肿瘤蛋白质组学重点实验室的技术支持、指导和帮助, 在此表示忠心的感谢!
胃溃疡是临床常见病之一, 由于其复发率极高, 其整体治疗水平不尽如人意. 因此, 有必要从蛋白质整体水平对胃溃疡复发的产生机制进行研究, 故而对早期预测及其诊断胃溃疡复发, 进一步提高其治愈率, 改善预后有重要意义. 自 1994年Wilkins和 Williams提出蛋白质组(Proteome)后, 以其为核心的技术的快速发展使胃溃疡复发的早期预测、诊断及其药物靶点的筛选成为可能.
白质组学作为一门应用大规模白质分离和识别技术研究蛋白质组的学科, 是对基因组所表达的整套蛋白质的分析. 主要分为三个方向:(1)建立蛋白质组或亚蛋白质组及其蛋白质组连锁群; (2)以重要生命过程或重大疾病为对象进行重要生理病理体系或过程的差异蛋白质组学研究; (3)蛋白质组学支撑平台和生物信息学的研究. 其中差异蛋白质组学已成为溃疡研究的最前沿领域.
利用蛋白质组研究技术, 对正常大鼠、胃溃疡复发大鼠胃组织进行对照分析, 不仅对胃溃疡复发标志物的筛选鉴定、胃溃疡复发的早期诊断有重要意义, 还将促进胃溃疡复发机制的探索, 为进一步筛选抗胃溃疡复发的药物提供有效的靶蛋白.
通过观察胃溃疡复发大鼠与正常大鼠胃组织蛋白质组整体变化, 从整体上寻找潜在的药物靶点,并且通过相关标志物进行胃溃疡复发的早期诊断和治疗, 对于抗胃溃疡复发具有重要的意义.
差异蛋白质组学研究: 又称功能蛋白质组研究, 以重要生命过程或重大疾病为对象进行重要生理病理体系或过程的比较蛋白质组学研究, 对正常组织及病理组织等进行对照分析, 以进一步探讨疾病的发生机制.
本文对IL-1b致乙酸性胃溃疡复发大鼠的比较蛋白质组学进行了研究, 结果结论可靠, 有理论价值.
电编: 李琪 编辑:王晓瑜
| 3. | 熊 国良, 李 家邦, 陈 文红, 喻 长远. 健胃愈疡颗粒对胃溃疡大鼠胃黏膜Bcl-2、Bax表达的调节. 中国中医基础医学杂志. 2003;9:38-40. |
| 6. | Gygi SP, Rochon Y, Franza BR, Aebersold R. Correlation between protein and mRNA abundance in yeast. Mol Cell Biol. 1999;19:1720-1730. [PubMed] |
| 8. | Watanabe T, Arakawa T, Fukuda T, Higuchi K, Kobayashi K. Role of neutrophils in a rat model of gastric ulcer recurrence caused by interleukin-1 beta. Am J Pathol. 1997;150:971-979. [PubMed] |
| 9. | Araki N, Morimasa T, Sakai T, Tokuoh H, Yunoue S, Kamo M, Miyazaki K, Abe K, Saya H, Tsugita A. Comparative analysis of brain proteins from p53-deficient mice by two-dimensional electrophoresis. Electrophoresis. 2000;21:1880-1889. [PubMed] |
| 10. | Gorg A, Obermaier C, Boguth G, Harder A, Scheibe B, Wildgruber R, Weiss W. The current state of two-dimensional electrophoresis with immobilized pH gradients. Electrophoresis. 2000;21:1037-1053. [PubMed] |
| 11. | Candiano G, Bruschi M, Musante L, Santucci L, Ghiggeri GM, Carnemolla B, Orecchia P, Zardi L, Righetti PG. Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis. 2004;25:1327-1333. [PubMed] |
| 12. | Tarnawski A, Stachura J, Krause WJ, Douglass TG, Gergely H. Quality of gastric ulcer healing: a new, emerging concept. J Clin Gastroenterol. 1991;13 Suppl 1:S42-S47. [PubMed] |
| 13. | Tarnawski A, Douglass TG, Stachura J, Krause WJ. Quality of gastric ulcer healing: histological and ultrastructural assessment. Aliment Pharmacol Ther. 1991;5 Suppl 1:79-90. [PubMed] |
| 14. | 梅 武轩, 邓 兰琼, 崔 世高. 柴胡桂枝汤对大鼠乙酸胃溃疡愈合质量的影响. 中国中西医结合脾胃杂志. 2000;8:278. |
| 15. | 张 永峰, 赵 燕平, 刘 立昌, 贾 秀琴, 朱 炎. 健胃汤抗大鼠乙酸胃溃疡及泼尼松再损伤的实验研究. 中国中西医结合消化杂志. 2002;15:86-88. |
| 19. | 李 国成, 陶 秀良, 罗 树星. 健脾益气中药对乙酸慢性胃溃疡大鼠热休克蛋白表达的影响. 中国中西医结合脾胃杂志. 1999;7:133-136. |
| 22. | Morino M, Tsuzuki T, Ishikawa Y, Shirakami T, Yoshimura M, Kiyosuke Y, Matsunaga K, Yoshikumi C, Saijo N. Specific expression of HSP27 in human tumor cell lines in vitro. In Vivo. 1997;11:179-184. [PubMed] |
| 23. | Hahm KB, Park IS, Kim YS, Kim JH, Cho SW, Lee SI, Youn JK. Role of rebamipide on induction of heat-shock proteins and protection against reactive oxygen metabolite-mediated cell damage in cultured gastric mucosal cells. Free Radic Biol Med. 1997;22:711-716. [PubMed] |
| 24. | Mehlen P, Coronas V, Ljubic-Thibal V, Ducasse C, Granger L, Jourdan F, Arrigo AP. Small stress protein Hsp27 accumulation during dopamine-mediated differentiation of rat olfactory neurons counteracts apoptosis. Cell Death Differ. 1999;6:227-233. [PubMed] |
| 25. | Ortiz C, Cardemil L. Heat-shock responses in two leguminous plants: a comparative study. J Exp Bot. 2001;52:1711-1719. [PubMed] |
| 26. | Kuznetsov G, Bush KT, Zhang PL, Nigam SK. Perturbations in maturation of secretory proteins and their association with endoplasmic reticulum chaperones in a cell culture model for epithelial ischemia. Proc Natl Acad Sci USA. 1996;93:8584-8589. [PubMed] |
| 27. | Nakamura K, Rokutan K, Marui N, Aoike A, Kawai K. Induction of heat shock proteins and their implication in protection against ethanol-induced damage in cultured guinea pig gastric mucosal cells. Gastroenterology. 1991;101:161-166. [PubMed] |
| 28. | Teramae N, Azuma T, Habu Y, Kodama T, Kashima K, Aoike A, Kawai K. Expression of heat shock protein in human gastric mucosa. Gastroenterol Jpn. 1991;26:683. [PubMed] |
| 29. | Mizushima T, Tsutsumi S, Rokutan K, Tsuchiya T. Suppression of ethanol-induced apoptotic DNA fragmentation by geranylgeranylacetone in cultured guinea pig gastric mucosal cells. Dig Dis Sci. 1999;44:510-514. [PubMed] |
| 30. | 李 洪, 刘 桥义, 杨 天德. 热休克蛋白的抗凋亡作用. 国外医学. 临床生物化学与检验学分册. 2002;21:118-119. |