修回日期: 2006-11-01
接受日期: 2006-11-28
在线出版日期: 2007-02-08
目的: 通过单独及联合应用选择性COX-2抑制剂尼美舒利和5-LOX抑制剂AA861处理胃癌细胞系AGS, 比较各实验组的增殖凋亡率, 探讨联合抑制COX-2和5-LOX两条通路对胃癌细胞系AGS增殖凋亡的影响.
方法: AGS细胞在含100 mL/L小牛血清+100 kU/L青、链霉素的RPMI1640培养基中培养, 取对数生长期细胞做为实验组. 以相差显微镜观察药物处理前后的细胞形态改变; 设立AA861(25, 50, 100 μmol/L)组, 尼美舒利(50, 100, 200 μmol/L)组, 及AA861联合尼美舒利处理组(50 μmol/L AA861+100 μmol/L尼美舒利), 用四氮唑蓝(MTT)法在24, 48, 72 h测量细胞吸光度, 以此检测单用及联用AA861与尼美舒利对细胞生长增殖的影响; 实验通过脱氧核糖核酸末端转移酶介导的dUTP缺口末端标记法(TUNEL)和吖啶橙/溴化乙啶(AO/EB)染色法检测细胞凋亡率, 以DNA-LADDER法观察凋亡.
结果: 相差显微镜观察, 药物处理组细胞与对照组相比, 形态发生明显改变. MTT显示, 除尼美舒利200 μmol/L的24, 48 h处理组及AA861 25 μmol/L的24 h处理组外, 尼美舒利和AA861基本呈时间、剂量依赖性抑制AGS细胞增殖. TUNEL染色法表明, 尼美舒利或AA861处理组的细胞凋亡率随着剂量的增加而升高. 药物处理48 h后, MTT法表明, 细胞增殖在AA861组和尼美舒利组与两药联用组间相比差异显著(0.240±0.002 vs 0.207±0.001, P<0.01; 0.211±0.002 vs 0.207±0.001, P<0.05); TUNEL染色法表明, 单药组与两药联用组细胞凋亡率相比差异明显(AA861组: 18.67%±0.03%, 尼美舒利组: 20.94%±0.48% vs 两药联用组: 23.76%±0.92%, P<0.01); AO/EB染色法也同时表明, 细胞凋亡单药组与两药联用组相比差异明显(AA861组: 18.17%±0.28%、尼美舒利组: 19.35%±0.74% vs 两药联用组: 23.78%±0.04%, P<0.01). DNA琼脂糖凝胶电泳法显示, 两药联合处理AGS细胞组与单药处理组比较, 癌细胞增殖被抑制, 凋亡明显增加.
结论: COX-2抑制剂尼美舒利和5-LOX抑制剂AA861对胃癌AGS细胞的增殖抑制以及促凋亡作用基本呈时间浓度依赖性. 联用尼美舒利和AA861抑制COX-2与5-LOX两条通路, 与单独抑制其中一条通路比较, 能更有效抑制胃癌细胞增殖, 促进凋亡.
引文著录: 陈浩莉, 邹来玉, 李建英, 王小众, 陈治新, 黄月红. 联合抑制环氧合酶-2与5-脂氧合酶对胃癌细胞增殖凋亡的影响. 世界华人消化杂志 2007; 15(4): 323-331
Revised: November 1, 2006
Accepted: November 28, 2006
Published online: February 8, 2007
AIM: To evaluate the efficacy of the selective cyclooxygenase-2 (COX-2) inhibitor nimesulide, 5-lipoxygenase (5-LOX) inhibitor AA861 and their combination on the proliferation and apoptosis of human gastric carcinoma cell line AGS.
METHODS: Human gastric carcinoma cell line AGS was cultured in RPMI1640 medium with 100 mL/L fetal bovine serum (FBS), 100 kU/L penicillin G and 100 kU/L streptomycin in an incubator at 37°C, with 100% humidity and 50 mL/L CO2. Then AGS cells were treated with AA861 (25, 50, 100 mmol/L) or nimesulide (50, 100, 200 mmol/L) or in combination. The morphological changes of AGS cells were observed and photographed by inverted microscopy. The proliferation of AGS cells was detected by thiazolyl blue tetrazolium bromide (MTT) assays. Acridineorange-ethidiumbromide (AO-EB) fluorescence staining, TUNEL staining and DNA-fragment assay were used to evaluate the apoptotic of AGS cells.
RESULTS: The morphological changes were observed in AGS cells treated by nimesulide, AA861 or their combination under the inverted microscope. MTT assay revealed that nimesulide and AA861 inhibited the proliferation of AGS cells in a dose- and time-dependent manner, except for nimesulide of 200 mmol/L at the 24th and 48th hour as well as AA861 of 25 mmol/L at the 24th hour. TUNEL staining showed that the apoptosis rate was elevated with the increase of nimesulide and AA861 concentration. MTT assay (AA861: 0.240 ± 0.002 vs combination: 0.207 ± 0.001, P < 0.01; nimesulide: 0.211 ± 0.002 vs combination: 0.207 ± 0.001, P < 0.05), AO-EB staining (AA861: 18.17% ± 0.28%, nimesulide: 19.35% ± 0.74% vs combination: 23.78% ± 0.04%, P < 0.01), TUNEL staining (AA861: 18.67% ± 0.03%, nimesulide: 20.94% ± 0.48% vs combination: 23.76% ± 0.92%, P < 0.01) and DNA-fragment assay showed that the combined treatment of AA861 and nimesulide was superior to AA861 or nimesulide alone in inhibiting the proliferation and inducing the apoptosis of AGS cells at the 48th hour.
CONCLUSION: Either COX-2 inhibitor nimesulide or 5-LOX inhibitor AA861 can inhibit the proliferation and induce the apoptosis of human AGS cells. The dual inhibition of COX-2 and 5-LOX may present a superior anticancer efficacy to either inhibition of COX-2 or 5-LOX alone.
- Citation: Chen HL, Zou LY, Li JY, Wang XZ, Chen ZX, Huang YH. Dual suppression of cyclooxygenase-2 and 5-lipoxygenase inhibits proliferation and induces apoptosis of gastric cancer cell line AGS. Shijie Huaren Xiaohua Zazhi 2007; 15(4): 323-331
- URL: https://www.wjgnet.com/1009-3079/full/v15/i4/323.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i4.323
胃癌是严重威胁人类生命健康的恶性肿瘤, 具体发病机制至今仍不明确, 亦无有效的治疗方法. 近几年来, 随着国内外研究的深入, 花生四烯酸(arachidonic acid, AA)代谢通路在胃癌的形成与发展中的作用日益受到广泛关注. 环氧合酶(cyclooxygenase, COX)及脂氧合酶(lipoxygenase, LOX)是催化体内花生四烯酸代谢的两个关键酶. 细胞膜上的磷脂在磷脂酶A2作用下释放出AA, AA经COX及LOX两条通路代谢产生一系列生物活性物质, 如前列腺素(PGs)、血栓烷素A(TXA2)、羟基廿碳四烯酸(HETEs)和白细胞三烯(LTs)等. 通过这些活性物质, COX及LOX影响细胞信号转导, 结构及代谢, 进而对包括肿瘤, 炎症在内的多种疾病产生作用[1-3]. COX分为COX-1和COX-2两种亚型, 根据底物加氧位点的不同, LOX也分为5-LOX, 8-LOX, 12-LOX和15-LOX. 国内外研究发现, COX-2和5-LOX两条通路在多种肿瘤的形成与发展中扮演重要的角色[1-4]. 研究显示, 在结直肠癌、胃癌、食管癌、胰腺癌等多种肿瘤组织或细胞中存在COX-2和5-LOX的高表达, 而相应正常组织则不表达或者表达量很少[5-9]; 同时, 体内体外的实验也表明, 应用选择性COX-2抑制剂或5-LOX抑制剂都可降低下游活性产物, 抑制肿瘤细胞增殖, 并诱导凋亡[7,9-11]. 但关于联合抑制COX-2及5-LOX两条通路, 将对肿瘤细胞造成的影响研究较少, 胃癌中的COX-2及5-LOX双通路抑制则未见报道. 我们通过单独及联合应用选择性COX-2抑制剂尼美舒利和5-LOX抑制剂AA861处理胃癌细胞系AGS, 比较各处理组增殖凋亡率, 探讨联合抑制COX-2和5-LOX两条通路对胃癌细胞系AGS增殖凋亡的影响.
人胃癌细胞系AGS(中分化胃腺癌细胞系)购自中国科学院上海细胞生物研究所, 5-LOX抑制剂AA861、选择性COX-2抑制剂尼美舒利和胰酶均购自Sigma公司; 脱氧核糖核酸末端转移酶介导的dUTP缺口末端标记法(TUNEL)凋亡检测试剂盒购自德国罗氏(Roche, Germany)公司; DNA抽提试剂盒购自Gentra公司; 四甲基偶氮唑盐(MTT)购自Fluka公司; RPMI1640购自Gibco公司; 其余试剂均为国产生化试剂.
细胞在含100 mL/L新生牛血清+100 kU/L青、链霉素的RPMI1640培养基中, 于37℃, 50 mL/L CO2培养箱中常规培养. 取对数生长期的AGS细胞, 经2.5 g/L胰酶消化后, 按实验要求以不同浓度接种于培养板或培养瓶, 常规培养待细胞贴壁后, 换无血清1640培养液同步化24 h, 按不同实验目的分为对照组、AA861处理组、尼美舒利处理组、AA861联合尼美舒利处理组. 其中AA861组, 可分为25 μmol/L, 50 μmol/L, 100 μmol/L三组; 而尼美舒利则分为50 μmol/L, 100 μmol/L, 200 μmol/L三组; AA861联合尼美舒利处理组则为50 μmol/L AA861+100 μmol/L尼美舒利. AA861和尼美舒利都溶于溶剂二甲基亚砜(DMSO)中, 使用时用无血清的1640培养液稀释至终浓度, 对照组含等体积溶剂DMSO, 所有处理组的溶剂DMSO浓度均<1 g/L. 实验皆重复3遍.
1.2.1 倒置显微镜观察细胞形态: AGS细胞以4×104-7×104个/孔接种于6孔细胞培养板中, 于药物处理后48 h取各浓度实验组和对照组细胞, 倒置显微镜下观察细胞形态.
1.2.2 MTT法检测各实验组的细胞增殖情况: AGS细胞以5×103/孔接种于96孔细胞培养板中, 同步化后添加药物, 设不接种细胞的空白对照和只加等体积溶剂DMSO的对照组, 每个浓度每个时间点重复7孔. 药物处理后的24, 48和72 h, 每孔加入MTT溶液(5 g/L) 20 μL, 37℃孵育4 h后吸去上清, 每孔再加入DMSO溶液150 μL, 振荡10 min. 空白孔调零, 测490 nm波长处每孔的吸光度值(A值), 求平均值. 对照组细胞抑制率记为0. 实验组按照下列公式计算细胞抑制率: 细胞抑制率 = (1-实验组A值/对照组A值)×100%.
1.2.3 实验组AGS细胞凋亡率的检测: (1)TUNEL染色法: 严格按照TUNEL试剂盒的产品说明书操作. DAB染色后, 苏木素复染, 封片, 光镜下观察、计数并拍照. 每片计数500个细胞, 计算细胞凋亡率(即每100个细胞中TUNEL阳性细胞所占的百分比); (2)AO/EB染色法: 细胞接种于六孔培养板中, 按实验要求设立分组, 培养48 h, 按终浓度5 mg/L的比例加入AO染液(acridine orange/AO, 100 mg/L溶于PBS)和EB染液(ethidium bromide/EB, 100 mg/L溶于PBS), 迅速于荧光显微镜下观察、拍照. 每片计数500个细胞, 计算细胞凋亡率, 凋亡率 = (早期凋亡细胞+晚期凋亡细胞)/总细胞数×100%; (3)DNA琼脂糖凝胶电泳法: 常规消化、收集好实验组细胞, 严格按DNA抽提试剂盒产品说明书进行操作. 取细胞总DNA 20 μg, 18 g/L琼脂糖凝胶(含0.5 g/L溴化乙锭)电泳分离(80 V, 40 min), 紫外光下自显影, 经计算机扫描成像.
统计学处理 所得数据以mean±SD表示, 采用SPSS13 for windows软件包进行分析, 组间均数比较用t检验和方差分析, 率间比较用χ2检验.
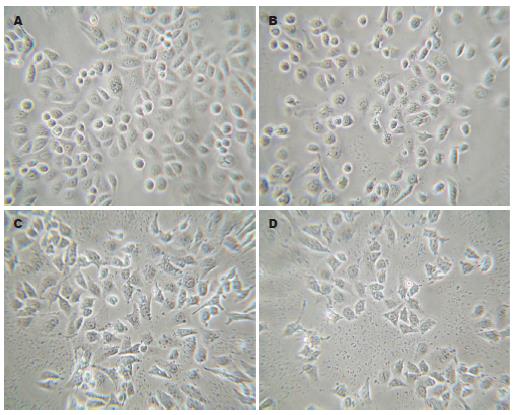
单独及联合应用尼美舒利和AA861处理细胞48 h后, 置于相差显微镜下观察, 50 μmol/L AA861处理组的细胞, 胞核变小, 核仁明显, 细胞变小, 形态变成梭形或变圆; 而100 μmol/L尼美舒利处理组的细胞则形态更不规则, 多边似星形; 两药联用组的细胞数目大量减少, 细胞胞体变圆, 脱离贴壁状态, 成为悬浮细胞, 贴壁的细胞则胞质内可见泡状结构, 胞质浓缩, 胞体变小, 形态亦不规则; 对照组细胞则呈多边形贴壁生长, 悬浮细胞很少(图1).
除尼美舒利200 μmol/L的24, 48 h处理组及AA861 25 μmol/L的24 h处理组外, 尼美舒利和AA861基本呈时间、剂量依赖性抑制AGS细胞增殖, 细胞增殖抑制率呈上升趋势. 尼美舒利200 μmol/L处理细胞72 h, 药物的抑制率最高(55.66%), 尼美舒利50 μmol/L处理细胞24 h, 药物的抑制率最低(18.74%, 表1). 100 μmol/L AA861作用72 h, AGS细胞的增殖抑制率可达63.80%(表2). AA861和尼美舒利共同作用AGS细胞48 h, 实验组细胞的增殖抑制率高于分别单用尼美舒利(P<0.05)或AA861处理(P<0.01)的实验组(表3).
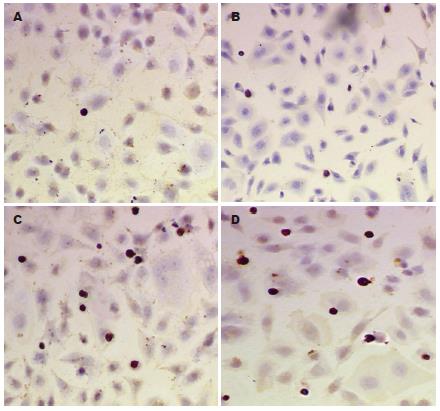
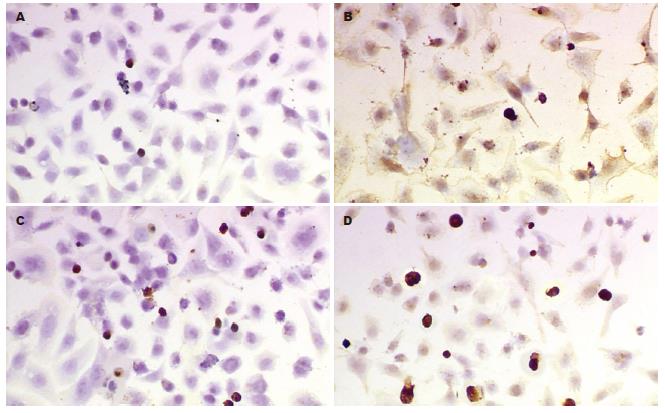
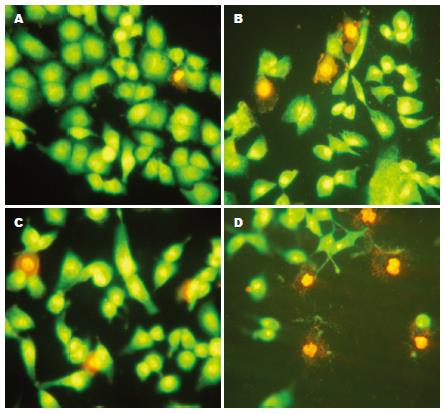
经TUNEL染色与苏木素复染后, 实验组非凋亡细胞的胞核呈淡蓝紫色着染, 核形态大小比较一致, 凋亡细胞的核呈深棕色着染, 核固缩, 不规整, 大小不一致. 对照组凋亡细胞少见, 在不同视野下进行细胞计数, 测得其凋亡率为4.75%±0.15%(n = 3), 不同浓度的尼美舒利和AA861分别处理48 h, 其促进AGS细胞凋亡的作用基本呈浓度依赖性; 在作用48 h后, 联合应用100 μmol/L尼美舒利和50 μmol/L AA861的实验组细胞凋亡率高于单用其中一种同浓度药物的实验组细胞凋亡率(P<0.01), 两药联用组为23.76%±0.92%(n = 3), 尼美舒利组为20.94%±0.48%(n = 3), 而AA861组为18.67%±0.03%(n = 3), 药物处理组与对照组(4.75%±0.15%)比较, 均有显著性差异(P<0.01) (表4, 图2-4).
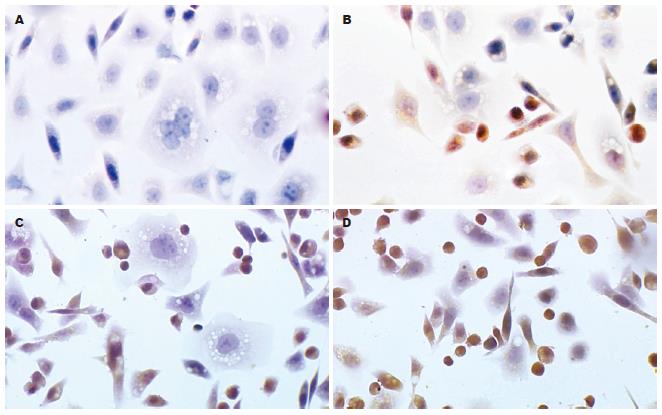
在AO/EB染色法中, 根据观察可将细胞分为4种类型: 正常活细胞(viable non-apoptotic cell, VNA)细胞核染色质被AO染成均一绿色或黄绿色, 细胞核结构正常; 早期凋亡细胞(viable apoptotic cell, VA)细胞核染色质也被AO染成绿色或黄绿色, 但染色不均一, 细胞核呈固缩状、圆珠状或碎片状; 晚期凋亡细胞(non-viable apoptotic cell, NVA)核染色质被EB染成橙色或红色并呈固缩状或圆珠状; 坏死细胞(non-viable non-apoptotic cell, NVNA)核染色质也被EB染成橙色或红色但细胞核结构正常(图5). 单独及联合应用尼美舒利和AA861作用48 h后, 各组的细胞调亡率: 对照组为4.17%±0.15%, AA861(50 μmol/L)组为18.71%±0.28%, 尼美舒利单用组(100 μmol/L)为19.35%±0.74%, 尼美舒利(100 μmol/L)与AA861(50 μmol/L)合用组为23.78%±0.04%, 药物组的细胞调亡率显著高于对照组(P<0.05), 与同等浓度的单药组相比, 合用组的细胞调亡率明显升高(P<0.01).
单用及联用尼美舒利和AA861处理48 h后, AGS细胞DNA琼脂糖凝胶电泳呈现出典型的DNA梯状条带(图6), 表明DNA链在核小体间发生断裂, 生成寡核小体, 提示AGS细胞凋亡. 其中, 以两药联用组条带最亮, 对照组未能诱导出梯形条带.
AA的代谢酶在多种肿瘤组织中存在过表达, 并参与肿瘤细胞的增殖凋亡分化过程, 与肿瘤的血管生成, 侵袭力, 远处转移以及临床预后有关[1-2,4,6]. 如何抑制AA的代谢酶通路来预防和治疗肿瘤成为当今的研究热点. 其中, 5-LOX通路和COX-2通路是现今研究得最为深入的两条代谢途径. Hong et al[9]发现, 5-LOX和COX-2在结肠癌、肺癌、前列腺癌、乳腺癌等上皮癌细胞中都存在过表达, 体内体外实验中, 应用5-LOX抑制剂或COX-2抑制剂阻断AA的代谢都可引起多种恶性肿瘤细胞活性降低, 诱导凋亡, 延缓肿瘤生长速度, 降低远处转移率[10-12]. 研究发现, 使用外源性PGE2处理或将COX-2基因的质粒转染多种肝细胞癌细胞株都能明显促进肿瘤细胞的增殖; 将反义COX-2质粒转染上述肿瘤细胞则可抑制增殖[13]. 同时也有报道称, 无论应用药理学上的5-LOX抑制剂还是转染5-LOX的反义寡核苷酸来抑制5-LOX, 都能显著促进培养在纤维连接蛋白上的胰腺癌细胞凋亡[14].
随着研究的深入, 有学者发现, AA的代谢通路存在着动态平衡, COX途径和LOX途径之间具有交叉作用. 研究表明, 基因敲除5-LOX[15]或COX-1/COX-2[16]会导致其他通路的活化, 一个通路的化学抑制剂有可能也激活其他花生四烯酸代谢通路[17-18]. 据报道, 单独应用COX-2抑制剂作用烟草提取物预处理过的结肠癌细胞, 肿瘤细胞增殖受抑制, 凋亡增加, 但在PGE2降低的同时, 却伴随LTB4水平升高, 而联合应用COX-2抑制剂和5-LOX抑制剂的实验组对肿瘤的抑制效果优于只用一种同浓度抑制剂的实验组, 同时, PGE2和LTB4含量都降低[19]. 拉伸人髌腱成纤维细胞(HPTFs)的实验中也发现, 加入消炎痛在抑制PGE2产生的同时, 能产生更多的LTB4, 而加入FLAP抑制剂MK-886在抑制LTB4产生的同时, PGE2的产生却异常增多[20]. Cherukuri et al[21]还发现, 在头颈癌UMSCC 14A细胞中加入COX-2抑制剂塞来考昔处理, 随着PGE2水平降低, 5-HETE的水平提高. 而Peters-Golden et al[22]报道, 在因5-LOX基因敲除而LT不足的小鼠模型与野生型小鼠对照中发现, 基因敲除小鼠的PGE2水平明显升高. 从这些学者的研究中, 我们似乎真的可以推测: COX-2和5-LOX通路间存在动态平衡, 抑制其中一种酶可能会引起酶底物向另一种酶转移, 导致这种酶的合成或活性增加[23]. 那么同时抑制COX-2和5-LOX两条通路在肿瘤的预防和治疗方面将具有重要意义和前景. 有学者报道, 在肺癌模型中发现, 同时抑制COX-2和5-LOX通路比单独抑制某一通路更有效[24].
国内学者的前期研究发现, COX-2抑制剂尼美舒利显著抑制胃癌细胞SGC-7901的增殖, 并诱导凋亡, 且伴随COX-2下游产物PGE2含量的降低[25]. 而在二甲苯蒽诱导的仓鼠口腔癌模型研究中, 单用或者联用5-LOX抑制剂齐留通及COX-2抑制剂塞来考昔都明显降低磷状细胞癌的发生率, 并且在相同剂量下两药连用比单药更大程度降低磷癌发生率, 具有累加效应[26]. 那么联用COX-2抑制剂和5-LOX抑制剂对胃癌细胞的作用如何, 国内外未见报道. 本实验通过检测COX-2抑制剂尼美舒利和5-LOX抑制剂AA861单独及联合作用于AGS胃癌细胞后, 引起的胃癌细胞增殖凋亡变化, 探讨联合抑制COX-2和5-LOX两条通路对胃癌细胞AGS的作用. 实验中, 我们用相差显微镜观察药物对AGS细胞形态的影响, 单用尼美舒利组和两药联合组细胞形态变化都较大, 对照组形态几乎没有变化, 提示单独及联合抑制COX-2和5-LOX两条通路都会影响细胞的形态. 实验中, MTT结果提示, 尼美舒利和AA861单独作用AGS细胞时, 其抑制细胞增殖的作用基本呈浓度时间依赖性. 200 μmol/L尼美舒利作用24 h, 其细胞增殖抑制率几乎与100 μmol/L组相等, 作用48 h后, 对细胞的增殖抑制率甚至略低于100 μmol/L组, 考虑可能与高浓度尼美舒利抑制COX-2后, 引起花生四烯酸底物向脂氧合酶途径转移, 刺激5-LOX酶活性升高或者合成增加, 导致5-HETE, LTB4等下游活性物质含量升高, 促进细胞增殖有关. 单独及联合应用尼美舒利和AA861处理AGS细胞48 h, 两药联合组的细胞抑制率明显高于单药组, 考虑联合抑制COX-2与5-LOX两条通路, 阻断底物增加对5-LOX通路的刺激作用, 抑制5-LOX下游活性产物的升高, 更有效抑制了细胞增殖. 在TUNEL法检测细胞凋亡率实验中, 不同浓度尼美舒利和AA861单独作用AGS细胞48 h, 处理组的细胞凋亡率随药物浓度升高而升高, 两药联合作用48 h的细胞凋亡率明显高于对照组和同浓度单药组; 进一步AO/EB法检测细胞凋亡率, 也证实两药联合作用组的细胞凋亡率高于对照组和同浓度单药组. 但与AO/EB法检测的细胞凋亡率比较, TUNEL法检测的实验组凋亡率略高, 估计与TUNEL法利用DNA聚合酶和末端脱氧核糖核酸转移酶(TdT)来标记DNA链断端的核酸, 应用TdT进行的末端反应将有DNA链断端的细胞着色, 无法区别凋亡与坏死, 故存在一定的假阳性率有关. DNA琼脂糖凝胶电泳实验进一步证实, COX-2抑制剂尼美舒利和5-LOX抑制剂AA861单独及联合作用于AGS胃癌细胞, 都可诱导细胞凋亡.
总之, COX-2抑制剂尼美舒利和5-LOX抑制剂AA861对胃癌AGS细胞的增殖抑制与促进凋亡的作用, 呈时间剂量依赖性, 而联合应用尼美舒利和AA861抑制COX-2与5-LOX两条通路, 与单独抑制其中一条通路比较, 能更有效的抑制胃癌细胞增殖, 促进凋亡. 但双通路抑制对肿瘤细胞具有更强促凋亡作用的具体机制仍不明确. 据报道, 5-LOX抑制剂可通过降低下游产物5-HETE和LTB4水平, 作用于细胞外调节激酶级联(MEK/ERK)途径及三磷酸肌醇激酶(PI3K)/Akt途径[27-28], 促进细胞凋亡; 还可干扰抗凋亡蛋白(如Bcl-2, Mcl-1)和促凋亡蛋白(Bax)的平衡, 升高促凋亡蛋白/抗凋亡蛋白比值触发线粒体释放细胞色素C, 激活Caspase级联反应导致凋亡[29]. 同时, COX-2抑制剂也可降低PGE2水平, 影响PI3K/Akt通路[30]及调节促/抑凋亡因子(Bcl-2, MAKs/ras, Caspase-3, Par-4)的平衡[31], 以促进细胞凋亡. 那么, 5-LOX抑制剂联合COX-2抑制剂作用于胃癌细胞, 是否也通过减少下游产物, 作用于一系列信号通路及凋亡相关蛋白, 促进细胞凋亡, 并阻断底物转移所致的另一代谢通路激活, 进一步阻断COX-2或5-LOX的促癌作用? 还需要我们今后进行更深入的研究, 以期为肿瘤防治找到一条更有效的新途径
近年来研究发现, 花生四烯酸代谢酶在肿瘤的形成发展中具有重要作用, 其中COX-2 与5-LOX代谢花生四烯酸产生大量活性物质, 介导细胞增殖凋亡、肿瘤血管生成、远处转移等生物学行为. 胃癌是我国常见的恶性肿瘤, 至今无有效的治疗方法, 从机制上寻找积极有效的预防与治疗方法具有重要的意义. 目前关于联合运用COX-2抑制剂与5-LOX抑制剂对肿瘤细胞的作用的研究多集中于大肠癌、口腔癌, 联合抑制COX-2与5-LOX对胃癌的作用情况, 国内外鲜有研究.
本实 验 通过单独及联合应用选择性COX-2抑制剂尼美舒利和5-LOX抑制剂 AA861处理胃癌细胞系AGS, 研究联合抑制COX-2 及5-LOX两条通路对胃癌的影响.发现联用尼美舒利和AA861抑制 COX-2与5-LOX两条通路, 与单独抑制其中一条通路比较, 能更有效抑制胃癌细胞增殖, 促进凋亡.
本实验通过研究联合抑制COX-2 及5-LOX两条通路对胃癌的影响, 进一步探讨胃癌的具体发病机制, 并为寻找新的有效治疗方法提供理论依据.
1 环氧合酶: 是前列腺素类生物合成的限速酶, 催化代谢花生四烯酸生成血栓烷素 (TXA2)和前列腺素E2(PGE2)等活性物质, 参与疼痛, 炎症, 肿瘤等疾病进程. 2 脂氧合酶: 是以铁离子为辅基的一组同工酶, 可将具有1, 4-顺顺-戊二烯结构的多不饱和脂肪酸如花生四烯酸、亚油酸等代谢成为5-HETE, LTB4, 12-HETE, 13-S-HETE等生物活性产物, 从而影响细胞信号传导、结构及代谢.
本文单独及联合应用选择性COX-2抑制剂尼美舒利和5-LOX 抑制剂AA861处理胃癌细胞系 AGS, 分析其对胃癌细胞系AGS增殖凋亡的影响, 有一定创新性, 方法较可靠.
电编: 张敏 编辑:王晓瑜
| 1. | Trifan OC, Hla T. Cyclooxygenase-2 modulates cellular growth and promotes tumorigenesis. J Cell Mol Med. 2003;7:207-222. [PubMed] |
| 2. | Romano M, Claria J. Cyclooxygenase-2 and 5-lipoxygenase converging functions on cell proliferation and tumor angiogenesis: implications for cancer therapy. FASEB J. 2003;17:1986-1995. [PubMed] |
| 3. | Claria J, Romano M. Pharmacological intervention of cyclooxygenase-2 and 5-lipoxygenase pathways. Impact on inflammation and cancer. Curr Pharm Des. 2005;11:3431-3447. [PubMed] |
| 4. | Tsujii M, DuBois RN. Alterations in cellular adhe-sion and apoptosis in epithelial cells overexpressing prostaglandin endoperoxide synthase 2. Cell. 1995;83:493-501. [PubMed] |
| 6. | Soumaoro LT, Iida S, Uetake H, Ishiguro M, Takagi Y, Higuchi T, Yasuno M, Enomoto M, Sugihara K. Expression of 5-lipoxygenase in human colorectal cancer. World J Gastroenterol. 2006;12:6355-6360. [PubMed] |
| 7. | Hoque A, Lippman SM, Wu TT, Xu Y, Liang ZD, Swisher S, Zhang H, Cao L, Ajani JA, Xu XC. Increased 5-lipoxygenase expression and induction of apoptosis by its inhibitors in esophageal cancer: a potential target for prevention. Carcinogenesis. 2005;26:785-791. [PubMed] |
| 8. | Hennig R, Ding XZ, Tong WG, Schneider MB, Standop J, Friess H, Buchler MW, Pour PM, Adrian TE. 5-Lipoxygenase and leukotriene B(4) receptor are expressed in human pancreatic cancers but not in pancreatic ducts in normal tissue. Am J Pathol. 2002;161:421-428. [PubMed] |
| 9. | Hong SH, Avis I, Vos MD, Martinez A, Treston AM, Mulshine JL. Relationship of arachidonic acid metabolizing enzyme expression in epithelial cancer cell lines to the growth effect of selective biochemical inhibitors. Cancer Res. 1999;59:2223-2228. [PubMed] |
| 10. | Huang RH, Chai J, Tarnawski AS. Identification of specific genes and pathways involved in NSAIDs-induced apoptosis of human colon cancer cells. World J Gastroenterol. 2006;12:6446-6452. [PubMed] |
| 11. | Kang HF, Wang XJ, Liu XX, Dai ZJ, Xue FJ, Xue XH. Chemopreventive Effect of Tamoxifen Combined with Celecoxib on DMBA-induced Breast Cancer in Rats. Ai Zheng. 2006;25:1346-1350. [PubMed] |
| 12. | Gregor JI, Kilian M, Heukamp I, Kiewert C, Kristiansen G, Schimke I, Walz MK, Jacobi CA, Wenger FA. Effects of selective COX-2 and 5-LOX inhibition on prostaglandin and leukotriene synthesis in ductal pancreatic cancer in Syrian hamster. Prostaglandins Leukot Essent Fatty Acids. 2005;73:89-97. [PubMed] |
| 13. | Leng J, Han C, Demetris AJ, Michalopoulos GK, Wu T. Cyclooxygenase-2 promotes hepatocellular carcinoma cell growth through Akt activation: evidence for Akt inhibition in celecoxib-induced apoptosis. Hepatology. 2003;38:756-768. [PubMed] |
| 14. | Edderkaoui M, Hong P, Vaquero EC, Lee JK, Fischer L, Friess H, Buchler MW, Lerch MM, Pandol SJ, Gukovskaya AS. Extracellular matrix stimulates reactive oxygen species production and increases pancreatic cancer cell survival through 5-lipoxygenase and NADPH oxidase. Am J Physiol Gastrointest Liver Physiol. 2005;289:G1137-1147. [PubMed] |
| 15. | Goulet JL, Snouwaert JN, Latour AM, Coffman TM, Koller BH. Altered inflammatory responses in leukotriene-deficient mice. Proc Natl Acad Sci USA. 1994;91:12852-12856. [PubMed] |
| 16. | Gavett SH, Madison SL, Chulada PC, Scarborough PE, Qu W, Boyle JE, Tiano HF, Lee CA, Langenbach R, Roggli VL. Allergic lung responses are increased in prostaglandin H synthase-deficient mice. J Clin Invest. 1999;104:721-732. [PubMed] |
| 17. | Fiorucci S, Meli R, Bucci M, Cirino G. Dual inhibitors of cyclooxygenase and 5-lipoxygenase. A new avenue in anti-inflammatory therapy? Biochem Pharmacol. 2001;62:1433-1438. [PubMed] |
| 18. | Schuligoi R, Amann R, Prenn C, Peskar BA. Effects of the cyclooxygenase-2 inhibitor NS-398 on thromboxane and leukotriene synthesis in rat peritoneal cells. Inflamm Res. 1998;47:227-230. [PubMed] |
| 19. | Ye YN, Wu WK, Shin VY, Bruce IC, Wong BC, Cho CH. Dual inhibition of 5-LOX and COX-2 suppresses colon cancer formation promoted by cigarette smoke. Carcinogenesis. 2005;26:827-834. [PubMed] |
| 21. | Cherukuri DP, Nelson MA. Do elevated levels of eicosanoids play a role in head and neck cancer recurrence and metastasis? Implications for prevention and treatment. Cancer Biol Ther. 2004;3:853-854. [PubMed] |
| 22. | Peters-Golden M, Bailie M, Marshall T, Wilke C, Phan SH, Toews GB, Moore BB. Protection from pulmonary fibrosis in leukotriene-deficient mice. Am J Respir Crit Care Med. 2002;165:229-235. [PubMed] |
| 23. | Shureiqi I, Lippman SM. Lipoxygenase modulation to reverse carcinogenesis. Cancer Res. 2001;61:6307-6312. [PubMed] |
| 24. | Rioux N, Castonguay A. Inhibitors of lipoxygenase: a new class of cancer chemopreventive agents. Carcinogenesis. 1998;19:1393-1400. [PubMed] |
| 26. | Li N, Sood S, Wang S, Fang M, Wang P, Sun Z, Yang CS, Chen X. Overexpression of 5-lipoxygenase and cyclooxygenase 2 in hamster and human oral cancer and chemopreventive effects of zileuton and celecoxib. Clin Cancer Res. 2005;11:2089-2096. [PubMed] |
| 27. | Tong WG, Ding XZ, Talamonti MS, Bell RH, Adrian TE. LTB4 stimulates growth of human pancreatic cancer cells via MAPK and PI-3 kinase pathways. Biochem Biophys Res Commun. 2005;335:949-956. [PubMed] |
| 28. | O'Flaherty JT, Rogers LC, Chadwell BA, Owen JS, Rao A, Cramer SD, Daniel LW. 5(S)-Hydroxy-6,8,11,14-E,Z,Z,Z-eicosatetraenoate stimulates PC3 cell signaling and growth by a receptor-dependent mechanism. Cancer Res. 2002;62:6817-6819. [PubMed] |
| 29. | Tong WG, Ding XZ, Witt RC, Adrian TE. Lipoxygenase inhibitors attenuate growth of human pancreatic cancer xenografts and induce apoptosis through the mitochondrial pathway. Mol Cancer Ther. 2002;1:929-935. [PubMed] |
| 30. | Sheng H, Shao J, Washington MK, DuBois RN. Prostaglandin E2 increases growth and motility of colorectal carcinoma cells. J Biol Chem. 2001;276:18075-18081. [PubMed] |
| 31. | Dempke W, Rie C, Grothey A, Schmoll HJ. Cyclooxygenase-2: a novel target for cancer chemo-therapy? J Cancer Res Clin Oncol. 2001;127:411-417. [PubMed] |