修回日期: 2007-10-29
接受日期: 2007-11-11
在线出版日期: 2007-12-18
目的: 探讨重症急性胰腺炎(SAP)肺损伤(ALI)时肺表面活性蛋白A(SP-A)的表达及其在ALI发病中的作用, 并观察清胰汤对SP-A表达和病情转归的影响.
方法: 采用胆胰管内逆行注入1.5%去氧胆酸钠建立大鼠SAP时ALI模型. 将SD大鼠随机分为假手术组(n = 10)、模型组(n = 10)和清胰汤组(n = 10). 假手术组仅行剖腹术, 翻动胰腺. 清胰汤组在建立SAP模型后30 min和12 h清胰汤ig(10 mL/kg). 各组大鼠在术后24 h测PaO2和血淀粉酶. 应用逆转录聚合酶链式反应(RT-PCR)检测肺SP-A mRNA的表达强度, Western-blot观察SP-A表达, 并观察胰、肺病理变化及肺泡Ⅱ型上皮细胞的电镜下变化.
结果: 模型组血淀粉酶(7144.19 U/L±727.91 U/L)显著高于清胰汤组(4283.51 U/L±527.52 U/L)和假手术组(1193.41 U/L±192.54 U/L, P<0.01). 模型组PaO2显著低于假手术组和清胰汤组(79.24±5.84 vs 96.78±3.81, 79.24±5.84 vs 88.16±5.07, P<0.01). 清胰汤组肺SP-A mRNA表达显著高于模型组(P<0.01), 肺SP-A蛋白的表达显著高于模型组, SP-A mRNA的表达与肺损伤的程度呈负相关. 清胰汤组胰、肺病理及电镜改变较模型组减轻.
结论: SAP时肺泡Ⅱ型上皮细胞功能受损, SP-A mRNA表达降低导致急性肺损伤的机制之一. 清胰汤能保护肺泡Ⅱ型上皮细胞功能, 恢复SP-A mRNA正常表达, 维持肺泡功能, 从而对肺组织起保护作用.
引文著录: 张雪梅, 陈海龙, 王朝晖. 清胰汤对大鼠急性胰腺炎肺损伤时SP-A表达的影响. 世界华人消化杂志 2007; 15(35): 3738-3743
Revised: October 29, 2007
Accepted: November 11, 2007
Published online: December 18, 2007
AIM: To investigate the expression of surfactant protein A (SP-A) in the lungs of rats with severe acute pancreatitis (SAP), and the effect of Qingyitang on acute lung injury (ALI) induced by SAP.
METHODS: SD rats were randomly divided into sham-operation group (SO, n = 10), SAP model group (SAP, n = 10) and Qingyitang group (QYT, n = 10). Severe acute pancreatitis was induced in the SAP and QYT groups. Sham operations were only performed on rats in the SO group. QYT (10 mL/kg) was intragastrically administered 30 min and 12 hours after SAP was induced in the QYT group. Serum amylase (AMY) levels, PaO2 and lung wet/dry ratio (W/D) were determined. The level of SP-A mRNA expression in lung was detected by reverse transcription polymerase chain reaction (RT-PCR). SP-A protein in lung was detected by Western blotting. Pathological changes in the pancreas, lung and alveolar type II cells were observed 24 hours after the establishment of the model.
RESULTS: The serum levels of AMY (7144.19 U/L ± 727.91 U/L) in rats of the SAP group were remarkably higher than those in rats of the QYT (4283.51 U/L ± 527.52 U/L) and SO (1193.41 U/L ± 192.54 U/L, P < 0.01) groups. The levels of PaO2 in rats of the SAP group (79.24 mmHg ± 5.84 mmHg) were lower than those in rats of the SO (96.78 mmHg ± 3.81 mmHg) and QYT (88.16 mmHg ± 5.07 mmHg, P < 0.01) groups. The expression levels of SP-A mRNA and SP-A in the rat lungs of the SAP group were significantly decreased compared with those in rats in the SO and QYT groups (P < 0.01). The pathologic changes of the pancreas, lung and alveolar type II cells in rats of the QYT and SO groups were milder than those in rats of the SAP group.
CONCLUSION: The levels of SP-A decrease remarkably in rats with ALI induced by SAP. Administration of QYT reduces injury of lung by protecting alveolar type II cells and increasing the expression of SP-A.
- Citation: Zhang XM, Chen HL, Wang ZH. Influence of Qingyitang on surfactant protein A expression in severe acute pancreatitis-induced lung injury in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(35): 3738-3743
- URL: https://www.wjgnet.com/1009-3079/full/v15/i35/3738.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i35.3738
重症急性胰腺炎(severe acute pancreatitis, SAP)死亡率高达15%-25%[1], 其中死亡病例中有50%发生重度肺损伤[2]. 急性胰腺炎(acute pancreatitis, AP)一旦启动胰腺腺泡的炎症过程, 病情进一步发展会导致全身炎症反应综合征(systemic inflammatory response syndrome, SIRS). 其中急性肺损伤(acute lung injury, ALI)和急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是SAP常见而严重的并发症之一[3]. 已有研究证实, 肺泡Ⅱ型上皮细胞功能改变在急性肺损伤中起重要作用[4-6], 其主要功能是合成、分泌肺泡表面活性物质. 肺表面活性蛋白A(surfactant protein A, SP-A)是肺泡表面活性物质的主要成分之一, 对维持肺泡的结构、功能具有重要作用[7]. 本文通过大鼠SAP合并ALI模型, 探讨SP-A的变化在急性胰腺炎肺损伤发生机制中的作用及清胰汤对其的影响.
健康成年清洁级♂SD大鼠30只, 体质量180-220 g, 大连医科大学实验动物中心提供, 适应性饲养1 wk. 清胰汤组成: 茵陈20 g、栀子20 g、大黄20 g、芒硝20 g、木香15 g、柴胡5 g、元胡15 g、白芍15 g、甘草6 g、当归15 g、双花20 g、连翘20 g, 制成质量体积比为1:1的药液, 灭菌处理后瓶装冰箱存放. 去氧胆酸钠为Sigma公司产品, TRIzol为Invitrogen公司产品. 引物由大连宝生物合成, SP-A: 5'-GGAAGCCCTGGGATCCCTGG-3'(上游), 5'-TAATGGTATCAAAGTTGACTG-3'(下游), GAPDH: 5'-CCATGGAGAAGGCTGGGG3'(上游), 5'-CAAAGTTGTCATGGATGACC-3'(下游). RT-PCR试剂盒为大连宝生物公司产品, 兔抗大鼠SP-A抗体和生物素标记羊抗兔抗体为Santa Cruz公司产品, PCR扩增仪为Biometra公司产品, 紫外分光光度计为美国Beckman Coulter公司产品, 凝胶图像分析系统(AABI Gel Analysis), Bio-RAD电泳系统.
1.2.1 分组和造模: 将实验大鼠随机分为假手术组(SO组)、模型组(SAP组)和清胰汤治疗组(QYT组), n = 10. 采用胆胰管内逆行注入1.5%去氧胆酸钠建立大鼠SAP时ALI模型. 大鼠术前12 h禁食、不禁水, 用100 g/L水合氯醛(3 mL/kg)ip麻醉, 无菌条件下, 腹壁正中切口入腹, 显露出十二指肠. 于胆管出肝门端以无损伤小动脉夹暂时阻断胆管, 寻找到胆胰管十二指肠乳头开口处. 在其对侧肠壁插入1 mL小注射器, 针头经胆胰管十二指肠乳头开口入胆胰管, 妥善固定. 以15 g/L去氧胆酸钠匀速注入(1 mL/kg, 0.1 mL/min), 注毕后拔管, 5 min后去除小动脉夹缝合腹壁. SO组于开腹后翻动胰腺数次, 关腹. QYT组分别于造模成功后30 min和12 h给予清胰汤(10 mL/kg) ig. 各组动物分别于造模成功后24 h留取标本. 颈动脉采血做动脉血气分析, 经下腔静脉采血, 用全自动生化分析仪检测血淀粉酶.
1.2.2 肺湿/干比值(W/D)测定: 动物放血致死后取右肺称湿重, 置60℃烤箱连续烘烤24 h. 去除水分至衡重, 称肺干重, W/D.
1.2.3 病理检查: 左肺中叶用40 g/L中性甲醛固定液中, 石蜡包埋制作5 μm切片, HE染色后显微镜观察并照相. 病理医师单盲读片, 肺病理改变采用Derks et al[4]描述的评分标准评分. 40 g/L甲醛固定胰腺组织, 切片后行HE染色, 显微镜观察并照相.
1.2.4 肺组织中SP-A mRNA表达的检测: 采用反转录聚合酶链式反应(reverse transcription polymerase chain reaction, RT-PCR)技术. TRIzol试剂抽提肺组织中总RNA, 经紫外光检测A260和A280, A260/A280在1.6-2.2之间, 计算总RNA的浓度. 逆转录后行PCR扩增, 反应条件: 99℃预变性5 min, 94℃变性30 s, 55℃ 退火30 s, 72℃延伸60 s, 循环30次, 72℃延伸7 min, 最后降至4℃结束反应. PCR产物琼脂糖凝胶电泳后, 用凝胶图像分析系统进行电泳条带密度分析, 以SP-A条带与GAPDH条带密度比代表靶基因mRNA的表达水平.
1.2.5 Western blot检测肺组织SP-A的表达: 左肺下叶置入蛋白裂解液, 制备组织匀浆, 提取蛋白质, 用考马斯亮蓝法测定蛋白含量. 取蛋白100 μg, 12% SDS-PAGE电泳, 转膜, 5%脱脂奶粉37℃封闭1 h, 加入兔抗大鼠的SP-A抗体, 4℃过夜, 漂洗3次, 加入辣根过氧化酶标记的Ⅱ抗(山羊抗兔IgG-HRP), 常温1 h后漂洗, 加入ECL试剂, 即刻压片成像.
1.2.6 电镜观察: 从每组中随机取出3例. 肺组织取材后, 经25 g/L的戊二醛固定1 h, 常规脱水, 浸透, 包埋, 超薄切片, 经锇酸染色后, 置透射电镜下观察肺泡Ⅱ型上皮细胞.
统计学处理 数据以mean±SD表示, 采用t检验. 相关性检验采用线性回归分析. 应用SPSS10.0统计软件分析, 以P<0.05表示差异有显著性. 等级资料采用Wilcoxon等级资料秩和检验.
与SO组比较, SAP模型组PaO2明显下降(t = 0.7953, P<0.01), 表明SAP组肺功能有明显损伤. QYT组PaO2与SAP组比较有明显升高, 差别有显著性(t = 3.644, P<0.01). SAP组AMY(7144.19 U/L±727.91 U/L)显著高于SO组(1193.41 U/L±192.54 U/L, t = 24.993, P<0.01). QYT组AMY(4283.51 U/L±527.52 U/L)与SAP组比较有显著降低(t = 10.063, P<0.01). SAP模型组肺组织W/D(8.57±2.45)较SO组(3.70±0.90)有显著增高(t = 5.280, P<0.01). QYT组肺组织W/D(4.05±0.52)与SAP组比较比值有显著降低(t = 5.113, P<0.01)(表1).
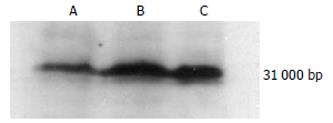
SAP组SP-A mRNA表达较SO组明显减少(t = 7.453, P<0.01), QYT治疗组SP-A mRNA表达较SAP组显著增高(t = 4.497, P<0.01)(表1, 图1).
SO组SP-A蛋白有明显表达, 与SO组比较, SAP组SP-A表达显著降低; QYT组与SAP组比较SP-A表达有明显升高(图2).
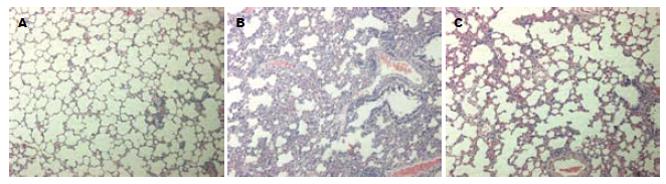
SO组为正常肺组织病理切片, 肺组织结构清晰, 肺泡壁薄, 肺泡腔内偶见巨噬细胞, 未见中性粒细胞浸润. SAP模型组可见肺间质高度充血、水肿, 大部肺泡间隔明显增宽, 较多的肺泡萎陷及邻近肺泡隔断裂形成肺大泡, 肺间质大量中性粒细胞浸润, 毛细血管扩张、充血, 灶状肺泡内出血, 组织学评分显著高于SO组(t = 34.069, P<0.01). QYT组可见肺组织结构清晰, 肺泡间质轻度充血, 可见少量白细胞浸润, 组织学评分显著低于SAP组(t = 10.624, P<0.01)(表1, 图3). SP-A mRNA表达与肺损伤评分呈负相关(SAP组: t = 0.876, P<0.01, QYT组: t = 0.750, P<0.05).
SO组胰腺结构大致正常. SAP组可见胰腺弥漫性出血、片状坏死, 胰腺间质及腺泡炎症细胞浸润. QYT组胰腺病变较SAP组明显减轻(图4).
见SO组肺泡Ⅱ型细胞形状较规则, 细胞表面有很多长短不一、粗细不等的微绒毛, 胞核明显, 胞质内含有数量不等、大小不一的特征性板层小体, 且可看到其不同的成熟阶段. SAP组可见肺泡Ⅱ型细胞相对不规则、细胞变性、甚至崩解、细胞表面微绒毛减少, 胞质内板层小体排空明显增多而致空泡化并可见脱落的板层小体. QYT组可见肺泡Ⅱ型上皮细胞形态较SAP组明显好转, 板层小体空泡化, 较SAP组明显减轻(图5).
肺表面活性蛋白(surfactant protein, SP)是肺泡表面活性物质(pulmonary surfactant, PS)的有效活性成分. 其重要功能是促进肺泡气-液界面的表面活性膜的形成和稳定, 防止肺泡萎陷. SP-A是SP含量最多的一种多功能糖蛋白, 由肺泡Ⅱ型细胞及Clara细胞合成并分泌入呼吸道[8]. 其在维护并增强PS系统的表面活性、促进PS磷脂单分子层在气液界面的吸附扩展、调控PS系统的自身稳定、参与宿主呼吸系统局部防御机制等方面都有非常重要的作用[9]. 近年来, 人们认识到肺内PS活性成分的减少可能比总量的减少在肺损伤发病中更有意义. 研究表明, 随着PS系统及肺功能损害, 肺内SP-A减少[9-10]. SP-A减少可使PS活性降低、代谢障碍, 使PS对氧自由基和脂质过氧化物, 以及渗出血浆蛋白灭活作用的抵抗能力明显减弱[9,11-14]. Mora et al[15]在LPS引起鼠ALI的动物模型中发现, 24 h内鼠支气管肺泡灌洗液内SP-A和SP-B含量减少, 同时伴有PS功能和肺功能的障碍. 本实验发现, SAP合并急性肺损伤模型24 h后, PaO2下降, 肺W/D明显增加. 病理检查见弥漫性肺实质损伤和肺水肿, 符合急性肺损伤的病理改变. 进一步检测肺组织SP-A mRNA的表达发现, 肺组织SP-A表达减弱, Western blot检查见肺SP-A蛋白表达减少, 提示SAP并发ALI可致大鼠PS有效成分SP-A含量的减少, 肺内SP-A表达降低. 本实验以肺W/D比、肺组织病理评分来判定肺损伤程度, 并将肺损伤程度与肺组织SP-A mRNA表达相关性进行分析, 发现SP-A表达与肺损害程度呈负相关, 提示肺内SP-A含量的减少可能发生在转录水平. 电镜检查可见急性胰腺炎肺损伤后Ⅱ型肺泡上皮细胞微绒毛减少甚至消失, 细胞内线粒体水肿, 嵴消失, 板层小体空泡变性, Ⅱ型肺泡上皮细胞结构的破坏可能是SP-A mRNA表达减弱的原因之一. 本研究表明, 肺内SP-A mRNA表达减弱可能在急性胰腺炎肺损伤时起重要作用.
我们的临床和实验研究已经证明, 清胰汤治疗急性胰腺炎具有较好的疗效, 并发现其有减轻ALI的作用. 其对肺组织SP-A的影响未见报道. 本实验发现, QYT组肺组织SP-A mRNA表达与SAP组比较有显著增高, Western blot检测SP-A蛋白表达也较SAP组有显著增高. 与SAP组比较, QYT组PaO2显著升高、肺W/D显著降低. 这表明清胰汤有保护肺组织、减轻肺损伤的功能. 进一步电镜检查可见肺泡Ⅱ型上皮细胞损伤较SAP组明显减轻, 同样证明清胰汤对肺的保护功能. 保护肺泡Ⅱ型上皮细胞, 维持其合成、分泌SP-A的功能, 从而保持良好的肺表面张力, 防止肺泡萎陷, 维持肺功能可能是清胰汤治疗急性胰腺炎肺损伤的又一重要机制. 中医理论认为, 肺与大肠相表里. 若肺气被邪毒所遏, 失其宣肃, 则喘促息数, 传入阳明与肠道糟粕搏结, 肺气不通而浊气又不能从下而出, 扰乱了肺与大肠相表里的生理状态而出现喘满症. 而清胰汤有通腑利肠泻肺实的作用, 使肺气得以宣发肃降,在治疗肺系感染中有显著疗效. 总之, 清胰汤在SAP时ALI保护作用机制可概括如下[16-19]: (1)通里攻下有利于肠麻痹的解除, 能促进腹腔内肠腔内血管活性及毒性物质的排除. (2)已经证明通里攻下与清热解毒法是防治肠源性感染与内毒素血症的有效措施, 有助于减轻坏死胰腺的感染及脓肿形成. (3)通里攻下与清热解毒中药对内毒素具有降解作用, 能抑制内毒素介导的细胞因子及其他炎性介质引起的过度炎性反应. (4)通里攻下和活血化瘀药物能改善腹腔内器官的血液灌注, 疏通微循环, 防止过氧化损伤, 并能促进炎性渗出物的吸收. (5)减少中性粒细胞在大鼠肺组织中黏附和聚集, 提高肺的通气和换气功能, 降低肺毛细血管通透性有积极作用. (6)保护肺泡型上皮细胞, 促进SP-A的合成和分泌, 从而防止肺泡萎陷, 维持肺功能, 可能是清胰汤治疗SAP时ALI的重要机制之一. 本研究进一步探讨了急性胰腺炎肺损伤的发生机制, 丰富了中药清胰汤治疗急性胰腺炎的内涵.
肺损伤(ALI)是SAP常见的并发症, 其发生机制尚未明确. 肺泡Ⅱ型上皮细胞功能改变在急性肺损伤中起重要作用, 其主要功能是合成、分泌肺泡表面活性物质, SP-A是肺泡表面活性物质的主要成分之一. SP-A在急性胰腺炎肺损伤时的变化, 及其在SAP合并ALI发生机制中的作用尚未见报道.
SAP合并ALI时肺部细胞功能的改变是近年的研究热点. 肺泡Ⅱ型上皮细胞是维持肺功能的主要细胞, 其在ALI时的功能改变及在SAP时如何保护肺功能、早期预防ALI是目前急需解决的难题.
Mora et al在LPS引起鼠ALI的动物模型中发现24 h内鼠支气管肺泡灌洗液内SP-A和SP-B含量减少, 同时伴有PS功能和肺功能的障碍. 本实验发现SAP合并急性肺损伤模型24 h后, 肺组织SP-A mRNA的表达减弱, 肺SP-A蛋白表达减少. 肺SP-A含量的减少可能发生在转录水平, Ⅱ型肺泡上皮细胞结构的破坏可能是SP-A mRNA表达减弱的原因之一.
本文首次研究SAP合并ALI时肺泡Ⅱ型上皮细胞形态、功能改变. 主要研究了在转录和翻译水平肺SP-A的表达变化, 同时研究了清胰汤治疗后肺泡Ⅱ型上皮细胞形态改变及SP-A表达的变化.
本研究表明, 在SAP合并ALI时, 肺泡Ⅱ型上皮细胞SP-A表达降低. 应用清胰汤可以减轻肺损伤, 使SP-A表达较SAP组增高, 为临床上早期应用清胰汤防治SAP合并ALI提供理论依据.
SP-A: 肺泡表面活性蛋白A, 由肺泡Ⅱ型上皮细胞合成并分泌到肺泡腔. 他是肺泡表面活性物质的主要成分, 主要功能是使肺泡气-液界面的表面活性膜形成和稳定, 防止肺泡萎陷.
本文研究内容新颖, 技术路线和方法科学性强, 具有一定的理论价值和临床参考价值.
编辑: 何燕 电编: 郭海丽
| 1. | Pastor CM, Matthay MA, Frossard JL. Pancreatitis-associated acute lung injury: new insights. Chest. 2003;124:2341-2351. [PubMed] [DOI] |
| 2. | Steer ML. Relationship between pancreatitis and lung diseases. Respir Physiol. 2001;128:13-16. [PubMed] [DOI] |
| 3. | Raghu MG, Wig JD, Kochhar R, Gupta D, Gupta R, Yadav TD, Agarwal R, Kudari AK, Doley RP, Javed A. Lung complications in acute pancreatitis. JOP. 2007;8:177-185. [PubMed] |
| 4. | Funk AJ, Mandrell TD, Lokey SJ, Kosanke SD, Li CS, Potters CF. Effects of leukotriene inhibition on pulmonary morphology in rat pup lungs exposed to hyperoxia. Comp Med. 2007;57:186-192. [PubMed] |
| 5. | Derks CM, Jacobovitz-Derks D. Embolic pneumopathy induced by oleic acid. A systematic morphologic study. Am J Pathol. 1977;87:143-158. [PubMed] |
| 6. | Wang XD, Börjesson A, Sun ZW, Wallèn R, Deng XM, Zhang HY, Hallberg E, Andersson R. The association of type II pneumocytes and endothelial permeability with the pulmonary custocyte system in experimental acute pancreatitis. Eur J Clin Invest. 1998;28:778-785. [PubMed] [DOI] |
| 7. | Haque R, Umstead TM, Ponnuru P, Guo X, Hawgood S, Phelps DS, Floros J. Role of surfactant protein-A (SP-A) in lung injury in response to acute ozone exposure of SP-A deficient mice. Toxicol Appl Pharmacol. 2007;220:72-82. [PubMed] [DOI] |
| 8. | Heinrich S, Hartl D, Griese M. Surfactant protein A--from genes to human lung diseases. Curr Med Chem. 2006;13:3239-3252. [PubMed] [DOI] |
| 9. | Takahashi H, Sano H, Chiba H, Kuroki Y. Pulmonary surfactant proteins A and D: innate immune functions and biomarkers for lung diseases. Curr Pharm Des. 2006;12:589-598. [PubMed] [DOI] |
| 10. | Sorensen GL, Husby S, Holmskov U. Surfactant protein A and surfactant protein D variation in pulmonary disease. Immunobiology. 2007;212:381-416. [PubMed] [DOI] |
| 11. | Kishore U, Greenhough TJ, Waters P, Shrive AK, Ghai R, Kamran MF, Bernal AL, Reid KB, Madan T, Chakraborty T. Surfactant proteins SP-A and SP-D: structure, function and receptors. Mol Immunol. 2006;43:1293-1315. [PubMed] [DOI] |
| 12. | Pastva AM, Wright JR, Williams KL. Immunomodulatory roles of surfactant proteins A and D: implications in lung disease. Proc Am Thorac Soc. 2007;4:252-257. [PubMed] [DOI] |
| 13. | Kingma PS, Whitsett JA. In defense of the lung: surfactant protein A and surfactant protein D. Curr Opin Pharmacol. 2006;6:277-283. [PubMed] [DOI] |
| 14. | Touqui L, Wu YZ. Interaction of secreted phospholipase A2 and pulmonary surfactant and its pathophysiological relevance in acute respiratory distress syndrome. Acta Pharmacol Sin. 2003;24:1292-1296. [PubMed] |
| 15. | Mora R, Arold S, Marzan Y, Suki B, Ingenito EP. Determinants of surfactant function in acute lung injury and early recovery. Am J Physiol Lung Cell Mol Physiol. 2000;279:L342-L349. [PubMed] |
| 17. | Qiu Y, Li YY, Li SG, Song BG, Zhao GF. Effect of Qingyitang on activity of intracellular Ca2+-Mg2+-ATPase in rats with acute pancreatitis. World J Gastroenterol. 2004;10:100-104. [PubMed] |
| 18. | Li YY, Sibaev A, Zhou MZ, Zhu GY, Yüce B, Storr M. The Chinese herbal preparation Qing Yi Tang (QYT) improves intestinal myoelectrical activity and increases intestinal transit during acute pancreatitis in rodents. Phytother Res. 2007;21:324-331. [PubMed] [DOI] |
| 19. | Li YY, Li XL, Yang CX, Zhong H, Yao H, Zhu L. Effects of Tetrandrine and QYT on ICAM-1 and SOD gene expression in pancreas and liver of rats with acute pancreatitis. World J Gastroenterol. 2003;9:155-159. [PubMed] [DOI] |