修回日期: 2007-10-17
接受日期: 2007-10-28
在线出版日期: 2007-11-28
目的: 探讨Galectin-3对CCl4致急性肝损伤时GRP78的调控作用.
方法: 选择ICR系的♂Galectin-3基因敲除型[Gal-3(-/-)]和其野生型[Gal(+/+)]小鼠, 一次灌胃给予CCl4, 观察给药后10, 24, 48和72 h的肝组织病理改变和检测其血清谷草转氨酶(AST)和谷丙转氨酶(ALT)活性, 并检测肝细胞不同细胞组分中的GRP78蛋白表达.
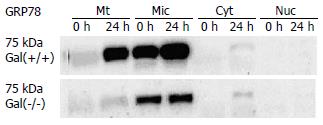
结果: 与Gal(+/+)型鼠比较, CCl4对Gal-3(-/-)型鼠的肝组织病理损伤出现时间早、损伤程度重. Gal-3(-/-)型鼠在CCl4灌胃后10和24 h的血清ALT活性(1860±191 U/L vs 1356±177 U/L, t = 6.12, P<0.01; 2789±236 U/L vs 2468±221 U/L, t = 3.14, P<0.01)及CCl4灌胃后10 h的血清AST活性(946±89 vs 623±73 U/L, t = 8.87, P<0.01)与Gal(+/+)型鼠比较显著升高. 对照组中Gal-3(+/+)型鼠的微粒体组分(Mic)中的GRP78蛋白表达显著高于Gal-3(-/-)型鼠(140.9±21.1 vs 76.1±9.5, t = 8.86, P<0.01). 在CCl4 ig后24 h, Gal-3(+/+)型鼠的肝细胞线粒体组分(Mt)和Mic中的GRP78蛋白表达明显升高, 并显著高于Gal-3(-/-)型鼠(Mt: 127.0±18.8 vs 49.1±6.3, P<0.01; Mic: 166.5±23.4 vs 87.7±11.6, P<0.01).
结论: Galectin-3蛋白在CCl4致急性肝损伤中可能具有一定的保护作用. 上调Mic和Mt中的GRP78蛋白表达可能是Galectin-3在CCl4对肝细胞损伤中发挥保护作用的一个途径.
引文著录: 张鸿, 具英花, 刘晓湘, 平贺紘一, 方秀斌. Galectin-3在CCl4致肝损伤及对GRP78调控的作用. 世界华人消化杂志 2007; 15(33): 3468-3473
Revised: October 17, 2007
Accepted: October 28, 2007
Published online: November 28, 2007
AIM: To evaluate the role of galectin-3 in CC14-induced liver damage and in modulation of Glucose regulated protein 78 (GRP78) in mice.
METHODS: Ten-week-old, Gal-3 (-/-) and Gal-3 (+/+) ICR male mice were treated with CCl4 (8 mL/kg) by lavage. Mice were killed at 0, 10, 24, 48 and 72 h after CCl4 administration. Pathological changes in the liver, serum activity of alanine aminotransferase (ALT) and aspartate aminotransferase (AST), and expression of GRP78 protein in different parts of the liver were examined.
RESULTS: Pathological changes induced by CCl4 in the liver of Gal-3 (-/-) mice were earlier and more serious than those in Gal-3 (+/+) mice. Serum activity of ALT in Gal-3 (-/-) mice was higher than that in Gal-3 (+/+) mice at 10 and 24 h after treatment with CCl4 (1860 ± 191 U/L vs 1356 ± 177 U/L, t = 6.12, P < 0.01; 2789 ± 236 U/L vs 2468 ± 221 U/L, t = 3.14, P < 0.01). In the control experiment, the expression of GRP78 protein in the Mic part of the liver cells of Gal-3 (+/+) mice was higher than that in Gal-3 (-/-) mice (140.9 ± 21.1 vs 76.1 ± 9.5, t = 8.86, P < 0.01). Twenty-four hours after CCl4 administration, the expression of GRP78 protein in both the Mt and Mic parts of the liver cells of Gal-3 (+/+) mice was significantly up-regulated, compared with that in Gal-3 (-/-) mice (Mt, 127.0 ± 18.8 vs 49.1 ± 6.3, P < 0.01; Mic, 166.5 ± 23.4 vs 87.7 ± 11.6, P < 0.01).
CONCLUSION: Galectin-3 seems to protect mouse liver from CCl4-induced damage, which may be attributed to the up-regulation of GRP78 protein.
- Citation: Zhang H, Ju YH, Liu XX, Hiraga K, Fang XB. Role of galectin-3 in CCl4-induced hepatic damage and in modulation of GRP78 in mice. Shijie Huaren Xiaohua Zazhi 2007; 15(33): 3468-3473
- URL: https://www.wjgnet.com/1009-3079/full/v15/i33/3468.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i33.3468
Galectins是半乳糖苷结合性动物外源性凝集素家族成员, 具有高度保守性, 广泛分布于所有的活性有机体. 目前, 在其家族中已经识别了14个成员, 根据发现的先后次序编为1-14. Galectin-3(分子量31 kDa)是Galectins家族的最重要成员之一, 他有两个结构域, 氨基末端有高度保守的酪氨酸-、脯氨酸-、多甘氨酸残基[1]. Galectin-3是一种早期快反应基因. 研究发现, Galectin-3具有促进细胞增生和抑制细胞凋亡的功能[2]. 平贺 et al研究发现[3-4], 在CCl4诱导急性肝损伤24 h与72 h后, 肝细胞匀浆中发现了一种30 kDa的高表达蛋白, 经免疫印迹确定为Galectin-3. CCl4是公认的急性肝损伤性毒物, 那么, Galectin-3在CCl4损伤肝组织中的意义如何? 是否对损伤的肝组织具有保护作用? 目前, 尚无相关的研究报道.
葡萄糖调节蛋白78(glucose regulated protein, GRP78)被认为是Hsp70家族的成员之一, 是一类高度保守的应激蛋白. 作为一种分子伴侣, 他主要参与蛋白质的折叠和转运[5]. 近年来研究表明, 许多应激条件都可以诱导其表达上调, 以维持内质网的稳定, 具有保护细胞、减缓其损伤的作用[6]. 那么, 在CCl4急性肝损伤中, 是否有GRP78蛋白表达的上调? Galectin-3与对GRP78蛋白表达的调节是否有关? 由于人们对GRP78和Galectin-3关注的时间较短, 研究资料很少. 本研究中, 我们选择Galectin-3基因敲除型[Gal-3(-/-)]和其野生型[Gal-3(+/+)]小鼠, 对Galectin-3在CCl4致急性肝组织损伤中的作用、GRP78在CCl4致应激损伤中的表达及Galectin-3与GRP78的关系进行探讨, 为揭示Galectin-3在CCl4致急性肝损伤中的作用及其可能的机制提供实验依据.
野生型[Gal-3(+/+)]ICR♂健康小鼠, 10周龄, 由日本国立肿瘤研究所提供. Galectin-3基因敲除型[Gal-3(-/-)]ICR♂健康小鼠, 10周龄, 由日本富山医科药科大学生化学第一研究室提供.
将Gal-3(+/+)和Gal-3(-/-)型小鼠各50只, 分别随机分成0, 10, 24, 48, 72 h组, 每组10只. 进食标准颗粒饲料, 自由饮水. 染毒前禁食12 h, 将CCl4与食用橄榄油按1:1混合, 制备染毒液. 按8 mL/kg的剂量给小鼠一次性灌胃染毒. 染毒后, 实验动物常规饲养.
1.2.1 小鼠肝组织病理切片制备及观察: 在CCl4灌胃后的0, 10, 24, 48, 72 h, 分别将各组小鼠乙醚麻醉, 心脏取血后, 断头处死. 迅速取出肝脏, 用生理盐水将血液洗去, 用小剪刀将小鼠肝脏切成1 cm×1 cm×0.3 cm的小块, 并立即用100 mL的中性福尔马林固定32 h. 按常规方法进行肝组织的石蜡包埋, 用切片机切成5 μm厚的组织切片, 并对组织切片进行常规的HE染色.
1.2.2 小鼠肝细胞组分的分离和GRP78蛋白表达的检测: 将对照组和CCl4灌胃后24 h的小鼠, 乙醚麻醉后断头处死, 迅速取肝脏, 置于小平皿中(以下操作均在4℃下进行), 用小剪刀将肝组织剪成小块, 称质量后转移到棒型组织研磨管中, 按9 mL/g加入0.25 mol/L蔗糖缓冲液, 经电动研杆研磨制成匀浆, 并经纱布过滤. 此滤液为肝细胞研磨液(HO), 将HO转移到离心管中, 4℃, 6000 g离心10 min(CS100GX, 日本日立公司), 沉淀即为细胞核组分(Nuc). 取上清, 4℃, 8000 g离心10 min, 沉淀即为线粒体组分(Mt); 取上清, 4℃, 105 000 g离心60 min, 沉淀即为微粒体组分(Mic). 上清部分为细胞基质组分(Cyt). 分别对小鼠肝细胞HO, Nuc, Mt, Mic和Cyt进行蛋白定量(BCA蛋白质定量检测试剂, PIERCE公司). 按蛋白均衡各组分上样体积为5-20 μL, 进行SDS- PAGE电泳(3000xi Bio-Rad). 电泳后在电转移槽中将PAGE凝胶中的蛋白质转移至硝酸纤维素膜, 用含50 g/L牛奶TBST封闭1 h, 将转印膜加入一抗(抗GRP78抗体, Santa Cruz), 室温孵育1 h, 用TBST液洗膜5 min×3次. 将转印膜加入二抗温孵育1 h, 除去抗体孵育液, 用TBST液洗膜10 min×3次. 加入ECL蛋白印迹检测分析试剂(Amersham Biosciences), 在化学冷光影像分析仪(LAS-1000plus, 日本富士公司)中反应30 min, 化学发光显影、摄影记录. 将免疫蛋白印迹显影图扫描, 再利用ChemiImager5500 V2.03图像分析软件对实验结果进行分析, 用平均光密度值代表蛋白含量.
1.2.3 血清中ALT, AST酶活性检测: 将取出的血液室温下放置, 析出血清后, 2000 r/min离心10 min, 分离血清. 用Infinity TM ALT试剂和Infinity TM AST(Sigma, St. Louis, MO, USA)分别检测小鼠血清中ALT, AST酶活性.
统计学处理 实验数据用mean±SD表示, 将相同时间组的Gal-3(-/-)型小鼠和Gal-3(+/+)型小鼠的检测结果进行t检验.
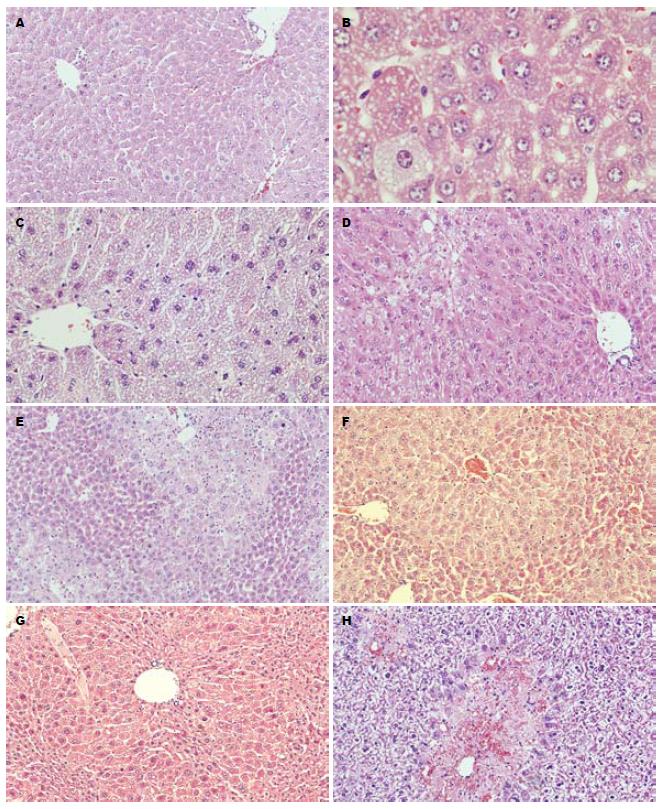
在CCl4灌胃后10 h, Gal-3(-/-)型小鼠的肝组织病理切片中出现明显的病理损伤改变. 主要表现是肝细胞索排列紊乱, 肝窦受压变窄, 以肝小叶中央静脉为中心的大片脂肪变性, 变性的肝细胞胞质明显空亮, 细胞核受压, 偏向一侧(图1A). 高倍镜可见细胞基质中有大量的小空泡, 并可见少量增生(图1B). 但Gal-3(+/+)型小鼠的肝组织病理切片却未见明显的病理损伤改变.
在CCl4灌胃后24 h, Gal-3(-/-)型小鼠肝组织病理损伤进一步加重, 在以肝小叶中央静脉为中心的大片严重脂肪变性基础上, 出现点片状的肝细胞坏死, 并可见无结构的均质粉染的细胞轮廓, 可见核碎裂、核溶解和核消失(图1C). Gal-3(+/+)型小鼠的肝组织病理损伤轻微, 以肝细胞的脂肪变性为主, 并主要集中在肝小叶的周边部. 其病理改变显著轻于Gal-3(-/-)型小鼠在CCl4灌胃后10 h的病理改变(图1D).
在CCl4染毒后48 h, Gal-3(-/-)型小鼠的肝组织病理切片中, 肝小叶轮廓消失, 出现大片的肝细胞坏死(图1E). Gal-3(+/+)型小鼠虽表现肝索紊乱, 但肝小叶轮廓还很清晰, 肝细胞脂肪变性明显, 并可见较多的代偿增生(图1F).
在CCl4染毒后72 h, Gal-3(+/+)型小鼠的肝细胞坏死、变性严重, 肝细胞可见明显肿胀, 肝索变宽, 部分肝窦狭小或消失, 但仍可见肝小叶轮廓(图1G). Gal-3(-/-)型小鼠的肝索解离, 肝细胞溶解, 出现大片肝组织坏死, 肝窦明显扩张、充血、甚至出血(图1H).
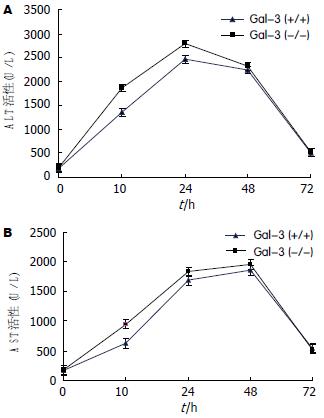
CCl4灌胃后10和24 h, Gal-3(-/-)型小鼠血清ALT活性比Gal-3(+/+)型小鼠显著升高(1860±191 U/L vs 1356±177 U/L, t = 6.12, P<0.01; 2789±236 U/L vs 2468±221 U/L, t = 3.14, P<0.01). 在其他时间, Gal-3(-/-)型小鼠血清ALT活性与Gal-3(+/+)型小鼠比较未见显著差异. 在Gal-3(-/-)型小鼠, 其血清ALT活性在CCl4灌胃后24 h达到高峰, 其均值为2789±236 U/L, 随后下降, 在72 h时下降到518±71 U/L(图2).
图2显示, CCl4灌胃后10 h, Gal-3(-/-)型小鼠的血清AST活性比Gal-3(+/+)型小鼠显著升高(946±89 vs 623±73 U/L, t = 8.87, P<0.01). 在其他时间, Gal-3(-/-)型小鼠的血清AST活性与Gal-3(+/+)型小鼠比较未见显著差异. 在Gal-3(-/-)型小鼠, 其血清AST活性在CCl4灌胃后48 h达到高峰, 其均值为1957±185 U/L, 随后下降, 在72 h时下降到521 ±68 U/L.
肝脏是物质代谢的中心. 当肝功能受到损害时, 物质的代谢过程受到阻碍, 致使肝脏中甘油三酯、胆固醇等代谢障碍, 导致肝细胞中脂肪含量发生异常, 灵敏地反映肝细胞受损的程度. 本实验的病理观察和血清ALT和AST活性检测结果证实, 在CCl4引起的急性肝损伤中, Gal-3(-/-)型小鼠的肝组织损伤比其野生型小鼠出现的时间早、损伤的程度重. 这提示, Galectin-3可能在CCl4致肝损伤的早期具有保护肝细胞, 减缓其损伤的作用.
目前研究结果显示, CCl4的肝毒性是一个多因素综合作用的过程, 损伤机制涉及脂质过氧化、共价结合、活性醛类、核酸低甲基化及Ca2+超载等因素[7]. 自由基被认为是CCl4肝毒性的始动机制. 研究证明, 进入机体的CCl4在肝细胞的P450酶系统的作用下, 将CCl4转化为CCl3•和Cl•自由基. CCl3•能和氨基酸、核苷酸、脂肪酸、蛋白质、核酸、脂类等多种有重要生理作用的生物分子反应. 在有氧的条件下, CCl3•能与氧反应生成过氧化自由基CCl3OO•, 这是一个比CCl3•活性更高、半衰期更短、更易使不饱和脂肪酸发生氧化反应的自由基. 不饱和磷脂被CCl3OO•过氧化后, 氧化反应能启动一系列的连锁发应, 直到多不饱和脂肪酸完全饱和为止, 同时生成醛类、羰基化合物和烃类, 即脂质过氧化物. 活性醛类可大量灭活氨基酸或巯基, 从而抑制酶活性、破坏DNA结构、阻滞蛋白质合成与分泌等. 由于活性醛类比CCl3•, CCl3OO•等自由基的活性小, 所以其毒作用持续时间更长, 并可把毒性效应传到其他的组织细胞. 有研究显示, CCl4处理后6 h活性醛类开始出现, 24 h达到峰值, 36到72 h后消失[8]. 这和本研究中的实验动物肝病理损伤变化相吻合, 进一步提示CCl4对肝组织的损伤机制与其诱导自由基产生的氧化应激有关.
GRP78作为分子伴侣, 是促进正常生长状态下细胞蛋白质成熟、维系细胞机能和生命的关键性调节物质. 在生理情况下, GRP78在内质网膜上通过与新生多肽以非共价键形式短暂地结合, 随后松开, 从而促进蛋白质的正确折叠和装配, 并协助蛋白质跨内质网膜转运到正确的位置. 同时, GRP78又是一种钙结合蛋白, 在应激反应时, 其基因的转录活性可提高l0-25倍, 表达量显著增高, 从而维持了内质网的钙稳态及内环境的稳定[9-10]. 另外, GRP78能转移内质网腔内的错误折叠蛋白, 保持细胞在应激状态下蛋白质合成的继续. GRP78还能降低细胞对杀伤性T细胞的敏感性, 阻止细胞凋亡[11]. 因此, 近年来研究认为, 细胞受刺激时GRP78呈高表达反应, 可能是细胞的一种重要的防御机制, 该机制对细胞有保护作用, 从而可延长在各种不利因素刺激下的细胞生存期[12].
本研究结果显示, 在正常生理条件下, Gal-3(+/+)型小鼠肝细胞的Mic中有GRP78蛋白的高表达, 但Gal-3(-/-)型小鼠的肝细胞Mic中GRP78蛋白表达水平显著降低, 提示Galectin-3蛋白的缺失可干扰GRP78蛋白的正常表达. 另一方面, CCl4灌胃24 h后, Gal-3(+/+)型小鼠肝细胞Mic和Mt的中GRP78蛋白表达均明显上调, 表明在CCl4引起的肝细胞应激损伤中, 机体上调了GRP78蛋白的表达. 但在Gal-3(-/-)型鼠肝细胞的Mic和Mt中的GRP78蛋白表达却没有明显的变化. 该研究结果揭示, Galectin-3参与肝细胞在生理和病理过程中对GRP78蛋白表达的调节. 上调Mic和Mt中的GRP78蛋白表达可能是Galectin-3在CCl4对肝细胞损伤中发挥保护作用的一个途径.
现已证明, 作为一个多功能蛋白, Galectin-3参与机体的各种生理和病理过程. 随着对Galectin-3各方面功能的研究不断深入, 人们将进一步弄清Galectin-3在各种病理生理反应中的机制, 使其在疾病的预防和治疗中发挥重要作用[13].
近年来, 大量对于Galectins的研究结果表明, Galectin-1-14的功能和作用逐渐被研究者所认识, 并且在此基础上发现了Galectin-15. 本研究结果提示, Galectin-3参与了肝细胞在生理和病理过程中对GRP78蛋白表达的调节. 上调Mic和Mt中GRP78蛋白的表达可能是Galectin-3在CCl4对肝细胞损伤中发挥保护作用的一个途径.
本文的科学性较强, 创新性好, 实验结果满意, 对基础和临床研究都有一定的参考意义.
编辑: 程剑侠 电编:郭海丽
| 1. | Cooper DN. Galectinomics: finding themes in complexity. Biochim Biophys Acta. 2002;1572:209-231. [PubMed] |
| 3. | Morigasaki S, Li F, Kawai A, Yamazaki K, Sikdar D, Hibino Y, Hiraga K. Interaction of albumin mRNA with proteins from rat liver with CCl(4)-induced injury. Biochem Biophys Res Commun. 2000;273:261-266. [PubMed] |
| 4. | Yamazaki K, Kawai A, Kawaguchi M, Hibino Y, Li F, Sasahara M, Tsukada K, Hiraga K. Simultaneous induction of galectin-3 phosphorylated on tyrosine residue, p21(WAF1/Cip1/Sdi1), and the proliferating cell nuclear antigen at a distinctive period of repair of hepatocytes injured by CCl4. Biochem Biophys Res Commun. 2001;280:1077-1084. [PubMed] |
| 5. | Ortiz C, Cardemil L. Heat-shock responses in two leguminous plants: a comparative study. J Exp Bot. 2001;52:1711-1719. [PubMed] |
| 6. | Lee AS. The glucose-regulated proteins: stress induction and clinical applications. Trends Biochem Sci. 2001;26:504-510. [PubMed] |
| 7. | Weber LW, Boll M, Stampfl A. Hepatotoxicity and mechanism of action of haloalkanes: carbon tetrachloride as a toxicological model. Crit Rev Toxicol. 2003;33:105-136. [PubMed] |
| 9. | Yang GH, Li S, Pestka JJ. Down-regulation of the endoplasmic reticulum chaperone GRP78/BiP by vomitoxin (Deoxynivalenol). Toxicol Appl Pharmacol. 2000;162:207-217. [PubMed] |
| 10. | Yang Y, Turner RS, Gaut JR. The chaperone BiP/GRP78 binds to amyloid precursor protein and decreases Abeta40 and Abeta42 secretion. J Biol Chem. 1998;273:25552-25555. [PubMed] |
| 11. | Liberman E, Fong YL, Selby MJ, Choo QL, Cousens L, Houghton M, Yen TS. Activation of the grp78 and grp94 promoters by hepatitis C virus E2 envelope protein. J Virol. 1999;73:3718-3722. [PubMed] |
| 12. | 张 莹, 孙 黎光. GRP78的研究进展. 国外医学•生理、病理科学与临床分册. 2005;25:251-253. |
| 13. | Leffler H. Galectins structure and function--a synopsis. Results Probl Cell Differ. 2001;33:57-83. [PubMed] |