修回日期: 2007-10-23
接受日期: 2007-10-28
在线出版日期: 2007-11-18
目的: 观探讨基因表达谱芯片技术在筛查肝硬化相关基因群表达中的作用.
方法: 按TRIzol法抽提肝硬化及正常肝脏组织总RNA, 分离纯化两种组织的mRNA. 经逆转录合成掺入生物素标记的cDNA合成探针, 与基因芯片(涵盖18 400个转录本, 代表14 500个明晰的基因)杂交, 扫描芯片荧光信号图像, 计算机分析, 比较二种组织基因表达谱差异.
结果: 2例肝硬化组织与正常肝脏组织相比, 有1424条基因(9.82%)共同表达差异, 其中共同上调基因980条和共同下调基因444条. 对1424条共同差异表达基因作了初步功能分类, 这些基因与肝硬化的发病机制存在相关性.
结论: 基因表达谱芯片技术可以筛选出肝硬化表达异常的相关基因群, 对其进一步研究有助于认识肝硬化的发病机制.
引文著录: 黄东凤, 黄介飞, 张弘, 黄晓平, 鲍柏军, 魏群, 华婷琰. 应用基因芯片技术筛选肝硬化相关基因. 世界华人消化杂志 2007; 15(32): 3377-3384
Revised: October 23, 2007
Accepted: October 28, 2007
Published online: November 18, 2007
AIM: To ascertain the effectiveness of GeneChip for screening hepatocirrhosis-related genes.
METHODS: Total RNA was isolated from tissues of two cases of hepatic cirrhosis and one normal liver by the TRIzol method, and then purified, reverse-transcribed to cDNA incorporating biotin-labeling probe, hybridized with GeneChip (covering 18 400 transcripts, representing 14 500 distinct genes). Picture signals of fluorescence in gene array were scanned and compared by computer analysis of differential expression of the genes in two tissues.
RESULTS: Same differentially expressed genes were 1424 (9.82%) and same up regulated and down regulated genes were 980 and 444 respectively, in two hepatic cirrhosis and tissue specimens one normal liver tissue specimen. These genes were initially classified according to their function, and further analysis showed they played an important role in the pathogenesis of hepatic cirrhosis.
CONCLUSION: The analysis of gene expression profile of hepatic cirrhosis using GeneChip can rapidly select associated abnormal genes, while further analysis of the obtained genes can help to elucidate the pathogenesis of hepatic cirrhosis.
- Citation: Huang DF, Huang JF, Zhang H, Huang XP, Bao BJ, Wei Q, Hua TY. Screening hepatocirrhosis-related genes by GeneChip. Shijie Huaren Xiaohua Zazhi 2007; 15(32): 3377-3384
- URL: https://www.wjgnet.com/1009-3079/full/v15/i32/3377.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i32.3377
各种病因所致的肝脏损伤都可引起局部的炎症, 继而成纤维细胞增生并由此导致肝内细胞外基质(extracellular matrix, ECM)异常沉积形成肝纤维化, 肝纤维化可进一步发展为肝硬化. 目前对肝硬化尚缺乏有效的治疗手段, 因此对肝硬化的研究成了近20年世界医学攻关的一个热点. 阐明肝硬化的发生机制并寻求有效的治疗方法具有重要的临床意义. 本实验主要通过基因表达谱芯片技术检测肝硬化和正常肝脏组织中基因群表达的不同, 筛选出相关的基因群, 为进一步深入研究其在肝硬化的发生、发展中的作用提供新的线索.
2例肝硬化标本由南通大学附属医院手术活检组织提供, 1例正常肝组织由上海生物芯片有限公司-生物芯片上海国家工程研究中心提供. 分别于标本切取后立刻(10 min内)将所取组织放入液氮中冻存备用, 所有标本均由病理证实.
所用基因芯片为美国Affymetrix公司的 U133 A 2.0基因表达谱芯片, 由上海生物芯片有限公司-生物芯片上海国家工程研究中心提供. Affymetrix U133 A 2.0基因表达谱芯片涵盖了18 400个转录本(RNA), 代表了145 00个明晰的基因.
按TRIzol试剂使用说明书提取总肝RNA. 肝组织中加入TRIzol试剂后, 于冰浴中匀浆, 加入氯仿、异丙醇, 离心, 抽提总RNA. 用琼脂糖凝胶电泳检测总RNA的28S和18S比例,以评估总RNA的完整性; 紫外分光光度计测定260 nm和280 nm的吸收峰计算总RNA的纯度. 按QIAGEN Oligotex Direct mRNA kit提供的操作手册提取Poly(A)+mRNA. 按要求取1-8 μg总RNA反转录得到cDNA, 纯化双链DNA, 并将其片段化处理. 严格按QIAGEN RNeasy Total RNA Isolation kit试剂盒提供的操作手册纯化生物素标记的cRNA. 用分光光度计分析RNA浓度. 芯片使用前需平衡至室温, 杂交炉中45℃, 60 r/min预杂交芯片10 min. 加等体积处理好的杂交液, 然后在杂交炉中45℃, 60 r/min杂交芯片16 h. 把杂交好的芯片进行洗脱、染色, 最后扫描芯片. 用Affymetrix扫描仪扫描芯片后, GCOS1.2软件读取、处理数据. 差异基因筛选标准: change为Increase或Marginal Increase, log ratio(实验组和对照组比值取log2后的值)≥1, 实验组(肝硬化)Detection为Present的为上调基因; 为Decrease或Marginal Decrease, log ratio≤-1, 对照组(正常组)Detection为Present的为下调基因.
统计学处理 经Affymetrix扫描仪扫描芯片后, 用Affymetrix公司的GCOS1.2软件读取、处理数据.
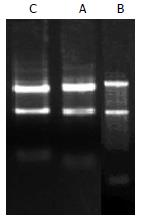
所抽提的总RNA, 经分光光度计检测A260, A280的吸光度, 确定样品的浓度和纯度. 算得A260/A280均>1.9, 表明所提取总RNA纯度较高, 而且没有蛋白质和DNA残留. RNA样品的具体信息见表1. 经10 g/L甲醛变性琼脂糖凝胶电泳后, 18S和28S电泳条带清晰, 28S条带无明显降解(图1), 说明总RNA质量完好, 结果合格, 可以进行芯片实验.
| 实验编号 | 样品编号 | RNA浓度(g/L) | cRNA A值 |
| A | 肝硬化1 | 1.311 | 1.93 |
| B | 肝硬化2 | 2.312 | 1.98 |
| C | 正常肝组织 | 1.806 | 1.94 |
2例基因芯片检测结果显示, 符合质控标准, 信号强度达到要求, 5'/3'比值正常. 正常肝组织cRNA、肝硬化组织cRNA分别与含18 400条转录本的芯片杂交.
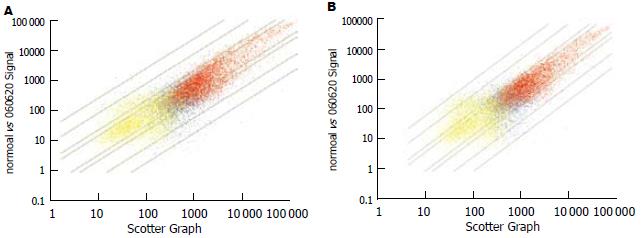
图2(A-B)以散点图的形式描述了肝硬化组织/正常肝组织对应的18 400条转录本的信号平均强度. 按差异显著性标准筛选出在肝硬化组织中共同差异表达基因有1424条, 占筛选项基因总数的9.82%. 其中上调表达的基因有980条, 下调表达的基因有444条.
2例肝硬化组织中共同差异表达的基因有980条基因上调和444条基因下调. 对共同差异表达为上调的基因初步功能共分16类. 在2例组织中发现共同上调的包括抗氧化活性相关基因、凋亡或肿瘤相关基因、结合蛋白相关基因、代谢相关基因、细胞周期相关基因、酶活性调节相关基因、分子马达相关基因、营养储备相关基因、分子功能退化相关基因、信号传导相关基因、结构分子相关基因、转录调控相关基因、翻译调控相关基因和物质运输相关基因. 在2例组织中未发现共同上调的包括分子伴娘调控相关基因、未知分子功能相关基因. 对其中部分分类基因列表如表1. 而对共同差异表达为下调的基因初步功能分类(共分16类), 在未发现共同下调的较共同上调的增加了抗氧化活性相关基因, 对其中部分分类基因列表如表2.
| 功能分类 | GenBank ID | 基因名称 | 基因代码 | 染色体定位 | Signal log Ratio | |
| 上调 | 抗氧化活性相关 | NM_006793 | peroxiredoxin 3 | PRDX3 | chr10q25-q26 | 1.1 |
| M12523 | 白蛋白 | ALB | chr4q11-q13 | 2.3 | ||
| 凋亡或肿瘤相关 | NM_004396 | DEAD(Asp-Glu-Ala-Asp)box多肽5 | DDX5 | chr17q21 | 2.1 | |
| NM_003292 | 活化MET致癌基因已易位的启动子区 | TPR | chr1q25 | 3.4 | ||
| NM_007315 | 信号传导子及转录激活子1 | STAT1 | chr2q32.2 | 2.3 | ||
| NM_000245 | met原癌基因 | MET | chr7q31 | 1.2 | ||
| NM_000596 | 胰岛素样生长因子结合蛋白1 | IGFBP1 | chr7p13-p12 | 6.4 | ||
| NM_003299 | 肿瘤排斥抗原(gp96)1 | TRA1 | chr12q24.2-q24.3 | 1.6 | ||
| BC002704 | 信号传导子及转录激活子1, 91 kDa | STAT1 | chr2q32.2 | 2.8 | ||
| NM_021960 | 髓样细胞非白血性白血病序列1 | MCL1 | chr1q21 | 1.7 | ||
| 结合蛋白相关 | NM_004539 | 天冬酰胺酰-tRNA合成酶 | NARS | chr18q21.2-q21.3 | 1.8 | |
| NM_003472 | DEK致癌基因 | DEK | chr6p23 | 2.1 | ||
| NM_005381 | 核仁素 | NCL | chr2q12-qter | 1 | ||
| NM_004859 | 笼形蛋白重肽(Hc) | CLTC | chr17q11-qter | 1 | ||
| NM_018834 | 基质蛋白3 | MATR3 | chr5q31.2 | 1.6 | ||
| NM_002156 | 热休克蛋白60 kDa 1 | HSPD1 | chr2q33.1 | 1.3 | ||
| NM_006585 | 伴侣素封闭物TCP1, 亚单位8 | CCT8 | chr21q22.11 | 2.3 | ||
| NM_003144 | 信号序列受体, α | SSR1 | chr6p24.3 | 1.7 | ||
| 代谢相关 | NM_004539 | 天冬酰胺酰-tRNA合成酶 | NARS | chr18q21.2-q21.3 | 1.8 | |
| NM_004939 | DEAD(Asp-Glu-Ala-Asp)盒多肽1 | DDX1 | chr2p24 | 1.4 | ||
| NM_005154 | 泛素特异蛋白酶8 | USP8 | chr15q21.2 | 2 | ||
| N54448 | 热应激反应蛋白12 | HRSP12 | chr8q22 | 1.4 | ||
| NM_004728 | DEAD(Asp-Glu-Ala-Asp)盒多肽21 | DDX21 | chr10q21 | 2.1 | ||
| NM_001239 | 细胞周期蛋白H | CCNH | chr5q13.3-q14 | 1.9 | ||
| NM_006910 | 视网膜母细胞瘤结合蛋白6 | RBBP6 | chr16p12.2 | 4.9 | ||
| NM_015675 | DNA-损伤诱导生长停滞β | GADD45B | chr19p13.3 | 2 | ||
| 酶活性调节相关 | NM_002734 | 蛋白激酶, cAMP-依赖调节子I型α | PRKAR1A | chr17q23-q24 | 2 | |
| NM_002923 | G蛋白信号系统调节子2 | RGS2 | chr1q31 | 2.4 | ||
| NM_000293 | 磷酸化酶激酶激酶β | PHKB | chr16q12-q13 | 1.7 | ||
| NM_012294 | Rap鸟嘌呤核苷酸交换因子5 | RAPGEF5 | chr7p15.3 | 2.3 | ||
| NM_001735 | 补体成分5 | C5 | chr9q33-q34 | 1.6 | ||
| NM_014495 | 血管生成素-类似物3 | ANGPTL3 | chr1p31.1-p22.3 | 2.3 | ||
| 分子马达相关 | BF432550 | 肌球蛋白IB | MY01B | chr2q12-q34 | 2 | |
| 营养储备相关 | NM_005637 | 染色体18滑膜肉瘤易位 | SS18 | chr18q11.2 | 2.5 | |
| 分子功能退化相关 | NM_012433 | 剪接因子3b, 亚单位1 | SF3B1 | chr2q33.1 | 2.6 | |
| NM_003092 | 核内小分子核糖核蛋白多肽B | SNRPB2 | chr20p12.2-p11.22 | 1.6 | ||
| NM_005872 | 乳房癌放大序列2 | BCAS2 | chr1p21-p13.3 | 1.6 | ||
| 信号传导相关 | NM_000245 | met原癌基因 | MET | chr7q31 | 1.2 | |
| NM_007315 | 信号传导子及转录激活子1 | STAT1 | chr2q32.2 | 2.3 | ||
| NM_002296 | 核纤层蛋白B受体 | LBR | chr1q42.1 | 1.5 | ||
| NM_001166 | 颗粒症病毒IAP(基因)重复封闭物2 | BIRC2 | chr11q22 | 1.7 | ||
| NM_004124 | 神经胶质成熟因子β | GMFB | chr14q22.2 | 1.2 | ||
| NM_001338 | 柯萨奇病毒和腺病毒受体 | CXADR | chr21q21.1 | 1.5 | ||
| AL096842 | 线粒体肿瘤抑制基因1 | MTUS1 | chr8p22 | 1.1 | ||
| 结构分子相关 | NM_004859 | 笼形蛋白重肽(Hc) | CLTC | chr17q11-qter | 1 | |
| NM_018834 | 基质蛋白3 | MATR3 | chr5q31.2 | 1.6 | ||
| NM_000971 | 核糖体蛋白L7 | RPL7 | chr8q21.11 | 1.3 | ||
| NM_002291 | 层粘连蛋白β1 | LAMB1 | chr7q22 | 2.5 | ||
| 转录调控相关 | NM_000971 | 核糖体蛋白L7 | RPL7 | chr8q21.11 | 1.3 | |
| NM_014739 | BCL2-关联转录因子1 | BCLAF1 | chr6q22-q23 | 2 | ||
| NM_001964 | 早期生长应答1 | EGR1 | chr5q31.1 | 3 | ||
| NM_005935 | 髓样/淋巴样或混合性白血病易位子2 | MLLT2 | chr4q21 | 1.6 | ||
| NM_001310 | cAMP应答元件结合蛋白-类似物2 | CREBL2 | chr12p13 | 1.8 | ||
| NM_016614 | TRAF和TNF受体相关蛋白 | TTRAP | chr6p22.3-p22.1 | 1.6 | ||
| 翻译调控相关 | NM_014670 | 基本亮氨酸拉链和W2域1 | BZW1 | chr2q33 | 1.7 | |
| NM_001412 | 性连锁真核·译起始因子1A | EIF1AX | chrXp22.12 | 1.3 | ||
| NM_015904 | 真核·译起始因子5B | EIF5B | chr2p11.1-q11.1 | 3.2 | ||
| NM_004730 | 真核·译终止因子1 | ETF1 | chr5q31.1 | 2.7 | ||
| NM_024863 | 转录延伸因子A(SII)-类似物4 | TCEAL4 | chrXq22.2 | 1.8 | ||
| NM_002453 | 线粒体·译起动因子2 | MTIF2 | chr2p14-p16 | 1.8 | ||
| 物质运输相关 | NM_001829 | 氯化物途径3 | CLCN3 | chr4q33 | 1.2 | |
| NM_004896 | 空泡的蛋白质分选26 | VPS26 | chr10q21.1 | 1.3 | ||
| NM_003715 | 小囊泡停靠蛋白质p115 | VDP | chr4q21.1 | 1.8 | ||
| NM_002223 | 肌醇1, 4, 5-三磷酸根受体2型 | ITPR2 | chr12p11 | 2 | ||
| 下调 | 凋亡或肿瘤相关 | NM_005022 | 抑制蛋白1 | PFN1 | chr17p13.3 | -1.9 |
| NM_002634 | 阻抑蛋白 | PHB | chr17q21 | -1.2 | ||
| NM_005745 | B-cell受体相关蛋白31 | BCAP31 | chrXq28 | -1.1 | ||
| NM_004343 | 钙网织蛋白 | CALR | chr19p13.3-p13.2 | -1.4 | ||
| NM_000358 | 转化生长因子β | TGFBI | chr5q31 | -1.6 | ||
| NM_002011 | 纤维母细胞生长因子受体4 | FGFR4 | chr5q35.1-qter | -1 | ||
| NM_005538 | 抑制素βC | INHBC | chr12q13.1 | -2.7 | ||
| NM_018468 | 早老素增强子2同系物 | PSENEN | chr19q13.12 | -1.5 | ||
| 结合蛋白相关 | X07868 | 胰岛素样生长因子Ⅱ | IGFⅡ | chr11p15.5 | -1.4 | |
| NM_003752 | 真核·译起始因子3, 亚单位8 | EIF3S8 | chr16p11.2 | -1.3 | ||
| NM_004343 | 钙网织蛋白 | CALR | chr19p13.3-p13.2 | -1.4 | ||
| NM_001916 | 细胞色素c-1 | CYC1 | chr8q24.3 | -1.3 | ||
| NM_003321 | 线粒体的Tu·译延伸因子 | TUFM | chr16p11.2 | -1.2 | ||
| NM_005538 | 抑制素βC | INHBC | chr12q13.1 | -2.7 | ||
| NM_014868 | 环指蛋白10 | RNF10 | chr12q24.31 | -1.1 | ||
| 代谢相关 | NM_002065 | 谷氨酸氨连接酶(谷氨酰胺合酶) | GLUL | chr1q31 | -3.5 | |
| NM_001428 | 烯醇酶1 | EN01 | chr1p36.3-p36.2 | -1.2 | ||
| NM_006623 | 磷酸甘油酸脱氢酶 | PHGDH | chr1p12 | -1.2 | ||
| NM_000075 | 周期素依赖性蛋白激酶4 | CDK4 | chr12q14 | -1.3 | ||
| NM_004390 | 组织蛋白酶H | CTSH | chr15q24-q25 | -1.7 | ||
| NM_005035 | 线粒体的DNA定向RNA多聚酶 | POLRMT | chr19p13.3 | -1.1 | ||
| NM_001069 | 微管蛋白, β2 | TUBB2 | chr6p25 | -1.3 | ||
| NM_000060 | 生物素化物酶 | BTD | chr3p25 | -1 | ||
| 细胞周期相关 | NM_002950 | (内质网)核糖体结合糖蛋白I | RPN1 | chr3q21.3-q25.2 | -1.6 | |
| NM_001916 | 细胞色素c-1 | CYC1 | chr8q24.3 | -1.3 | ||
| NM_000244 | 多发性内分泌腺瘤综合征I | MEN1 | chr11q13 | -1.2 | ||
| NM_001150 | 膜内氨酰氨基肽酶 | ANPEP | chr15q25-q26 | -1.2 | ||
| 酶活性调节相关 | NM_001320 | 酪蛋白激酶2β-多肽 | CSNK2B | chr6p21-p12|6p21.3 | -1 | |
| NM_004491 | 糖皮质激素受体DNA结合因子1 | GRLF1 | chr19q13.3 | -1.8 | ||
| NM_004127 | G蛋白途径抑制子1 | GPS1 | chr17q25.3 | -1.8 | ||
| 分子马达相关 | NM_004082 | 动力蛋白激活蛋白1 | DCTN1 | chr2p13 | ||
| NM_001614 | 肌动蛋白γ1 | ACTG1 | chr17q25 | -1 | ||
| 分子功能退化相关 | NM_004343 | 钙网织蛋白 | CALR | chr19p13.3-p13.2 | -1.4 | |
| 信号传导相关 | NM_002840 | 蛋白酪氨酸磷酸酶受体型F | PTPRF | chr1p34 | -1.1 | |
| NM_005745 | B-cell 受体相关蛋白31 | BCAP31 | chrXq28 | -1.1 | ||
| NM_014748 | 分选连接蛋白17 | SNX17 | chr2p23-p22 | -2.1 | ||
| NM_002205 | 纤维连接因子受体α多肽 | ITGA5 | chr12q11-q13 | -1.7 | ||
| NM_002162 | 细胞间黏附分子3 | ICAM3 | chr19p13.3-p13.2 | -1.1 | ||
| NM_004633 | 白介素1受体, II型 | IL1R2 | chr2q12-q22 | -1.8 | ||
| NM_000024 | 肾上腺素能的β-2-受体表面 | ADRB2 | chr5q31-q32 | -1 | ||
| 结构分子相关 | NM_001614 | 肌动蛋白γ1 | ACTG1 | chr17q25 | -1 | |
| NM_004927 | 线粒体核糖体蛋白L49 | MRPL49 | chr11q13 | -1.3 | ||
| NM_002949 | 线粒体核糖体蛋白蛋白L12 | MRPL12 | chr17q25 | -1 | ||
| 转录调控相关 | NM_001428 | 烯醇酶1 | EN01 | chr1p36.3-p36.2 | -1.2 | |
| NM_004491 | 糖皮质激素受体DNA结合因子1 | GRLF1 | chr19q13.3 | -1.8 | ||
| NM_003195 | 转录延伸因子A(SII), 2 | TCEA2 | chr20q13.33 | -2.6 | ||
| NM_005693 | 细胞核受体亚科1, 团H, 成员3 | NR1H3 | chr11p11.2 | -1.3 | ||
| NM_000457 | 肝细胞核因子4, α | HNF4A | chr20q12-q13.1 | -2.1 | ||
| 翻译调控相关 | NM_003752 | 真核翻译起始因子3, 亚单位8 | EIF3S8 | chr16p11.2 | -1.3 | |
| NM_003321 | 线粒体的Tu·译延伸因子 | TUFM | chr16p11.2 | -1.2 | ||
| NM_004927 | 线粒体核糖体蛋白L49 | MRPL49 | chr11q13 | -1.3 | ||
| 物质运输相关 | NM_006148 | LIM and SH3蛋白1 | LASP1 | chr17q11-q21.3 | -1 | |
| NM_001916 | 细胞色素c-1 | CYC1 | chr8q24.3 | -1.3 | ||
| NM_002631 | 磷酸葡萄糖酸脱氢酶 | PGD | chr1p36.3-p36.13 | -1.9 | ||
| NM_006623 | 磷酸甘油酸脱氢酶 | PHGDH | chr1p12 | -1.2 | ||
| NM_006066 | 乙醛还原酶 | AKR1A1 | chr1p33-p32 | -1.1 | ||
| NM_003365 | 泛醇-细胞色素C还原酶核心蛋白I | UQCRC1 | chr3p21.3 | -1.4 |
很多基因具有多功能, 参与细胞周期, 信号传导, 结合蛋白, 转录, 翻译, 凋亡. 这些基因均至少参与两种不同的细胞活动过程. 对其中部分分类基因列表如表3.
| 功能分类 | GenBank ID | 基因名称 | 基因代码 | 染色体定位 | Signal Log Ratio |
| 上调 | NM_004396 | DEAD(Asp-Glu-Ala-Asp) box多肽5 | DDX5 | chr17q21 | 2.1 |
| NM_007315 | 信号传导子及转录激活子1 | STAT1 | chr2q32.2 | 2.3 | |
| NM_003299 | 肿瘤排斥抗原(gp96)1 | TRA1 | chr12q24.2-q24.3 | 1.6 | |
| NM_021960 | 髓样细胞非白血性白血病序列1 | MCL1 | chr1q21 | 1.7 | |
| NM_000596 | 胰岛素样生长因子结合蛋白1 | IGFBP1 | chr7p13-p12 | 6.4 | |
| NM_007315 | 信号传导子及转录激活子1, 91 kDa | STAT1 | chr2q32.2 | 2.3 | |
| NM_003292 | 活化MET致癌基因已易位的启动子区 | TPR | chr1q25 | 3.4 | |
| chr9q12-q21.2| | |||||
| NM_000700 | 膜联蛋白A1 | ANXA1 | 9q12-q21.2 | 3.2 | |
| NM_003810 | 肿瘤坏死因子超家族, 成员10 | TNFSF10 | chr3q26 | 1.2 | |
| NM_006910 | 视网膜母细胞瘤结合蛋白6 | RBBP6 | chr16p12.2 | 4.9 | |
| BC004490 | v-fos FBJ鼠骨肉瘤病毒致瘤基因同系物 | FOS | chr14q24.3 | 6.6 | |
| NM_004859 | 笼形蛋白重肽(Hc) | CLTC | chr17q11-qter | 1 | |
| NM_002156 | 热休克蛋白60 kDa 1(伴侣素) | HSPD1 | chr2q33.1 | 1.3 | |
| NM_003472 | DEK致癌基因(DNA结合) | DEK | chr6p23 | 2.1 | |
| 下调 | NM_002634 | 阻抑蛋白 | PHB | chr17q21 | -1.2 |
| X07868 | 胰岛素样生长因子Ⅱ | IGFⅡ | chr11p15.5 | -1.4 | |
| NM_004343 | 钙网织蛋白 | CALR | chr19p13.3-p13.2 | -1.4 | |
| NM_001916 | 细胞色素c-1 | CYC1 | chr8q24.3 | -1.3 | |
| NM_002997 | 多配体1 | SDC1 | chr2p24.1 | -1.4 | |
| NM_001654 | v-raf鼠肉瘤3611病毒致瘤基因同系物 | ARAF | chrXp11.4-p11.2 | -1.6 | |
| NM_000075 | 周期素依赖性蛋白激酶4 | CDK4 | chr12q14 | -1.3 | |
| NM_030662 | 促分裂原活化蛋白激酶激酶2 | MAP2K2 | chr19p13.3 | -1.2 | |
| NM_001328 | C末端结合蛋白1 | CTBP1 | chr4p16 | -1.2 | |
| NM_004364 | CCAAT/增强子结合蛋白α | CEBPA | chr19q13.1 | -1.5 | |
| NM_003156 | 间质相互作用分子1 | STIM1 | chr11p15.5 | -1 | |
| NM_001654 | v-raf鼠肉瘤3611病毒致瘤基因同系物 | ARAF | chrXp11.4-p11.2 | -1.6 | |
| NM_001150 | 膜内氨酰氨基肽酶 | ANPEP | chr15q25-q26 | -1.2 |
众所周知, 肝硬化的发生、发展是一个复杂的多因素、多步骤的过程, 是许多肿瘤相关基因表达失常或多种基因失活所致. 因此肝硬化组织中相关基因及基因组的变化研究显得更为重要. 本实验中我们采用了美国Affymetrix公司的U133 A 2.0基因表达谱芯片, 检测到肝硬化组织与正常肝脏组织间有1424条(9.82%)存在差异表达的基因, 其中上调表达的基因有980条, 下调表达的基因有444条.
这些差异基因初步分为16类, 包括抗氧化活性相关、凋亡或肿瘤相关、结合蛋白相关、代谢相关、细胞周期相关、酶活性调节相关基因等. 我们的结果表明, 肝硬化的发生发展是一个多基因参与的复杂变化过程, 涉及到许多相关基因群的变化.
首先, 肝纤维化是指慢性肝病晚期的组织学变化, 是一种在损害因子持续作用下渐进的病理过程. 以ECM增加为特征, 同时伴有肝实质的广泛破坏、再生, 导致肝小叶和肝血管结构的紊乱, 是继发于包括慢性乙型(丙型)病毒肝炎等几乎所有的慢性肝病, 最终发展形成肝硬化. HSC(肝星状细胞)是肝纤维化ECM的主要来源细胞. 生长因子在调控HSC形态演变及功能变化中起的作用更是日益受到重视[1]. HSC的激活是肝纤维化发生发展的中心环节, 可分为"启动阶段"和"持久化阶段". 在"启动阶段", 肝细胞受损后释放丝裂原, 旁分泌作用于HSC, 引起HSC的增殖, 并使肝细胞生长丧失接触抑制. 随后活化的枯否(Kupffer)细胞、内皮细胞及血小板释放细胞因子, 如转化生长因子(TGF)、血小板衍生生长因子(PDGF)、肝细胞生长因子(HGF)等, 促进HSC激活转化为肌成纤维细胞(MFB), 继而进入激活的"持久化阶段", HSC维持激活状态并产生纤维化. 其中肝细胞生长因子随肝纤维化进程逐渐升高, 在早期有促进肝细胞再生, 具有抗纤维化作用. HGF最初是从血浆中获得, 是一种来源于肝脏间质细胞, 亦可由肝外组织产生, 是强烈的肝细胞增殖刺激因子. Stoker et al[2]发现成纤维细胞分泌一种能促进上皮细胞集落扩散的细胞因子, 称为离散因子(SF). 通过对这两种细胞因子的结构和功能的研究, 发现HGF和SF为同一物质[3]. HGF/SF通过与细胞膜上特异受体即原癌基因c-Met[4]编码的一种跨膜酪氨酸蛋白激酶结合, 引起酪氨酸蛋白激酶活化, 激活细胞内多个信号级联反应, 如磷脂酰肌醇3激酶、磷脂酶c、Ras-GTP激酶活性蛋白, 是一种多效性生长因子, 并非肝特异性生长因子, 能刺激多种类型细胞分化、增殖、再生、运动、迁移扩散及形态的发生[5-8]. cMet是原癌基因, 其编码的蛋白, 是一类具有自主性磷酸化活性的跨膜受体. HGF与cMet结合后激活受体发生自身磷酸化, 进而导致多种底物蛋白磷酸化, 从而引起细胞内一系列信号传导, 最终发挥HGF/SF的生物学功能, 除引起正常细胞的生物学行为外, 还可以刺激肿瘤细胞的离散、增殖、血管形成、转移、侵袭等[9-10]. 在既往的关于cMet的研究中, 大多数集中于结肠直肠癌、甲状腺癌、鼻咽癌、肺癌、乳腺癌、肝癌等恶性肿瘤[11-15]. 魏文芸 et al[16]报道显示, 在慢性肝病、肝硬化、肝癌的患者中, HGF的水平有所增高, 以肝硬化的血清HGF的增高最为显著, 显著高于慢性肝病组和肝癌组(P<0.001), 并与肝硬化病理变化相符合. 肝硬化主要病理变化是肝细胞坏死, 肝间质细胞增生, 而HGF在肝脏主要是由肝间质细胞所分泌. Kim et al[17]发现静止HSC未检测到c-Met表达, 培养3 d后表达增加. Cramer et al[18]也在体内外实验研究中发现, 活化HSC能表达c-Met. 在肝纤维化过程中, 间质细胞低表达转为高表达, HGF不仅作用于正常上皮细胞, 而且作用于病理情况下由间质细胞转化而成的肌成纤维细胞, 促进纤维化. 而现有不少实验报道[19-20], HGF在受损早期即明显升高并有抗纤维化作用. 在本实验中HGF、c-Met、TPR(已易位的活化MET癌基因启动子)全部上调, 与部分报道一致, 部分不一致. 推断HGF、c-Met、TPR在肝纤维化不同时段发挥一定作用, 且作用可能不同. 因此, HGF/SF可能成为肝硬化早期诊断指标及潜在治疗靶点, 而其在肝硬化向肝癌转变过程中的作用有待进一步研究.
在我们筛选出的共同差异表达基因中, 还有一些基因在肝硬化组织中参与细胞内信号传递和基因表达调控等多种细胞过程, 如STAT1、DDX5等. STAT(signal transducer and activator of transcription)是一类新型细胞内信号传递和基因表达调控因子家族, 由9个成员构成. 自从在干扰素对培养细胞基因转录诱导研究中发现该家族以来, 他一直是细胞因子研究领域的热点. 他与炎症、肿瘤、免疫性疾病的关系日益受到人们的重视[21]. 其家族成员参与许多细胞因子、生长因子的信号转导, 调节人体免疫反应、炎症反应和细胞的生长、分化等. 近年来研究发现, STAT具有强烈的抑制细胞凋亡、促进细胞增殖的作用, 参与人类恶性肿瘤的发生、发展和演变. 细胞因子通过JAK/STAT途径, 激活STAT而诱导目的基因表达[22]. 在正常生理状态下, STAT的激活仅持续数分钟至几小时, 对于正常细胞的生理功能, 如胚胎发育、器官形成、免疫功能的完善、细胞的生长、分化等, 起着关键性作用[23]. STAT1(signal transducer and activator of transcription 1)位于染色体chr2q32.2, 多种细胞因子可以诱导STAT1的激活, 主要包括干扰素(IFN)、表皮生长因子(EGF)、血小板衍生生长因子(PDGF)、白介素-6(IL-6)等[24]. 亦有研究认为, STAT1通过调节iNOS及NO的表达发挥其在炎症反应中的作用[25]. 有研究发现[26], 在博莱霉素(BLM)致大鼠肺纤维化模型中, 其肺泡巨噬细胞(AM)内存在STAT1的异常活化. 提示BLM组的AM内存在STAT1的异常活化; 异常活化的STAT1可引起包括ICAM-1及STAT1本身在内的多种STAT1依赖性免疫反应基因的表达增加, 增加表达的ICAM-1可诱导炎性细胞在肺内募集, 分泌细胞因子, 引起肺部炎症反应, 参与肺泡炎及随后的肺纤维化的形成. 本实验中STAT1上调, 可能是因为肝脏慢性炎症激活JAK/STAT信号通路或STAT信号通路引起级联反应, 促进肝纤维化形成.
目前, 基因芯片技术我们正在被广泛地应用于对肝硬化复杂的发生、发展过程的研究及通过基因表达谱的分析来认识肝硬化的发病机制, 为肝硬化的诊断和治疗提供了科学依据. 本研究结果表明, 共有16类基因群1424条基因在肝硬化组织中异常表达, 表明肝硬化中很可能存在互相协调共同表达的基因群. 因此利用基因表达谱芯片技术对肝硬化进行基因群水平研究, 筛选在肝硬化相关的多个环节上起重要作用的分子和起关键调节作用的基因, 以揭示肝硬化在基因水平上的本质, 为肝硬化的早期诊断和早期治疗提供理论依据.
各种病因尤其乙肝所致的肝脏损伤都可引起局部的炎症, 继而成纤维细胞增生并由此导致肝内细胞外基质异常沉积形成肝纤维化, 肝纤维化进一步发展为肝硬化. 肝硬化早期无症状, 不易诊断, 且肝硬化与肝细胞癌(HCC)的发生发展密切相关, 被视为肝癌的癌前病, 严重危害人们健康; 目前对肝硬化尚缺乏有效的诊断治疗手段, 因此, 阐明肝硬化发生的分子机制并寻求有效的治疗方法具有重要的临床意义, 对肝硬化的研究就成为近20年世界医学攻关的一个热点.
基因芯片技术, 可同时检测成百上千个基因的表达, 已被成功地应用于基因功能研究的各个领域. 进行大规模基因表达已成为研究病理生理过程的卓有成效的方法. 有关基因芯片技术研究肝硬化发病机制的研究报道却比较少.
本文利用美国Affymetrix公司U133 A 2.0基因表达谱芯片基因芯片技术检测肝硬化差异基因的表达并进行了功能分类. 基因初步功能共分16类.
基因表达谱: 常被称为是某一生理或病理现象的分子图像, 研究对象是细胞中的mRNA的稳定水平, 可以从RNA水平探讨基因与疾病的关系, 直接筛选表达差异的基因.
本文设计合理, 实验结果丰富可信, 有一定的参考价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Friedman SL. Seminars in medicine of the Beth Israel Hospital, Boston. The cellular basis of hepatic fibrosis. Mechanisms and treatment strategies. N Engl J Med. 1993;328:1828-1835. [PubMed] |
| 2. | Stoker M, Gherardi E, Perryman M, Gray J. Scatter factor is a fibroblast-derived modulator of epithelial cell mobility. Nature. 1987;327:239-242. [PubMed] |
| 4. | Bottaro DP, Rubin JS, Faletto DL, Chan AM, Kmiecik TE, Vande Woude GF, Aaronson SA. Iden-tification of the hepatocyte growth factor receptor as the c-met proto-oncogene product. Science. 1991;251:802-804. [PubMed] |
| 5. | Gohda E. Function and regulation of production of hepatocyte growth factor (HGF). Nippon Yakurigaku Zasshi. 2002;119:287-294, 309. [PubMed] |
| 6. | Birchmeier C, Birchmeier W, Gherardi E, Vande Woude GF. Met, metastasis, motility and more. Nat Rev Mol Cell Biol. 2003;4:915-925. [PubMed] |
| 7. | Schmidt C, Bladt F, Goedecke S, Brinkmann V, Zschiesche W, Sharpe M, Gherardi E, Birchmeier C. Scatter factor/hepatocyte growth factor is essential for liver development. Nature. 1995;373:699-702. [PubMed] |
| 8. | Bahary N, Zon LI. Development. Endothelium--chicken soup for the endoderm. Science. 2001;294:530-531. [PubMed] |
| 9. | Miyazawa K, Shimomura T, Kitamura N. Activation of hepatocyte growth factor in the injured tissues is mediated by hepatocyte growth factor activator. J Biol Chem. 1996;271:3615-3618. [PubMed] |
| 10. | Parr C, Jiang WG. Expression of hepatocyte growth factor/scatter factor, its activator, inhibitors and the c-Met receptor in human cancer cells. Int J Oncol. 2001;19:857-863. [PubMed] |
| 11. | Herynk MH, Stoeltzing O, Reinmuth N, Parikh NU, Abounader R, Laterra J, Radinsky R, Ellis LM, Gallick GE. Down-regulation of c-Met inhibits growth in the liver of human colorectal carcinoma cells. Cancer Res. 2003;63:2990-2996. [PubMed] |
| 12. | Mineo R, Costantino A, Frasca F, Sciacca L, Russo S, Vigneri R, Belfiore A. Activation of the hepatocyte growth factor (HGF)-Met system in papillary thyroid cancer: biological effects of HGF in thyroid cancer cells depend on Met expression levels. Endocrinology. 2004;145:4355-4365. [PubMed] |
| 13. | Qian CN, Guo X, Cao B, Kort EJ, Lee CC, Chen J, Wang LM, Mai WY, Min HQ, Hong MH. Met protein expression level correlates with survival in patients with late-stage nasopharyngeal carcinoma. Cancer Res. 2002;62:589-596. [PubMed] |
| 14. | Ma PC, Jagadeeswaran R, Jagadeesh S, Tretiakova MS, Nallasura V, Fox EA, Hansen M, Schaefer E, Naoki K, Lader A. Functional expression and mutations of c-Met and its therapeutic inhibition with SU11274 and small interfering RNA in non-small cell lung cancer. Cancer Res. 2005;65:1479-1488. [PubMed] |
| 15. | Jiang WG, Grimshaw D, Lane J, Martin TA, Abounader R, Laterra J, Mansel RE. A hammerhead ribozyme suppresses expression of hepatocyte growth factor/scatter factor receptor c-MET and reduces migration and invasiveness of breast cancer cells. Clin Cancer Res. 2001;7:2555-2562. [PubMed] |
| 17. | Kim WH, Matsumoto K, Bessho K, Nakamura T. Growth inhibition and apoptosis in liver myofibroblasts promoted by hepatocyte growth factor leads to resolution from liver cirrhosis. Am J Pathol. 2005;166:1017-1028. [PubMed] |
| 18. | Cramer T, Schuppan D, Bauer M, Pfander D, Neuhaus P, Herbst H. Hepatocyte growth factor and c-Met expression in rat and human liver fibrosis. Liver Int. 2004;24:335-344. [PubMed] |
| 19. | 刘 芳, 徐 启勇, 叶 燕青. 肝细胞生长因子在肺纤维化模型中的表达及意义. 武汉大学学报(医学版). 2005;26:408-411. |
| 20. | Takemura M, Furuta N, Nakamura S, Okuno M, Seishima M, Noma A, Sugihara J, Murakami N, Sugiyama H, Moriwaki H. Determination and clinical significance of human hepatocyte growth factor in serum. Rinsho Byori. 1992;40:1168-1172. [PubMed] |
| 22. | Schindler CW. Series introduction. JAK-STAT signaling in human disease. J Clin Invest. 2002;109:1133-1137. [PubMed] |
| 23. | Levy DE, Lee CK. What does Stat3 do? J Clin Invest. 2002;109:1143-1148. [PubMed] |
| 24. | Wormald S, Zhang JG, Krebs DL, Mielke LA, Silver J, Alexander WS, Speed TP, Nicola NA, Hilton DJ. The comparative roles of suppressor of cytokine signaling-1 and -3 in the inhibition and desensitization of cytokine signaling. J Biol Chem. 2006;281:11135-11143. [PubMed] |
| 25. | Salonen T, Sareila O, Jalonen U, Kankaanranta H, Tuominen R, Moilanen E. Inhibition of classical PKC isoenzymes downregulates STAT1 activation and iNOS expression in LPS-treated murine J774 macrophages. Br J Pharmacol. 2006;147:790-799. [PubMed] |
| 26. | Fan XM, Wang ZL, Li ZH. STAT1 activation and STAT1-dependent immune-response gene ICAM-1 expression in alveolar macrophages of rats suffered from interstitial pulmonary fibrosis. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 2003;19:3-6. [PubMed] |