修回日期: 2007-10-18
接受日期: 2007-10-28
在线出版日期: 2007-11-18
目的: 观察沙利度胺对大鼠实验性肝纤维化的治疗效果并探讨其作用机制.
方法: 四氯化碳腹腔注射制备大鼠肝纤维化模型后, 应用沙利度胺(100 mg/kg) ig分别治疗2、4、6 wk作为动态观察时相点. HE染色观察肝组织病理变化, 放射免疫法检测血清透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PCⅢ)和Ⅳ型胶原(CⅣ)的表达, 免疫组织化学法检测细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)和E-选择素(E-selectin)蛋白质的表达, 逆转录聚合酶链反应法检测ICAM-1、VCAM-1和E-selectin mRNA的表达.
结果: 与肝纤维化组相比, 沙利度胺治疗4 wk、6 wk能显著降低大鼠肝组织纤维化积分, 显著降低血清HA(176.6±7.5 μg/L, 173.8±6.7 μg/L vs 486.9±12.4 μg/L)、LN(38.4±5.8 μg/L, 34.7±7.3 μg/L vs 84.5±5.2 μg/L)、PCⅢ(44.3±5.5 μg/L, 40.2±6.1 μg/L vs 65.0±5.6 μg/L)、CⅣ(31.8±6.7 μg/L, 30.4±5.7 μg/L vs 55.6±6.5 μg/L)的含量(P<0.05), 沙利度胺治疗2 wk, 4 wk, 6 wk组均可显著降低ICAM-1、VCAM-1和E-selectin蛋白和mRNA的表达(P<0.05).
结论: 沙利度胺可通过下调ICAM-1、 VCAM-1和E-selectin表达水平而发挥抗肝纤维化作用.
引文著录: 肖艳菊, 罗和生, 吕鹏. 黏附分子在沙利度胺所致大鼠肝纤维化中的作用机制. 世界华人消化杂志 2007; 15(32): 3372-3376
Revised: October 18, 2007
Accepted: October 28, 2007
Published online: November 18, 2007
AIM: To investigate the therapeutic effects and mechanism of thalidomide on hepatic fibrosis in rats.
METHODS: Liver fibrosis in rats was induced by intraperitoneal injection of carbon tetrachloride for 4 weeks. The rats were killed at 2, 4 and 6 wk after treatment with 100 mg/kg intragastric thalidomide. Liver fibrosis score was assessed under the light microscope by H&E staining. Serum hyaluronic acid (HA), laminin (LN), procollagen type Ⅲ (PCⅢ) and collagen type Ⅳ were detected by radioimmunoassay. Expression of ICAM-1, VCAM-1 and E selectin were examined by immunohistochemistry. mRNA levels for ICAM-1, VCAM-1, and E selectin was detected by reverse-transcriptase polymerase chain reaction.
RESULTS: Compared with the liver fibrosis group, fibrosis score in thalidomide-treated rats (4 or 6 wk) was obviously improved (P < 0.05). Serum HA (176.6 ± 7.5 μg/L, 173.8 ± 6.7 μg/L vs 486.9 ± 12.4 μg/L), LN (38.4 ± 5.8 μg/L, 34.7 ± 7.3 μg/L vs 84.5 ± 5.2 μg/L), PCⅢ (44.3 ± 5.5 μg/L, 40.2 ± 6.1 μg/L vs 65.0 ± 5.6 μg/L) and collagen Ⅳ (31.8 ± 6.7 μg/L, 30.4 ± 5.7 μg/L vs 55.6 ± 6.5 μg/L) in rats treated with thalidomide for 4 or 6 wk were significantly lower than those in rats with liver fibrosis (P < 0.05). Expression of ICAM-1, VCAM-1 and E selectin protein and mRNA was significantly reduced in thalidomide-treated rats, compared with that in rats with liver fibrosis (P < 0.05).
CONCLUSION: Thalidomide can reverse liver fibrosis in rats via down-regulation of the expression of ICAM-1, VCAM-1 and E selectin.
- Citation: Xiao YJ, Luo HS, Lv P. Effects of thalidomide on adhesion molecules in rat liver fibrosis. Shijie Huaren Xiaohua Zazhi 2007; 15(32): 3372-3376
- URL: https://www.wjgnet.com/1009-3079/full/v15/i32/3372.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i32.3372
肝损伤时内皮细胞表型发生改变, 从而表达细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)、E-选择素(E-selectin)等, 能黏附中性粒细胞、淋巴细胞和单核细胞或Kupffer细胞, 加重炎症和免疫损伤[1-3]. 沙利度胺可以下调黏附分子和选择素, 可利用这一机制用来治疗肝纤维化.
1.1.1 实验动物: ♂Wistar大鼠, SPF级, 体质量85-95 g, 由湖北省实验动物研究中心提供, 许可证号: SCXK(鄂)2003-0005. 自由饮水, 饲以条杆状动物饲料.
1.1.2 主要试剂: 沙利度胺(常州制药厂有限公司产品)与生理盐水配成1%溶液. 四氯化碳(郑州试剂二厂产品), 国产分析纯, 与食用花生油按1:6比例配成溶液. 透明质酸(hyaluronic acid, HA), 层粘连蛋白(laminin, LN), Ⅲ型前胶原(procollagen Type Ⅲ, PCⅢ), Ⅳ型胶原(Collagen Type Ⅳ, CⅣ)放免试剂盒为上海海军医学研究所产品; 小鼠抗大鼠ICAM-1抗体为美国Santa Cruz公司产品; 兔抗大鼠VCAM-1抗体、E-selectin抗体为武汉博士德生物工程公司产品; SP试剂盒为福建迈新公司产品; TRIzol RNA抽提试剂为美国Invitrogen公司产品; M-MLV逆转录酶为美国Promega公司产品; Taq DNA聚合酶为日本TaKaRa公司产品.
1.2.1 动物分组及处理: 将65只大鼠随机分为两组, 正常对照组(N组)10只和模型组55只. 模型组均用四氯化碳花生油溶液按2 mL/kg ip, 每周3次, N组ip等量的纯花生油. 4 wk后, 模型组中大鼠死亡5只, 存活50只, 随机处死其中8只作为A组, 见肝纤维化模型形成, 取血清及新鲜肝组织速冻保存. 模型组中其他42只随机分成治疗组32只和自动逆转组(B组)10只. 正常对照组和自动逆转组改用等量的生理盐水ig, 6 wk后处死. 治疗组大鼠改用沙利度胺溶液100 mg/kg体质量ig, 在2 wk、4 wk和6 wk末随机处死12、10和10只, 作为C、D和E组, 取血清及新鲜肝组织速冻保存.
1.2.2 肝脏病理学检查: 每只大鼠均取肝右叶的肝组织进行HE染色观察肝纤维化程度(S). S分期参考2000年西安会议修订的病毒性肝炎防治方案. S0期的积分为0, S1期的积分为1, 依次类推.
1.2.3 放射免疫法检测血清HA、LN、PCⅢ和C: Ⅳ的表达: 操作严格按试剂盒使用说明进行.
1.2.4 免疫组织化学法检测ICAM-1、VCAM-1和E-selectin的表达: 使用S-P法, DAB显色, 具体步骤参照试剂盒说明书进行. ICAM-1、VCAM-1和E-selectin的阳性表达位于胞质或胞膜. 每例随机观察5个高倍视野(400倍), 每个视野计数1000个细胞, 记录阳性细胞的百分比.
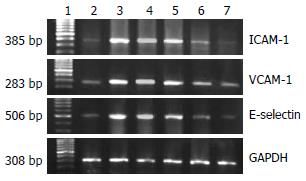
1.2.5 逆转录-聚合酶链反应(RT-PCR)方法测定肝组织ICAM-1、VCAM-1、E-selectin: mRNA的表达: 取肝组织100 mg, 加入TRIzol 1 mL, 一步法提取总RNA, 标本均经紫外分光光度计测定其纯度及含量. 取总RNA 1 μg, 逆转录成cDNA. 取1 μL cDNA用于PCR的扩增. 引物由上海赛百盛生物工程公司合成. 序列为: ICAM-1(385 bp): 上游, 5'-CTGCAGAGCACAAACAGCAGAG-3';下游, 5'-AAGGCCGCAGAGCAAAAGAAGC-3'; VCAM-1(283 bp); 上游, 5'-TAAGTTACACAGCAGTCAAATGGA-3'; 下游, 5'-CACATACATAAATGCCGGAATCTT-3'; E-selectin(506 bp): 上游, 5'-CAACGTGCACGTTTGACTGT-3'; 下游, 5'-AGGTCAAGGCTTGAACACTG-3'; GAPDH(309 bp): 上游, 5'-TCCCTCAAGATTGTCAGCAA-3'; 下游, 5'-AGATCCACAACGGATACATT-3'. PCR反应体系为25 μL, 反应条件为: ICAM-1(94℃ 60 s, 55℃ 60 s, 72℃ 60 s, 32个循环), VCAM-1(95℃ 60 s, 55℃ 60 s, 72℃ 60 s, 32个循环), E-selectin(94℃ 30 s, 53℃ 45 s, 72℃ 60 s, 35个循环), GAPDH(94℃ 30 s, 53℃ 30 s, 72℃ 45 s, 35个循环). 看家基因GAPDH作为内参照. PCR产物进行15 g/L琼脂糖凝胶电泳, 溴化乙淀染色, 法国Vilber Lourmat凝胶成像分析系统照相及测定条带的面积和灰度值. 以目的条带的面积×灰度值/GAPDH条带的面积×灰度值的比值代表mRNA的表达水平.
统计学处理 全部数据采用SPSS11.5软件进行统计分析. 实验数据均以mean±SD表示, 采用单因素方差分析(one-way ANOVA), P<0.05为差异有统计学意义.
光镜下正常对照组肝脏形态学基本正常. 模型组可见灶状坏死, 伴炎性细胞浸润, 小叶结构紊乱, 肝内有纤维性间隔形成, 形成稳定的完全性中心-中心和(或)中心-门静脉性纤维间隔并存的肝纤维化. 治疗组(4 wk组、6 wk组)大鼠肝纤维化程度较模型组明显减轻, 表现为肝组织坏死不明显, 汇管区少量纤维组织增生, 向小叶内延伸. 肝纤维化组较正常组肝纤维化积分显著升高(P<0.05). 自动逆转组较模型组肝纤维化积分有所降低, 但差别无统计学意义(P>0.05). 沙利度胺治疗4 wk组、6 wk组肝纤维化积分较肝纤维化组显著降低(P<0.05, 表1).
肝纤维化组血清HA、LN、PCⅢ和CⅣ水平均显著高于正常组(P<0.05). 自动逆转组血清HA、LN、PCⅢ和CⅣ水平较肝纤维化组有所降低, 但无显著性差异(P>0.05). 使用沙利度胺治疗后, 治疗4 wk, 6 wk组大鼠的血清HA、LN、PCⅢ和CⅣ浓度较肝纤维化组和治疗2 wk组均显著降低(P<0.05, 表2).
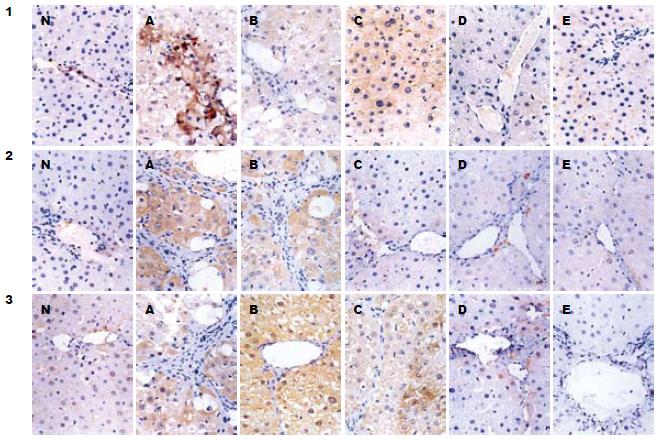
正常组大鼠肝组织仅血管内皮细胞有少量ICAM-1表达, 肝窦周细胞表达较弱, 肝细胞及胆管上皮细胞无表达. 肝纤维化组大鼠肝组织ICAM-1表达较正常组明显增加, 除肝窦周细胞、血管内皮细胞ICAM-1表达增强, 肝细胞也出现ICAM-1的表达, ICAM-1阳性细胞多分布在汇管区周围、肝小叶内炎性细胞浸润区和坏死灶内. VCAM-1、E-选择素同样在正常组大鼠几乎无表达, 在肝纤维化时的表达和分布与ICAM-1类似(图1).
肝纤维化组大鼠肝组织ICAM-1、VCAM-1、E-selectin阳性细胞百分数显著高于正常组(P<0.05). 自动逆转组大鼠肝组织ICAM-1、VCAM-1、E-selectin阳性细胞百分数较肝纤维化组大鼠有所降低, 但无显著性差异(P>0.05). 各治疗组ICAM-1、VCAM-1、E-selectin阳性细胞百分数较肝纤维化组显著减少(P<0.05), 且治疗4 wk、6 wk组ICAM-1、VCAM-1和E-selectin的表达下降较治疗2 wk组更为显著(P<0.05, 表3).
| 分组 | n | ICAM-1 | VCAM-1 | E-selectin |
| 蛋白 | ||||
| N | 10 | 3.0±0.7 | 2.4±0.8 | 2.3±0.8 |
| A | 8 | 60.8±6.4a | 83.8±9.5a | 76.1±0.4a |
| B | 10 | 57.6±7.1a | 80.3±9.4a | 74.7±7.5a |
| C | 12 | 49.6±6.8ace | 20.8±6.5ace | 64.2±8.6ace |
| D | 10 | 8.1±0.8aceg | 9.0±1.0aceg | 11.8±1.4aceg |
| E | 10 | 7.9±0.7aceg | 8.9±1.1aceg | 7.0±1.0aceg |
| mRNA | ||||
| N | 10 | 0.35±0.07 | 0.58±0.08 | 0.26±0.06 |
| A | 8 | 1.51±1.11a | 1.24±0.10a | 1.37±0.12a |
| B | 10 | 1.47±0.11a | 1.21±0.10a | 1.28±0.11a |
| C | 12 | 1.33±0.10ace | 1.16±0.24ace | 1.16±0.11ace |
| D | 10 | 0.69±0.09aceg | 0.75±0.10aceg | 0.42±0.11aceg |
| E | 10 | 0.60±0.10aceg | 0.67±0.11aceg | 0.36±0.11aceg |
肝纤维化组大鼠ICAM-1、VCAM-1和E-selectin mRNA水平较正常组明显升高(P<0.05). 自动逆转组大鼠肝组织ICAM-1、VCAM-1和E-selectin mRNA较肝纤维化组大鼠有所降低, 但无显著性差异(P>0.05). 各治疗组的ICAM-1、VCAM-1和E-selectin mRNA水平较肝纤维化组显著下降(P<0.05), 且治疗4 wk、6 wk组ICAM-1、VCAM-1和E-selectin mRNA水平较治疗2 wk组下降更为显著(P<0.05, 图2, 表3).
沙利度胺曾被广泛用于治疗失眠症和妊娠反应. 近年研究发现, 沙利度胺致畸作用的证据并不充分, 而且由于他重要的抗炎、免疫调节及抗血管生成作用, 近年来又重新受到重视, 对其作用机制的认识和临床适应症的研究进一步深入[4-5]. Yeh et al[6]证实沙利度胺能够治疗致死性的肝脏坏死性炎症, 促进肝硬化的恢复. Muriel et al[7]在大鼠CCl4肝硬化模型中同时给予沙利度胺, 发现羟脯胺酸含量显著降低、肝脏组织学改变减轻、胶原带变细, 提示沙利度胺可以防止CCl4引起的炎症和纤维化.
我们的研究发现, 与肝纤维化组相比, 自动逆转组大鼠肝组织病理学和血清肝纤维化指标HA、LN、PCⅢ、CⅣ的浓度均无明显变化, 但是沙利度胺治疗4 wk组、6 wk组可显著改善大鼠肝组织病理学变化, 显著降低血清肝纤维化指标HA、LN、PCⅢ、CⅣ的含量, 表明沙利度胺可以有效地逆转实验性大鼠肝纤维化. 使用沙利度胺4 wk时作用明显, 但是使用6 wk与使用4 wk并无显著性差异, 表明沙利度胺治疗肝纤维化存在明显的时间窗.
肝星状细胞(HSC)的活化和增殖是肝纤维化发生的中心事件. 研究发现, 静息的HSC不表达ICAM-1, 而活化的HSC则可增加ICAM-1基因表达及其表达产物. 这从细胞水平上提示ICAM-1的表达与HSC的活化及肝纤维化的发生密切相关. 炎症细胞表面的LFA-1、MAC-1与靶细胞膜上的ICAM-1结合, 从而导致肝细胞和窦周细胞损伤而致纤维化. VCAM-1可能不仅促进中性粒细胞, 而且也促进单核细胞及T淋巴细胞浸入肝实质, 与炎症的发生及发展有密切的关系. E-selectin参与外周血白细胞与血管内皮细胞黏附过程的起始黏附. 肝组织血管内皮细胞表达的E-selectin可介导炎性细胞和免疫细胞的浸润, 引起肝组织炎症, 促使肝星状细胞激活, 故可促进纤维化的发生及发展.
本实验发现, 在正常组和模型组大鼠肝组织中均有ICAM-1、VCAM-1和E-selectin mRNA的表达, 但模型组的表达强度显著增加. 模型组大鼠肝组织ICAM-1、VCAM-1、E-选择素蛋白表达较正常组明显增加, 除肝窦周细胞、血管内皮细胞表达增强, 肝细胞也出现阳性表达, 说明黏附分子的表达增强可能与肝纤维化的发病机制有关. Teo[8]发现, 沙利度胺可以减少TNF-α诱导的人脐静脉内皮细胞上的细胞表面黏附分子ICAM-1、VCAM-1和E-selectin的表达密度. Geitz et al[9]也证实, ICAM-1、VCAM-1和E-selectin参与中性粒细胞和内皮细胞黏附的瀑布效应, 沙利度胺可阻断这些黏附分子的上调. 本研究发现, 使用沙利度胺治疗实验性大鼠肝纤维化, 可明显减弱ICAM-1、VCAM-1、E-selectin mRNA和蛋白的表达, 且随着沙利度胺作用时间的延长, 抑制ICAM-1、VCAM-1、E-selectin表达的作用逐步增强, 呈一定的时间效应关系. 本实验观察到ICAM-1、VCAM-1、E-selectin mRNA表达与蛋白表达的水平一致, 说明其转录和翻译在同一水平. 沙利度胺对大鼠肝纤维化的治疗作用可能是通过同时下调ICAM-1、VCAM-1和E-selectin的转录和翻译水平来实现的.
此项研究表明, 沙利度胺可通过下调ICAM-1、VCAM-1和 E-selectin表达水平而发挥抗纤维化作用. 这将有助于揭示沙利度胺治疗肝纤维化的机制, 也为肝纤维化的治疗提供新的思路.
沙利度胺由于其重要的抗炎, 免疫调节及抗血管生成作用, 近年来受到重视, 沙利度胺可以下调黏附分子和选择素, 而肝损伤时会表达细胞间黏附分子, 利用之以及只可用来治疗肝纤维化.
本文研究了沙利度胺可通过下调ICAM-1、 VCAM-1和E-selectin表达水平而发挥抗肝纤维化作用, 对沙利度胺老药新用有一定的科研意义.
本文立题新颖, 选用指标先进, 数据准确, 设计方法合理, 对沙利度胺老药新用有一定的科研意义.
编辑: 何燕 电编:郭海丽
| 1. | Huang YS, Wu JC, Chan CY, Chao Y, Chang FY, Lee SD. Circulating intercellular adhesion molecule-1 in chronic liver disease and hepatocellular carcinoma. Zhonghua Yi Xue Za Zhi (Taipei). 1999;62:487-495. [PubMed] |
| 2. | Ho JW, Poon RT, Tong CS, Fan ST. Clinical significance of serum vascular cell adhesion molecule-1 levels in patients with hepatocellular carcinoma. World J Gastroenterol. 2004;10:2014-2018. [PubMed] |
| 3. | Cervello M, Virruso L, Lipani G, Giannitrapani L, Soresi M, Carroccio A, Gambino R, Sanfililippo R, Marasa L, Montalto G. Serum concentration of E-selectin in patients with chronic hepatitis, liver cirrhosis and hepatocellular carcinoma. J Cancer Res Clin Oncol. 2000;126:345-351. [PubMed] |
| 4. | Rajkumar SV. Current status of thalidomide in the treatment of cancer. Oncology (Williston Park). 2001;15:867-874; discussion 877-879. [PubMed] |
| 5. | Eleutherakis-Papaiakovou V, Bamias A, Dimopoulos MA. Thalidomide in cancer medicine. Ann Oncol. 2004;15:1151-1160. [PubMed] |
| 6. | Yeh TS, Ho YP, Huang SF, Yeh JN, Jan YY, Chen MF. Thalidomide salvages lethal hepatic necroinflammation and accelerates recovery from cirrhosis in rats. J Hepatol. 2004;41:606-612. [PubMed] |
| 7. | Muriel P, Fernandez-Martinez E, Perez-Alvarez V, Lara-Ochoa F, Ponce S, Garcia J, Shibayama M, Tsutsumi V. Thalidomide ameliorates carbon tetrachloride induced cirrhosis in the rat. Eur J Gastroenterol Hepatol. 2003;15:951-957. [PubMed] |
| 8. | Teo SK. Properties of thalidomide and its analogues: implications for anticancer therapy. AAPS J. 2005;7:E14-19. [PubMed] |
| 9. | Geitz H, Handt S, Zwingenberger K. Thalidomide selectively modulates the density of cell surface molecules involved in the adhesion cascade. Immunopharmacology. 1996;31:213-221. [PubMed] |