修回日期: 2007-09-29
接受日期: 2007-09-28
在线出版日期: 2007-10-28
目的: 探讨多层螺旋CT(multi-slice spiral CT, MSCT)和血清肿瘤标志物对胃癌术前评估的价值.
方法: 对220例活检证实的胃癌患者术前行MSCT检查, 并将其结果与手术病理结果对照. 同时, 术前检测该220例患者血清中肿瘤标志物CA125, CA19-9, CA72-4, CEA和AFP的水平, 并分析其与胃癌临床病理特征的关系.
结果: MSCT对胃癌T和N分期的判断准确率分别为78.64%和74.09%, 对胃癌远处转移判断的敏感度、特异度和准确率分别为65.63%, 99.47%和94.55%, 对胃癌肝脏、腹膜和远处淋巴结转移判断的敏感度及TNM分期和可切除性的判断准确率分别为83.33%, 33.33%和78.57%, 58.54%和91.36%. 采用ROC分析评价时, 血清CA125对胃癌浸润深度、远处转移、腹膜转移和TNM分期判断的准确率均较高, 血清CA19-9对胃癌可切除性判断的准确率较高, 血清CA72-4对胃癌腹膜转移和远处淋巴结转移判断的准确率均较高. 当10 mg/L和11 mg/L分别作为血清CEA和AFP的临界值时, 血清CEA水平与患者性别、胃癌最大径、组织学类型、浸润深度、远处转移、远处淋巴结转移和TNM分期密切相关, 但血清AFP水平与患者年龄、性别、肿瘤部位、肿瘤最大径、组织学类型、浸润深度、转移、TNM分期和可切除性均无关.
结论: 多层螺旋CT和血清肿瘤标志物CA125, CA19-9, CA72-4和CEA对胃癌术前评估具有较大的临床应用价值, 但血清AFP对胃癌术前评估的价值有限.
引文著录: 严超, 朱正纲, 燕敏, 陈克敏, 陈军, 刘炳亚, 尹浩然, 林言箴. 多层螺旋CT和血清肿瘤标志物对胃癌术前评估的价值. 世界华人消化杂志 2007; 15(30): 3194-3203
Revised: September 29, 2007
Accepted: September 28, 2007
Published online: October 28, 2007
AIM: To investigate the value of multi-slice spiral CT (MSCT) and serum tumor markers in the preoperative assessment of gastric carcinoma.
METHODS: MSCT was performed preoperatively in 220 patients with gastric carcinoma confirmed by biopsy, and the results were compared with surgical pathological findings. In addition, preoperative serum tumor marker levels of CA125, CA19-9, CA72-4, CEA and AFP were measured, and the correlation between tumor marker levels and clinicopathological parameters of gastric carcinoma was analyzed.
RESULTS: The overall accuracy of MSCT in preoperative T staging of gastric carcinoma was 78.64%. The overall accuracy of MSCT in preoperative N staging of gastric carcinoma was 74.09%. The diagnostic sensitivity, specificity and accuracy of MSCT for determining distant metastases of gastric carcinoma were 65.63%, 99.47% and 94.55%, respectively. The diagnostic sensitivity of MSCT was 83.33% for hepatic metastasis, 33.33% for peritoneal metastasis, and 78.57% for distant lymph node metastasis. The overall accuracy of MSCT for determination of TNM stage of gastric carcinoma was 58.54%. The accuracy of MSCT in evaluating resectability of gastric carcinoma was 91.36%. Receiver operating characteristics analysis showed that the accuracy of serum CA125 for determination of depth of invasion, distant metastasis, peritoneal metastasis, and TNM stage of gastric carcinoma was relatively high. The accuracy of serum CA19-9 for determination of surgical resectability was relatively high. In addition, the accuracy of serum CA72-4 for determination of peritoneal and distant lymph node metastasis of gastric carcinoma was relatively high. The recommended cut-off value of serum CEA and AFP was 10 mg/L and 11 mg/L, respectively. The serum CEA level was closely related to gender, maximum diameter of gastric carcinoma, histological type, depth of invasion, distant metastasis, distant lymph node metastasis, and TNM stage. However, there was no significant correlation between serum AFP level and age, gender, tumor location, maximum tumor diameter, histological type, depth of invasion, lymph node, distant, hepatic, peritoneal and distant lymph node metastasis, TNM stage; and surgical resectability.
CONCLUSION: The clinical value of MSCT and serum CA125, CA19-9, CA72-4 and CEA in the preoperative assessment of gastric carcinoma is relatively high. However, serum AFP has limited value in the preoperative assessment of gastric carcinoma.
- Citation: Yan C, Zhu ZG, Yan M, Chen J, Liu BY, Yin HR, Chen KM, Lin YZ. Clinical significance of multi-slice spiral CT and serum tumor markers in the preoperative assessment of gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(30): 3194-3203
- URL: https://www.wjgnet.com/1009-3079/full/v15/i30/3194.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i30.3194
准确的胃癌术前评估是胃癌外科综合治疗方案实施的需要, 在术前评估的基础上, 不同分期的胃癌患者可选择相应的治疗方案. 随着多层螺旋CT(multi-slice spiral CT, MSCT)扫描技术和检查方法的改进, 其对胃癌术前分期的准确率得到明显提高[1-7]. Yang et al[7]的研究显示, MSCT对胃癌术前T和N分期的判断准确率分别达到88%和80%. 与此同时, 肿瘤标志物对胃癌的诊断、预后和复发类型的判断有一定的价值. 有研究显示, 多种血清肿瘤标志物的表达水平与胃癌患者的临床分期密切相关[8-10]. 因此, 本研究旨在探讨MSCT和多种血清肿瘤标志物(CA125, CA19-9, CA72-4, CEA和AFP)对胃癌术前评估的价值.
选取2005-03/2007-05经胃镜活检证实的220例胃癌患者, 男143例, 女77例, 中位年龄55(22-87岁). 癌肿位于下1/3区143例, 中1/3区57例, 上1/3区20例, 分化型胃癌(中高分化腺癌)81例, 未分化型胃癌(低分化腺癌、印戒细胞癌、黏液腺癌)139例. 所有患者均于术前2 wk内按照我们既往报道的方法[11]行MSCT检查, 检查结果由2名放射科医师进行评定. 同时, 术前2 wk内抽血, 送检验科测定胃癌患者的血清肿瘤标志物(CA125, CA19-9, CA72-4, CEA和AFP)水平. 在220例胃癌患者中, 有193例接受根治或姑息性切除术, 16例行剖腹探查术, 11例行转流手术. 对于仅行转流或探查术的病例, 其T4分期参照探查结果, 伴远处转移者同时参与TNM分期(Ⅳ期)研究. 对于姑息性切除的病例, 其明显肿大且可疑转移的淋巴结均尽可能予以切除, 术中对肝脏、腹膜和远处淋巴结等可疑转移灶均予活检. 因此, 分别有220, 193, 220和205例患者参与胃癌术前T, N, M和TNM分期研究.
胃癌分期采用TNM分期法(UICC第4版). 在MSCT图像上, 正常胃壁厚度一般在5 mm以下; 在增强扫描图像上可呈1-3层结构[12], 胃癌则表现为胃壁增厚和(或)胃壁异常增强. MSCT判断胃癌浸润深度的标准参照文献[12], 但对T4期胃癌的诊断在胃癌与邻近脏器间的脂肪层消失的基础上, 需合并邻近脏器内CT值的改变. 在MSCT图像上胃周淋巴结短径超过6 mm和胃周外淋巴结短径超过8 mm视为转移淋巴结[13]. 当MSCT发现第12组以上转移淋巴结、肝脏转移灶、腹水等, 均视为远处转移(M1). 血清CA125, CA19-9, CA72-4, CEA和AFP的推荐临界值分别为35 kU/L, 37 kU/L, 5.3 kU/L, 10 mg/L和11 mg/L, 当测量值超过临界值时判断为阳性.
统计学处理 应用SPSS11.0软件进行数据处理. 计量资料用mean±SD表示, 采用独立样本t检验或单向方差分析分析胃癌血清肿瘤标志物水平与其临床病理特征的关系. 分析胃癌血清肿瘤标志物的阳性率与其临床病理特征的关系采用χ2检验和Fisher确切概率法. P<0.05表示有统计学意义. 采用ROC分析评价胃癌血清肿瘤标志物对胃癌浸润深度、淋巴结转移、远处转移、肝脏转移、腹膜转移、远处淋巴结转移、TNM分期和可切除性术前判断的价值, 以ROC曲线下面积(Az)评价其价值, 当Az = 0.5为完全无价值, Az在0.50-0.70之间为价值较低, 在0.70-0.90之间具有中等价值, 0.90以上具有较高的价值, Az = 1为完善的诊断.
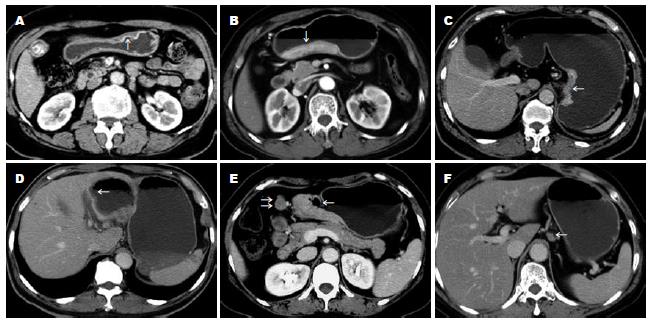
MSCT对早期和进展期胃癌的检出率分别为74.47%(35/47)和98.27%(170/173). MSCT对胃癌T分期的判断准确率为78.64%(173/220), 其中T1为78.72%(37/49), T2为41.38%(12/29), T3为84.38%(81/96), T4为89.58%(43/48)(图1A-E, 表1). MSCT对胃癌N分期的判断准确率为74.09%(143/193), 其中N0为73.68%(56/76), N1为68.33%(41/60), N2为80.70%(46/57)(图1E-F, 表2). MSCT判断胃癌淋巴结转移的敏感度、特异度和准确率分别为85.47%(100/117), 73.68%(56/76)和80.83%(156/193). MSCT对胃癌远处转移判断的敏感度、特异度和准确率分别为65.63%(21/32), 99.47%(187/188)和94.55%(208/220). MSCT对胃癌肝脏转移判断的敏感度、特异度和准确率分别为83.33%(5/6), 100%(214/214)和99.55%(219/220). MSCT对胃癌腹膜转移判断的敏感度、特异度和准确率分别为33.33%(6/18), 99.50%(201/202)和94.09%(207/220). MSCT对胃癌远处淋巴结转移判断的敏感度、特异度和准确率分别为78.57%(11/14), 99.51%(205/206)和98.18%(216/220). MSCT对胃癌TNM分期判断的准确率为58.54%(120/205), 其鉴别Ⅰa-Ⅲa和Ⅲb-Ⅳ期胃癌的准确率为86.83%(178/205)(表3). MSCT对胃癌可切除性判断的敏感度、特异度和准确率为96.37%(186/193), 55.56%(15/27), 91.36%(201/220).
| 病理分期 | n | MSCT分期 | ||||
| T1 | T2 | T3 | T4 | 准确率(%) | ||
| T1 | 47 | 37 | 5 | 5 | 0 | 78.72 |
| T2 | 29 | 5 | 12 | 11 | 1 | 41.38 |
| T3 | 96 | 2 | 5 | 81 | 8 | 84.38 |
| T4 | 48 | 0 | 0 | 5 | 43 | 89.58 |
| 病理分期 | n | MSCT分期 | |||
| N0 | N1 | N2 | 准确率(%) | ||
| N0 | 76 | 56 | 13 | 7 | 73.68 |
| N1 | 60 | 15 | 41 | 4 | 68.33 |
| N2 | 57 | 2 | 9 | 46 | 80.70 |
| 病理分期 | n | MSCT分期 | |||||
| Ⅰa | Ⅰb | Ⅱ | Ⅲa | Ⅲb | Ⅳ | ||
| Ⅰa | 39 | 27 | 8 | 3 | 0 | 1 | 0 |
| Ⅰb | 20 | 7 | 6 | 5 | 2 | 0 | 0 |
| Ⅱ | 29 | 2 | 7 | 8 | 7 | 5 | 0 |
| Ⅲa | 41 | 1 | 1 | 5 | 24 | 8 | 2 |
| Ⅲb | 35 | 0 | 0 | 2 | 6 | 22 | 5 |
| Ⅳ | 41 | 0 | 0 | 0 | 3 | 5 | 33 |
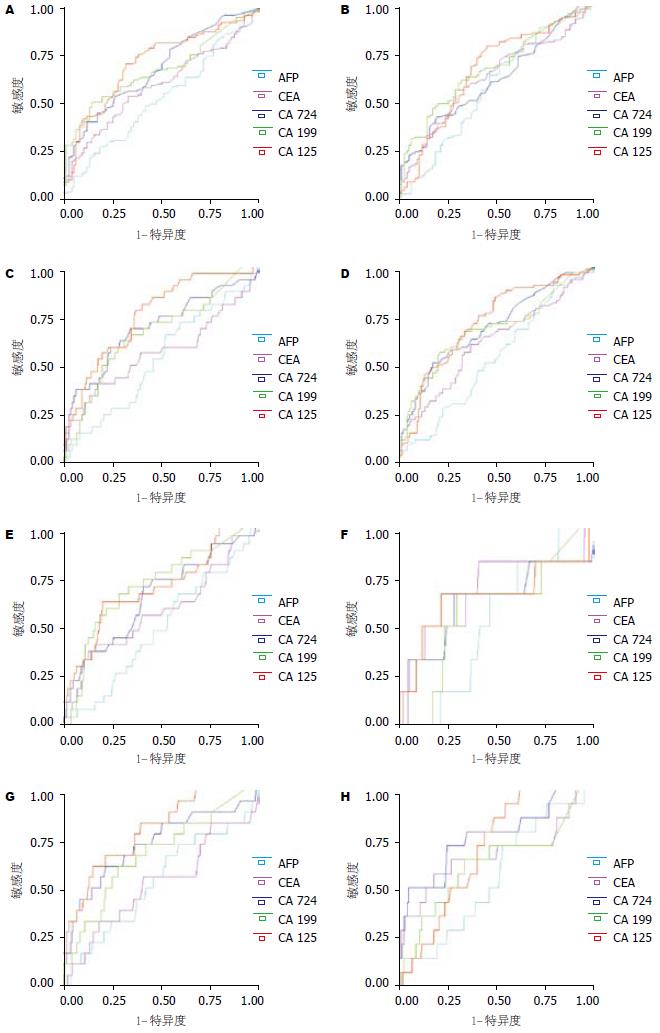
血清CA125水平与胃癌最大径(P<0.01)、组织学类型(P<0.05)、浸润深度(P<0.001)、淋巴结转移(P<0.01)、远处转移(P<0.01)、腹膜转移(P<0.05)、TNM分期(P<0.01)和可切除性(P<0.05)密切相关, 但与患者年龄、性别、肿瘤部位、肝脏和远处淋巴结转移无关. 血清CA19-9水平与胃癌最大径(P<0.05)、浸润深度(P<0.01)和TNM分期(P<0.05)密切相关, 但与患者年龄、性别、肿瘤部位、组织学类型、淋巴结转移、远处转移、肝脏转移、腹膜转移、远处淋巴结转移和可切除性无关. 血清CA72-4水平与胃癌最大径(P<0.01)、浸润深度(P<0.01)、淋巴结转移(P<0.05)和TNM分期(P<0.05)密切相关, 但与患者年龄、性别、肿瘤部位、组织学类型、远处转移、肝脏转移、腹膜转移、远处淋巴结转移和可切除性无关. 血清CEA和AFP水平与患者年龄、性别、肿瘤部位、肿瘤最大径、组织学类型、浸润深度、淋巴结转移、远处转移、肝脏转移、腹膜转移、远处淋巴结转移、TNM分期和可切除性均无关(表4). ROC分析显示, 血清CA125对胃癌浸润深度(浆膜浸润)、远处转移、腹膜转移和TNM分期(Ⅰa-Ⅲa/Ⅲb-Ⅳ)判断的准确率均较高(ROC曲线下面积[Az]分别为0.71, 0.76, 0.79和0.72), 血清CA19-9对胃癌可切除性判断的准确率较高(ROC曲线下面积[Az]为0.71), 血清CA72-4对胃癌腹膜转移和远处淋巴结转移判断的准确率均较高(ROC曲线下面积[Az]分别为0.73和0.76)(图2).
| 临床病理因素 | n | CA125 (kU/L) | P值 | CA19-9 (kU/L) | P值 | CA72-4 (kU/L) | P值 | CEA (mg/L) | P值 | AFP(mg/L) | P值 |
| 年龄(岁) | 0.531 | 0.301 | 0.382 | 0.162 | 0.813 | ||||||
| <61 | 125 | 15.52±20.92 | 143.83±574.82 | 12.92±46.55 | 3.81±8.69 | 4.49±12.84 | |||||
| ≥61 | 95 | 17.34±21.74 | 285.39±1378.58 | 8.49±18.64 | 34.82±214.41 | 4.16±4.84 | |||||
| 性别 | 0.521 | 0.314 | 0.332 | 0.281 | 0.583 | ||||||
| 女性 | 77 | 17.57±24.35 | 323.96±1536.60 | 14.81±47.94 | 3.16±9.68 | 3.84±4.01 | |||||
| 男性 | 143 | 15.63±19.43 | 140.88±527.92 | 8.96±29.79 | 24.76±175.07 | 4.63±12.28 | |||||
| 肿瘤部位 | 0.950 | 0.135 | 0.218 | 0.714 | 0.590 | ||||||
| 下1/3 | 143 | 16.10±22.00 | 120.10±510.79 | 8.89±27.49 | 22.93±174.85 | 4.82±12.41 | |||||
| 中1/3 | 57 | 17.06±22.58 | 433.31±1776.18 | 18.24±58.27 | 7.53±22.25 | 3.76±3.45 | |||||
| 上1/3 | 20 | 15.66±8.93 | 160.91±393.36 | 5.54±6.27 | 3.83±4.06 | 2.65±1.15 | |||||
| 肿瘤最大径(cm) | 0.004 | 0.018 | 0.001 | 0.875 | 0.118 | ||||||
| <5 | 121 | 12.44±15.46 | 45.25±264.56 | 3.00±4.61 | 18.57±177.92 | 3.28±1.86 | |||||
| ≥5 | 99 | 21.03±25.98 | 400.16±1447.87 | 20.79±53.70 | 15.53±77.17 | 5.66±1.96 | |||||
| 组织学类型 | 0.016 | 0.484 | 0.057 | 0.403 | 0.724 | ||||||
| 分化型 | 81 | 12.62±9.40 | 142.67±499.70 | 6.10±10.18 | 6.72±19.15 | 4.03±5.38 | |||||
| 未分化型 | 139 | 18.46±25.54 | 241.26±1204.54 | 13.87±45.92 | 23.3±177.32 | 4.54±12.14 | |||||
| 浸润深度 | 0.000 | 0.005 | 0.001 | 0.116 | 0.245 | ||||||
| T1/2 | 76 | 9.92±7.37 | 14.16±55.30 | 2.68±4.54 | 2.16±2.70 | 3.25±2.03 | |||||
| T3/4 | 144 | 19.68±20.09 | 305.66±1229.71 | 15.40±45.25 | 25.14±174.53 | 4.93±12.46 | |||||
| 淋巴结转移 | 0.006 | 0.088 | 0.013 | 0.097 | 0.287 | ||||||
| N0 | 76 | 10.69±8.57 | 67.99±499.43 | 3.00±5.83 | 2.06±2.39 | 3.45±3.24 | |||||
| N1/2 | 117 | 15.52±13.52 | 295.88±1294.13 | 12.31±39.15 | 13.06±71.09 | 5.19±13.65 | |||||
| 远处转移 | 0.008 | 0.249 | 0.064 | 0.178 | 0.992 | ||||||
| M0 | 188 | 13.09±11.51 | 172.73±990.04 | 7.39±25.67 | 4.26±12.79 | 4.35±10.75 | |||||
| M1 | 32 | 35.22±44.25 | 394.31±1078.53 | 32.23±72.35 | 93.25±365.25 | 4.33±5.85 | |||||
| 肝脏转移 | 0.309 | 0.664 | 0.800 | 0.395 | 0.752 | ||||||
| 无 | 214 | 16.06±21.21 | 209.89±1017.46 | 10.90±37.56 | 14.04±134.30 | 4.39±10.31 | |||||
| 有 | 6 | 25.03±22.47 | 29.05±28.44 | 14.80±18.84 | 129.75±304.25 | 3.05±0.77 | |||||
| 腹膜转移 | 0.019 | 0.257 | 0.092 | 0.757 | 0.732 | ||||||
| 无 | 202 | 13.56±11.89 | 173.54±963.72 | 7.78±25.21 | 18.08±147.55 | 4.42±10.60 | |||||
| 有 | 18 | 47.16±55.20 | 557.54±1362.98 | 47.24±93.58 | 7.28±16.60 | 3.56±2.03 | |||||
| 远处淋巴结转移 | 0.523 | 0.425 | 0.096 | 0.191 | 0.675 | ||||||
| 无 | 206 | 16.07±21.67 | 190.83±1006.77 | 7.87±25.06 | 4.48±13.12 | 4.27±10.29 | |||||
| 有 | 14 | 19.82±14.84 | 412.84±971.43 | 57.84±104.08 | 204.43±542.31 | 5.46±8.58 | |||||
| TNM分期 | 0.004 | 0.032 | 0.030 | 0.127 | 0.165 | ||||||
| Ⅰa-Ⅲa | 129 | 12.22±12.29 | 56.03±387.87 | 5.34±23.53 | 2.30±2.73 | 3.42±2.64 | |||||
| Ⅲb, Ⅳ | 76 | 23.33±30.93 | 462.35±1598.14 | 19.01±50.83 | 44.61±239.25 | 6.16±16.88 | |||||
| 可切除性 | 0.025 | 0.963 | 0.140 | 0.350 | 0.550 | ||||||
| 否 | 27 | 35.54±47.90 | 196.54±452.53 | 27.92±64.83 | 77.76±376.09 | 3.25±1.65 | |||||
| 是 | 193 | 13.62±12.03 | 206.14±1059.12 | 8.64±30.98 | 8.73±55.54 | 4.50±10.84 |
当35 kU/L, 37 kU/L, 5.3 kU/L, 10 mg/L和11 mg/L分别作为血清CA125, CA19-9, CA72-4, CEA和AFP的临界值时, 血清CA125水平与胃癌远处转移(P<0.01)、腹膜转移(P<0.001)和可切除性(P<0.01)密切相关, 但与患者年龄、性别、肿瘤部位、肿瘤最大径、组织学类型、浸润深度、淋巴结转移、肝脏转移、远处淋巴结转移和TNM分期无关. 血清CA19-9水平与胃癌最大径(P<0.001)、浸润深度(P<0.001)、淋巴结转移(P<0.001)、远处转移(P<0.01)、腹膜转移(P<0.05)、TNM分期(P<0.001)和可切除性(P<0.001)密切相关, 但与患者年龄、性别、肿瘤部位、组织学类型、肝脏转移和远处淋巴结转移无关. 血清CA72-4水平与胃癌最大径(P<0.001)、浸润深度(P<0.001)、淋巴结转移(P<0.01)、远处转移(P<0.01)、腹膜转移(P<0.01)、远处淋巴结转移(P<0.05)、TNM分期(P<0.001)和可切除性(P<0.05)密切相关, 但与患者年龄、性别、肿瘤部位、组织学类型和肝脏转移无关. 血清CEA水平与患者性别(P<0.05)、胃癌最大径(P<0.05)、组织学类型(P<0.05)、浸润深度(P<0.05)、远处转移(P<0.01)、远处淋巴结转移(P<0.01)和TNM分期(P<0.001)密切相关, 但与患者年龄、肿瘤部位、淋巴结转移、肝脏转移、腹膜转移和可切除性均无关. 血清AFP水平与患者年龄、性别、肿瘤部位、肿瘤最大径、组织学类型、浸润深度、淋巴结转移、远处转移、肝脏转移、腹膜转移、远处淋巴结转移、TNM分期和可切除性均无关(表5).
| 临床病理 因素 | n | CA125 (kU/L) | P值 | CA19-9 (kU/L) | P值 | CA72-4 (kU/L) | P值 | CEA (mg/L) | P值 | AFP (mg/L) | P值 | |||||
| - | + | - | + | - | + | - | + | - | + | |||||||
| 年龄(岁) | 0.411 | 0.268 | 0.48 | 0.398 | 1.000 | |||||||||||
| <61 | 125 | 118 | 7 | 100 | 25 | 95 | 30 | 117 | 8 | 122 | 3 | |||||
| ≥61 | 95 | 87 | 8 | 70 | 25 | 76 | 19 | 86 | 9 | 92 | 3 | |||||
| 性别 | 0.674 | 0.399 | 0.285 | 0.037 | 1.000 | |||||||||||
| 女性 | 77 | 71 | 6 | 62 | 15 | 63 | 14 | 75 | 2 | 75 | 2 | |||||
| 男性 | 143 | 134 | 9 | 108 | 35 | 108 | 35 | 128 | 15 | 139 | 4 | |||||
| 肿瘤部位 | 0.327 | 0.923 | 0.681 | 0.624 | 0.582 | |||||||||||
| 下1/3 | 143 | 131 | 12 | 110 | 33 | 112 | 31 | 133 | 10 | 138 | 5 | |||||
| 中1/3 | 57 | 54 | 3 | 45 | 12 | 45 | 12 | 51 | 6 | 56 | 1 | |||||
| 上1/3 | 20 | 20 | 0 | 15 | 5 | 14 | 6 | 19 | 1 | 20 | 0 | |||||
| 肿瘤最大径(cm) | 0.081 | 0.000 | 0 | 0.027 | 0.093 | |||||||||||
| <5 | 121 | 116 | 5 | 106 | 15 | 107 | 14 | 116 | 5 | 120 | 1 | |||||
| ≥5 | 99 | 89 | 10 | 64 | 35 | 64 | 35 | 87 | 12 | 94 | 5 | |||||
| 组织学类型 | 0.162 | 0.596 | 0.307 | 0.018 | 0.672 | |||||||||||
| 分化型 | 81 | 78 | 3 | 61 | 20 | 66 | 15 | 75 | 6 | 78 | 3 | |||||
| 未分化型 | 139 | 127 | 12 | 109 | 30 | 105 | 34 | 128 | 11 | 136 | 3 | |||||
| 浸润深度 | 0.073 | 0.000 | 0 | 0.040 | 0.667 | |||||||||||
| T1/2 | 76 | 74 | 2 | 72 | 4 | 71 | 5 | 74 | 2 | 75 | 1 | |||||
| T3/4 | 144 | 131 | 13 | 98 | 46 | 100 | 44 | 129 | 15 | 139 | 5 | |||||
| 淋巴结转移 | 0.487 | 0.000 | 0.002 | 0.067 | 1.000 | |||||||||||
| N0 | 76 | 74 | 2 | 72 | 4 | 69 | 7 | 74 | 2 | 74 | 2 | |||||
| N1/2 | 117 | 110 | 7 | 86 | 31 | 85 | 32 | 106 | 11 | 113 | 4 | |||||
| 远处转移 | 0.002 | 0.002 | 0.002 | 0.005 | 1.000 | |||||||||||
| M0 | 188 | 180 | 8 | 152 | 36 | 153 | 35 | 178 | 10 | 183 | 5 | |||||
| M1 | 32 | 25 | 7 | 18 | 14 | 18 | 14 | 25 | 7 | 31 | 1 | |||||
| 肝脏转移 | 0.349 | 0.621 | 0.617 | 0.070 | 1.000 | |||||||||||
| 无 | 214 | 200 | 14 | 166 | 48 | 167 | 47 | 199 | 15 | 208 | 6 | |||||
| 有 | 6 | 5 | 1 | 4 | 2 | 4 | 2 | 4 | 2 | 6 | 0 | |||||
| 腹膜转移 | 0.000 | 0.036 | 0.001 | 0.636 | 1.000 | |||||||||||
| 无 | 202 | 193 | 9 | 160 | 42 | 163 | 39 | 187 | 15 | 196 | 6 | |||||
| 有 | 18 | 12 | 6 | 10 | 8 | 8 | 10 | 16 | 2 | 18 | 0 | |||||
| 远处淋巴结转移 | 1.000 | 0.093 | 0.017 | 0.002 | 0.329 | |||||||||||
| 无 | 206 | 192 | 14 | 162 | 44 | 164 | 42 | 194 | 12 | 201 | 5 | |||||
| 有 | 14 | 13 | 1 | 8 | 6 | 7 | 7 | 9 | 5 | 13 | 1 | |||||
| TNM分期 | 0.107 | 0.000 | 0 | 0.000 | 0.197 | |||||||||||
| Ⅰa-Ⅲa | 129 | 123 | 6 | 116 | 13 | 114 | 15 | 126 | 3 | 127 | 2 | |||||
| Ⅲb, Ⅳ | 76 | 68 | 8 | 48 | 28 | 47 | 29 | 64 | 12 | 72 | 4 | |||||
| 可切除性 | 0.005 | 0.000 | 0.049 | 0.139 | 1.000 | |||||||||||
| 否 | 27 | 21 | 6 | 12 | 15 | 17 | 10 | 23 | 4 | 27 | 0 | |||||
| 是 | 193 | 184 | 9 | 158 | 35 | 154 | 39 | 180 | 13 | 187 | 6 | |||||
胃癌术前分期是实施胃癌外科综合治疗方案的需要, 在胃癌术前评估的基础上, 不同分期可选择相应的治疗方案. 对于Ⅰa和Ib期胃癌, 其手术效果非常好, 部分胃黏膜癌因其淋巴结转移率极低还可行局限性切除术(如EMR或LPG等). 对于Ⅱ和Ⅲa 期胃癌, 其淋巴结转移可能性较大, 但该组病例行根治性手术的效果较好, 且多能实现R0切除, 故其治疗以根治性手术为主. 对于Ⅲb 和Ⅳ期胃癌, 单纯手术往往难以达到根治目的, 常存在肉眼或镜下残留灶, 所以多为姑息性切除且不能明显改善预后, 对于这部分病例有必要行新辅助化疗等术前治疗, 待肿瘤体积或转移灶得以适当控制后再考虑手术[14-18]. 因此, 准确的术前分期对选择合理的胃癌治疗方案至关重要.
CT常作为判断胃癌远处转移(M分期)的方法, 其对胃癌术前T、N分期的临床应用价值长期以来存在较大的争议. 但是, 目前由于多层螺旋CT扫描技术的发展和检查方法的改进, 明显提高了CT对胃癌术前T, N分期的准确率. 因为MSCT扫描速度快, 能完成对靶器官的多期扫描, 并且可对容积扫描数据进行多层面重建(MPR), 甚至可实现CT仿真胃镜检查[19]. Yang et al[7]的研究显示, MSCT对胃癌术前T和N分期的判断准确率分别达到88%和80%. 近期的比较研究亦显示, MSCT对胃癌术前T, N分期的准确率(76%-83.3%和70%-75%)与EUS(86%-87.5%和79.1%-90%)无明显差别[20-21]. 我们的一项比较研究亦显示, MSCT有可能代替EUS成为胃癌术前分期的首选方法[22].
我们的研究显示, MSCT对胃癌术前T, N, M和TNM分期的准确率均较高, 其鉴别Ⅰa-Ⅲa和Ⅲb-Ⅳ期胃癌的准确率达86.83%, 对胃癌可切除性的判断准确率达91.36%, 所以MSCT基本能够满足胃癌外科综合治疗方案实施的需要. 但本研究同时显示, MSCT对腹膜转移判断的敏感度仍较低(33.33%), 对早期胃癌的检出率偏低(74.47%)并且无法准确鉴别黏膜和黏膜下癌. 因此, 如能联合内镜超声检查、腹腔镜检查及其他分子生物学检测手段, 有望进一步提高胃癌术前分期的准确率[23-26]. 血清CA125水平与胃癌最大径、组织学类型、浸润深度、淋巴结转移、远处转移、腹膜转移、TNM分期和可切除性密切相关. ROC分析进一步显示, 血清CA125对胃癌浸润深度、远处转移、腹膜转移和TNM分期(Ⅰa-Ⅲa/Ⅲb-Ⅳ)判断的准确率均较高. 所以, 血清CA125水平与胃癌进展程度密切相关, 其对胃癌术前评估的临床应用价值较大, 但35 kU/L可能并非其最佳工作点. 当35 kU/L作为其临界值时, 血清CA125水平与胃癌远处转移、腹膜转移和可切除性密切相关, 但与肝脏和远处淋巴结转移无关, 其对腹膜转移判断的敏感度、特异度和准确率分别达33.33%(6/18), 95.54%(193/202)和90.45%(199/220), 其敏感度与MSCT相当. Nakata et al[27]采用35 kU/L作为血清CA125的临界值, 结果显示其对胃癌腹膜转移判断的敏感度、特异度和准确率分别达39.39%(13/33), 95.7%(336/351)和90.89%(349/384), 敏感度高于CT(21.2%), 其结果与本研究结果基本一致. 所以, 当35 kU/L作为血清CA125的临界值时, 其对胃癌腹膜转移判断的特异度非常高, 并且可以获得与MSCT相当的敏感度, 具有较高的临床应用价值.
ROC分析显示, 血清CA19-9对胃癌可切除性判断的准确率较高. 当37 kU/L作为血清CA19-9的临界值时, 血清CA19-9水平与胃癌最大径、浸润深度、淋巴结转移、远处转移、腹膜转移、TNM分期和可切除性密切相关, 其对胃癌浆膜浸润和淋巴结转移判断的阳性预测值分别达92.0%(46/50), 88.57%(31/35), 对胃癌可切除性判断的准确率达78.64%(173/220), 对腹膜转移判断的敏感度和特异度分别为44.44%(8/18)和79.21%(160/202). Choi et al[8]的研究进一步显示, 术前和术后血清CA19-9水平对胃癌腹膜复发判断的敏感度较高, 说明血清CA19-9水平与胃癌进展程度密切相关, 其对胃癌术前评估具有一定的临床应用价值.
血清CA72-4水平与胃癌最大径、浸润深度、淋巴结转移和TNM分期密切相关, 当5.3 kU/L作为血清CA72-4的临界值时, 血清CA72-4水平与胃癌最大径、浸润深度、淋巴结转移、远处转移、腹膜转移、远处淋巴结转移、TNM分期和可切除性密切相关, 其对胃癌浆膜浸润和淋巴结转移判断的阳性预测值分别达89.80%(44/49), 82.05%(32/39), 对腹膜转移判断的敏感度和特异度分别为55.56%(10/18)和80.69%(163/202), 对远处淋巴结转移判断的敏感度和特异度分别为50.0%(7/14)和79.61%(164/206). Louhimo et al[28]的研究显示, 术前血清CA72-4水平与胃癌TNM分期密切相关, 并且是胃癌患者的独立预后因素, 说明血清CA72-4水平与胃癌进展程度密切相关, 其对胃癌术前评估具有一定的临床应用价值.
当10 mg/L作为血清CEA的临界值时, 血清CEA水平与患者性别、胃癌最大径、组织学类型、浸润深度、远处转移、远处淋巴结转移和TNM分期密切相关, 其对远处淋巴结转移判断的敏感度、特异度和准确率分别为35.71%(5/14), 94.17%(194/206)和90.45%(199/220), 说明血清CEA水平与胃癌进展程度密切相关, 其对胃癌术前评估具有一定的临床应用价值. Marrelli et al[29]的研究显示, 术前血清CEA水平与术后血行复发密切相关, 但本研究显示血清CEA水平与胃癌肝脏转移无关(P = 0.07), 可能系由于本组肝脏转移病例数较少所致, 故有待进一步扩大病例数以明确其关系. 血清AFP水平与患者年龄、性别、肿瘤部位、肿瘤最大径、组织学类型、浸润深度、淋巴结转移、远处转移、肝脏转移、腹膜转移、远处淋巴结转移、TNM分期和可切除性均无关. 血清AFP阳性的胃癌是一种特殊类型胃癌, 即产AFP胃癌, 仅占所有胃癌病例的2.7%-4.3%[3,16]. Ishigami et al[9]的研究显示, 产AFP胃癌浸润深度较深、淋巴结转移率高, 术后复发者均伴有肝脏转移, 预后较差. Kono et al[30]的研究亦显示, 产AFP胃癌浸润深度较深、淋巴结转移率高, 肝脏转移率高, TNM分期较晚, 预后较差. 本研究中产AFP胃癌仅有6例(2.73%), 其血清AFP阳性率与胃癌各临床病理因素间均无显著相关, 并且所有产AFP胃癌患者均未发生同时性肝脏转移, 说明血清AFP对胃癌术前评估的价值有限, 对于产AFP胃癌的临床病理特征则有待累积病例数以深入研究.
总之, 我们认为多层螺旋CT和血清肿瘤标志物CA125, CA19-9, CA72-4和CEA对胃癌术前评估具有较大的临床应用价值, 但血清AFP对胃癌术前评估的价值有限.
准确的胃癌术前评估是胃癌外科综合治疗方案实施的需要, 在术前评估的基础上, 不同分期的胃癌患者可选择相应的治疗方案. 随着多层螺旋CT(MSCT)扫描技术和检查方法的改进, 其对胃癌术前分期的准确率得到明显提高, 与此同时, 肿瘤标志物对胃癌的诊断、预后和复发类型的判断有一定的价值. 有研究显示多种血清肿瘤标志物的表达水平与胃癌患者的临床分期密切相关.
胃癌术前分期采用的方法包括影像学及相关分子生物学检查方法. 在影像学检查方法中MSCT对胃癌术前分期的价值越来越受到重视, 其是否能成为胃癌术前分期的首选方法则有待进一步开展其与其他影像学检查方法的对比研究, 以明确, 分子生物学检查方法中最简单实用的无疑是对血清中胃癌转移相关指标的检测, 所以筛查血清中与胃癌进展程度密切相关的指标具有重要的临床意义.
Chen et al的研究显示, 应用16排螺旋CT轴位图像对胃癌术前T和N分期判断的准确率分别为73%和71%, 但结合分析多层面重建(MPR)图像时可分别达89%和78%. Yang et al的研究显示, 通过综合分析64排螺旋CT轴位和MPR图像对胃癌术前T和N分期的判断准确率分别达到88%和80%. 该两项研究充分说明, MSCT由于其扫描技术的进步, 对胃癌术前分期的准确率得到明显提高, 有望成为胃癌术前分期的首选方法.
本文通过对大组病例研究充分肯定了MSCT在胃癌术前评估中的价值, 同时表明MSCT对胃癌腹膜转移判断的敏感度较低, 有待联合腹腔镜等检查方法以提高判断准确率. 本文详尽分析了胃癌各临床病理因素与多种血清肿瘤标志物的关系, 进一步明确了各肿瘤标志物的临床应用价值.
MSCT对胃癌术前评估具有较大的临床应用价值, 如联合检测血清肿瘤标志物CA125, CA19-9, CA72-4和CEA能进一步提高胃癌术前分期的准确率, 但血清AFP对胃癌术前评估的价值有限.
1 CA125: 糖链蛋白125是一种大分子多聚糖蛋白, 存在于上皮性卵巢癌组织和患者的血清中, 主要用于辅助诊断恶性浆液性卵巢癌和上皮性卵巢癌, 同时也是卵巢癌疗效观察的指标. 2 CA19-9: 糖链蛋白19-9又称胃肠癌相关抗原, 在正常人的分泌物如唾液、精液、乳汁和消化液中存在, 目前认为检测血清CA19-9可作为胰腺癌和胆道癌等恶性肿瘤的辅助诊断指标, 对监测病情变化和复发有较大价值. 3 CA72-4: 糖链蛋白72-4是胃肠道肿瘤和卵巢癌的标志物. 4 CEA: 癌胚抗原最初发现于成人结肠癌组织中, 是一种结构复杂的可溶性糖蛋白, 胚胎期主要存在于胎儿的胃肠管、胰腺和肝脏, 出生后明显降低, CEA是一种广谱肿瘤标志物, 在恶性肿瘤的鉴别诊断、病情监测和疗效评价等方面有重要价值. 5 AFP: 甲胎蛋白是胎儿发育早期, 由肝脏和卵黄囊合成的一种血清糖蛋白, 胎儿出生后不久即逐渐消失, 1964年Tatarinov报道肝细胞癌患者血清中AFP升高, 目前检测血清中AFP是临床上诊断肝癌的重要指标.
本文研究设计合理, 方法得当, 其结果对临床工作有一定指导意义.
编辑: 程英升 电编:马文华
| 1. | Shin KS, Kim SH, Han JK, Lee JM, Lee HJ, Yang HK, Choi BI. Three-dimensional MDCT Gastrography Compared With Axial CT for the Detection of Early Gastric Cancer. J Comput Assist Tomogr. 2007;31:741-749. [PubMed] |
| 2. | Kim JH, Eun HW, Choi JH, Hong SS, Kang W, Auh YH. Diagnostic performance of virtual gastroscopy using MDCT in early gastric cancer compared with 2D axial CT: focusing on interobserver variation. AJR Am J Roentgenol. 2007;189:299-305. [PubMed] |
| 3. | Chen CY, Wu DC, Kang WY, Hsu JS. Staging of gastric cancer with 16-channel MDCT. Abdom Imaging. 2006;31:514-520. [PubMed] |
| 4. | Shimizu K, Ito K, Matsunaga N, Shimizu A, Kawakami Y. Diagnosis of gastric cancer with MDCT using the water-filling method and multiplanar reconstruction: CT-histologic correlation. AJR Am J Roentgenol. 2005;185:1152-1158. [PubMed] |
| 5. | Chen CY, Hsu JS, Wu DC, Kang WY, Hsieh JS, Jaw TS, Wu MT, Liu GC. Gastric cancer: preoperative local staging with 3D multi-detector row CT--correlation with surgical and histopathologic results. Radiology. 2007;242:472-482. [PubMed] |
| 6. | Kim HJ, Kim AY, Oh ST, Kim JS, Kim KW, Kim PN, Lee MG, Ha HK. Gastric cancer staging at multi-detector row CT gastrography: comparison of transverse and volumetric CT scanning. Radiology. 2005;236:879-885. [PubMed] |
| 7. | Yang DM, Kim HC, Jin W, Ryu CW, Kang JH, Park CH, Kim HS, Jung DH. 64 multidetector-row computed tomography for preoperative evaluation of gastric cancer: histological correlation. J Comput Assist Tomogr. 2007;31:98-103. [PubMed] |
| 8. | Choi SR, Jang JS, Lee JH, Roh MH, Kim MC, Lee WS, Qureshi W. Role of serum tumor markers in monitoring for recurrence of gastric cancer following radical gastrectomy. Dig Dis Sci. 2006;51:2081-2086. [PubMed] |
| 9. | Ishigami S, Natsugoe S, Nakashima H, Tokuda K, Nakajo A, Okumura H, Matsumoto M, Nakashima S, Hokita S, Aikou T. Biological aggressiveness of alpha-fetoprotein (AFP)-positive gastric cancer. Hepatogastroenterology. 2006;53:338-341. [PubMed] |
| 10. | Fujimura T, Kinami S, Ninomiya I, Kitagawa H, Fushida S, Nishimura G, Kayahara M, Shimizu K, Ohta T, Miwa K. Diagnostic laparoscopy, serum CA125, and peritoneal metastasis in gastric cancer. Endoscopy. 2002;34:569-574. [PubMed] |
| 11. | 严 超, 朱 正纲, 燕 敏, 陈 克敏, 陈 军, 项 明, 陈 明敏, 刘 炳亚, 尹 浩然, 林 言箴. 进展期胃癌CT征象与其临床病理特征的关系. 外科理论与实践. 2005;10:413-418. |
| 12. | Takao M, Fukuda T, Iwanaga S, Hayashi K, Kusano H, Okudaira S. Gastric cancer: evaluation of triphasic spiral CT and radiologic-pathologic correlation. J Comput Assist Tomogr. 1998;22:288-294. [PubMed] |
| 13. | D'Elia F, Zingarelli A, Palli D, Grani M. Hydro-dynamic CT preoperative staging of gastric cancer: correlation with pathological findings. A prospective study of 107 cases. Eur Radiol. 2000;10:1877-1885. [PubMed] |
| 15. | Napieralski R, Ott K, Kremer M, Becker K, Boulesteix AL, Lordick F, Siewert JR, Hofler H, Keller G. Methylation of tumor-related genes in neoadjuvant-treated gastric cancer: relation to therapy response and clinicopathologic and molecular features. Clin Cancer Res. 2007;13:5095-5102. [PubMed] |
| 16. | Roth AD, Fazio N, Stupp R, Falk S, Bernhard J, Saletti P, Koberle D, Borner MM, Rufibach K, Maibach R. Docetaxel, cisplatin, and fluorouracil; docetaxel and cisplatin; and epirubicin, cisplatin, and fluorouracil as systemic treatment for advanced gastric carcinoma: a randomized phase II trial of the Swiss Group for Clinical Cancer Research. J Clin Oncol. 2007;25:3217-3223. [PubMed] |
| 17. | den Dulk M, Verheij M, Cats A, Jansen EP, Hartgrink HH, Van de Velde CJ. The essentials of locoregional control in the treatment of gastric cancer. Scand J Surg. 2006;95:236-242. [PubMed] |
| 18. | D'Ugo D, Persiani R, Rausei S, Biondi A, Vigorita V, Boccia S, Ricci R. Response to neoadjuvant chemotherapy and effects of tumor regression in gastric cancer. Eur J Surg Oncol. 2006;32:1105-1109. [PubMed] |
| 19. | Hur J, Park MS, Lee JH, Lim JS, Yu JS, Hong YJ, Kim KW. Diagnostic accuracy of multidetector row computed tomography in T- and N staging of gastric cancer with histopathologic correlation. J Comput Assist Tomogr. 2006;30:372-377. [PubMed] |
| 20. | Bhandari S, Shim CS, Kim JH, Jung IS, Cho JY, Lee JS, Lee MS, Kim BS. Usefulness of three-dimensional, multidetector row CT (virtual gastroscopy and multiplanar reconstruction) in the evaluation of gastric cancer: a comparison with conventional endoscopy, EUS, and histopathology. Gastrointest Endosc. 2004;59:619-626. [PubMed] |
| 21. | Habermann CR, Weiss F, Riecken R, Honarpisheh H, Bohnacker S, Staedtler C, Dieckmann C, Schoder V, Adam G. Preoperative staging of gastric adenocarcinoma: comparison of helical CT and endoscopic US. Radiology. 2004;230:465-471. [PubMed] |
| 22. | 陈 军, 严 超, 朱 正纲, 燕 敏, 陈 克敏, 诸 琦, 刘 炳亚, 尹 浩然, 林 言箴. 内镜超声检查和多层螺旋CT对胃癌术前T、N分期的比较研究. 中国实用外科杂志. 2005;25:278-281. |
| 23. | Yan C, Zhu ZG, Zhu Q, Yan M, Chen J, Liu BY, Yin HR, Lin YZ. A preliminary study of endoscopic ultrasonography in the preoperative staging of early gastric carcinoma. Zhonghua Zhongliu Zazhi. 2003;25:390-393. [PubMed] |
| 24. | Bentrem D, Gerdes H, Tang L, Brennan M, Coit D. Clinical correlation of endoscopic ultrasonography with pathologic stage and outcome in patients undergoing curative resection for gastric cancer. Ann Surg Oncol. 2007;14:1853-1859. [PubMed] |
| 25. | Song KY, Kim JJ, Kim SN, Park CH. Staging laparoscopy for advanced gastric cancer: is it also useful for the group which has an aggressive surgical strategy? World J Surg. 2007;31:1228-1223. [PubMed] |
| 26. | Yan C, Zhu ZG, Yu YY, Ji J, Zhang Y, Ji YB, Yan M, Chen J, Liu BY, Yin HR. Expression of vascular endothelial growth factor C and chemokine receptor CCR7 in gastric carcinoma and their values in predicting lymph node metastasis. World J Gastroenterol. 2004;10:783-790. [PubMed] |
| 27. | Nakata B, Hirakawa-YS Chung K, Kato Y, Yamashita Y, Maeda K, Onoda N, Sawada T, Sowa M. Serum CA 125 level as a predictor of peritoneal dissemination in patients with gastric carcinoma. Cancer. 1998;83:2488-2492. [PubMed] |
| 28. | Louhimo J, Kokkola A, Alfthan H, Stenman UH, Haglund C. Preoperative hCGbeta and CA 72-4 are prognostic factors in gastric cancer. Int J Cancer. 2004;111:929-933. [PubMed] |
| 29. | Marrelli D, Pinto E, De Stefano A, de Manzoni G, Farnetani M, Garosi L, Roviello F. Preoperative positivity of serum tumor markers is a strong predictor of hematogenous recurrence of gastric cancer. J Surg Oncol. 2001;78:253-258. [PubMed] |