修回日期: 2007-08-20
接受日期: 2007-09-01
在线出版日期: 2007-09-08
目的: 探讨梗阻性黄疸围手术期应用小剂量多巴胺对肾髓质水通道蛋白2(aquaporin 2)蛋白表达影响.
方法: ♂Wistar大鼠70只随机分为4组, 分别为对照组(n = 10)、梗阻性黄疸组(n = 20)、多巴胺5 µg组(n = 20)和多巴胺10 µg组(n = 20). 梗阻性黄疸组及多巴胺组大鼠全身麻醉后建立梗阻性黄疸动物模型; 对照组大鼠行假手术. 7 d后全麻下解除胆管梗阻, 对照组再次行假手术. 多巴胺组于胆管再通手术之前于股静脉套管针穿刺泵入多巴胺, 剂量分别为5 µg/(kg·min)和10 µg/(kg·min); 而假手术组及梗阻性黄疸组大鼠泵入9 g/L生理盐水, 泵注持续2 h, 并将各组动物随机均分为立即取材组和24 h后取材组. 腔静脉血离心后收集血清冻存检测胆红素、肌酐和尿素氮; 分离肾脏髓质冻存, 免疫印迹法(Western blotting)法检测aquaporin 2的表达.
结果: 解除梗阻早期鼠血清胆红素水平下降. 血尿素氮及肌酐未见明显改变. 通过Western blotting对肾髓质aqp2表达测定发现, 梗阻性黄疸组解除梗阻0 h取材组aqp2表达较对照组明显下降(15 665±1181 vs 21 966±1544, P<0.01), 而解除梗阻24 h后aqp2表达出现明显上升(36 490±1822 vs 21 917±2661, P<0.01). 多巴胺5 µg组0与24 h aqp2表达更接近CO组(16 010±646, 22 715±575 vs 21 966±1544, 21 917±2661); 10 µg组各时间点aqp2表达与梗黄组接近(13 581±1662, 32 313±1453 vs 15 665±1181, 36 490±1822), 未见多巴胺有明显调节aqp2表达作用.
结论: 胆管梗阻损伤肾脏集合管上皮细胞结构并抑制水重吸收功能; 低浓度多巴胺可调控集合管水通道蛋白2表达.
引文著录: 王勇, 陈卫民, 高林林, 刘金钢. 多巴胺调控实验性梗阻性黄疸围手术期肾髓质水通道蛋白2表达. 世界华人消化杂志 2007; 15(25): 2714-2717
Revised: August 20, 2007
Accepted: September 1, 2007
Published online: September 8, 2007
AIM: To investigate the changes in aquaporin 2 expression after bile duct recanalization and the effects of low-dose dopamine on perioperative renal aquaporin 2 expression.
METHODS: Seventy wistar rats were randomly allocated to 4 groups. Sixty rats underwent common bile duct ligation, while the other 10 underwent sham operation. The common duct was ligated on a silicon tube of 2 mm external diameter. Seven days later, the experimental rats were randomly allocated into another 3 groups. Rats in the obstructive jaundice group were injected with 9 g/L normal saline (NS), while those in the other 2 groups were injected with dopamine at 5 or 10 µg/(kg•min), respectively. After 2 h treatment, half in each group were killed and the others were killed 24 h later. Serum was collected from each rat to assess hepatic and renal functions. The right renal medulla was separated and kept at -80℃ until used to measure aquaporin 2 expressions by Western blotting.
RESULTS: In the early period of bile duct recanalization, serum bilirubin levels decreased. There were no significant changes in blood urine or creatine. Renal aquaporin 2 expression was detected by Western blotting. Aquaporin 2 expression in the experimental group treated with dopamine 5 µg/(kg•min) was nearly the same as that in the normal group, both at 0 and 24 h (16 010 ± 646 and 22 715 ± 575 vs 21 966 ± 1544 and 21 917 ± 2661), and better than the group treated with dopamine 10 µg/(kg•min).
CONCLUSION: Low-dose dopamine injection appears to modulate expression of aquaporin 2 in the renal collective tubule epithelium, and to have a positive effect on perioperative renal function in obstructive jaundice.
- Citation: Wang Y, Chen WM, Gao LL, Liu JG. Dopamine modulates perioperative renal medulla aquaporin 2 expression in experimental obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2007; 15(25): 2714-2717
- URL: https://www.wjgnet.com/1009-3079/full/v15/i25/2714.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i25.2714
梗阻性黄疸是胆道外科常见疾病, 其病情复杂, 而且全身各重要脏器损伤出现早、损伤重, 8%左右围手术期出现急性肾功能不全[1]. 胆管梗阻时肾脏损伤多伴发较严重的肾集合管病变, 且围手术期这种损伤进一步加重, 对肾集合管结构和功能的研究有助于肾功能保护. 1991年Peter Agre发现水通道蛋白之后, 为分子水平研究肾损伤提供了条件[2]. 水通道蛋白2(aquaporin2, aqp2)定位在集合管上皮主细胞顶质膜, 是肾集合管上皮结构蛋白. 近期针对药物、缺血性肾功能衰竭时水通道蛋白2变化的研究屡见报道[3]. 临床上广泛应用的药物多巴胺具有调节尿量的作用, 但其对肾水通道蛋白2表达的影响却未见相关报道. 本文旨在探讨梗阻性黄疸围手术期静脉泵入小剂量多巴胺对于大鼠肾aqp2蛋白表达的影响.
♂Wistar大鼠70只, 体质量250-300 g, 由中国医科大学第二医院实验动物中心提供. 经隔离检疫7 d, 无疾病者入选. 鼠操作台, 消毒设备, 无菌手术器械, 0号无菌丝线, 0.9 mm 22 G套管针, 5 mL注射器(BD公司), 2 mm灭菌硅胶导管(ED公司), 环氧乙烷灭菌子弹头, 无菌纱布, 灭菌真空采血管(促凝管), 小儿外科缝合针, 美国Sigma 1-13台式离心机, ALIAS微量输液泵(Baxtar公司), 液氮罐, -20和-80℃冰箱(Hitachi公司), 100 g/L水合氯醛, Penicillin注射液400万单位, 多巴胺注射液10 g/L, 灭菌生理盐水100 mL, aquaporin 2一抗: 兔抗aquaporin 2(武汉博士德公司, No. BA0649); 羊抗兔IgG二抗(美国Sigma公司, No. A3687).
动物随机分为4组, 分别为假手术对照组(CO, n = 10), 体质量为271.4±17.9 g; 梗阻性黄疸盐水组(OJ, n = 20), 体质量为265.9±21.2 g; 梗阻性黄疸多巴胺5 µg/(kg·min)组(DP5, n = 20), 体质量为272.7±11.2 g. 梗阻性黄疸多巴胺10 µg/(kg·min)组(DP10, n = 20), 体质量为271.4±13.5 g.
1.2.1 动物模型的构建: im 100 g/L水合氯醛3 mL/kg麻醉大鼠, 麻醉成功后将鼠固定于工作台上. 剑突下1 cm备皮, 约2 cm长正中切口进腹, 锐性分开腹直肌进入腹腔. 暴露胆总管、用0号丝线用硅胶导管作为垫片将胆总管固定于导管上, 然后逐层关腹. 4 h后正常进饮食, 7 d后再次麻醉, 解除梗阻时, 仅需要在结扎部位切口, 找到导管、并切断丝线、取出导管即可. 手术之前, 消毒腹股沟区, 切一横行1 cm切口, 暴露股静脉, 远心端结扎, 22G套管针近心端穿刺成功后固定. 对照组和梗阻性黄疸生理盐水组泵入9 g/L生理盐水5 mL/(kg·h), 而多巴酚丁胺5 µg/(kg·min)组和多巴酚丁胺10 µg/(kg·min)组泵入多巴酚丁胺, 速度分别为5 µg/(kg·min)和10 µg/(kg·min). 而总量均为5 mL/(kg·h). 总输液时间控制在2 h. 输液结束后按存活数量将各组动物随机均分为立即取材组和24 h后取材组. 头皮针穿刺取腔静脉血6-8 mL置于真空采血管内, 静置30 min后, 3000 r/min离心10 min, 取上清置于灭菌子弹头内冻于-20℃冰箱内待测直接胆红素(D-bil), 肌酐(CREA)和尿素氮的含量. 取右侧肾脏分离出髓质置于灭菌子弹头内用液氮罐转移至-80℃冰箱内待测.
1.2.2 Western blot检测: 称取150 mg标本加入6倍体积的细胞裂解液A匀浆, 4℃ RCF 20 000 g离心1.5 h, 上清为胞质蛋白样品. 沉淀(膜的成分)加入细胞裂解液B 1 mL在冰水中匀浆, 超声粉碎20 s, 间隔20 s, 3次, 4℃静置过夜, 4℃ RCF 20 000 g离心1.5 h, 取上清为胞膜蛋白样品. Lorry法蛋白定量: 各取样品50 μL蛋白定量, 以浓度最低管为基准, 调节蛋白浓度, 加5×样品缓冲液, 煮沸3-5 min. 按顺序过胶, 转膜和扫描.
统计学处理 所有计量资料均采用mean±SD表示, 采用SPSS11.5软件包, 经方差齐性检验后入选, 采用单因素方差分析或独立样本t检验, P<0.05为有统计学意义.
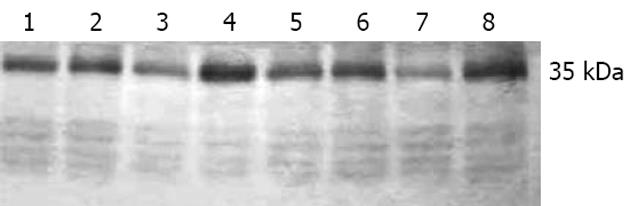
各组动物均顺利完成实验. 胆管梗阻3 d后大鼠耳缘、尾部见黄染. 同时尿液颜色逐渐加深. 取材时梗阻性黄疸组大鼠腹腔见较多腹水, 胆管增粗、管壁变薄. 胆管张力不大, 可能与再通有关. 各组血生化结果见表1, 胆红素解除梗阻后aqp2表达见图1.
| 分组 | 直接胆红素(μmol/L) | 肌酐(μmol/L) | 尿素氮(mmol/L) | aqp2 | |
| CO | 0 h | 2.44±1.32 | 21.20±4.49 | 8.00±0.28 | 21 966±1544 |
| 24 h | 2.86±3.89 | 29.00±9.03 | 10.41±2.04 | 21 917±2661 | |
| OJ | 0 h | 66.16±10.24 | 22.80±8.59 | 9.26±0.89 | 15 665±1181 |
| 24 h | 45.95±8.39b | 25.00±6.55 | 9.90±2.27 | 36 490±1822h | |
| DP5 | 0 h | 66.27±11.88 | 20.30±5.36 | 9.99±1.42 | 16 010±646 |
| 24 h | 51.86±10.01d | 25.00±6.85 | 9.95±2.20 | 22 715±575j | |
| DP10 | 0 h | 67.53±10.71 | 23.30±8.34 | 11.00±2.79 | 13 581±1662 |
| 24 h | 46.64±10.67e | 23.80±5.59 | 10.93±3.15 | 32 313±14531 |
梗阻性黄疸围手术期的肾功能损伤中肾小管损伤后果比较严重, 易引发急性肾小管坏死[4]. 梗阻性黄疸肾功能损伤可能存在几种机制, 即缺血再灌注损伤, 胆红素损伤, 内毒素损伤[5-8].
肾功能的损伤包括结构的损伤和功能损伤2个相互关联的部分, 能够灵敏反映肾脏结构、功能变化的指标, 对于研究肾损伤是非常重要的. 1991年Agre Peter发现肾脏水代谢依赖于一种细胞膜蛋白, 并最终定名为水通道蛋白, 这一发现合理的解释了肾脏自由水代谢的问题[9]. 经过10余年的研究, 水通道蛋白的研究重点逐渐转向水通道蛋白变化导致疾病的研究. 由于肾脏是水代谢的主要器官, 水通道蛋白在肾脏的研究对于揭示肾脏的病理生理改变具有重要作用[10]. 在药物、缺血等引起的肾功能衰竭的研究中发现aqp2表达明显下调, 且这一变化与集合管上皮细胞损伤程度明显相关[11-12]. 而梗阻性黄疸围手术期是肾集合管功能损伤进展最快的阶段, 早期临床上却可能没有任何症状, 难以引起临床医生足够重视[13]. 梗阻性黄疸早期肾小管功能损伤是否涉及肾小管上皮主细胞水通道蛋白2表达的改变目前国内外尚未见报道. 而肾脏水重吸收能力的调节主要在肾集合管, 一旦集合管受到损伤则直接影响全身水代谢的调节[14]. 本实验中应用Western印迹技术发现胆管梗阻-再通早期大鼠肾内aqp2蛋白表达较假手术组明显下降, 再通24 h后aqp2表达明显上调, aqp2含量甚至超过假手术组. 通过大量的关于aqp2的相关报道发现, 肾集合管aqp2表达的变化受到蛋白质翻译的影响. 自由基、一氧化氮、肿瘤坏死因子等细胞因子都会导致肾集合管aqp2蛋白表达下降[15-17]. 前期研究证实梗阻性黄疸时血胆红素、自由基、肿瘤坏死因子、内毒素等细胞因子含量较高. 因此, 胆管再通时aqp2表达受到抑制可能与此有关[18].
多巴胺对于肾aqp2表达的调节作用在本实验中得到证实. 应用Western印迹对泵入多巴胺的大鼠肾脏研究发现, 在解除梗阻后的2个时间点5 µg/(kg·min)组较10 µg/(kg·min)组aqp2表达更接近假手术组; 同样是低浓度多巴胺, 5 µg/(kg·min)组对于肾脏aqp2表达的调节作用强于10 µg/(kg·min)组, 其肾脏aqp2蛋白较其他各组更接近假手术组; 而10 µg/(kg·min)组肾脏aqp2蛋白与假手术组比较存在较大差异. 目前推测可能存在以下几种可能原因. 首先, 多巴胺低浓度有助于肾灌注的改善, 并可因而降低自由基、一氧化氮等缺血相关的细胞因子肾内浓度, 减少aqp2合成的抑制; 另外, aqp2可以通过血管加压素进行调节, 而多巴胺具有类似加压素的作用, 因此具有调节aqp2表达的作用[19]. 总之, 胆管梗阻-再通术后肾内aqp2含量明显降低; 24 h后这一变化得到纠正, 5 µg/(kg·min)泵入多巴胺调节肾集合管上皮细胞aqp2表达的作用明显.
感谢中国医科大学盛京医院中心试验室卢岩、高红老师的大力支持.
梗阻性黄疸是普通外科常见疾病, 肾功能损伤是其常见并发症. 多年来对于临床危重症肾功能保护常规应用小剂量多巴胺, 取得了一定的临床效果. 但近些年来针对其是否具有保护肾功能作用争议较大. 水通道蛋白是近些年发现的哺乳动物水代谢的主要蛋白, 二者之间是否具有联系尚不十分清楚.
本文着重探讨解除梗阻早期肾功能的变化与水通道蛋白2表达的关系, 有利于研究解除梗阻时体内内环境变化对肾集合管上皮细胞功能的影响.
通过梗阻性黄疸与水通道蛋白2表达变化的研究, 可以更加及时的了解肾功能的改变, 并及时对肾功能损伤加以有效的预防.
本文探讨梗阻性黄疸围手术期应用小剂量多巴胺对肾髓质水通道蛋白2表达影响, 有一定的创新性, 实验方法比较合理, 具有一定的学术参考价值.
编辑: 何燕 电编:何基才
| 1. | Fogarty BJ, Parks RW, Rowlands BJ, Diamond T. Renal dysfunction in obstructive jaundice. Br J Surg. 1995;82:877-884. [PubMed] [DOI] |
| 2. | King LS, Kozono D, Agre P. From structure to disease: the evolving tale of aquaporin biology. Nat Rev Mol Cell Biol. 2004;5:687-698. [PubMed] [DOI] |
| 3. | Sohn EJ, Kang DG, Lee HS. Protective effects of glycyrrhizin on gentamicin-induced acute renal failure in rats. Pharmacol Toxicol. 2003;93:116-122. [PubMed] [DOI] |
| 4. | Inan M, Sayek I, Tel BC, Sahin-Erdemli I. Role of endotoxin and nitric oxide in the pathogenesis of renal failure in obstructive jaundice. Br J Surg. 1997;84:943-947. [PubMed] [DOI] |
| 8. | 刘 金钢, 那 延立, 郭 宏斌, 田 野, 宋 军, 王 勇, 余 云. 生长激素减轻梗阻性黄疸时肠菌及内毒素移位的实验研究. 中国普外基础与临床杂志. 2002;9:172-174. |
| 9. | Preston GM, Carroll TP, Guggino WB, Agre P. Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein. Science. 1992;256:385-387. [PubMed] [DOI] |
| 10. | Nielsen S, Frokiaer J, Marples D, Kwon TH, Agre P, Knepper MA. Aquaporins in the kidney: from molecules to medicine. Physiol Rev. 2002;82:205-244. [PubMed] [DOI] |
| 11. | Gong H, Wang W, Kwon TH, Jonassen T, Frokiaer J, Nielsen S. Reduced renal expression of AQP2, p-AQP2 and AQP3 in haemorrhagic shock-induced acute renal failure. Nephrol Dial Transplant. 2003;18:2551-2559. [PubMed] [DOI] |
| 12. | Nejsum LN. The renal plumbing system: aquaporin water channels. Cell Mol Life Sci. 2005;62:1692-1706. [PubMed] [DOI] |
| 13. | Padillo FJ, Cruz A, Briceno J, Martin-Malo A, Pera-Madrazo C, Sitges-Serra A. Multivariate analysis of factors associated with renal dysfunction in patients with obstructive jaundice. Br J Surg. 2005;92:1388-1392. [PubMed] [DOI] |
| 14. | Kim SW, Jeon YS, Lee JU, Kang DG, Kook H, Ahn KY, Kim SZ, Cho KW, Kim NH, Han JS. Diminished adenylate cyclase activity and aquaporin 2 expression in acute renal failure rats. Kidney Int. 2000;57:1643-1650. [PubMed] [DOI] |
| 15. | Lee S, Kim W, Moon SO, Sung MJ, Kim DH, Kang KP, Jang YB, Lee JE, Jang KY, Park SK. Rosiglitazone ameliorates cisplatin-induced renal injury in mice. Nephrol Dial Transplant. 2006;21:2096-2105. [PubMed] [DOI] |
| 16. | Misharin AV, Resnenko AB, Fidelina OV, Grinevich VV, Akmaev IG. Antidiuretic hormone-V2-receptor-aquaporin-2 system in rat kidneys during acute inflammation. Bull Exp Biol Med. 2004;138:452-456. [PubMed] [DOI] |
| 17. | Cauwels A. Nitric oxide in shock. Kidney Int. 2007;72:557-565. [PubMed] [DOI] |
| 18. | Uslu A, Cayci M, Nart A, Karaca C, Zalluhoglu N, Gurkan A, Varilsuha C, Adagulu H. Renal failure in obstructive jaundice. Hepatogastroenterology. 2005;52:52-54. [PubMed] |