修回日期: 2006-10-10
接受日期: 2006-11-02
在线出版日期: 2007-01-18
目的: 观察西咪替丁对人胃癌SGC-7901细胞增殖、细胞周期分布及凋亡的影响, 并初步探讨其作用机制.
方法: 培养人胃癌SGC-7901细胞, 以不同浓度的西咪替丁处理后用MTT法检测SGC-7901细胞的增殖情况; 流式细胞术检测癌细胞周期和凋亡; Hoechst33258染色后荧光显微镜观察药物作用后癌细胞的形态变化; 透射电镜观察用药后细胞超微结构的改变; Western印记法检测Bcl-2和Bax蛋白表达.
结果: 以不同浓度的西咪替丁分别处理人胃癌SGC-7901细胞24 h和48 h, 结果发现, 在0.5, 1, 2.5, 5, 10 mmol/L时对SGC-7901细胞的增殖具有显著的抑制作用, 与对照组相比差异显著(24 h: 0.705±0.018, 0.560±0.038, 0.408±0.029, 0.276±0.042, 0.205±0.031 vs 0.803±0.012, P<0.05; 48 h: 0.902±0.024, 0.671±0.015, 0.420±0.030, 0.180±0.037, 0.0117±0.021 vs 1.079±0.040, P<0.05), 并呈时间和剂量依懒性, 而在0.25 mmol/L以下浓度对SGC-7901细胞未见明显细胞毒作用; 0.5-10 mmol/L西咪替丁作用后, 可观察到典型的细胞凋亡形态学改变; 流式细胞仪检测可见凋亡峰, G0/G1期细胞明显增多(60.83±2.27, 67.21±1.18, 75.15±4.01, 81.88±3.10, 86.99±1.43 vs 50.28±1.97, P<0.05); 西咪替丁还可下调SGC-7901细胞中的Bcl-2蛋白表达, 上调Bax蛋白表达.
结论: 西咪替丁可改变细胞周期分布, 并能通过下调Bcl-2、上调Bax蛋白表达, 诱导SGC-7901细胞凋亡, 从而抑制细胞增殖.
引文著录: 姜成钢, 李嘉斌, 徐惠绵, 于淼, 吴涛, 刘芙蓉. 西咪替丁对胃癌细胞SGC-7901增殖及凋亡的影响. 世界华人消化杂志 2007; 15(2): 118-122
Revised: October 10, 2006
Accepted: November 2, 2006
Published online: January 18, 2007
AIM: To investigate the effect of cimetidine on the proliferation and apoptosis of human gastric cancer cell line SGC-7901 and its related mechanism.
METHODS: Human gastric cancer cell SGC-7901 was cultivated by routine method, then treated with different concentrations of cimetidine. The proliferation of SGC-7901 cells was examined by MTT assay, and the cell cycle and apoptosis were detected by flow cytometry. After Hoechst33258 staining, the morphologic changes of SGC-7901 cells were observed under fluorescence microscope, and the ultrastructure of the cells was investigated by transmission electron microscopy. The levels of Bcl-2 and Bax protein expression were detected by Western blot analysis.
RESULTS: After dealing with cimetidine (0.5, 1, 2.5, 5, 10 mmol/L) for 24 and 48 hours, we found that cimetidine significantly inhibited the proliferation of SGC-7901 cells in a time- and concentration-dependent manner (24 h: 0.705 ± 0.018, 0.560 ± 0.038, 0.408 ± 0.029, 0.276 ± 0.042, 0.205 ± 0.031 vs 0.803 ± 0.012, P < 0.05; 48 h: 0.902 ± 0.024, 0.671 ± 0.015, 0.420 ± 0.030, 0.180 ± 0.037, 0.117 ± 0.021 vs 1.079 ± 0.040, P < 0.05), whereas there was no significant cytotoxic effect as the concentration was below 0.25 mmol/L. cimetidine at the concentrations of 0.5, 1, 2.5, 5, and 10 mmol/L induced typical apoptosis of SGC-7901 cells, and flow cytometry showed an apoptosis peak. The percentage of G0/G1-phase cells was significantly increased (60.83% ± 2.27%, 67.21% ± 1.18%, 75.15% ± 4.01%, 81.88% ± 3.10%, 86.99% ± 1.43% vs 50.28% ± 1.97%, P < 0.05). The expression of Bcl-2 protein was decreased while that of Bax protein was increased following cimetidine treatment.
CONCLUSION: Cimetidine may inhibit the proliferation of SGC-7901 cells through inducing cell apoptosis and cell cycle arrest.
- Citation: Jiang CG, Li JB, Xu HM, Yu M, Wu T, Liu FR. Effect of cimetidine on the proliferation and apoptosis of human gastric cancer cell line SGC-7901. Shijie Huaren Xiaohua Zazhi 2007; 15(2): 118-122
- URL: https://www.wjgnet.com/1009-3079/full/v15/i2/118.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i2.118
西咪替丁(cimetidine)是一种H2受体阻断剂, 广泛应用于胃、十二指肠溃疡及反流性食管炎的治疗. 近年来研究发现, 西咪替丁对消化系统肿瘤的治疗有良好的辅助作用. 但其作用机制尚不明确. 本研究以人胃癌细胞株SGC-7901作为体外实验模型, 观察西咪替丁对SGC-7901细胞的增殖、细胞周期分布及凋亡的影响, 以期为西咪替丁用于胃癌的临床治疗提供理论和实验依据.
胃癌细胞株SGC-7901由中国医科大学细胞生物学教研室提供. 西咪替丁、二甲基亚砜(DMSO)、碘化丙碇(PI)、Hoechst33258、Rnase、噻唑蓝(MTT)购自Sigma公司; 抗Bcl-2, Bax抗体购于Santa Cruz公司; RPMI1640培养基(Gibco BRL); 胎牛血清(天津TBD). 主要仪器: 流式细胞仪FAcscalibur, 美国BD公司、超速离心机4K15, Sigma公司、二氧化碳培养箱Thermo Forma, 美国、酶标仪Tecan, 奥地利、透射电镜HITACHI H-600, 日本、荧光显微镜Olympus IX-500, 日本、相差倒置显微镜 NIKON TMS, 日本.
1.2.1 细胞培养: 用RPMI1640培养液(含100 mL/L胎牛血清、100 kU/L青霉素、100 kU/L链霉素), 在37℃、体积分数为50 mL/L的CO2孵箱中常规培养. 2.5 g/L trypsin+0.2 g/L EDTA消化传代, 取对数生长期的细胞用于实验.
1.2.2 西咪替丁对SGC-7901细胞生长的影响: 取对数生长期的SGC-7901细胞按每孔1×104个细胞接种于96孔板中, 24 h后换液, 加入西咪替丁使其终浓度分别为1 mmol/L, 10 mmol/L, 100 mmol/L, 250 mmol/L, 500 mmol/L, 1 mmol/L, 2.5 mmol/L, 5 mmol/L, 10 mmol/L, 每个浓度每个时点均设4个平行孔及阴性对照和空白对照. CO2孵箱内继续培养24 h, 48 h. 于终止前4 h, 每孔加入MTT 20 mL(5 g/L), 振荡混匀, 继续孵育4 h后弃上清, 每孔加入150 mL DMSO轻轻振荡10 min,于490 nm波长处测定每孔A值, 计算细胞存活率. 细胞存活率 = (实验组A值/对照组A值)×100%.
1.2.3 流式细胞仪检测细胞周期分布及凋亡: 细胞培养24 h后换液, 实验组加入西咪替丁使其终浓度分别为0.25 mmol/L, 0.5 mmol/L, 1 mmol/L, 2.5 mmol/L, 5 mmol/L, 10 mmol/L, 设不加药对照组. 孵育48 h后胰酶消化收集细胞, 吹打成单细胞悬液 , PBS洗两次, 细胞计数 (细胞密度大于106/mL), 加入700 mL/L冷乙醇4℃固定24 h以上. PBS洗两次除尽乙醇, 加RnaseA至终浓度0.5 g/L, 37℃温育30 min. 4℃PI染液至终浓度50 mg/L暗室孵育1 h, 流式细胞仪检测. 以凋亡指数(APO)表示细胞凋亡情况APO = (凋亡细胞数/所测细胞数)×100%.
1.2.4 荧光染色实验: 将高压消毒的玻片置于6孔板内, 加入细胞悬液(调整细胞浓度为5×104/mL), 1 mL/孔; 置培养箱培养24 h至细胞生长旺盛, 分别加入西咪替丁, 使其终浓度分别为1 mmol/L, 5 mmol/L,10 mmol/L, 另设不含药培养液组作对照, 置培养箱中按细胞常规培养方法培养48 h. 取出盖玻片, 将盖片用PBS洗净, 加入0.5 mL固定液(甲醇∶冰醋酸 = 3∶1), 固定10 min,去固定液, 用PBS洗两次加入0.5 mL Hoechst33258(10 mg/L)染色液, 染色5 min, PBS洗两次. 紫外光激发, 荧光显微镜(×400)观察并照像.
1.2.5 透射电子显微镜观察凋亡细胞形态: 细胞培养24 h后换液, 实验组加入西咪替丁使其终浓度分别为1 mmol/L, 5 mmol/L, 10 mmol/L, 设不加药对照组. 孵育48 h后收获细胞, 2000 r/min离心10 min, 弃上清, 4℃预冷25 g/L戊二醛固定2 h, PBS洗涤, 10 g/L锇酸固定, 梯度乙醇丙酮脱水, 常规包埋、聚合、超薄切片、铅染、透射电镜观察.
1.2.6 免疫印迹法(Western blot) : 药物处理后收集悬浮及贴壁的细胞, 2000 r/min离心10 min, PBS洗2次. 裂解细胞, 以Bradford法测定细胞蛋白浓度. 将样品的蛋白浓度调整一致, 各取20 mL上样行SDS-PAGE, 电泳后转至PVDF膜上, 以50 g/L脱脂奶粉封闭后, 一抗封闭过夜, 再以辣根过氧化物酶标记的二抗封闭液封闭2 h, ECL试剂于暗室自显影. 自动电泳凝胶成像分析系统下成像分析.
统计学处理 采用SPSS12.0软件处理系统进行统计分析, 实验数据以mean±SD表示, 分析采用方差分析, 组间比较用SLD法, P<0.05为差异有显著性.
以不同浓度的西咪替丁分别处理贴壁的胃癌细胞24 h, 48 h, 结果发现在10, 5, 2.5, 1, 0.5 mmol/L浓度时胃癌细胞的生长受到明显的抑制(表1). 且其作用具有时间和剂量依懒性, 时间越长, 剂量越大, 抑制作用越明显. 在0.25 mmol/L以下浓度未见明显的细胞毒作用.
| 组别 | 24 h | 48 h | ||
| A490nm (mean±SD) | 存活率 (%) | A490nm (mean±SD) | 存活率 (%) | |
| 对照组 | 0.803±0.012 | - | 1.079±0.040 | - |
| 1 mmol/L | 0.816±0.021 | 101.6 | 1.068±0.018 | 99.0 |
| 10 mmol/L | 0.798±0.026 | 99.4 | 1.055±0.024 | 97.8 |
| 100 mmol/L | 0.781±0.029 | 97.3 | 1.046±0.027 | 96.9 |
| 0.25 mmol/L | 0.763±0.034 | 95.0 | 1.035±0.041 | 95.9 |
| 0.5 mmol/L | 0.705±0.018a | 87.8 | 0.902±0.024a | 83.6 |
| 1 mmol/L | 0.560±0.038a | 69.7 | 0.671±0.015a | 62.2 |
| 2.5 mmol/L | 0.408±0.029a | 50.8 | 0.420±0.030a | 38.9 |
| 5 mmol/L | 0.276±0.042a | 34.4 | 0.180±0.037a | 16.7 |
| 10 mmol/L | 0.205±0.031a | 25.5 | 0.117±0.021a | 10.8 |
流式细胞仪检测不同处理组的细胞周期分布, 每个样品计数2×104个细胞, 结果如表2所示. 在(0.5-10 mmol/L)浓度范围内, 西咪替丁可抑制SGC-7901从G0/G1期向S期过渡, 细胞被阻滞于G0/G1期, S期和G2/M期细胞数明显减少, 细胞分裂受到抑制. 细胞出现典型的凋亡峰, 且药物浓度越高, 凋亡细胞数量越多, 与对照组相比差异有显著性(P<0.05).
| 西咪替丁浓度(mmol/L) | 细胞周期% | 凋亡率% | ||
| G0/G1 | S | G2/M | ||
| 0 | 50.28±1.97 | 35.86±2.86 | 13.86±2.28 | 0.82±0.17 |
| 0.25 | 54.17±3.73 | 31.13±2.23 | 12.70±1.52 | 1.13±0.27 |
| 0.5 | 60.83±2.27a | 29.08±1.39a | 10.09±0.93a | 5.08±0.77a |
| 1 | 67.21±1.18a | 25.62±2.31a | 7.17±1.56a | 12.17±0.88a |
| 2.5 | 75.15±4.01a | 19.53±2.88a | 5.32±1.24a | 18.33±1.65a |
| 5 | 81.88±3.10a | 13.75±2.72a | 4.37±0.38a | 25.45±2.75a |
| 10 | 86.99±1.43a | 9.69±0.80a | 3.32±0.64a | 30.36±2.38a |
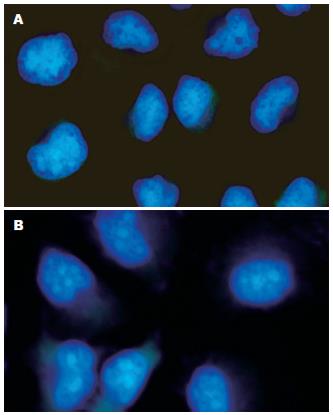
SGC-7901细胞经不同浓度西咪替丁作用48 h后, Hoechst 33258染色, 在荧光显微镜下观察, 见对照组细胞所发蓝色荧光较弱, 较均匀; 而经不同浓度西咪替丁作用48 h后的SGC-7901细胞出现核固缩, 呈致密强荧光, DNA浓缩并向核膜靠拢, 少数细胞核碎裂成块状(图1).
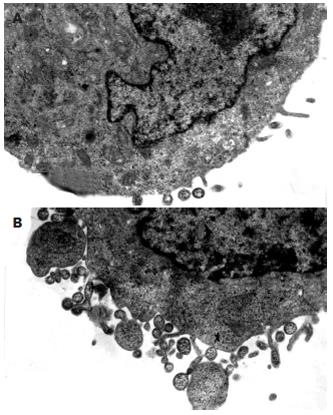
对照组细胞呈卵圆型, 细胞边缘可见少量微绒毛, 胞质内线粒体可见嵴, 粗面内质网表面可见核糖体, 细胞核可见核仁, 染色质正常. 实验组细胞边缘起泡出芽, 膨出. 可见凋亡小体, 表面有细胞膜包裹, 小体内残存细胞核及细胞器. 染色质浓缩呈团状块(图2).
胃癌是我国高发肿瘤[3-7], 其发病率在消化道肿瘤中居于第1位. 化疗的效果一直不尽如人意, 毒副作用严重, 不敏感或很快产生耐受, 寻找更加有效的治疗药物和辅助治疗手段, 乃当务之急.
西咪替丁为H2受体的特异性阻断剂, 是一种安全而有效的化学合成药. 近来研究表明, 西咪替丁可以明显提高胃肠道癌症患者的生存率[8-11]. 直至目前为止, 西咪替丁对肿瘤以及宿主作用的确切机制尚不完全明了. 有关研究认为, 其抗肿瘤的重要机制可能是通过增强免疫系统各部分功能从而起到免疫调节的作用. 具体为通过抑制T抑制性淋巴细胞(TS细胞)功能, 增强辅助性T淋巴细胞(TH细胞)产生白介素(IL-2), 以及促进天然杀伤细胞(NK细胞)活性等, 从而提高机体的免疫能力和具抗肿瘤作用[12-13], 但Rajendra et al[14]最新研究表明, 西咪替丁可直接抑制结、直肠癌细胞CaCo-2的增殖并促进其凋亡. 本研究以胃癌细胞SGC-7901为研究对象, 通过生长抑制实验发现, 西咪替丁在较低浓度(0.25 mmol/L以下)时, 并无明显细胞毒作用; 当药物浓度较高时, 其有明显的生长抑制作用, 10 mmol/L作用24 h可达到74.5%, 且随用药时间延长而增大, 10 mmol/L作用48 h可达89.2%; 其抑制作用具有时效和量效关系.
凋亡是不同于坏死的一种细胞死亡方式, 细胞凋亡在肿瘤的发生和生长过程中具有重要作用[15-16]. 为进一步探讨西咪替丁抑制SGC-7901细胞生长的机制, 本实验检测了不同浓度西咪替丁对胃癌细胞凋亡情况及细胞周期分布的影响. 通过荧光显微镜的形态学研究及透射电镜对细胞的超微结构观察, 发现了典型细胞凋亡形态学改变. 流式细胞仪检测亦可见凋亡细胞形成的亚G1峰, 其凋亡率与药物浓度成正比. 而在较低浓度0.25 mmol/L时, 其并无明显的诱导凋亡作用, 提示呈剂量依懒性诱导细胞凋亡, 从而抑制细胞生长. 流式细胞仪检查发现, 西咪替丁也使细胞周期分布发生明显变化. 西咪替丁作用48 h后, G0/G1期细胞增加, S期和G2/M期细胞减少. 细胞阻滞于G0/G1期而使细胞周期进程受阻, 影响细胞有丝分裂, 从而抑制细胞生长. 推测西咪替丁可能通过诱导凋亡, 影响细胞周期进程来抑制细胞增殖.
Bcl-2和Bax是调控细胞凋亡的一对基因, Bax是编码Bcl-2相关蛋白X的基因, Bax蛋白与Bcl-2蛋白大约有21%的同源性, 具有对抗Bcl-2蛋白抑制细胞凋亡的作用. 目前, 关于西咪替丁促凋亡机制的研究较少. 本研究从西咪替丁对细胞凋亡相关基因Bcl-2和Bax的调控角度探讨了其作用机制. 结果发现, 西咪替丁可下调Bcl-2蛋白表达, 同时上调Bax蛋白表达. 表明西咪替丁可能通过下调Bcl-2蛋白表达, 上调Bax蛋白表达以诱导胃癌细胞凋亡. 因此我们认为, 西咪替丁可改变细胞周期分布, 并可能通过下调Bcl-2、上调Bax蛋白表达, 诱导SGC-7901细胞凋亡, 从而抑制细胞增殖. 该结果为临床应用西咪替丁治疗胃癌提供了实验和理论依据. 但所需治疗药物浓度以及在体治疗效果, 有待动物实验及临床实验进一步证明.
胃癌是我国最常见的消化道肿瘤, 其死亡率位于各种恶性肿瘤前列. 化疗的效果一直不尽如人意, 毒副作用严重, 不敏感或很快产生耐受, 寻找更加有效的治疗药物和辅助治疗手段具有重要意义.
西咪替丁为H2受体的特异性阻断剂, 是一种安全而有效的化学合成药. 近来研究表明, 西咪替丁可以明显提高胃肠道癌症患者的生存率, 直至目前为止, 西咪替丁对肿瘤以及宿主作用的确切机制尚不完全明了, 急需解决.
本文从西咪替丁对细胞凋亡相关基因Bcl-2和Bax的调控角度进一步探讨了其作用机制, 揭示了西咪替丁可能通过下调Bcl-2蛋白表达, 上调Bax蛋白表达, 诱导SGC-7901细胞凋亡, 从而抑制细胞增殖.
本文从西咪替丁抑制肿瘤细胞增殖, 诱导细胞凋亡的角度为临床应用西咪替丁治疗胃癌提供了实验和理论依据, 但所需治疗药物浓度以及在体治疗效果, 有待动物实验及临床实验进一步证明.
尽管已有研究报道了西咪替丁对胃癌细胞MKN45生长和凋亡的影响, 但鉴于本文选用的细胞系不同, 故仍有参考价值.
电编: 李琪 编辑: 王晓瑜
| 1. | Adams JM, Cory S. The Bcl-2 protein family: arbiters of cell survival. Science. 1998;281:1322-1326. [PubMed] [DOI] |
| 2. | Chou RH, Huang H. Restoration of p53 tumor suppressor pathway in human cervical carcinoma cells by sodium arsenite. Biochem Biophys Res Commun. 2002;293:298-306. [PubMed] [DOI] |
| 3. | Sun L, Wang X. Effects of allicin on both telomerase activity and apoptosis in gastric cancer SGC-7901 cells. World J Gastroenterol. 2003;9:1930-1934. [PubMed] [DOI] |
| 4. | Zhao GH, Li TC, Shi LH, Xia YB, Lu LM, Huang WB, Sun HL, Zhang YS. Relationship between inactivation of p16 gene and gastric carcinoma. World J Gastroenterol. 2003;9:905-909. [PubMed] [DOI] |
| 5. | Zhao XH, Gu SZ, Liu SX, Pan BR. Expression of estrogen receptor and estrogen receptor messenger RNA in gastric carcinoma tissues. World J Gastroenterol. 2003;9:665-669. [PubMed] [DOI] |
| 6. | Ding YB, Chen GY, Xia JG, Zang XW, Yang HY, Yang L. Association of VCAM-1 overexpression with oncogenesis, tumor angiogenesis and metastasis of gastric carcinoma. World J Gastroenterol. 2003;9:1409-1414. [PubMed] [DOI] |
| 7. | Li HX, Chang XM, Song ZJ, He SX. Correlation between expression of cyclooxygenase-2 and angiogenesis in human gastric adenocarcinoma. World J Gastroenterol. 2003;9:674-677. [PubMed] [DOI] |
| 8. | Tønnesen H, Knigge U, Bülow S, Damm P, Fischerman K, Hesselfeldt P, Hjortrup A, Pedersen IK, Pedersen VM, Siemssen OJ. Effect of cimetidine on survival after gastric cancer. Lancet. 1988;2:990-992. [PubMed] [DOI] |
| 9. | Matsumoto S. Cimetidine and survival with colorectal cancer. Lancet. 1995;346:115. [PubMed] [DOI] |
| 10. | Svendsen LB, Ross C, Knigge U, Frederiksen HJ, Graversen P, Kjaergård J, Luke M, Stimpel H, Sparsø BH. Cimetidine as an adjuvant treatment in colorectal cancer. A double-blind, randomized pilot study. Dis Colon Rectum. 1995;38:514-518. [PubMed] [DOI] |
| 11. | Matsumoto S, Imaeda Y, Umemoto S, Kobayashi K, Suzuki H, Okamoto T. Cimetidine increases survival of colorectal cancer patients with high levels of sialyl Lewis-X and sialyl Lewis-A epitope expression on tumour cells. Br J Cancer. 2002;86:161-167. [PubMed] [DOI] |
| 12. | Watson SA, Wilkinson LJ, Robertson JF, Hardcastle JD. Effect of histamine on the growth of human gastrointestinal tumours: reversal by cimetidine. Gut. 1993;34:1091-1096. [PubMed] [DOI] |
| 13. | Hahm KB, Kim WH, Lee SI, Kang JK, Park IS. Comparison of immunomodulative effects of the histamine-2 receptor antagonists cimetidine, ranitidine, and famotidine on peripheral blood mononuclear cells in gastric cancer patients. Scand J Gastroenterol. 1995;30:265-271. [PubMed] [DOI] |
| 14. | Rajendra S, Mulcahy H, Patchett S, Kumar P. The effect of H2 antagonists on proliferation and apoptosis in human colorectal cancer cell lines. Dig Dis Sci. 2004;49:1634-1640. [PubMed] [DOI] |
| 15. | LaCasse EC, Baird S, Korneluk RG, MacKenzie AE. The inhibitors of apoptosis (IAPs) and their emerging role in cancer. Oncogene. 1998;17:3247-3259. [PubMed] [DOI] |
| 16. | Solary E, Dubrez L, Eymin B. The role of apoptosis in the pathogenesis and treatment of diseases. Eur Respir J. 1996;9:1293-1305. [PubMed] [DOI] |