修回日期: 2007-03-01
接受日期: 2007-03-23
在线出版日期: 2007-06-18
目的: 探讨IκB激酶β(inhibit kappa B kinase beta, IKKβ)在非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)大鼠肝组织中的表达及意义.
方法: 健康♂Wistar大鼠40只, 随机分为正常对照组(n = 20)和高脂模型组(n = 20), 分别给予标准饲料喂养和高脂饲料喂养. 16 wk末空腹处死全部大鼠, 收集血清和肝组织标本. 检测血清中ALT、AST及ELISA法检测血清TNF-α水平; 光镜下观察肝组织病理变化; RT-PCR和EMSA法分别检测肝组织IKKβ mRNA表达和核因子-κB(NF-κB)活性改变.
结果: 模型组大鼠血清ALT、AST、TNF-α水平、肝组织IKKβ mRNA表达及NF-κB活性均较正常对照组明显增强(96.63±14.2 U/L vs 39.50±12.2 U/L, 156.13±14.7 U/L vs 71.25±14.4 U/L, 48.23±3.4 U/L vs 6.74±1.3 U/L, 0.85±0.03 vs 0.22±0.02, 10.12±1.34 vs 1.58±1.23, P<0.01); 病理则表现不同程度的脂肪变性、炎症、坏死及窦周纤维化与对照组相比有显著差异(25.63±7.21 vs 1.24±3.24, 3.21±0.52 vs 0.49±0.36, 6.26±1.86 vs 3.02±1.17, P<0.01). 相关分析显示: 肝组织IKKβ mRNA的表达与NF-κB活性(r = 0.930)、脂肪变性(r = 0.681)和炎症坏死程度(r = 0.864)以及血清TNF-α水平(r = 0.762)正相关(P<0.05).
结论: IKKβ mRNA表达增加在NASH发病机制中发挥重要作用, 其通过介导NF-κB活化, 引起TNF-α的大量生成、释放, 诱导加重NASH的发生发展.
引文著录: 赵彩彦, 王亚东, 周俊英. IκB激酶β在非酒精性脂肪性肝炎发病机制中的作用. 世界华人消化杂志 2007; 15(17): 1881-1886
Revised: March 1, 2007
Accepted: March 23, 2007
Published online: June 18, 2007
AIM: To investigate the expression and significance of the inhibitor kappa B kinase beta (IKKβ) in livers of rats with non-alcoholic steatohepatitis (NASH).
METHODS: Forty healthy male Wistar rats were randomly divided into two equal groups. Rats in the normal control group were fed a standard diet, while the others in the model group were fed a fat-rich diet that consisted of 10% lard + 2% cholesterol + 5% corn oil + 83% standard diet. At the end of the 16th wk of the experiment all rats were sacrificed and serum and hepatic tissue were collected. Concentrations of alanine aminotransferase (ALT), aspartate aminotransferase (AST) were examined and the concentration of tumor necrosis factor alpha (TNF-α) in serum was measured by enzyme-linked immunosorbent assay (ELISA). Histological characters were observed by HE, Sudan IV, and Masson staining under microscopy. The expression of IKKβ mRNA and the binding activity of nuclear factor-kappa B (NF-κB) were determined by reverse transcription-polymerase chain reaction (RT-PCR) and electrophoretic mobility shift assay (EMSA), respectively.
RESULTS: Serum concentrations of ALT, AST and TNF-α in the model group were significantly increased (96.63 ± 14.2 U/L vs 39.50 ± 12.2 U/L, 156.13 ± 14.7 U/L vs 71.25 ± 14.4 U/L, 48.23 ± 3.4 U/L vs 6.74 ± 1.3 U/L, P < 0.01). The expression of IKKβ mRNA and the binding activity of NF-κB of rats in the NASH group were obviously higher than those in the normal control group (0.85 ± 0.03 vs 0.22 ± 0.02, 10.12 ± 1.34 vs 1.58 ± 1.23, P < 0.01). Steatosis, inflammation and fibrosis were present to different extents in the livers of rats with NASH (25.63 ± 7.21 vs 1.24 ± 3.24, 3.21 ± 0.52 vs 0.49 ± 0.36, 6.26 ± 1.86 vs 3.02 ± 1.17, P < 0.01). Further, the expression of IKKβ mRNA in hepatic tissue (r = 0.681) correlated positively with the binding activity of NF-κB (r = 0.864), the extent of steatosis (r = 0.930), inflammation and TNF-α levels (r = 0.762) in serum of the model group.
CONCLUSION: Increasing expression of IKKβ mRNA may have an important role in the pathogenesis of NASH by inducing activation of NF-κB and promoting production of TNF-α, thus contributing to the development of NASH.
- Citation: Zhao CY, Wang YD, Zhou JY. Role of the kappa B kinase beta inhibitor in the pathogenesis of nonalcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(17): 1881-1886
- URL: https://www.wjgnet.com/1009-3079/full/v15/i17/1881.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i17.1881
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)是以肝细胞脂肪沉积、小叶内炎症伴气球样变性为特征, 可伴Mallory小体和不同程度纤维化的一类遗传-环境-代谢应激相关性疾病, 为单纯性脂肪肝进展到脂肪性肝硬化的中间病理过程, 常合并于肥胖、糖尿病、高脂血症患者. 随着生活水平的提高和生活方式的改变, NASH已成为严重威胁人们身心健康的常见疾病[1-3].
IκB激酶β(inhibit kappa B kinase beta, IKKβ)复合物属丝氨酸/苏氨酸(Ser/Thr)蛋白激酶超家族成员, 主要包括IKKα, IKKβ和IKKγ 3个亚单位[4]. 其中IKKβ是促炎因子激活核因子κB(nuclear factor-kappa B, NF-κB)所必需的催化亚单位, 参与抗凋亡及炎症相关基因的调控[5-8]. 脂多糖(lipopolysaccharide, LPS)、肿瘤坏死因α(tumor necrosis factor alpha, TNF-α)等可通过多种信号途径活化IKKβ, 使下游NF-κB抑制因子(inhibitor nuclear factor-kappa B, IκB)特异位点丝氨酸磷酸化而降解, 继而NF-κB与之解离活化, 易位核内, 启动相关炎症介质基因转录[8-12]. 本文旨在探讨IKKβ和NF-κB在NASH大鼠肝脏中的表达变化及其机制, 进一步明确其在NASH发病中的作用, 为阐明NASH的发病机制提供理论基础.
健康♂Wistar大鼠40只, 体质量140±10 g, 由河北医科大学动物实验中心提供; IKKβ基因扩增引物、β-肌动蛋白(β-actin): 北京奥科生物工程有限公司; AMV反转录酶、Taq DNA聚合酶、NF-κB寡核苷酸、EMSA试剂盒: 美国Promega公司; 丙稀酰胺、N, N亚甲基双丙稀酰胺、DTT、PMSF、Hepes、精胺、亚精胺、NP-40、Aprotinin: 美国Sigma公司; [γ-32P] ATP: 北京福瑞生物工程公司; TNF-α ELISA试剂盒: 北京中山试剂公司; 过硫酸铵、EDTA、Tris等为国产分析纯试剂.
1.2.1 动物分组与标本制备: 40只Wistar大鼠, 标准饲料适应喂养1 wk后, 随机分为2组: 正常对照组20只, 标准饲料喂养; 模型组20只, 高脂饲料喂养, 即在标准饲料基础上2%胆固醇+10%猪油+5%玉米油[13-14]. 16 wk末, 禁食12 h后, 股静脉放血处死全部大鼠, 4℃离心分离血清, 检测丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)和TNF-α水平; 迅速分离肝脏并称质量, 计算肝脏湿质量/体质量×100%, 即为肝指数. 肝右叶中部快速切取两块肝组织, 40 g/L甲醛固定, 石蜡包埋、切片, 用于病理染色观察; 余肝组织置液氮速冻后, -80℃冰箱保存, 用于总RNA及核蛋白提取.
1.2.2 普通光镜下病理观察: HE染色观察肝组织炎症、坏死; SudanⅣ染色观察肝细胞脂肪变性, 以胞质中出现红色颗粒为阳性; Masson三重染色观察肝组织纤维化, 绿染部分为胶原纤维. 多功能病理图像分析仪测定脂变和胶原纤维面积, 每张切片选取四周及中央5个区域, 10倍物镜下计算平均面积密度(阳性面积与统计场面积百分比). 炎症活动度积分标准分为汇管区炎症(P)、小叶内炎症(L)、碎屑样坏死(PN)、桥接坏死(BN)4项, 每项根据病变程度分计1-4分, 按P+L+2PN+2BN公式计算总积分[15]. 以上均由富有经验的病理科医师双盲观察并评分.
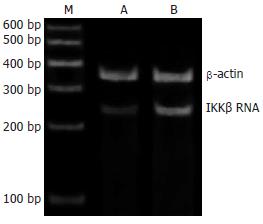
1.2.3 逆转录聚合酶链反应(RT-PCR)检测IKKβ mRNA的表达: 采用TRIzol一步法试剂盒提取肝组织总RNA, 逆转录合成cDNA模板, 在Taq DNA聚合酶作用下扩增IKKβ基因片段, 以β-actin为内参照. 引物序列及PCR反应参数如下(表1).
| 目的基因 | 引物序列(5'-3') | 扩增长度(bp) | 退火温度(℃) | 循环次数 |
| IKKβ | 上游 AGC TCT GGA ACC TCC TGA AGA | 246 | 60℃ | 30 |
| 下游 AGC TCC AGT CTA GGG TCG TGA | ||||
| β-actin | 上游 TGG AAT CCT GTG GCA TCC ATG AAA C | 348 | 55℃ | 29 |
| 下游 TAA AAC GCA GCT CAG TAA CAG TCC G |
PCR产物在80 g/L聚丙烯酰胺凝胶上80 V恒压电泳2 h, 0.5 mg/L溴化乙啶溶液中染色10 min, 应用BIO-PROFIF图像分析系统进行吸光度扫描, 以IKKβ/β-actin的比值计算IKKβ mRNA相对表达量.
1.2.4 肝组织核蛋白的提取: 参考文献[16]稍加改变. 肝组织匀浆、过滤, 收集细胞悬液, 4℃ 1850 g离心5 min, 弃上清. 快速将细胞沉淀重悬于5倍体积冷PBS缓冲液A中(mmol/L: Hepes-KOH 10, KCl 10, MgCl2 1.5, DTT 0.5, PMSF 0.5, 精胺0.15, 亚精胺0.5, 6 mL/L NP-40, pH 7.9), 混匀, 4℃ 1850 g离心10 min, 弃上清. 将细胞沉淀重悬于3倍体积冷PBS缓冲液B中(mmol/L: Hepes-KOH 10, KCl 10, MgCl2 1.5, DTT 0.5, PMSF 0.5, 精胺0.15, 亚精胺0.5, aprotinin14 mg/L, pH 7.9), 冰浴10 min, 期间上下匀浆15次, 4℃ 2500 g离心15 min, 弃上清.用2/3体积的缓冲液C(mmol/L: Hepes-KOH 20, KCl 10, MgCl2 1.5, DTT 0.2, PMSF 0.5, EDTA 0.2, aprotinin14 mg/L, 200 mL/L glycerol, pH 7.9)重悬细胞核沉淀, 上下匀浆10次, 同时加入缓冲液D(mmol/L: Hepes-KOH 20, NaCl 0.33, MgCl2 1.5, DTT 0.5, PMSF 0.5, EDTA 0.5, 14 mg/L aprotinin, 100 mL/L glycerol, pH 7.9) 震荡冰浴1 h.4℃ 10 000 g离心30 min, 收集上清, 紫外分光光度法测定蛋白质浓度, 分装-80℃保存.
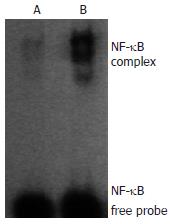
1.2.5 电泳迁移率改变分析(EMSA)检测NF-κB活性: 方法参照试剂盒说明书进行: 取1.75 μmol /L未标记的双链NF-κB寡核苷酸探针(5'-AGT TGA GGG GAC TTT CCC AGG C-3'; 3'-TCA ACT CCC CTG AAA GGG TCC G-5')2 μL, T4多核苷酸激酶1 μL, [γ-32P] ATP(0.37 GBq/mL)1 μL进行标记. 然后将核蛋白提取物25 μg置于10 μL凝胶滞留结合缓冲液中, 37℃孵育 10 min, 加入1 μL已标记的寡核苷酸探针, 37℃孵育30 min, 60 g/L非变性聚丙烯酰胺凝胶80 V电泳2 h. 真空干燥后压片, -80℃放射自显影72 h, 洗片后应用法国BIO-PROFIL图像分析系统进行扫描, 测量显色阳性区及背景阴性区的平均灰度值.
统计学处理 计量资料以mean±SD表示, 采用SPSS12.0统计软件处理所有数据, 两样本均数比较采用成组设计t检验, 方差不齐时采用t检验. 直线相关分析法进行相关性分析, 双侧P<0.05为有统计学差异, 双侧P<0.01为有显著统计学差异.
各组大鼠起始体质量无差别, 正常组大鼠活泼, 皮毛光滑, 体质量逐渐增加; 而高脂饲料喂养大鼠体质量增长迅速, 温顺, 不喜动且皮毛发黄, 蓬乱不顺滑. 实验结束时, 模型组大鼠体质量较正常组超质量20%以上, 肝质量、肝指数以及血清中ALT, AST, TNF-α含量均显著升高(P<0.01), 且TNF-α水平与肝脏炎症坏死程度呈正相关(r = 0.702, 表2).
正常组大鼠肝色鲜红, 边缘锐利, 明亮光泽; 模型组大鼠肝脏体积明显增大, 颜色呈浅黄、土黄色或红黄相间, 质软缘钝, 切面油腻感明显. 镜下正常组大鼠肝细胞正常, 小叶结构清晰, 肝细胞索排列整齐; 而模型组大鼠肝细胞浊肿、出现小泡性或大、小泡混合性脂肪变, 偶见Mallory小体, 点灶状或碎屑样坏死, 肝窦狭窄, 细胞病变以小叶三区为著, 汇管区扩大、伴枯否细胞增生及大量炎性细胞浸润, 并可见窦周及中央静脉周围纤维化(表3).
与正常组相比, 模型大鼠肝组织IKKβ mRNA表达及NF-κB活性显著增强(P<0.01); 进一步相关分析表明, IKKβ mRNA在模型组肝组织的表达与肝组织的脂肪变性、炎症坏死程度、NF-κB活性以及血清TNF-α水平均呈正相关(r值分别为0.681, 0.864, 0.930, 0.762)(表3, 图1, 图2).
目前, NASH确切发病机制尚未完全阐明, 最为成熟的"二次打击"学说[17]认为, 胰岛素抵抗(insulin resistance, IR)是NASH发病的中心环节[18], 一方面使得胰岛素抑制脂解的作用减弱, 促进肝脏脂质积聚, 引发肝细胞脂肪变性; 另一方面, IR还可诱发氧化应激、促进活性氧生成, 诱导肝内炎症细胞因子的产生、释放, 引发肝脏炎性损伤[19], 而抑制IR可显著降低肝组织脂肪变性及炎性损伤[20]. 众所周知, NF-κB是体内广泛存在的对氧化应激敏感的一种重要前炎症介质基因核转录因子, 在正常情况下, 其抑制蛋白IκB结合成无活性的二聚体, 存在于胞质中, 参与维持细胞生长、抗凋亡等生理功能. 在病理状态下, 内毒素、氧化应激和脂质过氧化等因素可激活NF-κB引发TNF-α, IL-1, IL-6等炎症细胞因子产生增加, 从而启动和扩大炎症反应, 最终导致脂肪性肝炎的形成[21-22], 但具体信号转导机制尚未明确.
研究表明, IκB激酶β存在于大多数细胞胞质中, 在肝细胞中亦有表达, 参与介导肝组织的炎症坏死, 同时IKKβ活化参与介导NASH中IR的形成[23-25]. 氧化应激、LPS、TNF-α等可通过G蛋白以及丝裂原激活的蛋白激酶(MAPK)信号通路激活IKKβ, 使IκBα磷酸化降解, NF-κB解离, 发生核易位[26-28], 与DNA上的特异靶基因结合, 调控IL-1、TNF-α等细胞因子、黏附分子和炎症相关的酶及蛋白质的表达, 启动和扩大炎症反应[6,21,29]. TNF-α的大量释放不仅直接诱导肝脏炎症损伤, 还可反馈加强IKKβ活化, 形成IKKβ-TNF-α恶性循环, 这一自身放大的瀑布效应进一步促进胰岛素受体底物(IRS)信号转导障碍、脂质过氧化及活性氧增加、线粒体解耦联蛋白-2表达上调以及三磷酸腺苷储备减低等机制, 诱导IR发生[30]. 此外, IKKβ还可通过活化NF-κB, 促进转位调节相关基因的表达而加重IR, 最终从不同环节促进脂肪性肝炎的发生发展[31].
本研究显示, 高脂饲料喂养可成功复制大鼠NASH模型, NASH大鼠肝组织IKKβ mRNA表达、NF-κB活性以及血清中TNF-α、氨基转移酶水平均显著增高, 说明高脂饮食可以引发肝细胞脂质积聚, 通过氧化应激、活化IKKβ等途径导致IR, 为NASH的发生提供基础.同时活化的IKKβ还可通过Iκβ/NF-κB信号通路诱导TNF-α等炎症介质的大量释放, 引发炎症瀑布效应, 这与王磊 et al[32]在急性肝损伤中研究发现一致. 这一实验结果证实了IKKβ作为NF-κB上游始动信号, 通过活化NF-κB介导NASH肝组织炎症损伤的病理生理过程, 为阐明NASH发病机制以及今后的有效治疗提供了理论基础.
目前认为, IKKβ核因子-κB抑制蛋白上游激酶, NF-κB活化所必需的催化亚单位, 其通过活化NF-κB, 诱导其核移位, 促进炎症介质基因的表达, 参与机体炎症反应. 同时, 有学者研究表明, 过度活化的IKKβ参与机体胰岛素抵抗(IR), 故此, 可以推测IKKβ可以通过不同途径参与脂肪性肝炎的形成, 但目前其在NASH炎症损伤中的作用机制国内尚无报道.
本文通过RT-PCR及EMSA方法观察NASH大鼠IKKβ及NF-κB表达变化, 探讨其在NASH发病中的作用机制, 为今后NASH的有效治疗提供理论基础, 有重要学术价值.
编辑: 王晓瑜 电编:郭海丽
| 1. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] |
| 2. | Sugden MC, Bulmer K, Gibbons GF, Knight BL, Holness MJ. Peroxisome-proliferator-activated receptor-alpha (PPARalpha) deficiency leads to dysregulation of hepatic lipid and carbohydrate metabolism by fatty acids and insulin. Biochem J. 2002;364:361-368. [PubMed] |
| 3. | Assy N, Bekirov I, Mejritsky Y, Solomon L, Szvalb S, Hussein O. Association between thrombotic risk factors and extent of fibrosis in patients with non-alcoholic fatty liver diseases. World J Gastroenterol. 2005;11:5834-5839. [PubMed] |
| 4. | Chen ZJ, Parent L, Maniatis T. Site-specific phosphorylation of IkappaBalpha by a novel ubiquitination-dependent protein kinase activity. Cell. 1996;84:853-862. [PubMed] |
| 5. | Li Q, Van Antwerp D, Mercurio F, Lee KF, Verma IM. Severe liver degeneration in mice lacking the IkappaB kinase 2 gene. Science. 1999;284:321-325. [PubMed] |
| 6. | May MJ, Ghosh S. IkappaB kinases: kinsmen with different crafts. Science. 1999;284:271-273. [PubMed] |
| 7. | Sizemore N, Lerner N, Dombrowski N, Sakurai H, Stark GR. Distinct roles of the Ikappa B kinase alpha and beta subunits in liberating nuclear factor kappa B (NF-kappa B) from Ikappa B and in phosphorylating the p65 subunit of NF-kappa B. J Biol Chem. 2002;277:3863-3869. [PubMed] |
| 8. | Huber MA, Denk A, Peter RU, Weber L, Kraut N, Wirth T. The IKK-2/Ikappa Balpha /NF-kappa B pathway plays a key role in the regulation of CCR3 and eotaxin-1 in fibroblasts. A critical link to dermatitis in Ikappa Balpha -deficient mice. J Biol Chem. 2002;277:1268-1275. [PubMed] |
| 9. | Guha M, Mackman N. LPS induction of gene expression in human monocytes. Cell Signal. 2001;13:85-94. [PubMed] |
| 10. | Lye E, Mirtsos C, Suzuki N, Suzuki S, Yeh WC. The role of interleukin 1 receptor-associated kinase-4 (IRAK-4) kinase activity in IRAK-4-mediated signaling. J Biol Chem. 2004;279:40653-40658. [PubMed] |
| 11. | 张 宇, 蒋 建新, 王 正国, 朱 佩芳, 吉 善和, 单 佑安, 周 继红. ERK1/2信号通路在小鼠库普弗细胞-内毒素反应中的活化规律及其作用. 中华创伤杂志. 2002;18:364-366. |
| 12. | 刘 兴, 冯 文莉, 康 格非. 脂多糖受体的研究进展. 国外医学(临床生物化学与检验学分册). 2001;22:134-135, 137. |
| 14. | Lieber CS, Leo MA, Mak KM, Xu Y, Cao Q, Ren C, Ponomarenko A, DeCarli LM. Model of nonalcoholic steatohepatitis. Am J Clin Nutr. 2004;79:502-509. [PubMed] |
| 16. | Schreiber E, Matthias P, Muller MM, Schaffner W. Rapid detection of octamer binding proteins with 'mini-extracts', prepared from a small number of cells. Nucleic Acids Res. 1989;17:6419. [PubMed] |
| 17. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] |
| 18. | Te Sligte K, Bourass I, Sels JP, Driessen A, Stockbrugger RW, Koek GH. Non-alcoholic steatohepatitis: review of a growing medical problem. Eur J Intern Med. 2004;15:10-21. [PubMed] |
| 20. | Zhao CY, Jiang LL, Li L, Deng ZJ, Liang BL, Li JM. Peroxisome proliferator activated receptor-gamma in pathogenesis of experimental fatty liver disease. World J Gastroenterol. 2004;10:1329-1332. [PubMed] |
| 21. | Mehta K, Van Thiel DH, Shah N, Mobarhan S. Nonalcoholic fatty liver disease: pathogenesis and the role of antioxidants. Nutr Rev. 2002;60:289-293. [PubMed] |
| 23. | Lentsch AB. Activation and function of hepatocyte NF-kappaB in postischemic liver injury. Hepatology. 2005;42:216-218. [PubMed] |
| 24. | Yuan M, Konstantopoulos N, Lee J, Hansen L, Li ZW, Karin M, Shoelson SE. Reversal of obesity- and diet-induced insulin resistance with salicylates or targeted disruption of Ikkbeta. Science. 2001;293:1673-1677. [PubMed] |
| 25. | Hirosumi J, Tuncman G, Chang L, Gorgun CZ, Uysal KT, Maeda K, Karin M, Hotamisligil GS. A central role for JNK in obesity and insulin resistance. Nature. 2002;420:333-336. [PubMed] |
| 27. | Delhase M, Hayakawa M, Chen Y, Karin M. Positive and negative regulation of IkappaB kinase activity through IKKbeta subunit phosphorylation. Science. 1999;284:309-313. [PubMed] |
| 28. | Fischer C, Page S, Weber M, Eisele T, Neumeier D, Brand K. Differential effects of lipopolysaccharide and tumor necrosis factor on monocytic IkappaB kinase signalsome activation and IkappaB proteolysis. J Biol Chem. 1999;274:24625-24632. [PubMed] |
| 29. | May MJ, Ghosh S. Signal transduction through NF-kappa B. Immunol Today. 1998;19:80-88. [PubMed] |
| 30. | Choudhury J, Sanyal AJ. Insulin resistance and the pathogenesis of nonalcoholic fatty liver disease. Clin Liver Dis. 2004;8:575-594. [PubMed] |