修回日期: 2007-03-19
接受日期: 2007-03-23
在线出版日期: 2007-06-08
目的: 探讨胰岛素抵抗在非酒精性脂肪性肝发病中的作用及机制, 观察二甲双胍对高脂饲养大鼠肝脏脂肪变的干预效果.
方法: 21只♂Wistar大鼠分为3组, 每组7只, 普通饮食组(SD), 高脂饮食组(HF), 二甲双胍组(HF-Met)在高脂饮食的同时给予二甲双胍, 共8 wk. 8 wk末处死大鼠, 称量附睾脂肪, 计算肝指数, 生化方法测定ALT、AST、TG、TC 、FFA、SOD和MDA. 放免法测定空腹胰岛素, 逆转录聚合酶链反应(RT-PCR)和ELISA法检测肝脏TNF-α mRNA和蛋白的表达, 用葡萄糖输注率(GIR)来评价胰岛素敏感性, 并观察肝组织病理变化.
结果: 与HF相比, HF-Met肝细胞脂肪变和小叶炎症明显减轻, 肝指数、胰岛素、AST、ALT、TG、FFA显著下降(3.25±0.26 vs 4.29±0.12, 33.37±8.34 vs 46.73±5.24, 17.29±5.34 vs 43.48±6.21, 4.10±2.47 vs 12.05±4.05, P<0.01; 106.0±31.04 vs 141.37±24.87, 48.31±16.11 vs 88.34±21.94, P<0.05)TNF-α的表达也显著下降, GIR增加(7.58±1.05 vs 6.31±1.28, P<0.05).
结论: 二甲双胍干预能明显改善高脂饲养大鼠的胰岛素抵抗, 降低肝脏TG、FFA和TNF-α的表达, 减轻肝脏脂肪变的程度, 提示胰岛素增敏治疗可能是NAFLD防治的一种积极策略.
引文著录: 陈世清, 黎华, 刘杞. 二甲双胍对高脂饲养大鼠肝脏脂肪变的干预作用. 世界华人消化杂志 2007; 15(16): 1810-1814
Revised: March 19, 2007
Accepted: March 23, 2007
Published online: June 8, 2007
AIM: To investigate the role and mechanism of insulin resistance in nonalcoholic fatty liver disease (NAFLD), and to evaluate the intervening effects of metformin (Met) on rats with hepatic steatosis induced by feeding a high fat diet.
METHODS: Twenty-one male Wistar rats were randomly divided into three equal groups. Rats in standard chow group (SD) were fed normal food, those in the high fat diet group (HF) had a high fat diet, and rats in the HF-Met group were fed a high fat diet but gavaged with Met for 8 wk. Rats were sacrificed at the end of 8 wk to weigh epididymal fat and calculate the liver index. Levels of ALT, AST, insulin, TG, TC, FFA, SOD, and MDA were detected by biochemistry, and fasting insulin by radioimmunoassay. mRNA and protein expression of hepatic TNF-α were detected by reverse-transcriptase polymerase chain reaction (RT-PCR) and Enzyme linked immunosorbent assay (ELISA), respectively. Insulin sensitivity was measured with Glucose Infusion Rate (GIR) by the euglycermic hyperinsulinemia clamp technique. Assessments of steatosis and inflammatory activity in all rats were scored under light a microscope.
RESULTS: Notable steatosis and lobular inflammatory activities were more decreased in HF-Met than those in HF. The liver index, insulin, and levels of AST, ALT, TG and FFA were significantly decreased in HF-Met compared with those in HF (3.25 ± 0.26 vs 4.29 ± 0.12, 33.37 ± 8.34 vs 46.73 ± 5.24, 17.29 ± 5.34 vs 43.48 ± 6.21, 4.10 ± 2.47 vs 12.05 ± 4.05, P < 0.01; 106.0 ± 31.04 vs 141.37 ± 24.87, 48.31 ± 16.11 vs 88.34 ± 21.94, P < 0.05) TNF-α expression also decreased, while GIR increased (7.58 ± 1.05 vs 6.31 ± 1.28, P < 0.05).
CONCLUSION: Metformin intervention can markedly improve insulin resistance induced by a high fat diet, decrease the levels of hepatic TG, FFA and TNF-α expression, while lessen hepatic steatosis, suggesting that it could be an active strategy to enhance insulin sensitivity in NAFLD.
- Citation: Chen SQ, Li H, Liu Q. Effects of metformin on hepatic steatosis induced in rats fed a high fat diet. Shijie Huaren Xiaohua Zazhi 2007; 15(16): 1810-1814
- URL: https://www.wjgnet.com/1009-3079/full/v15/i16/1810.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i16.1810
非酒精性脂肪肝病(NAFLD)发病率逐年升高, 起病渐趋低龄化, 已成为严重影响人类健康的主要慢性肝病, 但其发病机制尚不清楚, 直接影响了对该病的有效治疗. 近年研究发现, NAFLD与胰岛素抵抗密切相关, 胰岛素抵抗是NAFLD的重要特征[1]. 研究显示[2], 高脂饲养的大鼠可产生明显的胰岛素抵抗. 为了研究胰岛素抵抗对脂肪肝形成和发展的影响, 设想在胰岛素抵抗产生和肝脏脂质聚积的初始阶段, 给予胰岛素增敏治疗, 提升机体对胰岛素的敏感性, 降低高胰岛素血症及随之导致的脂代谢紊乱和细胞因子的异常, 有可能减轻或改善肝脏的脂肪变、炎症和坏死, 为NAFLD防治提供新的选择. 二甲双胍作为抗糖尿病药物, 具有胰岛素增敏作用, 可调节脂质代谢和脂肪细胞因子在肝脏中的表达[3], 我们通过二甲双胍对高脂饲养大鼠的干预处理, 来探讨胰岛素抵抗在NAFLD发病中的作用及可能的机制.
♂Wistar大鼠21只, 体质量170-190 g, 鼠龄4-6 wk, 分笼饲养在温度为22℃-28℃动物室中, 明暗周期为12 h(6 am-6 pm), 实验前适应性饲养1 wk, 天黑前投食, 自由饮水. 大鼠能量供给每天为320 kJ/只, 并且观察大鼠摄食量的变化. 高速低温离心机(Beckman公司), PCR扩增仪(Eppendorf公司), DU® series600全波长分光光度计(Beckman公司), GENEGENIUS成像仪(Gene公司), GENEGNOME化学发光仪(Gene公司). 水平电泳槽、电泳仪(北京六一仪器厂), 光学显微镜(XSZ-G)(重庆光学仪器厂). RT-PCR试剂盒(Promega公司), RNeasy Mini Kit(Qiagene公司), 核酸分子标准物(Mbi公司). 盐酸二甲双胍为中美上海施贵宝制药有限公司产品.
大鼠随机分为普通饮食组(standard chow diet, SD)、高脂饮食组(high-fat diet, HF)和二甲双胍组(HF-Metformin, HF-Met), 每组各7只. 普通饮食组喂养普通饲料, 二甲双胍组和高脂饮食组喂养高脂饲料. 普通饲料其蛋白质、脂肪、碳水化合物提供能量分别为21%, 19%和60%; 高脂饲料其蛋白质、脂肪、碳水化合物提供能量分别为15%, 45%和40%. 适应性喂养1 wk后, 普通饮食组继续喂养普通饲料, 二甲双胍组继续喂饲高脂饲料并用二甲双胍灌胃, 剂量为200 mg/(kg•d), 普通饮食组、高脂饮食组用等量生理盐水灌胃. 每天上午9时左右灌胃给药, 每周称重1次, 据此调整药物剂量, 饲养8 wk, 至 8 wk末全部大鼠称质量、测量血糖, 进行正常血糖-高胰岛素钳夹实验.
1.2.1 胰岛素敏感性的测定: 用正常血糖高胰岛素钳夹技术来评价胰岛素敏感性: 大鼠均禁食过夜12 h, 用200 mL/L乌拉坦(1.5 mL/kg)腹腔内注射麻醉后, 进行颈动脉和颈静脉插管留置. 胰岛素、葡萄糖分别用二个微电脑数字式微量注射泵由颈静脉泵入, 血液标本由颈动脉导管获取. 胰岛素输注率为10.0 mU/(kg·min), 从颈动脉取血用微型血糖仪在30 s内测出血糖值, 维持稳态血糖在5.0±0.5 mmol/L的范围内, 持续上述过程达2 h完成. 钳夹实验结束后, 计算灌流第2小时的葡萄糖输注率(glucose infusion rate, GIR), 判断大鼠的胰岛素敏感性. 钳夹结束颈动脉采血后处死动物, 迅速取出肝脏并称质量, 按常规制备血清, 并在肝脏的同一部位切取肝组织, 放入40 g/L甲醛溶液固定后制备石蜡切片.
1.2.2 肝脏TNF-a和肝脏脂质的抽取: 肝组织匀浆、离心、取上清, 用双抗体夹心ELISA法测定TNF-a及双缩脲法测匀浆蛋白浓度. 肝脏脂质的抽取采用Folch法[4].
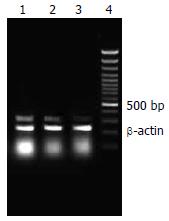
1.2.3 肝脏TNF-a mRNA表达: 利用RT-PCR测定肝脏组织TNF-a mRNA: 细胞总RNA用RNeasy Mini Kit根据操作说明提取, 然后进行RT-PCR. 用Primier 4.1软件设计目的基因和内参照β-actin引物, TNF-α mRNA引物序列如下: 上游引物: 5'-GGTCCCAACAAGGAGGAGAAGT-3'; 下游引物:5'-GTATGAAGTGGCAAATCGGCT -3'; 长度327 bp. 扩增条件为48℃ 45 min, 94℃ 2 min, 94℃ 40 s, 58℃ 60 s, 68 ℃ 90 s, 循环数30, 68℃退火7 min. 同时扩增β-actin基因(长度237 bp)作为内参照. 扩增产物在15 g/L的琼脂糖凝胶里电泳, 利用凝胶成像分析系统进行紫外光成像和图形分析, 测出各条带的光密度值. 结果以TNF-a条带和β-actin条带的光密度比值表示.
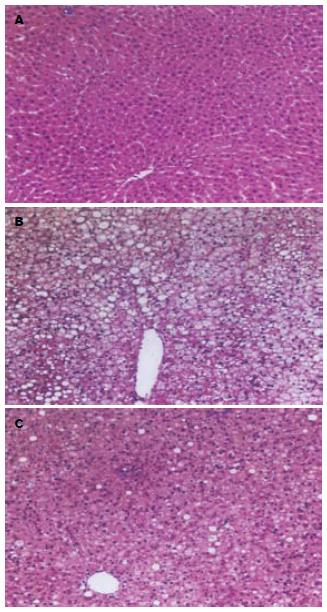
1.2.4 肝脏组织病理检查: 光镜下评估肝脏脂肪变性和炎症情况, 肝细胞脂肪变程度和脂肪性肝炎判断标准参照1999年Brunt et al[5]提出的分级和分期方法, 由病理学专家评判.
统计学处理 所有计量资料以均数±标准差(mean±SD)表示, 采用One-Way ANOVA和q检验, P<0.05表示统计学差异, P<0.01表示显著性差异. 所有资料应用SPSS12.0统计软件进行数据分析.
实验中高脂饲养大鼠性情温顺, 皮毛无光泽, 大便松软, 各组动物均无死亡发生, 大鼠每日摄食能量基本相当. 高脂饮食组大鼠的肝指数、附睾脂肪占体质量的百分比高于普通饮食组(P<0.01和P<0.05), 体质量无差别. 与高脂饮食组相比, 二甲双胍组大鼠体质量增加减缓(P<0.05); 肝指数、附睾脂肪占体质量的百分比明显降低(P<0.01和P<0.05), 且大鼠附睾脂肪占体质量的百分比与普通饮食组相近(表1).
空腹血糖各组间水平相似. 高脂饮食组大鼠的空腹胰岛素水平高于普通饮食组(P<0.05), GIR低于普通饮食组(P<0.01). 与高脂饮食组相比, 二甲双胍组大鼠空腹胰岛素水平明显降低(P<0.01), GIR高于高脂饮食组(P<0.05)(表1).
高脂饮食组大鼠的AST、ALT、MDA明显高于普通饮食组(P<0.01和P<0.05), SOD低于普通饮食组(P<0.01). 与高脂饮食组相比, 二甲双胍组大鼠AST、ALT、MDA明显降低 (P<0.01和P<0.05), SOD高于高脂饮食组(P<0.05)(表2).
高脂饮食组大鼠肝脏TG、TC、FFA明显高于普通饮食组(P<0.01). 与高脂饮食组相比, 二甲双胍组大鼠肝脏TG、FFA明显降低(P<0.05), TC无明显变化(表3).
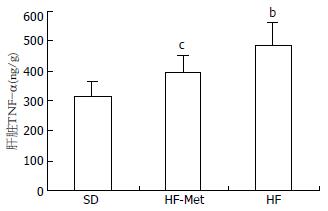
高脂饮食组大鼠肝脏TNF-α mRNA和蛋白含量明显高于普通饮食组(P<0.01). 与高脂饮食组相比, 二甲双胍组大鼠肝脏TNF-α mRNA和蛋白含量明显降低(P<0.01和P<0.05)(图1, 2).
NAFLD是脂质在肝细胞内聚积过多的一种病理状态, 是胰岛素抵抗在肝脏的局部表现, 且胰岛素抵抗可能是NAFLD形成的启动和促发因素[6]. 目前研究表明, 即使是预后良好的单纯性脂肪肝, 亦不能视为静止性病变, 由于遗传易感性和适应性反应机制的影响, 其肝病仍可能呈亚临床状态进展, 并可通过诱发全身炎症反应和代谢紊乱促进代谢综合征的发生. 为此, 需通过改善胰岛素抵抗、减轻氧应激、提高肝细胞存活能力来防治NAFLD及其相关事件. 二甲双胍能提高胰岛素受体酪氨酸激酶的活性, 增加胰岛素受体的数量、与靶组织的亲和力、促进葡萄糖转运蛋白的转位和抑制糖异生、减少肝脏葡萄糖的产生, 具有胰岛素增敏作用, 且研究证实二甲双胍可参与脂质代谢, 调节脂肪细胞因子在肝脏中的表达. 临床和实验研究均显示出对NAFLD有一定的防治效果[7-8], 但其具体的机制尚未完全阐明.
高脂饮食可引起肝脏和外周组织的胰岛素抵抗, 使胰岛素抗脂解作用受损, 血中的游离脂肪酸(FFA)增加, 进入组织的FFA增多, 在肝脏, 当进入肝细胞的FFA超过肝脏的氧化能力时, 过多的FFA就会转化为TG, 使TG在肝细胞内沉积, 导致肝脏发生脂肪变性, 而且脂肪酸还可活化多种细胞死亡途径直接杀伤肝细胞. 我们发现, 二甲双胍的干预可明显改善高脂饮食所致的胰岛素抵抗, 其可能与他能减轻体质量、降低循环的胰岛素水平和内脏脂肪的堆积, 减少FFA的产生, 增强了机体对胰岛素的敏感性有关. 长期的FFA增高可通过以下机制引起胰岛素抵抗: FFA增多使脂肪氧化增加, 葡萄糖氧化受到抑制[9]; 抑制胰岛素介导的细胞对葡萄糖的摄取[10]; 促进糖异生; 引起肝脏、骨骼肌中脂肪聚集, 造成该组织的胰岛素抵抗; 对胰岛素下游信号转导系统产生影响. 另一方面, 降低了肝脏的TNF-α, 阻断TNF-α引起的细胞外信号调节激酶的活化和脂滴包被蛋(perilipin)的下调, 抑制脂肪分解, 改善胰岛素抵抗[11]. 二甲双胍还可改善高脂饮食大鼠的脂代谢, 明显降低肝脏局部的TG和FFA, 从而减轻肝脏脂质的浸润, 改善肝脏的胰岛素抵抗和脂肪变性. FFA、TNF-α和高胰岛素血症的减轻还能改善或恢复肝脏胰岛素信号转导分子的异常, 有助于机体胰岛素敏感性的改善. 近年来研究发现, 二甲双胍可降低NAFLD升高的转氨酶, 但其对肝脏组织学的改善报道不一, 可能与研究对象的入选标准、药物的剂量、时间、组织学改善的判断方法等不同有关[12-13]. 本研究观察了二甲双胍干预对高脂饮食大鼠肝脏组织学影响, 结果显示, 与高脂饮食组相比, 肝脏的脂肪变、炎症细胞的浸润程度均有明显的改善, 这可能与他降低了肝脏FFA和TNF-α的水平, 改善了机体的胰岛素抵抗, 减轻了肝脏的"第一次打击"有关; 同时也与他增加肝脏SOD的活性、减少MDA的形成, 改善肝细胞的能量供应和抑制肝脏的氧化应激, 减轻了肝脏的"第二次打击"有关. 研究发现, 二甲双胍能提高高乳果糖喂养大鼠红细胞铜锰SOD的活性和血谷胱甘肽水平, 并独立于胰岛素敏感性的改善, 提示二甲双胍可能还具有一定的抗氧化作用和降低氧化应激反应[14-15].
总之, 二甲双胍在高脂饮食诱发大鼠脂肪肝的形成中显示出有效的干预作用, 表明胰岛素抵抗在NAFLD发病中占重要地位, 减轻胰岛素抵抗, 增加胰岛素敏感性有助于预防NAFLD.
NAFLD发病机制复杂, 目前认为胰岛素抵抗可能是其主要发病机制, 治疗靶点应该是提升机体胰岛素敏感性. 但胰岛素增敏剂对NAFLD治疗存在结果的不一致性. 本文用精确的方法判断了二甲双胍对高脂饮食所致脂肪肝大鼠胰岛素抵抗的影响, 并在此基础上探讨其对肝脏脂肪变的影响及其可能的机制, 为NAFLD的发病机制和防治提供了理论基础, 但二甲双胍对NAFLD的防治作用仍需要进行更多的大样本前瞻性临床研究.
本文利用抗糖尿病药物二甲双胍来研究胰岛素抵抗与NAFLD的关系, 证明二甲双胍对NAFLD有一定的防治效果.
非酒精性脂肪肝发病机制尚未完全阐明, 该文旨在研究胰岛素抵抗在NAFLD发病中的作用和机制. 实验设计合理, 图片清晰, 结果与结论较可靠, 有一定的学术价值.
编辑: 王晓瑜 电编:郭海丽
| 1. | Utzschneider KM, Kahn SE. Review: The role of insulin resistance in nonalcoholic fatty liver disease. JClin Endocrinol Me. tab. 2006;91:4753-4761. [PubMed] |
| 2. | Samuel VT, Liu ZX, Qu X, Elder BD, Bilz S, Befroy D, Romanelli AJ, Shulman GI. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease. J Biol Chem. 2004;279:32345-32353. [PubMed] |
| 3. | Hundal RS, Inzucchi SE. Metformin: new understandings, new uses. Drugs. 2003;63:1879-1894. [PubMed] |
| 4. | FOLCH J, LEES M, SLOANE STANLEY GH. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 1957;226:497-509. [PubMed] |
| 5. | Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR. Nonalcoholic steatohepatitis: a proposal for grading and staging the histological lesions. Am J Gastroenterol. 1999;94:2467-2474. [PubMed] |
| 6. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] |
| 7. | Lin HZ, Yang SQ, Chuckaree C, Kuhajda F, Ronnet G, Diehl AM. Metformin reverses fatty liver disease in obese, leptin deficient mice. Nat Med. 2000;6:998-1003. [PubMed] |
| 8. | Nair S, Diehl AM, Wiseman M, Farr GH Jr, Perrillo RP. Metformin in the treatment of non-alcoholic steatohepatitis: a pilot open label trial. Aliment Pharmacol Ther. 2004;20:23-28. [PubMed] |
| 9. | RANDLE PJ, GARLAND PB, HALES CN, NEWSHOLME EA. The glucose fatty-acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus. Lancet. 1963;1:785-789. [PubMed] |
| 10. | Boden G, Chen X, Ruiz J, White JV, Rossetti L. Mechanisms of fatty acid-induced inhibition of glucose uptake. J Clin Invest. 1994;93:2438-2446. [PubMed] |
| 11. | Ren T, He J, Jiang H, Zu L, Pu S, Guo X, Xu G. Metformin reduces lipolysis in primary rat adipocytes stimulated by tumor necrosis factor-alpha or isoproterenol. J Mol Endocrinol. 2006;37:175-183. [PubMed] |
| 12. | Marchesini G, Brizi M, Bianchi G, Tomassetti S, Zoli M, Melchionda N. Metformin in non-alcoholic steatohepatitis. Lancet. 2001;358:893-894. [PubMed] |
| 13. | Uygun A, Kadayifci A, Isik AT, Ozgurtas T, Deveci S, Tuzun A, Yesilova Z, Gulsen M, Dagalp K. Metformin in the treatment of patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2004;19:537-544. [PubMed] |
| 14. | Faure P, Rossini E, Wiernsperger N, Richard MJ, Favier A, Halimi S. An insulin sensitizer improves the free radical defense system potential and insulin sensitivity in high fructose-fed rats. Diabetes. 1999;48:353-357. [PubMed] |
| 15. | Beisswenger P, Ruggiero-Lopez D. Metformin inhibition of glycation processes. Diabetes Metab. 2003;29:6S95-103. [PubMed] |