修回日期: 2007-03-21
接受日期: 2007-03-31
在线出版日期: 2007-06-08
目的: 研究肿瘤坏死因子α(TNF-α)对肠上皮细胞紧密连接蛋白claudin-1定位和表达的影响, 探讨TNF-α增加肠上皮细胞屏障通透性的作用机制.
方法: Caco-2细胞(20-30代)应用含有2 mmol/L谷氨酰胺、20%胎牛血清的DMEM培养液培养7 d, 细胞生长达到融合后加入不同浓度的TNF-α(0, 10, 100 μg/L)继续培养24 h, 提取细胞蛋白制备NP-40可溶性及不溶性蛋白框架, Western blot检测磷酸化和非磷酸化的claudin-1蛋白含量, 并应用间接免疫荧光法检测claudin-1的定位, 实时定量PCR技术检测claudin-1 mRNA的表达.
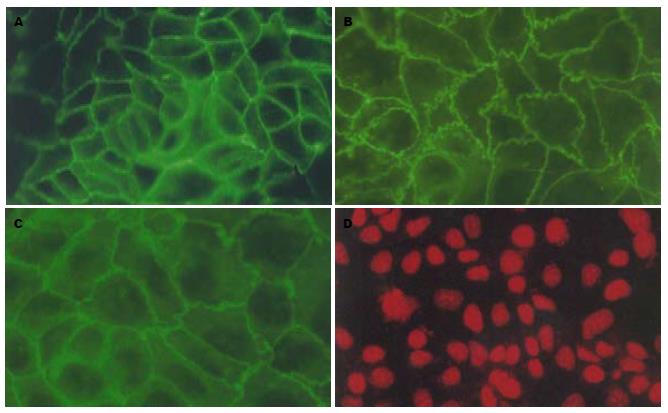
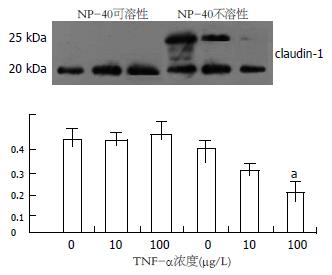
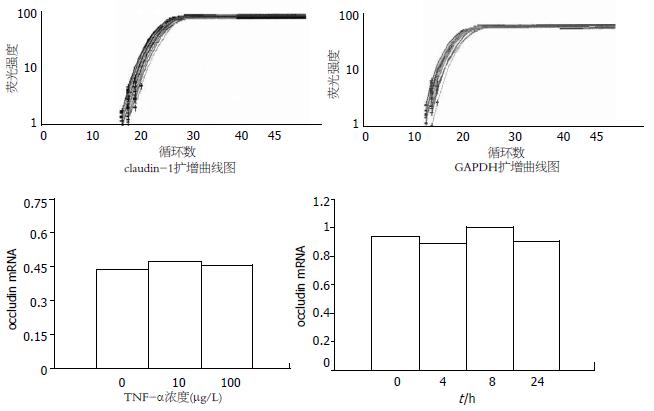
结果: 免疫荧光染色可见对照组claudin-1沿细胞膜分布, 呈蜂巢状线性荧光, 10 μg/L TNF-α引起claudin-1荧光信号减弱, 并呈锯齿状异常分布; Western blot分析显示claudin-1蛋白有两种表达形式, 一种为20 kDa(非磷酸化claudin-1), 主要存在于NP-40可溶性蛋白样品中; 另一种为25 kDa(磷酸化claudin-1), 只存在于NP-40不溶性蛋白样品中. TNF-α不影响20 kDa claudin-1蛋白的表达, 但可使25 kDa claudin-1蛋白表达下降且具有浓度依赖性(10, 100 μg/L: 0.31±0.02, 0.24±0.05 vs 0.43±0.09 P>0.05, P<0.05); 实时定量PCR结果显示不同浓度的TNF-α(10, 100 μg/L)作用24 h或100 μg/L TNF-α作用不同时间(4, 8和24 h)与正常对照组相比均不能引起claudin-1 mRNA的改变.
结论: TNF-α对Caco-2细胞紧密连接蛋白claudin-1 mRNA的表达没有影响, 但可以引起有功能的磷酸化claudin-1蛋白表达减少.
引文著录: 崔巍, 刘冬妍, 马力, 刘沛. TNF-α对肠上皮细胞紧密连接蛋白表达的作用. 世界华人消化杂志 2007; 15(16): 1788-1793
Revised: March 21, 2007
Accepted: March 31, 2007
Published online: June 8, 2007
AIM: To explore the mechanism of intestinal epithelial barrier disruption induced by tumor necrosis factor alpha (TNF-α). We detected the expression of the tight junction protein claudin-1 in Caco-2 cells with TNF-α treatment.
METHODS: Caco-2 cells between passages 20 and 30 were cultured with DMEM including 20% fetal bovine serum and 2 mmol/L glutamine for 7 d. Cells were then treated with different concentrations of TNF-α (0, 10, and 100 μg/L) for 24 h when they became fused. Protein was extracted from cells to prepare NP-40 detergent-soluble and insoluble protein fractions. Western blot was used to measure the protein levels of phosphorylated and unphosphorylated claudin-1. Indirect immunofluorescence was applied to the localization of claudin-1. Real-time quantity polymerase-chain reaction (RQ-PCR) was used to detect the mRNA expression of claudin-1.
RESULTS: Immunofluorescence showed that claudin-1 was distributed around the cell membrane and presented scrobiculate linear fluorescence. A 10 μg/L concentration of TNF-α caused weakened fluorescence signals that were abnormally distributed dentately. Claudin-1 has two molecular forms: one is the nonphosphorylated form (20 kDa) that primarily exists in NP-40 soluble proteins; the other is the phosphorylated form (25 kDa) that only exists in NP-40 insoluble proteins. TNF-α did not affect the protein expression of 65-kDa claudin-1 but decreased 80-kDa claudin-1 protein expression in a concentration-dependant manner compared with the control (10, 100 μg/L: 0.31 ± 0.02, 0.24 ± 0.05 vs 0.43 ± 0.09, P > 0.05, P < 0.05). Real time PCR demonstrated that the mRNA expression of claudin-1 in TNF-α treatment groups with different concentrations (10 and 100 μg/L) for 24 h, or a different reacting time (4, 8, 24 h), was not significantly different from the corresponding time normal groups (P > 0.05).
CONCLUSION: TNF-α does not affect the mRNA expression of the tight junction protein claudin-1 but decreases the expression of functional claudin-1 in Caco-2 cells.
- Citation: Cui W, Liu DY, Ma L, Liu P. Effect of tumor necrosis factor-α on protein expression of tight junction protein in intestinal epithelial cells. Shijie Huaren Xiaohua Zazhi 2007; 15(16): 1788-1793
- URL: https://www.wjgnet.com/1009-3079/full/v15/i16/1788.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i16.1788
肠黏膜屏障功能损害被认为是炎症性肠病的始动因素[1], 可引起肠黏膜屏障通透性增高, 使正常情况下不能通透的各种毒性物质、微生物进入肠壁, 诱发炎症反应. 炎性细胞因子TNF-α在这一过程中占据重要位置, 已有研究表明炎症性肠病患者TNF-α异常增高, 并伴随肠黏膜屏障通透性的增高, 应用TNF-α抗体可以降低这些患者肠黏膜屏障的通透性[2], 但是TNF-α引起肠黏膜屏障通透性增高的具体机制还不十分清楚. 炎症性肠病时肠黏膜屏障通透性增高的特征是肠上皮细胞旁路的通透性明显增高, 而肠上皮细胞旁路的通透性主要受紧密连接限制. 紧密连接由多种紧密连接蛋白组成, claudin-1是最重要的一种紧密连接蛋白, 对于屏障功能的维持和紧密连接的完整性具有重要作用. 有研究表明, claudin-1表达异常可使肠上皮细胞跨上皮细胞电阻(transepithelial electrical resistance, TEER)降低, 肠黏膜通透性增高[3]. 因此我们检测了TNF-α对紧密连接蛋白claudin-1表达的影响, 以探讨TNF-α增加肠上皮细胞屏障通透性的机制.
DMEM高糖培养基, FCS购自美国Gibcobrl公司, 非必须氨基酸、丙酮酸钠购自美国Hyclone公司, 谷氨酰胺、重组人 TNF-α购自美国Sigma公司, 兔抗claudin-1多克隆抗体购自美国Zymed公司, FITC、辣根过氧化物酶标记的羊抗兔IgG购自美国Santa Cruz公司, PCR试剂盒、T7体外转录试剂盒、定时定量PCR试剂盒购自大连宝生物工程有限公司.
1.2.1 细胞培养: Caco-2细胞应用含有200 mL/L胎牛血清、10 g/L非必须氨基酸、4 mmol/L谷氨酰胺和青霉素-链霉素双抗液的DMEM培养液, 在37℃、50 mL/L CO2条件下进行培养, 每7天按1:2的比例传代. 传代后7 d左右细胞生长达到融合, 加入不同浓度的TNF-α(0, 10, 100 μg/L)培养24 h后, 进行免疫荧光检测, 并收集Caco-2细胞提取蛋白及总RNA, -130℃保存待用. 每种实验均选取3组非同代细胞进行.
1.2.2 免疫荧光: 取同代细胞接种于盖玻片上, 待细胞生长融合70%左右加入处理因素, 取出盖玻片, PBS漂洗3次(每次10 min)后, 用40 g/L多聚甲醛固定15 min, PBS漂洗, 加入5 g/L Triton X-100处理10 min, PBS漂洗, 100 mL/L小牛血清白蛋白室温封闭30 min, 加入claudin-1抗体(1:50), 4℃过夜, PBS漂洗后加入FITC标记二抗(1:200)室温孵育1 h, 再用PBS漂洗, 蒸馏水洗后用甘油封片, 荧光显微镜下观察. PBS液代替一抗作为空白对照.
1.2.3 NP-40可溶性及不溶性蛋白框架的制备: 细胞用冰PBS洗3遍, 然后用NP-40蛋白裂解液(25 mmol/L HEPES, pH 7.4, 150 mmol/L NaCl, 4 mmol/L EDTA, 10 g/L Nonidet P-40, 25 mmol/L NaF, 1 mmol/L Na3VO4, 10 mmol/L sodium pyrophosphate, 1 mmol/L PMSF)冰上裂解细胞20 min, 4℃, 12 000 g离心30 min, 上清即为NP-40可溶性蛋白, 转移至新的Microtube内. 剩余沉淀应用SDS蛋白裂解液(25 mmol/L HEPES, pH 7.4, 4 mmol/L EDTA, 10 g/L SDS, 25 mmol/L NaF, 1 mmol/L Na3VO4, 10 mmol/L sodium pyrophosphate, 1 mmol/L PMSF)冰上裂解细胞20 min, 超声波粉碎5 s×5次, 4℃, 12 000 g离心30 min, 所得上清即为NP-40不溶性蛋白, 两种蛋白的混合物即为总蛋白. 采用BCA法对蛋白样品进行定量, 用蒸馏水将蛋白样品调成相同浓度, 加入相同体积上样缓冲液, 沸水煮5 min进行蛋白变性.
1.2.4 Western blot: 每个样本取等量蛋白(约50 μg)进行80 g/L SDS-PAGE凝胶电泳, 电压100 V, 2.5 h, 电泳后将蛋白转至硝酸纤维素膜上, 电压50 V, 2 h, 脱脂奶粉4℃封闭过夜, TBS洗5 min×3次, 加入多克隆兔抗claudin-1抗体(1:500)室温2 h, TTBS洗5 min×3次, 然后加入碱性磷酸酶标记的羊抗兔-IgG抗体(1:10 000)室温2 h, TTBS洗5 min×3次, ECL显色. 以同一样本的β-actin作为内参. 结果通过天能图像分析系统进行分析, claudin-1蛋白含量 = 样本claudin-1蛋白灰度值/同一样本β-actin灰度值.
1.2.5 实时定量PCR: 用TRIzol一步法提取细胞总RNA. 采用SYBR Green Ⅰ荧光染料嵌合法检测claudin-1 mRNA. 简言之先构建目的基因(claudin-1基因)和管家基因(GAPDH)的RNA标准品, 制作标准曲线, 利用标准曲线对样品中的目的基因和管家基因分别进行定量. 通过管家基因的校正, 检测各组大肠组织中claudin-1目的基因的相对表达量. Claudin-1 mRNA的相对表达量 = claudin-1基因拷贝数/GAPDH基因拷贝数. PCR反应体系的组成参照说明书进行, 反应条件为逆转录反应42℃ 10 min, 95℃ 2 min, PCR扩增95℃ 10 s 1个循环, 95℃ 5 s, 60℃ 20 s 45个循环. Claudin-1和GAPDH引物序列如下: Claudin-1引物: 5'-AAGAGTTGACAGTCCCATGGCATAC-3'(上游), 5'-ATCCACAGGCGAAGT TAATGGAAG-3'(下游); GAPDH引物: 5'-AAATGGTGAAGGT CGGTGTG-3'(上游), 5'-TGAAGGGGTCGTTGATGG-3'(下游). Claudin-1产物片段133 bp, GAPDH产物片段144 bp.
统计学处理 实验结果以mean±SD表示, 采用SPSS10.0统计软件对各组间数据进行单因素方差分析, 每种实验均选取3组数据进行分析.
对照组claudin-1蛋白主要沿细胞膜分布, 呈蜂巢状线性荧光; 加入TNF-α 10 μg/L可使claudin-1蛋白荧光信号减弱, 并呈锯齿状分布; 增加TNF-α浓度到100 μg/L发现claudin-1蛋白荧光信号进一步减弱, 锯齿状分布更加明显, 并且在胞浆内可见阳性染色. 以上结果提示TNF-α可引起claudin-1分布异常, 由膜顶端向膜下及胞浆转移, 并具有浓度依赖性(图1).
各组蛋白样品分为NP-40可溶性与NP-40不溶性两个框架分别进行蛋白杂交, 结果发现NP-40可溶性标本仅在20 kDa处见一特异性的蛋白条带, 对各条带进行灰度分析发现各组claudin-1蛋白的表达无明显差异. NP-40不溶性标本可见两条蛋白条带, 分别在20 kDa和25 kDa, 对各条带进行灰度分析发现各组标本20 kDa的蛋白含量无统计学差异, 但是对于25 kDa的蛋白含量, TNF-α组较对照组明显下降并呈剂量依赖性(0.31±0.02, 0.24±0.05 vs 0.43±0.09, P>0.05, P<0.05, 图2).
电泳结果和OD值结果显示, 构建的人claudin-1基因和GAPDH基因RNA标准品片段长度分别为358 bp和1043 bp. 其质量良好, 所获得的标准曲线相关系数为0.998, 线性关系良好, 融解曲线显示特异性良好. 利用标准曲线对样品中的claudin-1基因和GAPDH基因进行定量, 结果发现不同浓度TNF-α组与正常对照组比较claudin-1 mRNA的水平没有统计学差异(0.63±0.1,0.61±0.06 vs 0.6±0.07, P>0.05). 进一步我们检测了TNF-α 100 μg/L作用不同时间(4, 8, 24 h)claudin-1 mRNA水平的变化, 与正常对照组相应时间点相比, claudin-1 mRNA水平仍然没有统计学差异(0.9±0.4, 1.02±0.6, 0.92±0.3 vs 0.94±0.4, P>0.05). 这些结果提示TNF-α对claudin-1的调节不发生在转录水平(图3).
TNF-α已被证实是炎症性肠病时引起肠黏膜屏障功能损伤的重要启动因子, 这可以从下面几点证明: (1)炎症性肠病患者TNF-α水平异常增高, 并与肠黏膜损伤的程度直接相关[4]; (2)抗TNF-α抗体治疗炎症性肠病患者有效[5-8]; (3)TNF-α可引起其他细胞因子如IL-1, -6, -8, -12、CSF等增高, 这些细胞因子被证实参与了炎症性肠病的发生[4,6]. TNF-α引起肠黏膜屏障通透性增高的机制还不十分清楚, 与NF-κB活化有关[9], MLCK, MAPK, PKC等信号途径皆参与其调节[10-16]. 最近越来越多的研究表明, TNF-α可以增加肠上皮细胞细胞旁的通透性, 降低肠上皮细胞屏障的跨上皮电阻, 并认为这是TNF-α引起肠黏膜屏障通透性增高的主要原因[17-19]. 正常情况下肠上皮细胞细胞旁间隙是由连接复合体封闭的, 其中最重要的是紧密连接(tight junction, TJ)[20]. 紧密连接由多种紧密连接蛋白分子组成, 包括跨膜蛋白claudin-1、claudins、连接黏附分子(junctional adhesion molecule, JAM)和胞质附着蛋白Zos、AF6、7H6等. Claudin-1是最先分离出来的TJ跨膜蛋白, 分子量为20 kDa, 形成两个细胞外环和一个短的细胞内环. 相邻细胞间通过外环以"拉链"状结合产生细胞旁封闭. Claudin-1蛋白对于上皮细胞屏障功能的维持和紧密连接的完整性具有重要作用. 有研究表明, 用claudin-1转染L-纤维母细胞(缺乏TJ)后, 相邻细胞之间可以形成TJ样结构[21]. 另外在MDCK(犬肾上皮)细胞中增加claudin-1表达可以增加上皮细胞的TEER[22-23], 而在蟾蜍胚胎中, 转入缺乏完整结构的claudin-1片段可破坏屏障功能[24]. 这提示claudin-1是TJ的主要功能蛋白, 参与屏障功能的调节. 因此我们推测TNF-α是通过影响紧密连接蛋白的表达, 从而破坏紧密连接的完整性, 增加肠黏膜屏障的通透性. 为了验证这一假设, 我们检测了TNF-α对TJ中最重要的跨膜蛋白claudin-1表达和定位的影响. 我们首先应用免疫荧光染色对claudin-1蛋白的定位进行研究. 正常情况下, claudin-1定位在细胞膜顶端, 交织成网状, 加入TNF-α后, claudin-1由膜顶端向膜下转移, 表现为荧光信号呈锯齿状分布并有中断现象. 这说明TNF-α可以引起claudin-1蛋白分布异常, 使其不能定位在紧密连接上发挥功能, 从而引起紧密连接的断裂. 这与Han和Sappington在Caco-2细胞中的研究结果相一致[25-26]. Claudin-1存在磷酸化和非磷酸化两种形式, 磷酸化是其活性形式, 在ATP或钙转移实验中发现TJ的组装和高TEER的形成有赖于claudin-1酪氨酸残基的磷酸化[27]. 有研究表明磷酸化的claudin-1定位在TJ上, 而非磷酸化claudin-1沿膜的基底侧分布, 并且磷酸化会使claudin-1分子量上调并不溶于NP-40[28]. 利用这一特性我们制备了NP-40可溶性和不溶性蛋白框架, 分别进行claudin-1蛋白杂交. 结果发现在NP-40可溶性蛋白框架内只存在一种蛋白, 分子量在20 kDa, TNF-α不能影响其表达; 而在NP-40不溶性蛋白框架内存在两种蛋白, 一种为20 kDa的非磷酸化claudin-1蛋白, 一种为25 kDa的磷酸化claudin-1蛋白, TNF-α可以下调后者的表达并具有浓度依赖性. 这也进一步解释了免疫荧光中TNF-α为何会引起claudin-1蛋白的分布异常-是TNF-α减少claudin-1蛋白磷酸化的结果. 在目前研究中, TNF-α对claudin-1蛋白含量的影响存在不同结果, 有研究表明TNF-α或细胞因子混合物(TNF-α、IFN-γ、IL-1β)可以减少claudin-1蛋白的表达[25-26], 也有研究认为TNF-α对claudin-1蛋白总量没有影响[29-30]. 我们实验中发现TNF-α不影响claudin-1蛋白的总量, 但可以减少claudin-1蛋白的磷酸化, 这些结果上的差异可能与选择的细胞系及细胞因子的作用时间有关, 单一细胞因子及较短的作用时间(24 h)不引起claudin-1蛋白总量的改变. 有报道称TNF-α可以下调肠上皮细胞HT-29/B6 claudin-1基因启动子的表达[31-32], 提示claudin-1蛋白表达亦受转录水平的调节, 因此我们应用实时定量PCR技术检测了TNF-α对claudin-1 mRNA的影响, 结果表明无论哪种浓度的TNF-α均不能引起claudin-1 mRNA水平的变化. 对于蛋白分子调控, 其转录水平的调节与蛋白水平的调节具有一定的时相性, 因此我们又检测了TNF-α 100 μg/L作用不同时间(4, 8, 24 h)claudin-1 mRNA水平的变化, 同样没有发现任何阳性结果. 提示在Caco-2细胞中, TNF-α对claudin-1的调节发生在蛋白水平, 而不是转录水平, 这一结果也与Western blot实验中claudin-1蛋白的总量没有变化相一致. 在本实验中, 我们证明TNF-α可以减少紧密连接蛋白claudin-1磷酸化, 使其从紧密连接上解聚, 紧密连接断裂, 并认为这是TNF-α增加肠上皮屏障通透性的作用靶点. 为进一步研究TNF-α增加肠上皮细胞屏障通透性的分子机制提供基础.
炎症性肠病时肠上皮细胞旁路通透性的增高是其重要的发病基础, TNF-α可能发挥重要作用. 目前体内、体外的多项研究已经证实, TNF-α可以增加肠上皮细胞旁路的通透性, 但具体作用机制还不十分清楚. 肠上皮细胞旁路通透性主要受紧密连接调控, 而紧密连接由多种紧密连接蛋白组成, claudin-1是最重要的一种紧密连接蛋白, 其表达量的高低直接影响肠上皮细胞屏障的跨上皮细胞电阻. 那么TNF-α增加肠上皮细胞旁路的通透性是否是由于破坏紧密连接蛋白claudin-1而造成的呢?本文就这一问题研究了TNF-α对肠上皮细胞紧密连接蛋白claudin-1表达的影响.
炎症性肠病时TNF-α水平明显增高, 并且与肠黏膜屏障通透性增高密切相关. 但TNF-α引起肠黏膜屏障通透性增高的机制, 尤其是其发挥作用的信号传导通路是目前研究的热点.
在体外细胞培养中, TNF-α对紧密连接蛋白claudin-1表达的影响, 国内尚未见相关报道. 国外研究存在不同的结果, 有研究认为TNF-α可以使claudin-1表达减少, 也有研究认为TNF-α对claudin-1的表达没有影响.
目前关于TNF-α对肠上皮细胞间紧密连接蛋白claudin-1表达变化的文章国内尚未见报道.TNF-α对肠黏膜屏障损伤的研究主要集中在肠上皮细胞的凋亡, 对紧密连接蛋白表达的影响研究较少.
本研究发现在体外培养肠上皮细胞, TNF-α可以引起紧密连接蛋白claudin-1异常分布及磷酸化减少, 而对claudin-1mRNA的表达没有影响, 为进一步深入研究TNF-α损伤肠黏膜屏障的机制提供了基础.
紧密连接存在于各类上皮细胞及血管内皮细胞间的顶端, 形成一个顶端闭锁结构且发挥"屏障"和"防御"功能, 以控制细胞间的通透性和保持细胞的极性. 紧密连接由多种紧密连接蛋白组成, 包括claudin, claudin-1以及Zo-1,Zo-2,Zo-3等, 在不同的组织结构, 各种紧密连接蛋白的表达亦存在差别.
TNF-α是重要的炎性细胞因子, 在各种炎症疾病中起重要的作用, 近年来很多研究已经证实了他与肠黏膜屏障损伤有关. 本文利用分子生物学的方法在培养的肠上皮细胞上探讨了TNF-α与紧密连接蛋白claudin-1表达的关系, 目的明确, 研究方法先进, 结果具有一定的创新性为临床防治消化道炎性疾病提供了实验依据.
编辑: 王晓瑜 电编:郭海丽
| 1. | Ma TY. Intestinal epithelial barrier dysfunction in Crohn's disease. Proc Soc Exp Biol Med. 1997;214:318-327. [PubMed] |
| 2. | Suenaert P, Bulteel V, Lemmens L, Noman M, Geypens B, Van Assche G, Geboes K, Ceuppens JL, Rutgeerts P. Anti-tumor necrosis factor treatment restores the gut barrier in Crohn's disease. Am J Gastroenterol. 2002;97:2000-2004. [PubMed] |
| 3. | Hopkins AM, Walsh SV, Verkade P, Boquet P, Nusrat A. Constitutive activation of Rho proteins by CNF-1 influences tight junction structure and epithelial barrier function. J Cell Sci. 2003;116:725-742. [PubMed] |
| 5. | Ricart E, Panaccione R, Loftus EV, Tremaine WJ, Sandborn WJ. Infliximab for Crohn's disease in clinical practice at the Mayo Clinic: the first 100 patients. Am J Gastroenterol. 2001;96:722-729. [PubMed] |
| 6. | Rutgeerts P, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, Rachmilewitz D, Wolf DC, Olson A, Bao W. Comparison of scheduled and episodic treatment strategies of infliximab in Crohn's disease. Gastroenterology. 2004;126:402-413. [PubMed] |
| 7. | Hanauer SB, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, Rachmilewitz D, Wolf DC, Olson A, Bao W. Maintenance infliximab for Crohn's disease: the ACCENT I randomised trial. Lancet. 2002;359:1541-1549. [PubMed] |
| 8. | Zeissig S, Bojarski C, Buergel N, Mankertz J, Zeitz M, Fromm M, Schulzke JD. Downregulation of epithelial apoptosis and barrier repair in active Crohn's disease by tumour necrosis factor alpha antibody treatment. Gut. 2004;53:1295-1302. [PubMed] |
| 9. | Ma TY, Iwamoto GK, Hoa NT, Akotia V, Pedram A, Boivin MA, Said HM. TNF-alpha-induced increase in intestinal epithelial tight junction permeability requires NF-kappa B activation. Am J Physiol Gastrointest Liver Physiol. 2004;286:G367-376. [PubMed] |
| 10. | Wang F, Graham WV, Wang Y, Witkowski ED, Schwarz BT, Turner JR. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am J Pathol. 2005;166:409-419. [PubMed] |
| 11. | Patrick DM, Leone AK, Shellenberger JJ, Dudowicz KA, King JM. Proinflammatory cytokines tumor necrosis factor-alpha and interferon-gamma modulate epithelial barrier function in Madin-Darby canine kidney cells through mitogen activated protein kinase signaling. BMC Physiol. 2006;6:2. [PubMed] |
| 12. | Ye D, Ma I, Ma TY. Molecular mechanism of tumor necrosis factor-alpha modulation of intestinal epithelial tight junction barrier. Am J Physiol Gastrointest Liver Physiol. 2006;290:G496-504. [PubMed] |
| 13. | Ma TY, Boivin MA, Ye D, Pedram A, Said HM. Mechanism of TNF-{alpha} modulation of Caco-2 intestinal epithelial tight junction barrier: role of myosin light-chain kinase protein expression. Am J Physiol Gastrointest Liver Physiol. 2005;288:G422-430. [PubMed] |
| 14. | Banan A, Zhang LJ, Shaikh M, Fields JZ, Farhadi A, Keshavarzian A. Theta-isoform of PKC is required for alterations in cytoskeletal dynamics and barrier permeability in intestinal epithelium: a novel function for PKC-theta. Am JPhysiol Cell Ph. ysiol. 2004;287:C218-234. [PubMed] |
| 17. | Gitter AH, Bendfeldt K, Schmitz H, Schulzke JD, Bentzel CJ, Fromm M. Epithelial barrier defects in HT-29/B6 colonic cell monolayers induced by tumor necrosis factor-alpha. Ann N Y Acad Sci. 2000;915:193-203. [PubMed] |
| 18. | Schmitz H, Fromm M, Bentzel CJ, Scholz P, Detjen K, Mankertz J, Bode H, Epple HJ, Riecken EO, Schulzke JD. Tumor necrosis factor-alpha (TNFalpha) regulates the epithelial barrier in the human intestinal cell line HT-29/B6. J Cell Sci. 1999;112:137-146. [PubMed] |
| 19. | Bruewer M, Luegering A, Kucharzik T, Parkos CA, Madara JL, Hopkins AM, Nusrat A. Proinflammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms. J Immunol. 2003;171:6164-6172. [PubMed] |
| 21. | Furuse M, Fujita K, Hiiragi T, Fujimoto K, Tsukita S. Claudin-1 and -2: novel integral membrane proteins localizing at tight junctions with no sequence similarity to claudin-1. J Cell Biol. 1998;141:1539-1550. [PubMed] |
| 22. | McCarthy KM, Skare IB, Stankewich MC, Furuse M, Tsukita S, Rogers RA, Lynch RD, Schneeberger EE. Claudin-1 is a functional component of the tight junction. J Cell Sci. 1996;109:2287-2298. [PubMed] |
| 23. | Balda MS, Whitney JA, Flores C, Gonzalez S, Cereijido M, Matter K. Functional dissociation of paracellular permeability and transepithelial electrical resistance and disruption of the apical-basolateral intramembrane diffusion barrier by expression of a mutant tight junction membrane protein. J Cell Biol. 1996;134:1031-1049. [PubMed] |
| 24. | Chen Y, Merzdorf C, Paul DL, Goodenough DA. COOH terminus of claudin-1 is required for tight junction barrier function in early Xenopus embryos. J Cell Biol. 1997;138:891-899. [PubMed] |
| 25. | Han X, Fink MP, Delude RL. Proinflammatory cytokines cause NO*-dependent and -independent changes in expression and localization of tight junction proteins in intestinal epithelial cells. Shock. 2003;19:229-237. [PubMed] |
| 26. | Sappington PL, Han X, Yang R, Delude RL, Fink MP. Ethyl pyruvate ameliorates intestinal epithelial barrier dysfunction in endotoxemic mice and immunostimulated Caco-2 enterocytic monolayers. J Pharmacol Exp Ther. 2003;304:464-476. [PubMed] |
| 27. | Chen YH, Lu Q, Goodenough DA, Jeansonne B. Nonreceptor tyrosine kinase c-Yes interacts with claudin-1 during tight junction formation in canine kidney epithelial cells. Mol Biol Cell. 2002;13:1227-1237. [PubMed] |
| 28. | Sakakibara A, Furuse M, Saitou M, Ando-Akatsuka Y, Tsukita S. Possible involvement of phosphorylation of claudin-1 in tight junction formation. J Cell Biol. 1997;137:1393-1401. [PubMed] |
| 29. | Poritz LS, Garver KI, Tilberg AF, Koltun WA. Tumor necrosis factor alpha disrupts tight junction assembly. J Surg Res. 2004;116:14-18. [PubMed] |
| 30. | Quesnell RR, Erickson J, Schultz BD. Apical electrolyte concentration modulates barrier function and tight junction protein localization in bovine mammary epithelium. Am J Physiol Cell Physiol. 2007;292:C305-318. [PubMed] |
| 31. | Mankertz J, Waller JS, Hillenbrand B, Tavalali S, Florian P, Schoneberg T, Fromm M, Schulzke JD. Gene expression of the tight junction protein claudin-1 includes differential splicing and alternative promoter usage. BiochemBiophys Res Co. mmun. 2002;298:657-666. [PubMed] |
| 32. | Mankertz J, Tavalali S, Schmitz H, Mankertz A, Riecken EO, Fromm M, Schulzke JD. Expression from the human claudin-1 promoter is affected by tumor necrosis factor alpha and interferon gamma. J Cell Sci. 2000;113:2085-2090. [PubMed] |