修回日期: 2007-03-15
接受日期: 2007-03-23
在线出版日期: 2007-05-18
目的: 探讨Janus激酶(JAK)特异性抑制剂AG490联合化疗药物健择对人胰腺癌细胞系SW1990的生长增殖及STAT3转导通路的影响和其机制.
方法: 人胰腺癌细胞系SW1990分为对照组、AG490组、健择组及AG490+健择处理组. 培养48 h后, MTT法检测细胞增殖状态, 流式细胞仪检测细胞凋亡, Western blot和RT-PCR检测STAT3, Cyclin D1, Bcl-xL, Bax, Survivin的表达情况.
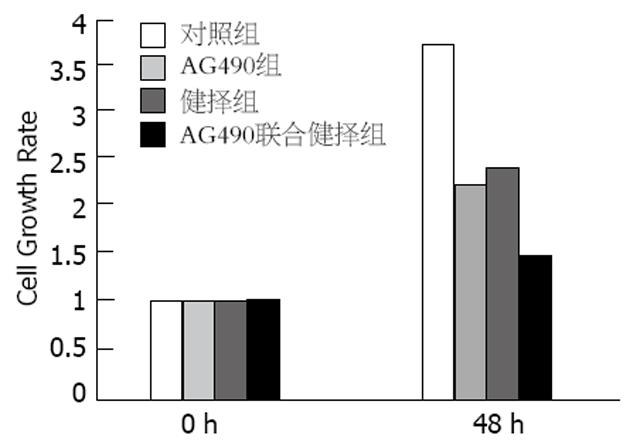
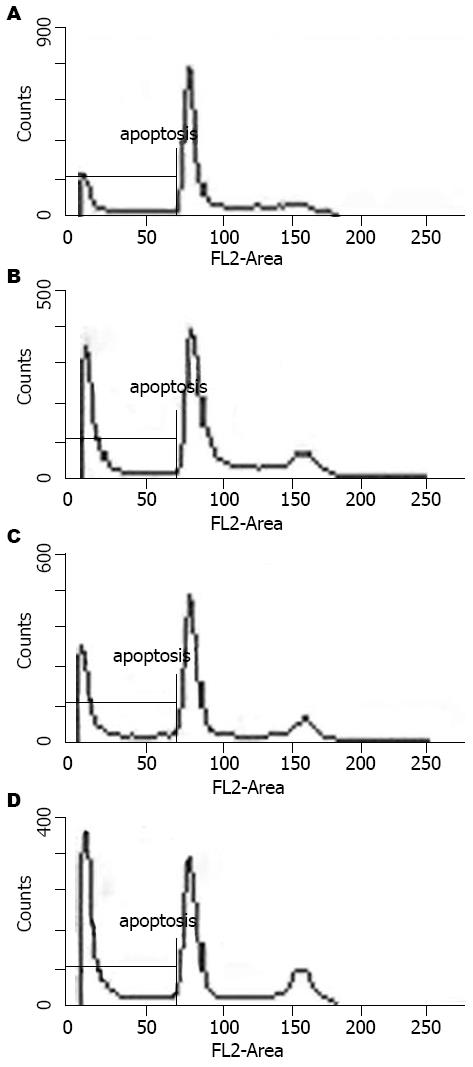
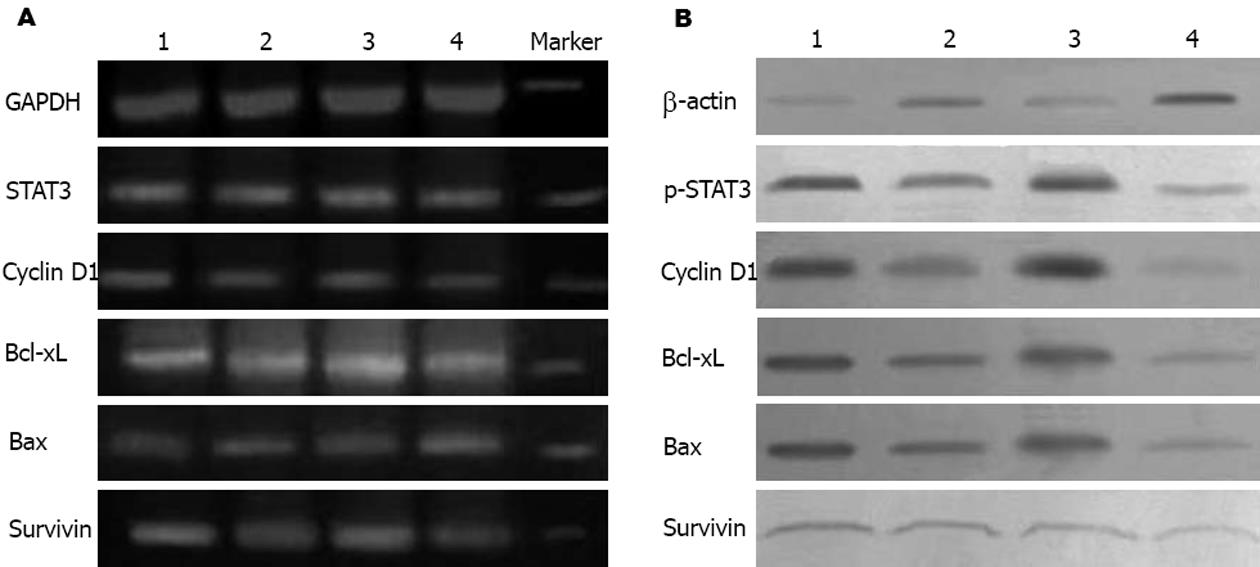
结果: AG490组和健择组的细胞增殖明显低于对照组(2.20±0.25, 2.30±0.220 vs 3.78±0.42, P<0.05), 凋亡率明显高于对照组(35.40%±3.08%, 34.64%±1.38% vs 16.49%±1.45%, P<0.05). 并且, AG490+健择组细胞增殖(1.49±0.15)明显低于明显低于AG490或健择组(P<0.05), 而凋亡率(43.80%±1.57%)则明显高于AG490或健择组(P<0.05). AG490处理SW1990 48 h后, p-STAT3表达明显低于对照组(13.83%±0.64% vs 79.87%±1.43%, P<0.05), 同时Cyclin D1(mRNA: 15.63%±0.59% vs 43.83%±0.64%, P<0.05; 蛋白: 17.50%±0.92% vs 49.87%±1.27%, P<0.05), Bcl-xL(mRNA: 13.93%±0.21% vs 75.70%±0.46%, P<0.05; 蛋白: 34.17%±1.70% vs 83.93%±0.80%, P<0.05)和Survivin(mRNA: 58.27%±0.42% vs 82.93%±1.68%, P<0.05; 蛋白: 13.23%±1.03% vs 18.60±1.08%, P<0.05)表达也明显降低, 而Bax的表达则明显增高(mRNA: 10.33%±1.18% vs 5.43%±0.70%, P<0.05; 蛋白: 13.07%±1.04% vs 6.23%±2.40%, P<0.05), 健择处理组上述指标与对照组相似.
结论: 阻断STAT3信号转导通路可以抑制人胰腺癌细胞增殖, 促进其凋亡, 健择联合AG490能起协同作用. AG490联合健择可能为胰腺癌治疗提供新的思路.
引文著录: 陈钢, 裘正军, 黄陈. AG490联合健择对人胰腺癌细胞生长的影响. 世界华人消化杂志 2007; 15(14): 1615-1621
Revised: March 15, 2007
Accepted: March 23, 2007
Published online: May 18, 2007
AIM: To investigate the effect of Janus kinase (JAK) specific inhibitor AG490 combined with gemcitabine on the proliferation of human pancreatic cancer cell line SW1990 and STAT3 signal transduction pathway as well as their mechanisms.
METHODS: Human pancreatic cancer cell line SW1990 was divided into control group, AG490-treated group, gemcitabine-treated group and AG490 + gemcitabine-treated group. After 48 h, the proliferation of SW1990 cells was detected by MTT assay. Flow cytometry was used to examine cell apoptosis. The expression of STAT3, Cyclin D1, Bcl-xL and Bax were detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively.
RESULTS: The proliferation of SW1990 cells was significantly lower in AG490 or gemcitabine group than that in control group (2.20 ± 0.25, 2.30 ± 0.220 vs 3.78 ± 0.42, P < 0.05), but the apoptosis rate was markedly higher (35.40% ± 3.08%, 34.64% ± 1.38% vs 16.49% ± 1.45%, P < 0.05). Moreover, the proliferation (1.49 ± 0.15) and apoptosis (43.80% ± 1.57%) had notable difference between AG490+gemcitabine group and AG490 or gemcitabine group. After 48 h, AG490 remarkably down-regulated the expression of p-STAT3 (13.83% ± 0.64% vs 79.87% ± 1.43%, P < 0.05), and the expression of Cyclin D1 (mRNA: 15.63% ± 0.59% vs 43.83% ± 0.64%, P < 0.05; protein: 17.50% ± 0.92% 49.87% ± 1.27%, P < 0.05), Bcl-xL (mRNA: 13.93% ± 0.21% vs 75.70% ± 0.46%, P < 0.05; protein: 34.17% ± 1.70% vs 83.93% ± 0.80%, P < 0.05) and Survivin (mRNA: 58.27% ± 0.42% vs 82.93% ± 1.68%, P < 0.05; protein: 13.23% ± 1.03% vs 18.60 ± 1.08%, P < 0.05) were also decreased in comparison with that in control group; however, Bax expression was increased (mRNA: 10.33% ± 1.18% vs 5.43% ± 0.70%, P < 0.05; protein: 13.07% ± 1.04% vs 6.23% ± 2.40%, P < 0.05). There was no difference between gemcitabine and control group.
CONCLUSION: Blockade of STAT3 signal pathway inhibits the proliferation and promotes the apoptosis of SW1990 cells. AG490 combined with gemcitabine shows a synergic effect, which provides a new therapeutic approach for pancreatic cancer therapy.
- Citation: Chen G, Qiu ZJ, Huang C. Effect of AG490 combined with gemcitabine on the growth of human pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2007; 15(14): 1615-1621
- URL: https://www.wjgnet.com/1009-3079/full/v15/i14/1615.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i14.1615
STAT3是信号转导与转录激活因子家族(signal transducers and activators of transcription, STATs)家族的一员. 多种细胞外信号, 如生长因子, 细胞因子, 非受体酪氨酸激酶, G蛋白等, 都可通过直接或间接激活JAK激活STAT3. 研究表明STAT3在头颈部鳞状细胞癌[1]、恶性黑色素瘤[2]、前列腺癌[3]、胰腺癌[4]、胃癌[5]等多种肿瘤组织与细胞系中异常表达和激活, 并与肿瘤的增殖分化、细胞凋亡、血管生成、侵袭转移和免疫逃避密切相关[6-8]. 本课题前期研究已在胰腺癌组织中发现磷酸化STAT3(p-STAT3)和Cyclin D1均过表达[9], 用AG490阻断STAT3转导通路可抑制人胰腺癌细胞增殖, 促进细胞凋亡, 并且AG490的剂量与其作用成正相关[10]. 本实验探讨AG490联合健择对高表达STAT3的人胰腺癌细胞系SW1990的生长增殖的影响和其机制.
DMEM细胞培养基、小牛血清、胰蛋白酶购自Hyclone公司, 噻唑蓝(MTT)购自Sigma公司. STAT3, p-STAT3第一抗体(针对705位酪氨酸磷酸化位点)均购自Cell Signal公司, Bcl-xL, Bax, Survivin, Cyclin D1第一抗体购自武汉博士德公司. 细胞核蛋白抽提试剂盒购自ActiveMotif 公司, RIPA细胞裂解液、辣根过氧化物酶结合的第二抗体和电化学发光(ECL)试剂盒购自Santa Cruz公司. JAK特异性抑制剂AG490购自Calbiochem公司, 健择(Gemcitabine, 吉西他滨)由美国礼来公司提供. 人胰腺癌细胞系SW1990 购自ATCC. 细胞在含100 mL/L小牛血清、100 kU/L青霉素和100 mg/L链霉素的DMEM完全培养基内, 37℃ 50 mL/L CO2饱和湿度孵箱中培养. 细胞单层贴壁生长, 至70%-80%融合时以2.5 g/L胰蛋白酶消化传代.
分4组: 对照组: 细胞于无血清培养液中培养48 h; AG490组: 细胞于加入AG490的无血清培养液中培养48 h; 健择组: 细胞于加入健择的无血清培养液中培养48 h; AG490+健择组: 细胞于同时加入AG490和健择的无血清培养液中培养48 h. 溶液中含等量DMSO, 各组DMSO体积分数不超过0.1%. 其中AG490和健择的浓度参照前期实验根据量效曲线选择药物浓度AG490: 40 μmol/L; 健择: 0.4 μmol/L[10-11].
1.2.1 MTT法检测细胞增殖: 取对数生长期细胞, 制成单细胞悬液, 按5×103个/孔(每孔100 μL)接种于96孔板, 贴壁生长后, 无血清培养细胞18-20 h, 使细胞同步化. 分别加入AG490, 健择和同时加同浓度的AG490联合健择, 每组设8个平行孔, 对照组加无血清培养基, 继续培养48 h后, 每孔加入浓度为5 g/L的MTT 20 μL, 继续培养4 h, 吸弃上清液, 每孔加入150 μL DMSO, 振荡10 min, 用酶标仪测定490 nm波长处每孔的光密度(A)值, 细胞增殖率为48 h与0 h的A490的相对比值, 绘制图.
1.2.2 流式细胞仪检测细胞凋亡: 各组处理细胞48 h后, 收集细胞, 制成单细胞悬液, 调整细胞数量为1×109/L. 4℃条件下500 r/min离心5 min, 弃上清. 加入1500 μL A溶液(胰酶消化液)充分作用, 再加入1500 μL B溶液(胰酶抑制酶液)5 min, 胶乳1500 μL C溶液(PI-碘化丙锭)作用15 min以上. 200目尼龙网过滤, 上机做采样分析.
1.2.3 Western blot检测蛋白表达: 各组细胞培养48 h后, 提取细胞蛋白. 总蛋白提取: 参照Santa Cruz公司提取方法进行. 细胞核蛋白提取参照ActiveMotif公司提取方法进行. 分别将相同含量的蛋白样品和2×上样缓冲液等体积混合, 100℃水中煮沸5 min使蛋白变性. SDS-PAGE 电泳后电转移至硝酸纤维素膜上. 5 g/L脱脂奶粉封闭后, 加入1∶1000稀释的第一抗体, 4℃孵育过夜, TBS洗膜后, 加入1∶2000稀释的第二抗体, 室温60 min, TBS洗膜后, ECL增强发光, X线曝光5 min. 以β-actin蛋白作内参照, 以BANDSCAN图像分析软件进行光密度积分值分析.
1.2.4 RT-PCR检测各基因表达: 各组细胞培养48 h后按照TRIzol说明书分别抽提细胞总RNA, 紫外分光光度仪定量. 取2 μg总RNA按试剂盒步骤逆转录为cDNA. PCR经优化反应条件, 总体系为50 μL, 其中10×Buffer 5 μL, MgCl2 5 μL, 10 mmol/L dNTP 1 μL, primer(10 mol/L)各1 μL, Taq酶0.6 U, cDNA 2 μL, 补足水至50 μL反应条件为94℃变性5 min, 变性94℃ 30 s, 退火58℃ 30 s, 延伸72℃ 30 s, 循环30次, 终末延伸72℃ 10 min. PCR产物经15 g/L琼脂糖凝胶(含5 g/L溴化乙锭)电泳分离, 紫外灯下观察并拍照. 凝胶成像系统分析条带灰度值, 并与GAPDH相比较计算结果.
统计学处理 实验重复3次, 独立完成. 实验数据用mean±SD表示, 应用SPSS11.5统计学软件, 采用单因素方差(ANOVA)分析及双变量相关分析, 以P<0.05为差异有显著性意义.
AG490, 健择, 及AG490联合健择作用SW1990 48 h后, 细胞增殖率分别为2.20±0.25, 2.30±0.22, 1.485±0.15, 明显低于对照组(3.78±0.42, P<0.05), 并且AG490联合健择后细胞增值率明显低于AG490或健择组(P<0.05)(图1).
AG490组和健择组凋亡比例分别为35.40%±3.08%和34.64%±1.38%, 明显高于对照组的16.49%±1.45%(P<0.05); 而AG490联合健择组凋亡比例43.80%±1.57%明显高于单独AG490组或健择组(P<0.05)(图2).
AG490或AG490联合健择作用48 h后SW1990细胞中Cyclin D1,Bcl-xL,Survivin的mRNA表达明显低于对照组和健择组(P<0.05), 而Bax的mRNA表达是明显增强的(P<0.05), 健择组则与对照组相似(P>0.05)(表1,图3A). AG490组和AG490联合健择组中的p-STAT3, Cyclin D1, Bcl-xL, Survivin的蛋白表达明显低于对照组和健择组(P<0.05), Bax蛋白表达明显增强(P<0.05); 健择组与对照组各指标相似(P>0.05)(表2, 图3B).
JAK/STATs信号转导通路与细胞增殖、分化及凋亡密切相关, STAT3的异常活化可导致细胞异常增殖和恶性转化. STAT3是近年来研究异常活跃的核转录因子, 在细胞因子等的作用下, JAK活化后诱导STAT3酪氨酸磷酸化激活形成p-STAT3, 2个分子p-STAT3形成二聚体进入细胞核, 与目的基因的启动子区域结合, 调节靶基因转录[12-13]. 研究表明在多种肿瘤组织和细胞中存在STAT3的异常活化和过表达, 并上调与细胞增殖、细胞凋亡、血管生成和侵袭转移等相关基因的表达, 在肿瘤的发生和发展中起重要作用, 目前STAT3已被定义为癌基因, 成为肿瘤研究中的热点之一[7].
α-氰基-(3, 4-羟基)N-苄苯乙烯胺(AG490)是JAK2的特异性拮抗剂, 是一种PTK抑制物[14]. 有资料[15]证实人脐静脉内皮细胞在可溶性白介素6(IL-6)受体α的诱导下可表达相关癌基因蛋白α, 将AG490作用于人脐静脉内皮细胞, 能特异性阻断JAK2信号转导通路, 内皮细胞中生长相关癌基因蛋白α的表达受到抑制. 许多研究均表明AG490可以明显抑制STAT3的活性, 抑制肿瘤细胞的增殖和诱导细胞凋亡. Ni et al[16]发现前列腺癌细胞中STAT3异常激活, 而使用AG490可阻断STAT3活化, 抑制前列腺癌细胞的体外增殖力和体内致瘤性. Burke et al[17]发现乳腺癌细胞株MAD-MB-468和卵巢癌细胞株Caov-3和MDAH2774中, AG490均可抑制STAT3的持续活化, 而诱导乳腺癌细胞凋亡. Toyonaga et al[18]分别使用AG490和显性失活(dominant negative)STAT3处理胰腺癌细胞, 发现AG490能显著抑制高表达STAT3细胞株Panc1和Kp4细胞的生长增殖. 本研究发现在人胰腺癌细胞株SW1990中存在p-STAT3的过表达, AG490作用48 h后p-STAT3表达下调, 明显抑制细胞增殖, 并可诱导细胞凋亡, 提示AG490可以通过抑制STAT3的激活而抑制细胞的增殖, 诱导细胞凋亡. 我们还发现健择联合AG490可以起到协同作用, 其抑制人胰腺癌细胞增殖, 促进凋亡的作用强于单用健择. 健择主要作用于S期, 使细胞停滞于S期产生细胞毒性[19]. 而Tomita et al[20]发现AG490通过改变p53, p21, Pim-1, c-Myc, Cyclin D2, Cdk4的表达阻滞ATL(adult T-cell Leukemia)细胞周期于G1期. Chun et al[21]发现联合使用Gefitinib(一种特异性的细胞周期阻滞剂, 通过抑制EGFR的磷酸化阻滞细胞周期于G1期)和健择, 其促头颈部癌细胞株UMSCC-1凋亡的作用优于单用健择; 并且先用健择培养24 h后用Gefitinib的效果优于先用Gefitinib培养24 h再加健择. 他们认为其机理可能是因为健择作用于细胞周期的S期而Gefitinib则阻滞细胞周期于G1, 先用健择后用Gefitinib可以起到协同作用; 而先用Gefitinib后用健择则使细胞大都阻滞于G1期, 因而未能增强健择的化疗效果. 本实验结果与Patrick et al的结果相似, 其机理可能也与AG490和健择作用于细胞不同周期有关.
本研究进一步研究了AG490和健择抑制胰腺癌细胞增殖, 诱导细胞凋亡的分子机制, 发现AG490作用SW1990细胞48 h后, 细胞周期素Cyclin D1的mRNA和蛋白表达下调, 而健择没有这种作用, 表明阻断STAT3活化可通过下调Cyclin D1的表达而抑制SW1990细胞的增殖. 本研究也发现用AG490培养细胞48 h后, p-STAT3的表达明显下调, Bcl-xL, Survivin mRNA和蛋白表达明显下调, Bax的表达则上调, 而细胞凋亡百分比明显升高, 健择对这些基因表达无明显作用. STAT3正是通过对抗凋亡基因Bcl-xL、Mcl-l、Survivin等调控而增强细胞抵抗凋亡的能力, 促进其恶性转化[22-23]. Leslie et al[24]在乳腺癌中发现Cyclin D1和STAT3的高表达, 用STAT3-C可上调Cyclin D1 mRNA的表达, 并且发现Cyclin D1启动子上存在STAT3的结合位点. Amin et al[25]使用显性负性STAT3抑制间变性大细胞淋巴瘤细胞的STAT3表达, 可显著下调Bcl-xL, Survivin等抗凋亡基因的表达, 诱导细胞凋亡. Gritsko et al[26]发现在对化疗耐受的高危人乳腺癌患者中, Survivin表达的增加与STAT3的增加是直接相关的(P = 0.001), STAT3可直接结合并调节Survivin启动子, 并且直接的阻断STAT3的信号通路则抑制了Survivin的表达. Nielsen et al[27]发现在蕈样肉芽肿肿瘤期细胞中用AG490在抑制STAT3表达的同时, Bcl-xL的表达下调, Bax的表达则上调. Bhardwai et al[28]则发现用白藜芦醇作用于多发性骨髓瘤细胞, 通过抑制STAT3, 进而抑制了Cyclin D1, Bcl-xL, Survivin, 上调了Bax, 促进骨髓瘤细胞的凋亡, 抑制了增殖. 可见AG490可能正是通过抑制STAT3的活化, 改变STAT3下游Cyclin D1, Bcl-xL, Bax, Survivin等基因的表达, 进而抑制人胰腺癌细胞的增殖, 促进凋亡的.
本研究初步探讨了AG490联合健择对高表达STAT3的人胰腺癌细胞系SW1990生长增殖的作用, 结果表明AG490联合健择可进一步增强AG490阻断STAT3转导通路的作用抑制人胰腺癌细胞的增殖, 促进其凋亡. 说明联合AG490和健择可能可以提高对胰腺癌的化疗效果, 提高疗效. 但STAT3转导通路的异常激活及协同作用的机制还需进一步研究, 研究STAT3信号转导通路可能为治疗胰腺癌提供新的思路.
胰腺癌是致死性最强的人类肿瘤之一, 占男性肿瘤死亡的第5位, 女性第6位, 由于其起病隐匿, 较少特异性症状和体征, 胰腺癌患者手术切除率不到20%, 术后复发率和转移率高. 健择(吉西他滨)是胰腺癌化疗的一线药物, 但如何提高化疗的效果和减少耐药性是临床需要解决的重要问题.
自从1985年Slamon教授通过与HER-2/neu癌基因的发现者Axel Ullrich博士合作, 确立了HER-2/neu与浸润性乳腺癌患者预后的关系, 从而为肿瘤的分子靶向治疗奠定了基础. 目前肿瘤的分子靶向治疗是肿瘤治疗的研究热点. 最新研发的一种酪氨酸酶抑制剂Lapatinib, 在体外试验中显示了对多种人类肿瘤细胞有活性. AG490作为酪氨酸酶抑制剂, 也在多种肿瘤中证实能抑制肿瘤细胞增殖, 促进凋亡.
Toyonaga et al使用AG490处理胰腺癌细胞, 发现AG490能显著抑制高表达STAT3细胞株Panc1和Kp4细胞的生长增殖. 马向涛 et al用AG490联合5-Fu, 处理结肠癌细胞, 发现两者联合在抑制结肠癌细胞增殖, 促进癌细胞凋亡方面能起到Ð同作用.
本实验用特异性的酪氨酸酶抑制剂AG490联合健择处理高表达STAT3细胞株SW1990, 观察对癌细胞增殖凋亡的影响, 并探讨其机制. 其结果对指导临床胰腺癌治疗有一定意义.
本实验结果表明联合应用AG490和健择可以起到协同作用, 这对临床提高胰腺癌治疗效果, 减少化疗耐药性有一定的提示作用. 研究STAT3信号转导通路可能为治疗胰腺癌提供新的思路.
该文研究了AG490联合健择对人胰腺癌细胞生长的影响, 该实验选题符合该领域的研究热点, 设计科学、合理, 作者掌握了相关的实验基础理论和专门实验技术, 统计处理符合统计学方法, 结论可靠, 为胰腺癌的治疗提供新思路, 有参考价值.
电编: 何基才 编辑:张焕兰
| 1. | Grandis JR, Drenning SD, Zeng Q, Watkins SC, Melhem MF, Endo S, Johnson DE, Huang L, He Y, Kim JD. Constitutive activation of Stat3 signaling abrogates apoptosis in squamous cell carcinogenesis in vivo. Proc Natl Acad Sci U S A. 2000;97:4227-4232. [PubMed] [DOI] |
| 2. | Kortylewski M, Jove R, Yu H. Targeting STAT3 affects melanoma on multiple fronts. Cancer Metastasis Rev. 2005;24:315-327. [PubMed] [DOI] |
| 3. | Lee SO, Lou W, Qureshi KM, Mehraein-Ghomi F, Trump DL, Gao AC. RNA interference targeting Stat3 inhibits growth and induces apoptosis of human prostate cancer cells. Prostate. 2004;60:303-309. [PubMed] [DOI] |
| 4. | Scholz A, Heinze S, Detjen KM, Peters M, Welzel M, Hauff P, Schirner M, Wiedenmann B, Rosewicz S. Activated signal transducer and activator of transcription 3 (STAT3) supports the malignant phenotype of human pancreatic cancer. Gastroenterology. 2003;125:891-905. [PubMed] [DOI] |
| 5. | Yu LF, Cheng Y, Qiao MM, Zhang YP, Wu YL. Activation of STAT3 signaling in human stomach adenocarcinoma drug-resistant cell line and its relationship with expression of vascular endothelial growth factor. World J Gastroenterol. 2005;11:875-879. [PubMed] [DOI] |
| 6. | Jing N, Tweardy DJ. Targeting Stat3 in cancer therapy. Anticancer Drugs. 2005;16:601-607. [PubMed] [DOI] |
| 7. | Haura EB, Turkson J, Jove R. Mechanisms of disease: Insights into the emerging role of signal transducers and activators of transcription in cancer. Nat Clin Pract Oncol. 2005;2:315-324. [PubMed] [DOI] |
| 8. | Hsieh FC, Cheng G, Lin J. Evaluation of potential Stat3-regulated genes in human breast cancer. Biochem Biophys Res Commun. 2005;335:292-299. [PubMed] [DOI] |
| 11. | 要 洁, 林 晨, 冯 奉仪, 张 雪燕, 付 明, 梁 萧, 吴 世凯, 董 梅, 宋 海峰, 钱 海利. 人胰腺癌吉西他滨耐药细胞系的建立及耐药特性的检测. 实用肿瘤杂志. 2005;20:199-203. |
| 12. | Bromberg JF, Wrzeszczynska MH, Devgan G, Zhao Y, Pestell RG, Albanese C, Darnell JE Jr. Stat3 as an oncogene. Cell. 1999;98:295-303. [PubMed] [DOI] |
| 14. | Li WQ, Dehnade F, Zafarullah M. Oncostatin M-induced matrix metalloproteinase and tissue inhibitor of metalloproteinase-3 genes expression in chondrocytes requires Janus kinase/STAT signaling pathway. J Immunol. 2001;166:3491-3498. [PubMed] [DOI] |
| 15. | Matsumiya T, Imaizumi T, Itaya H, Shibata T, Yoshida H, Sakaki H, Kimura H, Satoh K. Production of growth related oncogene protein-alpha in human umbilical vein endothelial cells stimulated with soluble interleukin-6 receptor-alpha: role of signal transducers, janus kinase 2 and mitogen-activated kinase kinase. Life Sci. 2002;70:3179-3190. [PubMed] [DOI] |
| 16. | Ni Z, Lou W, Leman ES, Gao AC. Inhibition of constitutively activated Stat3 signaling pathway suppresses growth of prostate cancer cells. Cancer Res. 2000;60:1225-1228. [PubMed] |
| 17. | Burke WM, Jin X, Lin HJ, Huang M, Liu R, Reynolds RK, Lin J. Inhibition of constitutively active Stat3 suppresses growth of human ovarian and breast cancer cells. Oncogene. 2001;20:7925-7934. [PubMed] [DOI] |
| 18. | Toyonaga T, Nakano K, Nagano M, Zhao G, Yamaguchi K, Kuroki S, Eguchi T, Chijiiwa K, Tsuneyoshi M, Tanaka M. Blockade of constitutively activated Janus kinase/signal transducer and activator of transcription-3 pathway inhibits growth of human pancreatic cancer. Cancer Lett. 2003;201:107-116. [PubMed] [DOI] |
| 19. | McGinn CJ, Shewach DS, Lawrence TS. Radiosensitizing nucleosides. J Natl Cancer Inst. 1996;88:1193-1203. [PubMed] [DOI] |
| 20. | Tomita M, Kawakami H, Uchihara JN, Okudaira T, Masuda M, Matsuda T, Tanaka Y, Ohshiro K, Mori N. Inhibition of constitutively active Jak-Stat pathway suppresses cell growth of human T-cell leukemia virus type 1-infected T-cell lines and primary adult T-cell leukemia cells. Retrovirology. 2006;3:22. [PubMed] [DOI] |
| 21. | Chun PY, Feng FY, Scheurer AM, Davis MA, Lawrence TS, Nyati MK. Synergistic effects of gemcitabine and gefitinib in the treatment of head and neck carcinoma. Cancer Res. 2006;66:981-988. [PubMed] [DOI] |
| 22. | Kanda N, Seno H, Konda Y, Marusawa H, Kanai M, Nakajima T, Kawashima T, Nanakin A, Sawabu T, Uenoyama Y. STAT3 is constitutively activated and supports cell survival in association with survivin expression in gastric cancer cells. Oncogene. 2004;23:4921-4929. [PubMed] [DOI] |
| 23. | Epling-Burnette PK, Liu JH, Catlett-Falcone R, Turkson J, Oshiro M, Kothapalli R, Li Y, Wang JM, Yang-Yen HF, Karras J. Inhibition of STAT3 signaling leads to apoptosis of leukemic large granular lymphocytes and decreased Mcl-1 expression. J Clin Invest. 2001;107:351-362. [PubMed] [DOI] |
| 24. | Leslie K, Lang C, Devgan G, Azare J, Berishaj M, Gerald W, Kim YB, Paz K, Darnell JE, Albanese C. Cyclin D1 is transcriptionally regulated by and required for transformation by activated signal transducer and activator of transcription 3. Cancer Res. 2006;66:2544-2552. [PubMed] [DOI] |
| 25. | Amin HM, McDonnell TJ, Ma Y, Lin Q, Fujio Y, Kunisada K, Leventaki V, Das P, Rassidakis GZ, Cutler C. Selective inhibition of STAT3 induces apoptosis and G(1) cell cycle arrest in ALK-positive anaplastic large cell lymphoma. Oncogene. 2004;23:5426-5434. [PubMed] [DOI] |
| 26. | Gritsko T, Williams A, Turkson J, Kaneko S, Bowman T, Huang M, Nam S, Eweis I, Diaz N, Sullivan D. Persistent activation of stat3 signaling induces survivin gene expression and confers resistance to apoptosis in human breast cancer cells. Clin Cancer Res. 2006;12:11-19. [PubMed] [DOI] |
| 27. | Nielsen M, Kaestel CG, Eriksen KW, Woetmann A, Stokkedal T, Kaltoft K, Geisler C, Ropke C, Odum N. Inhibition of constitutively activated Stat3 correlates with altered Bcl-2/Bax expression and induction of apoptosis in mycosis fungoides tumor cells. Leukemia. 1999;13:735-738. [PubMed] [DOI] |
| 28. | Bhardwaj A, Sethi G, Vadhan-Raj S, Bueso-Ramos C, Takada Y, Gaur U, Nair AS, Shishodia S, Aggarwal BB. Resveratrol inhibits proliferation, induces apoptosis, and overcomes chemoresistance through down-regulation of STAT3 and nuclear factor-kappaB-regulated antiapoptotic and cell survival gene products in human multiple myeloma cells. Blood. 2007;109:2293-2302. [PubMed] [DOI] |