修回日期: 2007-02-04
接受日期: 2007-02-13
在线出版日期: 2007-05-08
目的: 膜研究膜型-1基质金属蛋白酶(MT1-MMP)反义RNA对人胃癌细胞BGC823靶基因表达和侵袭特性的影响.
方法: 利用基因重组技术构建人MT1-MMP反义RNA真核表达载体, 转染人胃癌细胞BGC823, 应用RT-PCR、MTT、明胶酶谱和体外侵袭实验等方法观察人胃癌细胞BGC823转染前后, MT1-MMP mRNA表达水平、细胞生长、明教酶A活性及细胞体外侵袭能力等指标的变化.
结果: 成功构建了MT1-MMP反义RNA真核表达载体pasMMP14, 将其转染胃癌细胞BGC823后, 与阴性对照组相比, 实验组MT1-MMP mRNA表达水平降低, 抑制率为36%. 转染48 h, 明教酶A的活化受到了明显抑制. 转染72 h, 细胞增殖明显受抑(t = 2.358, P<0.01 vs 空白组; t = 2.727 P<0.01 vs 阴性组). 实验组的穿膜细胞数明显低于空白对照组和阴性对照组(t = 5.744, P<0.01; t = 5.695, P<0.01).
结论: 反义RNA对人胃癌细胞MT1-MMP基因表达和侵袭能力具有明显的抑制作用, MT1-MMP基因可作为胃癌抗侵袭治疗的分子靶点.
引文著录: 胡楠, 周晓武, 付汉江, 邢瑞云, 孔维, 郑晓飞. 反义RNA对胃癌细胞MT1-MMP基因表达和侵袭性的抑制作用. 世界华人消化杂志 2007; 15(13): 1470-1474
Revised: February 4, 2007
Accepted: February 13, 2007
Published online: May 8, 2007
AIM: To investigate the influence on the gene expression of membrane-type 1 matrix metalloproteinase (MT1-MMP) and invasiveness of human gastric carcinoma cell line BGC823 by antisense RNA.
METHODS: The eukaryotic expression vector carrying MT1-MMP antisense RNA was constructed with recombinant technology and then transfected into human gastric cancer cell line BGC823. The changes of MT1-MMP mRNA expression, cell proliferation, activation of gelatinase A and cell invasion ability were examined by reverse transcription-polymerase chain reaction (RT-PCR), MTT assay, zymography and Transwell invasion assay, respectively.
RESULTS: The eukaryotic expression vector (named pasMMP14) containing MT1-MMP antisense RNA was successfully constructed and transfected into BGC823 cells. The expression of MT1-MMP mRNA was down-regulated with an inhibitory rate of 36%, in comparison with that in negative control group. At the 48th hour after transfection with pasMMP14, the activity of gelatinase A was dramatically inhibited. After 72 hours, cell proliferation was significantly decreased as compared with that in pcDNA3.0 group and normal control group (t = 2.358, P < 0.01; t = 2.727, P < 0.01). Transwell invasion assay showed that the invasive property was greatly suppressed in pasMMP14-transfected group as compared with that in pcDNA3.0 group and normal control group (t = 5.744, P < 0.01; t = 5.695, P < 0.01).
CONCLUSION: Antisense RNA can evidently inhibit the gene expression of MT1-MMP and invasiveness of gastric cancer cells, suggesting that MT1-MMP gene may be a molecular target of anti-invasion therapy for gastric cancer.
- Citation: Hu N, Zhou XW, Fu HJ, Xing RY, Kong W, Zheng XF. Inhibitory effect of antisense RNA on the gene expression of membrane-type 1 matrix metalloproteinase and invasiveness of human gastric carcinoma cells. Shijie Huaren Xiaohua Zazhi 2007; 15(13): 1470-1474
- URL: https://www.wjgnet.com/1009-3079/full/v15/i13/1470.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i13.1470
肿瘤侵袭与转移是一个多步骤、多环节的过程, 涉及肿瘤细胞与宿主之间复杂的相互作用, 多种基因及其产物参与这一过程的调控, 而细胞外基质和基底膜的降解是其中的关键环节. MT1-MMP是第一个鉴定出的膜型基质金属蛋白酶, 其功能是激活明胶酶A, 促进明胶酶A对基底膜成分如Ⅳ型胶原和层黏连蛋白的降解, 且其自身也发挥降解细胞外基质的作用[1-2]. 目前的研究表明, MT1-MMP在胃癌组织中的高表达促进了胃癌的直接侵袭和远处转移[3-4], 我们先前的研究也得出了类似的结论[5-6]. 本实验通过构建抑制MT1-MMP表达的反义RNA真核表达载体, 脂质体导入人胃癌细胞系BGC823, 研究其对胃癌细胞MT1-MMP基因表达和侵袭能力的影响, 探讨MT1-MMP基因可否成为胃癌抗侵袭治疗的分子靶点.
人胃癌细胞BGC823由本实验室保存; 真核表达载体pcDNA3.0购于Invitrogen; EcoRⅠ和BamHⅠ限制性内切酶购于TaKaRa公司; RT-PCR试剂盒购于Invitrgen公司; DMEM、胎牛血清购于美国Gibco公司; 脂质体Lipofectmine2000购于Invitrogen公司; 四甲基偶氮唑蓝(MTT)购于Sigma公司; YM-30离心超滤管30KD购于Millipore公司; Transwell细胞培养小室购于Costar公司; Matrigel胶购于美国BD公司; 引物序列由上海生工生物技术有限公司合成.
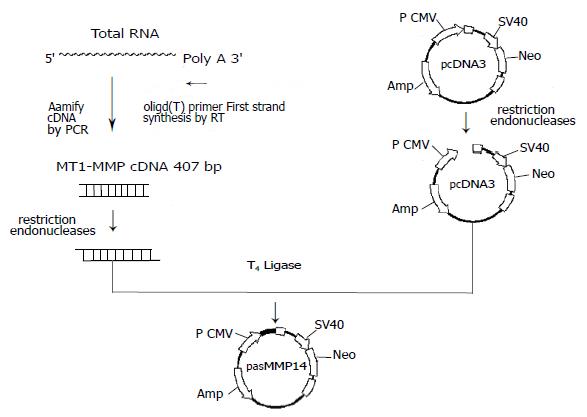
1.2.1 pasMMP14反义载体的构建: Trizol试剂抽提细胞总RNA, 操作按说明书进行. 取1 μg RNA反转录合成cDNA. 以MT1-MMP的cDNA全长为模板, 参考文献中的引物F1: 5'CCGGAATTCAAGTTCAGTGCCTACCGAAG3' F2: 5'CGCGGATCCCTTGTCTGGAACACCACATC3' (5'端含有EcoRⅠ, BamHⅠ酶切位点)扩增407 bp MT1-MMP cDNA片段[7]. 目的片段经琼脂糖凝胶电泳鉴定并回收后, EcoRⅠ, BamHⅠ双酶切, 反向连接到pcDNA3.0真核表达载体上, 转化JM109感受态. 对菌落PCR鉴定的阳性克隆进行双酶切和测序鉴定.
1.2.2 细胞培养与转染: 胃癌细胞用含100 mL/L胎牛血清的DMEM培养基在37 ℃, 50 mL/L CO2条件下培养. 待细胞长至对数生长期且80%融合时, 分别将载体pcDNA3.0和反义载体pasMMP14转染细胞. 操作按照Lipofectmine2000试剂的说明书进行转染.
1.2.3 RT-PCR检测MT1-MMP mRNA的表达: 在6孔板中每孔接种4×105细胞, 培养24 h. 取2 μg载体pcDNA3.0和反义载体pasMMP14转染细胞. 转染48 h后, TRIzol试剂提取细胞总RNA, 步骤按说明书. RNA沉淀于1 g/L DEPC处理水中, 紫外分光光度计测定浓度. 42 ℃恒温60 min进行逆转录反应后, 70 ℃加热15 min, 灭活逆转录酶活性. MT1-MMP引物: 5'CTTTTCCATCCCCTGACATACC 3'(上游), 5'CTGACTGAGCAACGAAGACCCT 3'(下游); 内参β-actin的引物: 5'GAAGGTGAAGGTCGGAGTC 3'(上游), 5'GAAGATGGTGATGGGATTTC 3'(下游). PCR条件均为: 94 ℃, 5 min; 94 ℃, 30 s; 60 ℃, 30 s; 72 ℃, 30 s(共30个循环); 72 ℃, 10 min. pcDNA3.0、paMMP14中MT1-MMP的扩增产物经10 g/L琼脂糖凝胶电泳和凝胶分析系统观察并照像.
1.2.4 明胶酶谱法分析明胶酶A的活性: 将生长状态良好的细胞, 分散后制成单细胞悬液, 按每孔1×105个细胞的密度接种于24孔细胞培养板中, 培养12 h. 弃去培养液, PBS洗2次后, 换成1mL无血清培养液继续培养, 12 h后转染. 分别收集转染后0, 12, 24, 36, 48 h的条件细胞培养液. 取1 mL此条件培养液用蛋白浓缩柱浓缩至约20 μL, 与2×SDS样品缓冲液等体积混合. 上样50 μg于100 g/L聚丙烯酰胺凝胶(含1 g/L明胶)在4 ℃、恒压120 V条件下电泳后, 凝胶置TritonX-100中漂洗30 min, 浸入反应缓冲液(50 mmol/L Tris-HCl, Ph8.0; 50 mmol/L NaCl, 10 mmol/L CaCl2)37 ℃孵育18 h, 5 g/L考马斯亮蓝R250染色、脱色至蓝色背景下显现出清晰的白色条带为止, 在光密度扫描下扫描摄片.
1.2.5 MTT比色法测定细胞生长曲线: 将生长状态良好的细胞, 分散后制成单细胞悬液, 按每孔4×103个细胞的密度接种于96孔细胞培养板中, 培养24 h后转染pasMMP14反义载体. 分别于不同时间点每孔加入20 μL 新配制的MTT(0.5 g/L). 于37 ℃继续孵育4 h后, 弃去MTT液, 加入150 μL DMSO混合均匀, 用酶联免疫检测仪测定各孔在492 nm波长的A值, 并计算平均值.
1.2.6 细胞体外侵袭能力检测: 将24孔板中的Transwell小室预冷至4 ℃. 取出Transwell培养板(膜孔径8.0 μm)在下室加入500 μL无血清NIH3T3细胞培养上清作趋化因子, Transwell杯底部加入50 μL无血清DMEM稀释的Matrigel, 37 ℃、30 min条件下风干, 使之在微孔滤膜上重组为基底膜结构. 上室加入正常细胞、转染pcDNA3.0及pasMMP14细胞的细胞悬液, 细胞数量为1×105 mL, 50 mL/L CO2, 37 ℃条件下, 培养24 h后轻轻拭去杯底部Matrigel和未浸润的细胞, 950 mL/L乙醇固定30 min, 结晶紫染色, 光镜下观察并随机选取4个视野, 计数穿膜细胞数并取其平均值, 以穿膜细胞的相对数目代表侵袭力.
统计学处理 数据用mean±SD表示, 采用SPSS11.0软件进行t检验统计分析, P<0.05具有显著性差异.
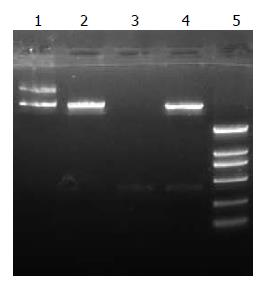
应用RT-PCR技术以BGC823细胞的cDNA为模板, 以含EcoRⅠBamHⅠ酶切位点的引物扩增出407 bp MT1-MMP片段. 目的片段经琼脂糖凝胶电泳鉴定并回收后, EcoRⅠBamHⅠ双酶切, 反向连接到pcDNA3.0真核表达载体上, 转化JM109感受态, 得到阳性克隆(pasMMP14反义载体的构建流程如图1). 对菌落PCR鉴定的阳性克隆进行双酶切(图2)和测序鉴定. 结果表明, 成功构建了pasMMP14反义载体.
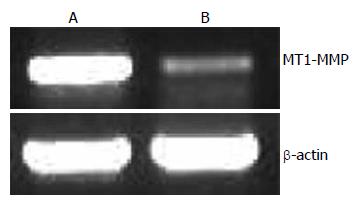
采用半定量RT-PCR技术检测MT1-MMP和内参β-actin的mRNA的表达水平(图3). 结果显示, 与阴性对照组相比, 实验组的细胞MT1-MMP的mRNA表达明显受抑, 抑制率为36%.
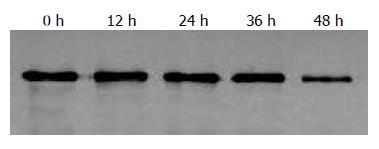
进行以明胶为底物的zymography分析, 结果显示, 在转染48 h的时候, pasMMP14的转染抑制了BGC823细胞中明胶酶A的活化(图4), 表明这种抑制作用是存在时间依赖性的.
MTT比色法检测结果显示(表1), 与空白组和阴性对照组相比, 在转染后72 h时实验组细胞的生长得到明显抑制(t = 2.358, P<0.01; t = 2.727 P<0.01). 空白组和阴性对照组相比较没有显著差异(P>0.05).
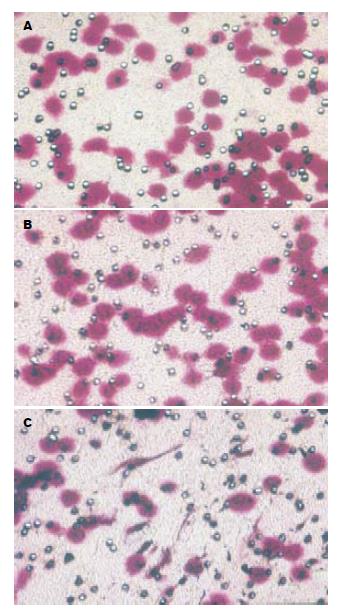
如果图5所示, 通过计数转染前后穿过人工基底膜的细胞数并进行比较后, 发现实验组穿过人工基底膜的细胞数明显减少(89±8.4), 与空白对照组(140±15.6)和阴性对照组(130±11.7)比较具有显著差异(t = 5.744, P<0.01; t = 5.695, P<0.01).而阴性对照组和实验组比较无显著差异(P>0.05).
现已知的膜型基质金属蛋白酶(membrane-type matrix metalloproteinase, MT-MMP)有6种, MT1-MMP是1994年Sato et al[8]首次克隆鉴定的MT-MMP家族第一个成员, 该基因定位于14q11,全长大于10 kb, 由10个外显子和9个内含子组成, 编码582个氨基酸[9]. 目前, 被认为是基质金属蛋白酶家族中与肿瘤侵袭转移关系最密切的酶[1-2]. 探讨MT1-MMP与胃癌侵袭与转移机制的关系成为近年来研究热点之一, 目前的研究可以得出如下结论: MT1-MMP基因及蛋白的高表达促进胃癌的局部侵袭和远处转移[3-6], 且与明胶酶A的活性密切相关, 他主要是作为明胶酶A的激活物, 促进明胶酶A活化而发挥降解基底膜作用, 同时本身也参与细胞外基质的降解, 调节黏附分子的作用和促进肿瘤新生血管的生成[1-2,10-12].
反义RNA是一种能与靶基因mRNA特异互补结合, 并抑制靶基因功能的小片段RNA. 自从1980年代初发现反义RNA以来, 他被作为一种调控特定基因表达的手段, 进行了广泛的研究. 近年来, 反义技术被广泛应用于肿瘤基因的研究中. 通过构建反义RNA表达载体封闭肿瘤相关癌基因或细胞因子表达, 抑制肿瘤生长的反义基因治疗方案已进入临床实验阶段[13]. 有关MT1-MMP反义RNA用于胃癌的侵袭研究尚未见报道, 为了寻找胃癌基因治疗的理想方案, 本实验中将MT1-MMP基因反义片段以定向克隆策略插入pcDNA3.0真核表达载体, 成功构建了pasMMP14反义真核表达载体. 我们观察到反义载体转染胃癌细胞BGC823后, MT1-MMP mRNA的表达受到了抑制, 细胞转染后72 h其增殖能力显著降低, 同时发现明胶酶A的活化也受到了抑制, BGC823细胞的体外侵袭力也明显降低. 综合本研究结果可以看出, MT1-MMP反义核酸抑制了胃癌细胞BGC823中MT1-MMP mRNA的表达, 进而抑制了细胞体外侵袭, 即MT1-MMP基因可以作为胃癌抗侵袭治疗的分子靶点, 而MT1-MMP反义RNA将来有可能成为一种新的、有效的抗肿瘤侵袭与转移药物. 同时加深了我们对于胃癌侵袭转移调控机制的理解和认识, 我们推测, 在MT1-MMP-明胶酶A-基底膜这一生物反应体系中, MT1-MMP既是明胶酶A活化的启动因素, 同时又是明胶酶A活性的控制因素, 二者同步发挥着促进胃癌侵袭与转移的作用.
膜型1-基质金属蛋白酶(MT1-MMP)与肿瘤侵袭转移关系密切, 他的基因高表达促进胃癌侵袭与转移, 其主要作用是激活明胶酶A, 同时还直接降解细胞外基质、调节黏附分子和促进肿瘤新生血管的形成.
通过构建反义RNA载体来抑制肿瘤MT1-MMP基因表达并进而抑制肿瘤的侵袭性仅在卵巢癌研究中有报道, 但未见在胃癌研究的报道.
成功构建真核表达的反义RNA载体, 转染胃癌细胞, 通过抑制MT1-MMP基因表达, 使明胶酶A活化受到抑制, 细胞增殖受抑, 最后细胞侵袭性受到抑制. 即采用反向遗传学方法进一步阐明了MT1-MMP与胃癌侵袭和转移的关系, 同时为后续的以MT1-MMP为靶标进行胃癌的基因治疗奠定了良好的实验基础.
业已证实, MT1-MMP是胃癌侵袭转移过程中的关键因素, 但MT1-MMP反义RNA对胃癌细胞侵袭的影响尚不清楚. 该文应用基因重组技术、细胞转染、RT-PCR、MTT、明胶酶谱等诸多先进的分子生物学方法研究发现, 反义RNA对胃癌细胞MT1-MMP基因表达和侵袭具有显著的抑制作用. 该研究结论对于探讨从基因水平治疗胃癌提供了新的思路和依据, 具有很好的学术价值和一定的临床意义.
电编: 郭海丽 编辑:王晓瑜
| 1. | Seiki M, Mori H, Kajita M, Uekita T, Itoh Y. Membrane-type 1 matrix metalloproteinase and cell migration. Biochem Soc Symp. 2003;253-262. [PubMed] [DOI] |
| 2. | Seiki M, Yana I. Roles of pericellular proteolysis by membrane type-1 matrix metalloproteinase in cancer invasion and angiogenesis. Cancer Sci. 2003;94:569-574. [PubMed] [DOI] |
| 3. | Mori M, Mimori K, Shiraishi T, Fujie T, Baba K, Kusumoto H, Haraguchi M, Ueo H, Akiyoshi T. Analysis of MT1-MMP and MMP2 expression in human gastric cancers. Int J Cancer. 1997;74:316-321. [PubMed] [DOI] |
| 4. | Yonemura Y, Endo Y, Takino T, Sakamoto K, Bandou E, Kinoshita K, Fushida S, Miwa K, Sugiyama K, Sasaki T. Membrane-type 1 matrix metalloproteinase enhances lymph node metastasis of gastric cancer. Clin Exp Metastasis. 2000;18:321-327. [PubMed] [DOI] |
| 7. | Wu M, Shi Y, Xi L, Li Q, Liao GN, Han ZQ, Lu YP, Ma D. Construction of antisense MT1-MMP vector and its inhibitory effects on invasion of human ovarian cancer cells. J Huazhong Univ Sci Technolog Med Sci. 2005;25:715-717. [PubMed] [DOI] |
| 8. | Sato H, Takino T, Okada Y, Cao J, Shinagawa A, Yamamoto E, Seiki M. A matrix metalloproteinase expressed on the surface of invasive tumour cells. Nature. 1994;370:61-65. [PubMed] [DOI] |
| 9. | Lohi J, Lehti K, Valtanen H, Parks WC, Keski-Oja J. Structural analysis and promoter characterization of the human membrane-type matrix metalloproteinase-1 (MT1-MMP) gene. Gene. 2000;242:75-86. [PubMed] [DOI] |
| 10. | Genis L, Galvez BG, Gonzalo P, Arroyo AG. MT1-MMP: universal or particular player in angiogenesis? Cancer Metastasis Rev. 2006;25:77-86. [PubMed] [DOI] |
| 11. | Takino T, Watanabe Y, Matsui M, Miyamori H, Kudo T, Seiki M, Sato H. Membrane-type 1 matrix metalloproteinase modulates focal adhesion stability and cell migration. Exp Cell Res. 2006;312:1381-1389. [PubMed] [DOI] |
| 12. | Sounni NE, Roghi C, Chabottaux V, Janssen M, Munaut C, Maquoi E, Galvez BG, Gilles C, Frankenne F, Murphy G. Up-regulation of vascular endothelial growth factor-A by active membrane-type 1 matrix metalloproteinase through activation of Src-tyrosine kinases. J Biol Chem. 2004;279:13564-13574. [PubMed] [DOI] |