修回日期: 2007-02-01
接受日期: 2007-02-08
在线出版日期: 2007-04-08
目的: 研究大鼠急性胰腺炎腺泡细胞凋亡情况, 凋亡调控基因Bax与凋亡蛋白酶Caspase-8的表达及其同疾病严重程度的关系.
方法: 胆胰管逆行注入不同浓度去氧胆酸钠方法制备大鼠急性胰腺炎模型, 设假手术(SO)组、急性水肿性胰腺炎(AEP)组和急性坏死性胰腺炎(ANP)组. 采用TUNEL技术检测胰腺腺泡细胞的凋亡, RT-PCR与免疫组化方法分别分析胰腺组织Bax, Caspase-8 mRNA及蛋白的表达, 对胰腺组织进行病理学评分并测定血清淀粉酶及IL-6, TNF-α含量.
结果: 与SO组比较, AEP与ANP组胰腺组织显示不同程度的病理损害, 血清淀粉酶(63413±6118, 1532134±17654 nkat/L vs 15736±483 nkat/L, P<0.01)及TNF-α (1.86±0.13, 2.97±0.14 mg/L vs 0.95±0.08 mg/L, P<0.01), IL-6 (47.10±7.05, 170.10±7.59 ng/L vs 29.20±4.47 ng/L, P<0.01)浓度显著升高, 且ANP组显著高于AEP组(P<0.05); AEP与ANP组腺泡细胞凋亡指数显著升高(22.09±3.71, 6.50±1.58 vs 0.13±0.05, P<0.01), 但ANP组显著低于AEP组(P<0.05). 同时发现, AEP与ANP组胰腺组织Bax (mRNA: 1.530±0.501, 1.046±0.337; 蛋白: 453.7±30.5, 339.4±26.7)和Caspase-8 (mRNA: 0.595±0.17, 0.505±0.173; 蛋白: 3606±337, 3134±231) mRNA及蛋白表达水平均显著高于SO组(Bax mRNA: 0.613±0.244, Bax蛋白: 245.2±30.0; Caspase-8 mRNA: 0.357±0.130, Caspase-8蛋白: 2396±266) (P<0.01), ANP组Bax mRNA及蛋白表达水平显著低于AEP组(1.046±0.337, 339.4±26.7 vs 1.530±0.501, 453.7±30.5, P<0.05), ANP组Caspase-8 mRNA及蛋白表达水平低于AEP组, 但差异不具有显著性意义.
结论: 急性胰腺炎时胰腺腺泡细胞发生凋亡伴随凋亡调控基因Bax与凋亡蛋白酶Caspase-8表达增加, 并同病情严重程度呈负相关关系.
引文著录: 陈海龙, 张桂信, 宫爱霞, 张利. 大鼠急性胰腺炎时胰腺腺泡细胞凋亡及Bax, Caspase-8的表达. 世界华人消化杂志 2007; 15(10): 1067-1072
Revised: February 1, 2007
Accepted: February 8, 2007
Published online: April 8, 2007
AIM: To investigate the apoptosis of pancreatic acinar cells and the expression of apoptosis-regulated genes Bax and Caspase-8 in experi-mental acute pancreatitis and their correlations with the severity of the disease in rats.
METHODS: The models of acute edematous pancreatitis (AEP) and acute necrotizing pancreatitis (ANP) were established by retrograde injection of different concentrations of sodium deoxycholate into the common biliary and pancreatic duct, and then the rats were randomly divided into 3 groups (10 for each): sham operated group (control), AEP group (treated with 7.5 g/L sodium deoxycholate) and ANP group (treated with 15 g/L sodium deoxycholat). The apoptosis of acinar cells was determined by terminal deoxynucleotidyl transferase-mediated nick end labeling (TUNEL) assay. The amounts of Bax and Caspase-8 mRNA expression in the pancreas were analyzed by semiquantitative reverse transcriptase polymerase chain reaction (RT-PCR). The expression of Bax and Caspase-8 protein were detected by immunohistochemical method. The levels of serum amylase, tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) were also measured respectively.
RESULTS: The levels of serum amylase (63413 ± 6118, 1532134 ± 17654 nkat/L vs 15736 ± 483 nkat/L, P < 0.01), TNF-α (1.86 ± 0.13, 2.97 ± 0.14 mg/L vs 0.95 ± 0.08 mg/L, P < 0.01) and IL-6 (47.10 ± 7.05, 170.10 ± 7.59 ng/L vs 29.20 ± 4.47 ng/L, P < 0.01) in AEP and ANP group were significantly higher than those in control group, and there were also significant differences between ANP and AEP group (P < 0.05). The apoptotic index (AI) in both AEP and ANP group was obviously higher than that in control group (22.09 ± 3.71, 6.50 ± 1.58 vs 0.13 ± 0.05, P < 0.01), and there was also marked difference between ANP and than AEP group (P < 0.05). Meanwhile, in AEP and ANP group the expression of Bax (mRNA: 1.530 ± 0.501, 1.046 ± 0.337; protein: 453.7 ± 30.5, 339.4 ± 26.7) and Caspase-8 (mRNA: 0.595 ± 0.17, 0.505 ± 0.173; protein: 3606 ± 337, 3134 ± 231) were observably higher than those in control group (Bax mRNA: 0.613 ± 0.244, Bax protein: 245.2 ± 30.0; Caspase-8 mRNA: 0.357 ± 0.130, Caspase-8 protein: 2396 ± 266) (P < 0.01). Bax expression was also significantly different between ANP and AEP group both at mRNA and protein level, but not Caspase-8 mRNA and protein.
CONCLUSION: In acute pancreatitis, the apoptosis of pancreatic acinar cells is negatively correlated with the severity of pancreatitis. Bax and Caspase-8 may contribute to the acinar cell apoptosis and reduction of AP severity.
- Citation: Chen HL, Zhang GX, Gong AX, Zhang L. Role of acinar cell apoptosis and expression of Bax and Caspase-8 in rats with acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1067-1072
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1067.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1067
急性胰腺炎(acute pancreatitis, AP)时最早期的改变发生在腺泡细胞内, 进而引起局部炎性反应, 乃至系统性炎症反应综合征(systemic inflammatory response syndrome, SIRS). 研究发现, 腺泡细胞凋亡或坏死的不同死亡方式对病情轻重起着重要作用[1-3], 腺泡细胞的凋亡可能是AP时机体的自我保护性机制而有助于减轻重症程度[4-7]. 与坏死不同, 细胞凋亡的发生受凋亡调控基因控制, 细胞裂解成凋亡小体并保持膜的完整性, 不释放溶酶体酶等细胞内容物, 不引起炎症反应. 因此, 深入研究AP腺泡细胞凋亡机制, 对于明确AP病理生理过程及阻止重症化进展具有重要意义. 我们通过制备大鼠不同严重程度AP模型, 研究不同凋亡调控基因的表达, 进一步探讨腺泡细胞凋亡的意义及可能机制.
♂清洁级健康SD大鼠30只, 体质量220-260 g(由大连医科大学实验动物中心提供). 随机分为: 假手术(SO)组, 急性水肿性胰腺炎(AEP)组和急性坏死性胰腺炎(ANP)组, 每组10只. 紫外可见分光光度计1000型, 瑞典; 低温冷冻超速离心机2K15, 美国Sigma; RT-PCR扩增仪, 德国Biomryis; 电泳仪, 美国Bio-rad; 凝胶图像分析软件, 美国Labworks 4.6; 免疫组化显微镜图像分析软件, 美国Image pro-plus 4.5; 北京解放军总医院TNF-α和IL-6放免检测试剂盒; 美国Invitrogen TRIzol提取试剂盒; 日本TaKaRa公司RT-PCR扩增试剂盒; PCR引物由宝生物工程(大连)有限公司合成, β-actin引物: 5'-TCA TGA AGT GTG TTG ACA TCC GTA AAG-3'(上游), 5'-CCT AGA AGC ATT TGC GGT GCA CGA TGG ACG-3'(下游), 扩增产物长285 bp; Bax引物: 5'-CTG AGC TGA CCT TGG AGC-3'(上游), 5'-GAC TCC AGC CAC AAA GAT G-3'(下游), 扩增产物长413 bp; Caspase-8引物: 5'-TGA TGA AGA GGC TCT GAG TAA-3'(上游), 5'-TGG CAA AGT GAC TGG ATA TA-3'(下游), 扩增产物长489 bp; 美国Promega TUNEL检测试剂盒; 福州迈新生物技术开发公司SP法免疫组化试剂盒, 美国Santa Cruz公司Bax一抗, Cell Signaling公司Caspase-8一抗.
1.2.1 动物模型的制作及标本采集: 动物术前禁食12 h, 自由饮水. 用30 g/L戊巴比妥(1.3 mL/kg) ip麻醉. 无菌条件下, 腹壁正中切口入腹. 显露出十二指肠乳头开口, 在十二指肠乳头对侧肠壁插入1 mL小注射器针头经胆胰管十二指肠乳头开口入胆胰管, 同时在胆管出肝门处用无损伤小动脉夹夹闭, 防止注入药物反流入肝脏. AEP组逆行匀速注入7.5 g/L去氧胆酸钠(1 mL/kg), 30 s注完; ANP组逆行匀速注入15 g/L去氧胆酸钠(1 mL/kg), 30 s注完; SO组仅开腹翻动胰腺数次, 常规关腹. 各组动物造模后于背部皮下分点注射2.5 mL无菌生理盐水, 补充水分. 24 h后存活大鼠(ANP组大鼠死亡2只)麻醉下打开腹腔, 腹主动脉采血, 留取血清-20 ℃保存待测淀粉酶及炎性细胞因子; 迅速切取部分胰腺组织(50 mg)置于加入1 mL TRIzol的EP管中超声波击碎混匀, -80 ℃保存待RT-PCR实验; 切取剩余大部分胰腺组织, 置于100 g/L中性磷酸盐缓冲液-甲醛中固定, 石蜡包埋, 4 μm连续切片, 分别行常规HE染色、TUNEL染色及免疫组织化学染色观察, 进行相关指标检测.
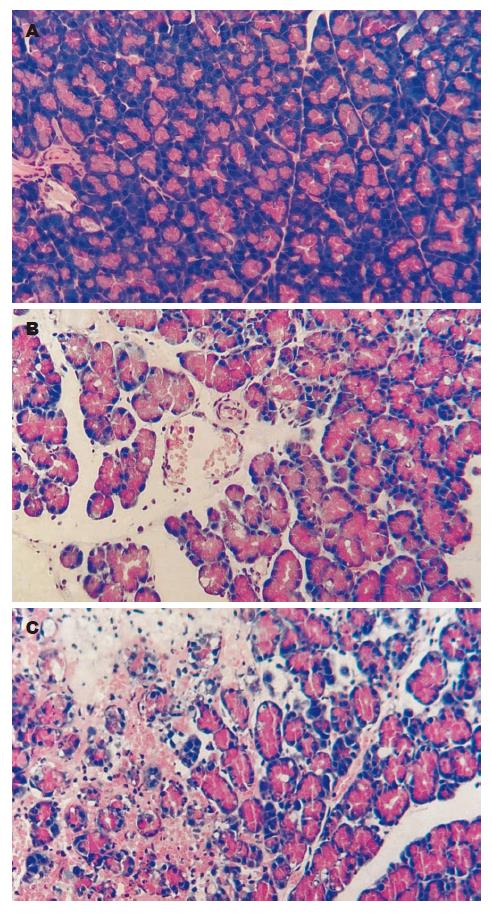
1.2.2 胰腺组织病理形态学观察: 切片HE染色后以Olympus显微镜观察并拍照, 由病理科主任医师协助阅片, 按照Kusske et al[8]评分标准进行评分.
1.2.3 血清淀粉酶测定: 采用临床全自动生化分析仪检测.
1.2.4 血清TNF-α和IL-6水平的测定: 采用TNF-α和IL-6放免试剂盒检测.
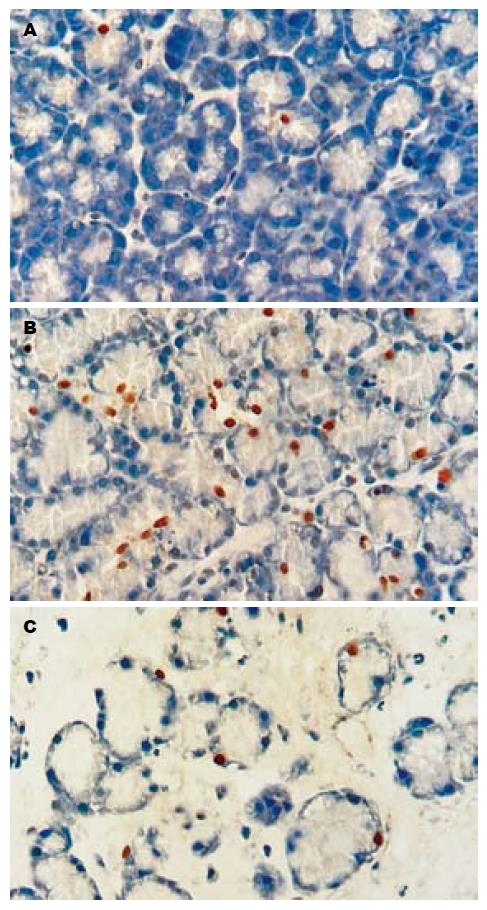
1.2.5 TUNEL法检测胰腺组织腺泡细胞凋亡: 石蜡组织切片常规脱蜡水化, 10 g/L蛋白酶k室温消化10 min, 40 g/L甲醛溶液固定5 min, Epuilibration Buffer缓冲液室温平衡5 min, 加rTdT酶反应液(每100 mL含98 mL Epuilibration Buffer, 1 mL Biotinylated Nucleotide Mix, 1 mL rTdT Enzyme)于37 ℃湿盒中反应60 min, 2×SSC中浸洗终止反应. 3 mL/L的H2O2浸洗5 min阻止内源性过氧化物, 1:500稀释的Streptavidin-HRP室温反应30 min, 加入新鲜配置的DAB工作液显色10 min, 去离子水漂洗后苏木精复染, 封片镜检. Olympus显微镜观察并拍照, 细胞核中有棕黄色颗粒者为阳性细胞, 即凋亡的胰腺腺泡细胞. 每张切片染色阳性区域随机选取5个高倍视野(×40), 计算500个腺泡细胞中阳性细胞所占的百分比, 即为凋亡指数(apoptosis index, AI).
1.2.6 RT-PCR检测Bax和Caspase-8 mRNA水平: 取出-80 ℃深低温冰箱中冻存的溶解在TRIzol中的胰腺组织, 室温放置5 min融化. 用日本TaKaRa公司总RNA提取试剂盒提取胰腺组织中的总RNA, 以紫外分光光度计测定A260:A280比值, 重复3次, 测得该比值稳定于1.8-2.0, 计算总RNA浓度. 取0.5 mg总RNA, 依次加入10×RT Buffer, MgCl2, dNTP Mixture, RNase Inhibitor, AMV Reverse Transcriptase, Oligo dT-Adaptor Primer, 以DEPC水补至总反应体积为20 mL, 反转录的反应温度分别为42 ℃, 99 ℃和5 ℃, 反应时间分别为30, 5和5 min, 循环一次, 结束反应. 取5 mL反转录产物, 分别加入20 pmol寡核苷酸引物, Taq DNA聚合酶, 5×PCR Buffer, 灭菌蒸馏水补至25 mL, PCR反应的变性、退火和延伸温度分别为: 94 ℃, 55 ℃和72 ℃, 反应时间分别为30 s, 30 s和1.5 min. Bax与β-actin各循环30次, Caspase-8循环35次. 产物取10 mL, 20 g/L琼脂糖凝胶电泳. 经凝胶扫描分析系统行吸光度扫描, 分别计算Bax和Caspase-8基因表达量与β-actin表达量的比值.
1.2.7 免疫组化检测Bax和Caspase-8蛋白的表达: 采用SP两步法染色, 操作过程按照试剂盒说明书进行, DAB显色, 苏木素复染, 中性树胶封片, 光镜下观察. Bax和Caspase-8蛋白主要在细胞质内表达, 含有棕黄色或棕黄色颗粒的腺泡细胞为阳性细胞. 每张切片随机选取4个高倍视野(×40), 应用Image-pro plus 4.5免疫组化彩色图像分析系统进行定量分析, 测定积分光密度值(IOD).
统计学处理 数据采用SPSS11.5统计分析软件进行处理, 所得数值以均数±标准差(mean±SD)表示, 组间比较采用方差分析和t检验, P<0.05为具有统计学意义.
SO组胰腺小叶清晰, 未见异常. AEP组胰腺间质明显水肿, 炎性浸润, 胰腺实质可见少量坏死, 小静脉扩张, 红细胞淤积. ANP组胰腺实质大片坏死, 出血及脂肪变性, 大量红细胞淤积, 血管扩张, 见大量中性粒细胞浸润于组织间隙及实质内(图1). 病理评分见表1, 从水肿、炎性细胞浸润、出血和坏死4个方面分别给予0-4分的评分.
与对照组相比, AEP组和ANP组血清淀粉酶及TNF-α和IL-6水平显著升高(P<0.01), 且ANP组大鼠各项值均显著高于AEP组(P<0.05, 表2).
应用TUNEL技术检测胰腺组织腺泡细胞的凋亡, 凋亡的腺泡细胞核内染色体发生规则性断裂而被染成棕黄色, 正常与坏死的腺泡细胞则不被染色. 发现正常胰腺组织(SO组)腺泡细胞凋亡极少, AEP组与ANP组腺泡细胞凋亡明显增多(P<0.01); 与AEP组相比较, ANP组凋亡明显减少, 凋亡指数(AI)显著下降(P<0.05, 表3, 图2).
SO, AEP及ANP组大鼠胰腺组织都有Bax与Caspase-8 mRNA的表达, AEP组与ANP组表达水平显著高于SO组(P<0.01), 且ANP组Bax mRNA表达水平显著低于AEP组(P<0.05), ANP组Caspase-8 mRNA表达水平低于AEP组, 但差异不具有显著性意义. 各组大鼠胰腺组织腺泡细胞胞质区有Bax蛋白及Caspase-8蛋白的表达, 表达水平同各自mRNA水平呈一致性的关系(表3).
1995年Kaiser et al[9]在实验研究中发现, 轻度AP胰腺腺泡细胞凋亡较多而坏死很少, ANP腺泡细胞大量坏死而凋亡很少以来, 腺泡细胞凋亡在AP发病中的意义与作用受到人们的重视. 众多实验研究均支持这样一个观点, 即病理条件下受损的腺泡细胞发生凋亡可以减少因坏死释放的活性胰酶, 减轻炎性介质的瀑布样级联反应, 可能是AP时机体的自我保护性机制[4-7], 中药茵陈承气汤、紫杉醇、芸香苷及大黄素均可通过不同的机制诱导胰腺腺泡细胞凋亡, 减轻实验性AP的严重程度[10-13]. 本实验研究结果恰恰证实了这一观点, 正常胰腺组织未发现腺泡细胞坏死, 凋亡细胞也极少; 在AEP和ANP大鼠均发现胰腺腺泡细胞的死亡, 前者凋亡指数(AI)显著高于后者而坏死相对较少, 后者虽然也有一定数量的凋亡, 但更多的腺泡细胞发生坏死的改变. 说明在AP的病理环境中, 胰腺腺泡细胞出现凋亡和坏死两种死亡方式, 在一定范围内, 凋亡和坏死是呈现相反变化的一对矛盾, 受损的腺泡细胞以凋亡方式死亡可以减少因坏死带来的更严重的后果, 因而病情较轻, 反之, 大量腺泡细胞发生坏死, 凋亡较少则病情危重. 因此, 胰腺腺泡细胞的凋亡同AP病情存在一定的相关性, 并且可能是重要的调节机制之一.
细胞凋亡是受众多凋亡相关基因控制的程序性细胞死亡, 其调控途径主要有细胞外死亡受体途径和细胞内线粒体途径. Bax是线粒体途径上重要的调控基因, 可以增加线粒体膜通透性, 促进细胞色素C的释放, 形成凋亡诱导复合物, 作用于凋亡效应因子导致细胞凋亡. AP时胰腺腺泡细胞Bax表达增强, 且AEP显著高于坏死性胰腺炎, 与腺泡细胞凋亡的改变一致. 表明Bax是线粒体途径上促进AP时腺泡细胞凋亡的重要调控基因, 同其他研究者的结论相符合[14-15]. 凋亡蛋白酶Caspase(半胱氨酸天冬酶)家族成员是存在于细胞质内凋亡信号传导途径的关键效应分子, 参与凋亡过程的调控, 被称为凋亡的分子执行者, 其激活是凋亡效应期的一个十分重要的生化事件[16]. 分为细胞凋亡的起始者(Caspase-2,8,9和10)与执行者(Caspase-3,6和7)[17-18]. Caspase的激活有两个独立的途径, 即细胞内线粒体途径和细胞外死亡受体途径[19-20]. 其中细胞外途径由胞外配体同跨膜死亡受体(Fas, TNF-R, TNF相关凋亡诱导受体)结合, 激活临近膜的起始Caspases, 活化的起始Caspases通过切割执行Caspases使之活化并作用于底物蛋白分子从而导致细胞凋亡的发生.
Caspase-8是这一途径上重要的启动子[23]. 有研究发现[21-23], 死亡受体途径中的Fas/FasL通路参与AP腺泡细胞凋亡过程, Fas与FasL基因表达的改变同腺泡细胞凋亡变化呈一致性的关系, Fas基因缺失时急性胰腺炎病情明显加重. 本实验结果表明AP时胰腺腺泡细胞凋亡增加伴随Caspase-8表达明显增强, 进一步证实死亡受体途径参与了AP时腺泡细胞的凋亡过程, Caspase-8是这一途径上重要的调控因子之一. AEP较ANP坏死性胰腺炎Caspase-8表达增加但不具有显著性意义. Caspase-8以单体形式存在, 在细胞外促凋亡刺激作用下形成二聚体而活化, 发挥酶的切割作用[19]. 因此, 还需在Caspase-8 mRNA与蛋白表达基础上进一步研究AP病程中其蛋白活性水平上的变化.
AP发病机制复杂, 在致病因素作用下胰腺腺泡细胞功能与结构的变化发挥着关键作用. AP时胰腺缺血再灌注损伤、各种炎症因子及活性氧族(ROS)等均对胰腺腺泡细胞的凋亡产生作用[24-26], 已有应用药物和基因手段调节腺泡细胞凋亡以减轻AP病情的相关实验研究[27-30]. 用分子生物学手段阐明病理环境中调控胰腺腺泡细胞凋亡的精细机制, 必将有助于进一步认清AP的发病机制, 从而寻找防治AP的有效措施.
研究发现, 胰腺腺泡细胞凋亡或坏死的不同死亡方式对急性胰腺炎(AP)病情轻重起着重要作用, 腺泡细胞的凋亡可能是AP时机体的自我保护性机制而有助于减轻重症程度. 与坏死不同, 细胞凋亡的发生受凋亡调控基因控制, 细胞裂解成凋亡小体并保持膜的完整性, 不释放溶酶体酶等细胞内容物, 不引起炎症反应. 因此, 深入研究AP腺泡细胞凋亡机制, 对于明确AP病理生理过程及阻止重症化进展具有重要意义.
细胞凋亡具有复杂的调控机制, AP时腺泡细胞的凋亡涉及死亡受体通路和线粒体通路等相关基因的参与, 并受各种病理生理因素的影响. 深入探讨AP病理环境中腺泡细胞凋亡发生的机制, 选择合适的作用耙点和治疗措施将是今后研究的热点和重点.
本文研究结果进一步证实了AP中胰腺腺泡细胞凋亡同病情的负相关性以及相关基因表达的意义, 对深入探讨腺泡细胞凋亡机制及AP的发病机制, 寻求有效治疗措施具有指导意义.
Caspase: 天冬氨酸特异性半胱氨酸蛋白酶, 是一组具有相似氨基酸序列、空间结构和底物特异性的酶, 是细胞凋亡调控途径的关键效应酶.
本文研究了大鼠急性胰腺炎时胰腺腺泡细胞凋亡及Bax, Caspase-8的表达, 科学性较高, 方法可靠, 有理论价值.
编辑: 王晓瑜 电编:张敏
| 1. | Bhatia M. Apoptosis versus necrosis in acute pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2004;286:G189-G196. [PubMed] [DOI] |
| 2. | Bhatia M. Apoptosis of pancreatic acinar cells in acute pancreatitis: is it good or bad? J Cell Mol Med. 2004;8:402-409. [PubMed] [DOI] |
| 3. | Bhatia M, Wong FL, Cao Y, Lau HY, Huang J, Puneet P, Chevali L. Pathophysiology of acute pancreatitis. Pancreatology. 2005;5:132-144. [PubMed] [DOI] |
| 4. | Bhatia M, Wallig MA, Hofbauer B, Lee HS, Frossard JL, Steer ML, Saluja AK. Induction of apoptosis in pancreatic acinar cells reduces the severity of acute pancreatitis. Biochem Biophys Res Commun. 1998;246:476-483. [PubMed] [DOI] |
| 5. | Saluja A, Hofbauer B, Yamaguchi Y, Yamanaka K, Steer M. Induction of apoptosis reduces the severity of caerulein-induced pancreatitis in mice. Biochem Biophys Res Commun. 1996;220:875-878. [PubMed] [DOI] |
| 6. | Kaiser AM, Saluja AK, Lu L, Yamanaka K, Yamaguchi Y, Steer ML. Effects of cycloheximide on pancreatic endonuclease activity, apoptosis, and severity of acute pancreatitis. Am J Physiol. 1996;271:C982-C993. [PubMed] |
| 7. | Takeyama Y. Significance of apoptotic cell death in systemic complications with severe acute pancreatitis. J Gastroenterol. 2005;40:1-10. [PubMed] [DOI] |
| 8. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] [DOI] |
| 9. | Kaiser AM, Saluja AK, Sengupta A, Saluja M, Steer ML. Relationship between severity, necrosis, and apoptosis in five models of experimental acute pancreatitis. Am J Physiol. 1995;269:C1295-C1304. [PubMed] |
| 10. | 尚 东, 关 凤林, 陈 海龙, 杨 佩满, 辛 毅, 刘 忠, 聂 凤宇, 胡 爱萍. 茵陈承气汤对大鼠急性出血坏死性胰腺炎腺泡细胞凋亡及调控基因的影响. 中国中西医结合外科杂志. 2002;8:70-73. |
| 14. | Gomez G, Lee HM, He Q, Englander EW, Uchida T, Greeley GH. Acute pancreatitis signals activation of apoptosis-associated and survival genes in mice. Exp Biol Med (Maywood). 2001;226:692-700. [PubMed] |
| 15. | Yu JH, Kim H, Kim KH. Calcium-dependent apoptotic gene expression in cerulein-treated AR42J cells. Ann N Y Acad Sci. 2003;1010:66-69. [PubMed] [DOI] |
| 16. | Strasser A, O'Connor L, Dixit VM. Apoptosis signaling. Annu Rev Biochem. 2000;69:217-245. [PubMed] [DOI] |
| 17. | Thornberry NA, Lazebnik Y. Caspases: enemies within. Science. 1998;281:1312-1316. [PubMed] [DOI] |
| 18. | Tibbetts MD, Zheng L, Lenardo MJ. The death effector domain protein family: regulators of cellular homeostasis. Nat Immunol. 2003;4:404-409. [PubMed] [DOI] |
| 19. | Green DR. Overview: apoptotic signaling pathways in the immune system. Immunol Rev. 2003;193:5-9. [PubMed] [DOI] |
| 20. | Nicholson DW, Thornberry NA. Apoptosis. Life and death decisions. Science. 2003;299:214-215. [PubMed] [DOI] |
| 21. | Yasuda H, Kataoka K, Ichimura H, Mitsuyoshi M, Iida T, Kita M, Imanishi J. Cytokine expression and induction of acinar cell apoptosis after pancreatic duct ligation in mice. J Interferon Cytokine Res. 1999;19:637-644. [PubMed] [DOI] |
| 22. | Jeyarajah DR, Kielar M, Gokaslan ST, Lindberg G, Lu CY. Fas deficiency exacerbates cerulein-induced pancreatitis. J Invest Surg. 2003;16:325-333. [PubMed] [DOI] |
| 23. | Li ZD, Ma QY, Xu J, Li M. [Colocalized expression of Fas and Fas-ligand in acute pancreatitis and its correlation with cell apoptosis]. Nanfang Yike Daxue Xuebao. 2006;26:25-29. [PubMed] |
| 24. | Fujimoto K, Hosotani R, Wada M, Lee J, Koshiba T, Miyamoto Y, Doi R, Imamura M. Ischemia-reperfusion injury on the pancreas in rats: identification of acinar cell apoptosis. J Surg Res. 1997;71:127-136. [PubMed] [DOI] |
| 26. | Yu JH, Lim JW, Kim KH, Morio T, Kim H. NADPH oxidase and apoptosis in cerulein-stimulated pancreatic acinar AR42J cells. Free Radic Biol Med. 2005;39:590-602. [PubMed] [DOI] |
| 27. | Gerasimenko JV, Gerasimenko OV, Palejwala A, Tepikin AV, Petersen OH, Watson AJ. Menadione-induced apoptosis: roles of cytosolic Ca(2+) elevations and the mitochondrial permeability transition pore. J Cell Sci. 2002;115:485-497. [PubMed] |
| 28. | Hahm KB, Kim JH, You BM, Kim YS, Cho SW, Yim H, Ahn BO, Kim WB. Induction of apoptosis with an extract of Artemisia asiatica attenuates the severity of cerulein-induced pancreatitis in rats. Pancreas. 1998;17:153-157. [PubMed] [DOI] |
| 29. | Cosen-Binker LI, Binker MG, Cosen R, Negri G, Tiscornia O. Relaxin prevents the development of severe acute pancreatitis. World J Gastroenterol. 2006;12:1558-1568. [PubMed] |
| 30. | Lupia E, Goffi A, De Giuli P, Azzolino O, Bosco O, Patrucco E, Vivaldo MC, Ricca M, Wymann MP, Hirsch E. Ablation of phosphoinositide 3-kinase-gamma reduces the severity of acute pancreatitis. Am J Pathol. 2004;165:2003-2011. [PubMed] [DOI] |