修回日期: 2006-10-11
接受日期: 2006-10-18
在线出版日期: 2007-01-08
目的: 研究缬草波春诱导胃癌细胞凋亡, 探讨其诱导凋亡与半胱氨酸酶(Caspase)及生存素(Survivin) mRNA、P53蛋白、Survivin蛋白表达的关系.
方法: 以100 mg/L的缬草波春作用于加Caspase-3抑制剂、Caspase-8抑制剂、Caspase-9抑制剂和未加Caspases抑制剂培养的MKN-45细胞24, 48和72 h, 用流式细胞仪分别检测细胞凋亡率; 不同浓度的缬草波春(5, 10, 25, 50, 100 mg/L)作用MKN-45细胞不同时间(24, 48, 72 h)后, 用tripure提取液提取细胞RNA, 用RT-PCR法, 检测Survivin mRNA的表达. 不同浓度缬草波春(50和100 mg/L)作用MKN-45胃癌细胞株24 h后, 用免疫组化的方法, 检测P53蛋白和Survivin蛋白的表达.
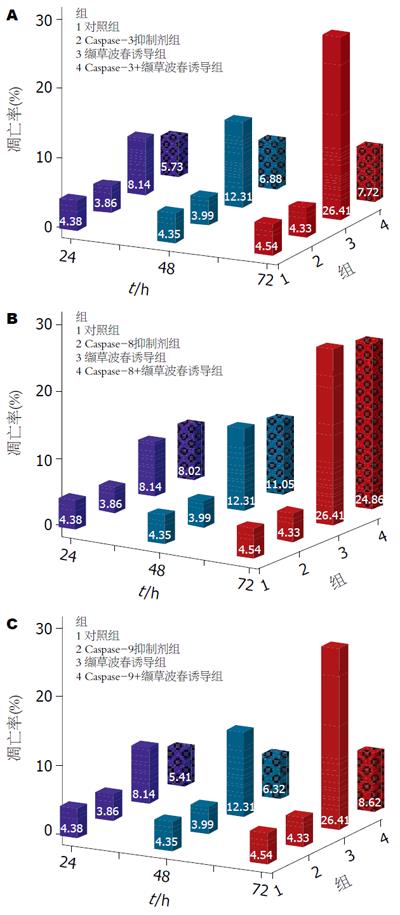
结果: 单用Caspase抑制剂组, 作用24, 48和72 h对MKN-45细胞凋亡率无明显影响, 与对照组比较差异无显著意义. Caspase-3抑制剂、Caspase-9抑制剂与缬草波春联合应用后24, 48和72 h使MKN-45细胞凋亡率高于对照组(24 h: 5.73%, 5.41% vs 4.38%, P<0.01; 48 h: 6.88%, 6.32% vs 4.35%, P<0.01; 72 h: 7.72%, 8.62% vs 4.54%, P<0.01), 低于缬草波春组(24 h: 5.73%, 5.41% vs 8.14%, P<0.01; 48 h: 6.88%, 6.32% vs 12.31%, P<0.01; 72 h: 7.72%, 8.62% vs 26.41%, P<0.01), 与对照组及缬草波春组比较差异均有显著意义(P<0.01). Caspase-8抑制剂与缬草波春联合应用后24, 48和72 h MKN-45细胞凋亡率明显增加, 与对照组比较差异有显著意义(8.02% vs 4.38%, P<0.01; 11.05% vs 4.35%, P<0.01; 24.86% vs 4.54%, P<0.01), 与单用缬草波春组比较差异无显著意义. 缬草波春降低MKN-45胃癌细胞株Survivin mRNA的表达, 并有浓度依赖性和时间依赖性, 而且使MKN-45胃癌细胞株P53蛋白表达增加, Survivin蛋白表达降低, 均有浓度依赖性.
结论: 缬草波春可诱导MKN-45细胞凋亡, 其作用可部分被Caspase-3, Caspase-9抑制剂所抑制, 但不能被Caspase-8抑制剂所抑制. 缬草波春诱导MKN-45胃癌细胞株凋亡与P53蛋白表达提高及Survivin mRNA和Survivin蛋白低表达降低有关.
引文著录: 叶建明, 胡品津, 易粹琼, 薛存宽, 呼闯营, 陈凤鸣, 钱伟. 缬草波春诱导MKN-45胃癌细胞凋亡. 世界华人消化杂志 2007; 15(1): 22-28
Revised: October 11, 2006
Accepted: October 18, 2006
Published online: January 8, 2007
AIM: To study the apoptosis of gastric cancer cell line MKN-45 induced by valepotriate and its relationship with the expression of Caspase, P53, and Survivin.
METHODS: Gastric cancer cell line MKN-45 was divided into 4 groups, named group A (control), B (treated with Caspase-3, -8 and -9 inhibitors), C (treated with valepotriate) and D (treated with inhibitory agents plus valepotriate), respectively. The apoptosis rates of MKN-45 cells were tested by fluorescence activated cell sorter (FACS) at different time (24, 48 and 72 h) in each group. After exposure to different concentrations of valepotriate for different time (12, 24, 48 and 72 h), MKN-45 cells were collected and the RNA was extracted by tripure agent. The mRNA expression of Survivin was assayed by reverse transcription-polymerase chain reaction (RT-PCR), while the protein expression of P53 and Survivin were detected by immunohistochemical methods 24 hours after exposure to different concentrations of valepotriate (50 and 100 mg/L).
RESULTS: The apoptosis rates of MKN-45 cells were not significantly different between group A and B at 24, 48 and 72 h (P > 0.05). The apoptosis rates were significantly higher in MKN-45 cells exposed to valepotriate plus Caspase-3 inhibitor or Caspase-9 inhibitor for 24, 48 and 72 h than those in group A (24 h: 5.73%, 5.41% vs 4.38%, P < 0.01; 48 h: 6.88%, 6.32% vs 4.35%, P < 0.01; 72 h: 7.72%, 8.62% vs 4.54%, P < 0.01), but lower than those in group C (24 h: 5.73%, 5.41% vs 8.14%, P < 0.01; 48 h: 6.88%, 6.32% vs 12.31%, P < 0.01; 72 h: 7.72%, 8.62% vs 26.41%, P < 0.01). The apoptosis rates of MKN-45 cells exposed to valepotriate plus Caspase-8 inhibitor for 24, 48 and 72 h were notably increased in comparison with those in group A (8.02% vs 4.38%, P < 0.01; 11.05% vs 4.35%, P < 0.01; 24.86% vs 4.54%, P < 0.01), but was not significantly different from those in group C (P > 0.05). Valepotriate down-regulated the expression of Survivin mRNA in MKN-45 cells in both concentration- and time-dependent manner. Valepotriate also down-regulated the expression of Survivin protein but up-regulated the expression of P53 protein in MKN-45 cells in a concentration-dependent way.
CONCLUSION: Valepotriate-induced apoptosis of MKN-45 cells is correlated with the high expression of P53 protein and low expression of Survivin mRNA and protein, and it can be inhibited by Caspase-3 inhibitor or Caspase-9 inhibitor, but not by Caspase-8 inhibitor.
- Citation: Ye JM, Hu PJ, Yi CQ, Xue CK, Hu CY, Chen FM, Qian W. Valepotriate-induced apoptosis of gastric cancer cell line MKN-45. Shijie Huaren Xiaohua Zazhi 2007; 15(1): 22-28
- URL: https://www.wjgnet.com/1009-3079/full/v15/i1/22.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i1.22
缬草波春是一种从纯中药神农缬草中所提取的化合物, 主要含二氢缬草酸酯(didrovaltrate)缬草三酯(valtrate)及一些萜烯类成分. 体外实验表明, 缬草波春的活性成分didrovaltrate, valtrate及其代谢降解产物缬草醛(baldrinal)对肝细胞癌细胞、Kreb's Ⅱ腹水癌细胞、骨髓造血祖细胞(CFU-GM, CFU-Eos)和人T2淋巴细胞有抑制作用. 我们的前期研究发现, 缬草波春对S-180腹水癌、结肠癌、肝癌有明显抑制作用, 动物实验显示, 毒副作用较小, 无明显骨髓抑制作用. 半胱氨酸酶(Caspase)是细胞调亡的重要信号分子, 是执行细胞凋亡的主要酶类, 绝大部分细胞凋亡依赖Caspase的存在. 我们通过Caspase抑制剂研究缬草波春诱导凋亡的途径是否依赖Caspase. 生存素(Survivin)是新近发现的凋亡抑制因子, 而P53是重要的抗癌因子, 参与化疗药物诱导肿瘤细胞凋亡的过程. 我们试图通过Caspase抑制剂对缬草波春诱导MKN-45胃癌细胞凋亡的影响及缬草波春诱导MKN-45胃癌细胞凋亡P53蛋白、Survivin mRNA及Survivin蛋白的表达阐明其诱导凋亡的机制.
缬草波春由华中科技大学同济医学院老年医学研究所提供. 取缬草波春1 g, 吐温-80 2 g和生理盐水100 mL混合, 4℃冰箱保存备用. MKN-45胃癌细胞由华中科技大学同济医学院协和医院中心实验室提供. Caspase抑制剂购自日本MBL公司, 为多肽类抑制剂, 分别为Caspase-3抑制剂(Z-DEVD-FMK)、Caspase-8抑制剂(Z-IETD-FMK)、Caspase-9抑制剂(Z-LEHD-FMK). 先用高纯度DMSO重构成10 10 mmol/L原液, 再用含100 mL/L小牛血清的RPMI 1640稀释成2 mmol/L浓度备用. Annexin-V-FITC Kit购自奥地利BenderMedSystems公司. 流式细胞仪为B.D公司产品. TRIpure分离试剂购自美国Roche Diagnostic Corp. UltrasensitiveTM S-P超敏试剂盒, 产品编号Kit-9701/9702/9703. 购自福州迈新生物技术开发有限公司. Survivin Ab-2(Line4F7), 鼠单抗0.5 mL, 浓度为200 mg/L, 购自美国Labvision公司.
1.2.1 Caspase抑制剂对缬草波春诱导MKN-45细胞凋亡的影响: 取对数生长期MKN-45细胞, 消化后用含100 mL/L FBS的RPMI 1640培养基制成细胞悬液, 接种于6孔板中, 每孔2 mL, 使细胞成指数生长后, 更换新鲜培养基. 1组为对照组, 加等量RPMI 1640培养基. 2组每孔加Caspase抑制剂, 使Z-DEVD-FMK, Z-IETD-FMK和Z-LEHD-FMK浓度为10 μmol/L[3]. 3组分别每孔加入缬草波春使其浓度为100 mg/L. 4组每孔同时加上述浓度的Caspase抑制剂和缬草波春. 分别培养24, 48和72 h, 每24 h更换1次培养基及药物. 终止培养后上流式细胞仪检测、分析.
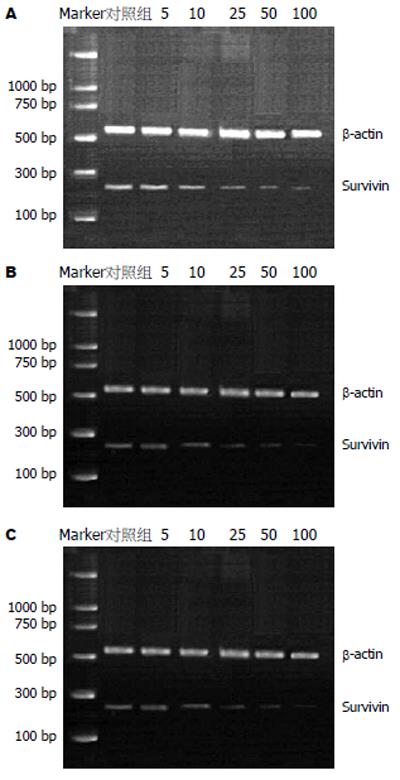
1.2.2 Survivin RT-PCR引物设计: Survivin引物: 上游引物: 5'-ACCAAGGGTTAATTCTTCA-3', 下游引物: 5'-AGGACCACCGCATCTC-3', 目的片段长度254 bp; β-actin引物: 上游引物: 5'-GGACCTGACTGACTACCTC-3', 下游引物: 5'-TCATACTCCTGCTTGCTG-3', 目的片段长度540 bp. 细胞RNA提取: MKN-45细胞悬液2 mL分别加入10 mL玻璃瓶, 待玻璃瓶底铺满后, 换液并分组. 对照组加等量RPMI 1640培养液, 其余加缬草波春使其浓度分别为5, 10, 25, 50及100 mg/L, 分别培养24, 48及72 h. 到规定培养时间后, 消化、离心收集细胞, 加入TRIpure液0.5 mL. 取溶于TRIpure液中细胞裂解液离心(1000 r/min), 液体分成3层, 取第1层总RNA 4 μg于一支0.2 mL离心管中, 65-70℃保温5 min, 离心数秒, 放置冰浴中. 按规定的程序进行RT-PCR. PCR产物行15 g/L琼脂糖凝胶电泳, 溴化乙锭染色, 紫外灯下观察.
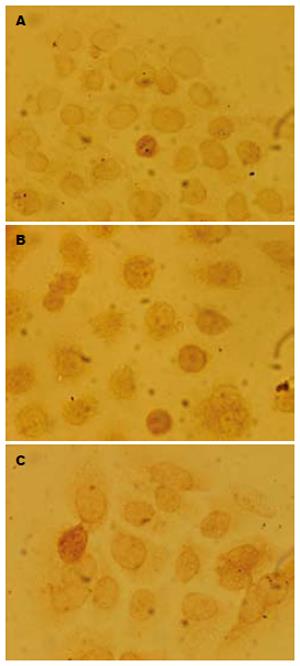
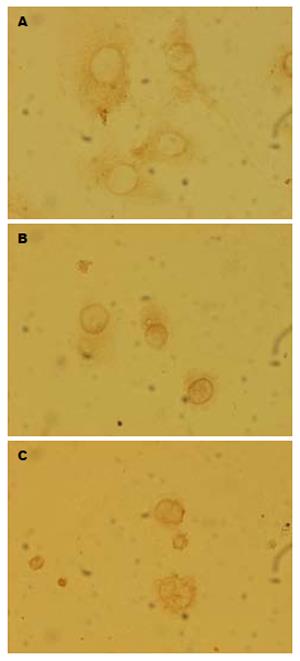
1.2.3 Survivin蛋白和P53蛋白的测定: (1)细胞涂片制备: 6孔培养板每孔先放入已消毒玻片, 加入含MKN-45细胞的培养液2 mL及浓度分别为50和100 mg/L的缬草波春, 对照组加入同体积的RPMI 1640培养液, 分别培养24及48 h. (2)UltrasensitiveTM S-P免疫组化染色: 试剂盒用生物素标记的第二抗体与链霉素抗生物素蛋白连接的过氧化物酶及底物色素混合来测定细胞和组织中的Survivin蛋白和P53蛋白抗原.
统计学处理 所得数据以mean±SD表示, 数据处理用SPSS11.0统计软件, 组间比较用方差分析(F检验), 与对照组比较用t检验.
Caspase-3抑制剂和缬草波春共同作用的凋亡率低于缬草波春组, 高于对照组, 比较差异有显著意义(P<0.01, 图1A). Caspase-8抑制剂和缬草波春共同作用的凋亡率高于对照组, 差异有显著意义(P<0.01), 与缬草波春组比较无明显差异(P>0.05, 图1B). 图1C与图1A类似.
缬草波春能降低MKN-45胃癌细胞Survivin mRNA的表达, 并有时间依赖性和浓度依赖性(图2).
2.3.1 P53的表达: P53蛋白主要在细胞核内表达, 对照组表达不明显, 而从低浓度(50 mg/L)组到高浓度(100 mg/L)组表达也随浓度增加而增强(图3).
2.3.2 Survivin的表达: Survivin的表达主要在胞质, 对照组表达最强, 随缬草波春浓度的增加Survivin的表达而减弱(图4).
Caspase抑制剂包括肽类抑制剂、生物性抑制剂和凋亡抑制蛋白家族(inhibitor of apoptosis protein, IAPS)[1-3]. 本实验所用为肽类抑制剂. 目前认为, 诱导细胞凋亡主要有Caspase依赖途径和非Caspase依赖途径, 而以Caspase依赖途径为主, Caspase激活有外源性和内源性两条途径[4-7]. 在外源性途径中, 细胞膜表面的TNF家族受体(Fas)接受外源性刺激信号后, 通过胞质中的蛋白网络传导至上游的启动子蛋白-Caspase-8, 激活启动凋亡程序[8-9]. 内源性途径的特点是线粒体的参与. 在接受包括DNA损伤在内的各种有害刺激时, 线粒体释放细胞色素C, 细胞色素C可和Apaf-1结合并使之活化, 活化的Apaf-1可以结合并激活Caspase-9, 导致内源性细胞凋亡过程的启动[10-11]. 活化的Caspase-8和Caspase-9裂解后可激活Caspase-3和下游众多的Caspase, 下游的蛋白酶级联反应是外源和内源途径的共同途径, 其中主要的效应分子是Caspase-3. 当然, 激活Caspase-9及Caspase-3最终还是会激活Caspase-8, 形成正反馈回路, 产生级联反应. 整个凋亡激活信号通路十分复杂, 不同信号分子之间相互联系, 不能绝然分开. 本研究显示, 流式细胞学检测发现缬草波春诱导MKN-45细胞凋亡可被Caspase-3抑制剂、Caspase-9抑制剂抑制, 而不被Caspase-8抑制剂抑制. 说明, 缬草波春诱导MKN-45细胞凋亡与Caspase有关, 通过启动内源性凋亡途径实现的, 与外源性凋亡途径无关. 而缬草波春诱导MKN-45细胞凋亡被Caspase-3抑制剂、Caspase-9抑制剂所抑制是不完全的, 可能还有其他途径参与, 有待更深入的研究.
P53是一种肿瘤抑制蛋白, 他控制大多数动物的细胞数, 在组织中广泛表达, 起着稳定染色体、DNA的作用. 当细胞的DNA受到辐射、药物等因素损伤时, P53的N-末端会因磷酸化而影响其和DNA, HDM2结合的能力, 从而被激活, 诱导细胞生长停滞、细胞衰老、分化、细胞凋亡及介导DNA修复. 若损伤的细胞处于G1期, P53触发细胞周期限制点. 如果细胞已进入S期, P53触发细胞凋亡. P53还通过上调Bax及IGF-BP-3, 抑制Bcl-2, Survivin表达, 从而调控细胞凋亡, 行使抑癌基因功能[12-14]. 临床上许多肿瘤的发生多是因为P53功能的丧失, 最主要的方式是基因突变, 其他原因有Rb, p16, BRCA1, BRCA2等抑癌基因异常, 同时P53抑癌蛋白的过度表达或P53的共刺激因子的缺乏也可引起P53抑癌功能丧失[15-17]. 新近发现的ASPP蛋白家族对P53家族的抑癌功能也有重要的影响[18-20]. 野生型P53蛋白表达的恢复有利于诱发肿瘤细胞的凋亡[21].
Survivin是新近发现的一个凋亡抑制因子, 是凋亡抑制蛋白家族(IAPs)成员, 正常组织除甲状腺和胎盘表达外均不表达, 在癌组织呈高表达[22]. Survivin可能的抑癌机制是: Survivin含有IAP家族特有的BIR片段, 通过其本身的BIR结构和Caspase-9结合, 抑制Caspase-9的促凋亡功能; 通过与SMAC(second mitochondria activator of caspase)结合间接促进XIAP的凋亡抑制作用; IAP家族成员之间协同作用; 与P53竞争与Caspase-9的结合; 抑制下游效应分子Caspase-3和Caspase-7[23-28]. 有实验发现, Survivin下调Survivin基因表达水平可以降低肿瘤细胞凋亡的阈值, 并且其表达与肿瘤细胞的耐药性有关, 其表达下调可增加肿瘤细胞对化疗药物的敏感性[29]. Survivin的表达与P53有密切的关系, 目前普遍认为, 野生型P53可抑制Survivin mRNA和蛋白的表达. 转染实验发现, 野生型P53的表达在许多细胞中对Survivin启动子有强烈的抑制作用[30]. 外源性Survivin的过表达能减低P53诱导的凋亡, 且具有量效关系, 提示Survivin的丧失参与了P53依赖的凋亡旁路[31]. 免疫学研究提示, P53与Survivin启动子结合, 其结合位点与E2F转录因子连接位点重叠. Mirza et al[32]认为, 基因缺失和突变都不是Survivin转录受抑的原因, P53对Survivin启动子内染色质的修饰才是真正的原因.
我们发现, 野生型P53蛋白主要表达在胞核内, 缬草波春使MKN-45胃癌细胞野生型P53蛋白表达增强, 并与浓度有相关性, 100 mg/L明显强于50 mg/L. Survivin mRNA在MKN-45胃癌细胞有强表达, 加用缬草波春后, 表达下降, 表达的强弱与时间与浓度呈负相关, Survivin蛋白的表达与Survivin mRNA是一致的. P53蛋白表达的上调, 一方面可加强bax等的促凋亡作用, 另一方面可抑制Survivin, bcl-2的表达, 促进凋亡发生. Survivin mRNA和Survivin蛋白的均表达降低, 说明Survivin蛋白表达降低主要是由于Survivin mRNA表达降低所致. P53高表达与Survivin蛋白低表达的关系, 可能受P53调节有关, 还有可能缬草波春直接通过某种途径促使Survivin mRNA表达降低, 使Survivin蛋白低表达, 也有可能P53的高表达是由于Survivin蛋白低表达所致, 具体机制有待进一步研究. P53高表达可增加胃癌细胞株对药物的敏感性, 启动细胞凋亡机制, 诱导细胞生长停滞. Survivin 蛋白表达减弱能使抑制Caspase-3, Caspase-7和Caspase-9的功能减弱, 增加胃癌细胞株对药物的敏感性, 从而促进凋亡. 缬草波春诱导的MKN-45胃癌细胞被Caspase-3和Caspase-9所抑制证实了上述推测.
缬草波春是一种从纯中药神农缬草中所提取的化合物, 国外80-90年代一些体外实验表明, 缬草波春的活性成分二氢缬草酸酯(didrovaltrate)缬草三酯(valtrate)及其代谢降解产物缬草醛(baldrinal)对肝细胞癌细胞、Kreb's Ⅱ腹水癌细胞、骨髓造血祖细胞(CFU-GM, CFU-Eos)和人T2淋巴细胞有抑制作用, 是否对胃癌细胞有抑制作用及作用机制如何未见报道, 本文课题组前期研究发现, 缬草波春对S-180腹水癌、结肠癌、肝癌有明显抑制作用, 本研究通过Caspase抑制剂、P53和Survivin对缬草波春诱导凋亡的影响, 探讨其机制, 为临床寻找价廉、有效和毒副作用小的新药提供理论依据.
本研究发现, 缬草波春诱导MKN-45胃癌细胞株凋亡与P53蛋白表达提高及Survivin mRNA和Survivin蛋白低表达降低有关.
文章是在以往系列工作的基础上的进一步延伸, 具有较高的理论意义.
电编: 张敏 编辑: 王晓瑜
| 1. | Vyas S, Juin P, Hancock D, Suzuki Y, Takahashi R, Triller A, Evan G. Differentiation-dependent sensitivity to apoptogenic factors in PC12 cells. J Biol Chem. 2004;279:30983-30993. [PubMed] [DOI] |
| 2. | Verhagen AM, Coulson EJ, Vaux DL. Inhibitor of apoptosis proteins and their relatives: IAPs and other BIRPs. Genome Biol. 2001;2:REVIEWS3009. [PubMed] |
| 3. | Tao L, Jiao X, Gao E, Lau WB, Yuan Y, Lopez B, Christopher T, RamachandraRao SP, Williams W, Southan G. Nitrative inactivation of thioredoxin-1 and its role in postischemic myocardial apoptosis. Circulation. 2006;114:1395-1402. [PubMed] [DOI] |
| 4. | Imajoh M, Sugiura H, Oshima S. Morphological changes contribute to apoptotic cell death and are affected by caspase-3 and caspase-6 inhibitors during red sea bream iridovirus permissive replication. Virology. 2004;322:220-230. [PubMed] [DOI] |
| 5. | Zhang Y, Bhavnani BR. Glutamate-induced apoptosis in neuronal cells is mediated via caspase-dependent and independent mechanisms involving calpain and caspase-3 proteases as well as apoptosis inducing factor (AIF) and this process is inhibited by equine estrogens. BMC Neurosci. 2006;7:49. [PubMed] [DOI] |
| 6. | Mühlethaler-Mottet A, Balmas K, Auderset K, Joseph JM, Gross N. Restoration of TRAIL-induced apoptosis in a caspase-8-deficient neuroblastoma cell line by stable re-expression of caspase-8. Ann N Y Acad Sci. 2003;1010:195-199. [PubMed] [DOI] |
| 7. | Cheema ZF, Santillano DR, Wade SB, Newman JM, Miranda RC. The extracellular matrix, p53 and estrogen compete to regulate cell-surface Fas/Apo-1 suicide receptor expression in proliferating embryonic cerebral cortical precursors, and reciprocally, Fas-ligand modifies estrogen control of cell-cycle proteins. BMC Neurosci. 2004;5:11. [PubMed] [DOI] |
| 9. | Hong SJ, Dawson TM, Dawson VL. Nuclear and mitochondrial conversations in cell death: PARP-1 and AIF signaling. Trends Pharmacol Sci. 2004;25:259-264. [PubMed] [DOI] |
| 10. | Brown NM, Martin SM, Maurice N, Kuwana T, Knudson CM. Caspase inhibition blocks cell death and results in cell cycle arrest in cytokine-deprived hematopoietic cells. J Biol Chem. 2007;282:2144-2155. [PubMed] |
| 11. | Ranaldi R, Palma S, Tanzarella C, Lascialfari A, Cinelli S, Pacchierotti F. Effect of p53 haploinsufficiency on melphalan-induced genotoxic effects in mouse bone marrow and peripheral blood. Mutat Res. 2007;615:57-65. [PubMed] |
| 12. | Nam NH, Parang K. Current targets for anticancer drug discovery. Curr Drug Targets. 2003;4:159-179. [PubMed] [DOI] |
| 13. | Smith DM, Gao G, Zhang X, Wang G, Dou QP. Regulation of tumor cell apoptotic sensitivity during the cell cycle (Review). Int J Mol Med. 2000;6:503-507. [PubMed] [DOI] |
| 14. | Perrone G, Vincenzi B, Santini D, Verzì A, Tonini G, Vetrani A, Rabitti C. Correlation of p53 and bcl-2 expression with vascular endothelial growth factor (VEGF), microvessel density (MVD) and clinico-pathological features in colon cancer. Cancer Lett. 2004;208:227-234. [PubMed] [DOI] |
| 15. | Braun K, Ehemann V, Waldeck W, Pipkorn R, Corban-Wilhelm H, Jenne J, Gissmann L, Debus J. HPV18 E6 and E7 genes affect cell cycle, pRB and p53 of cervical tumor cells and represent prominent candidates for intervention by use peptide nucleic acids (PNAs). Cancer Lett. 2004;209:37-49. [PubMed] [DOI] |
| 16. | Kurki S, Peltonen K, Latonen L, Kiviharju TM, Ojala PM, Meek D, Laiho M. Nucleolar protein NPM interacts with HDM2 and protects tumor suppressor protein p53 from HDM2-mediated degradation. Cancer Cell. 2004;5:465-475. [PubMed] [DOI] |
| 17. | Wen VW, Wu K, Baksh S, Hinshelwood RA, Lock RB, Clark SJ, Moore MA, Mackenzie KL. Telomere-driven karyotypic complexity concurs with p16INK4a inactivation in TP53-competent immortal endothelial cells. Cancer Res. 2006;66:10691-10700. [PubMed] [DOI] |
| 18. | Liu ZJ, Lu X, Zhong S. ASPP--Apoptotic specific regulator of p53. Biochim Biophys Acta. 2005;1756:77-80. [PubMed] |
| 19. | Slee EA, Lu X. The ASPP family: deciding between life and death after DNA damage. Toxicol Lett. 2003;139:81-87. [PubMed] [DOI] |
| 21. | Fricke E, Hermannstädter C, Keller G, Fuchs M, Brunner I, Busch R, Höfler H, Becker KF, Luber B. Effect of wild-type and mutant E-cadherin on cell proliferation and responsiveness to the chemotherapeutic agents cisplatin, etoposide, and 5-fluorouracil. Oncology. 2004;66:150-159. [PubMed] [DOI] |
| 22. | Kasof GM, Gomes BC. Livin, a novel inhibitor of apoptosis protein family member. J Biol Chem. 2001;276:3238-3246. [PubMed] [DOI] |
| 23. | Kominsky DJ, Bickel RJ, Tyler KL. Reovirus-induced apoptosis requires mitochondrial release of Smac/DIABLO and involves reduction of cellular inhibitor of apoptosis protein levels. J Virol. 2002;76:11414-11424. [PubMed] [DOI] |
| 25. | Chandele A, Prasad V, Jagtap JC, Shukla R, Shastry PR. Upregulation of survivin in G2/M cells and inhibition of caspase 9 activity enhances resistance in staurosporine-induced apoptosis. Neoplasia. 2004;6:29-40. [PubMed] [DOI] |
| 26. | Beltrami E, Plescia J, Wilkinson JC, Duckett CS, Altieri DC. Acute ablation of survivin uncovers p53-dependent mitotic checkpoint functions and control of mitochondrial apoptosis. J Biol Chem. 2004;279:2077-2084. [PubMed] [DOI] |
| 28. | Shin S, Sung BJ, Cho YS, Kim HJ, Ha NC, Hwang JI, Chung CW, Jung YK, Oh BH. An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and -7. Biochemistry. 2001;40:1117-1123. [PubMed] [DOI] |
| 29. | Blanc-Brude OP, Mesri M, Wall NR, Plescia J, Dohi T, Altieri DC. Therapeutic targeting of the survivin pathway in cancer: initiation of mitochondrial apoptosis and suppression of tumor-associated angiogenesis. Clin Cancer Res. 2003;9:2683-2692. [PubMed] |
| 30. | Shi Y. Survivin structure: crystal unclear. Nat Struct Biol. 2000;7:620-623. [PubMed] [DOI] |