修回日期: 2006-02-10
接受日期: 2006-02-13
在线出版日期: 2006-03-28
目的: 研究以非复制型重组腺病毒表达人轮状病毒NSP4基因作为新型轮状病毒基因疫苗的可行性.
方法: 用AdEasy系统构建表达NSP4蛋白的重组腺病毒, 并通过形态学观察、PCR、RT-PCR、Southern blot和Western blot等对重组腺病毒进行鉴定. 通过滴鼻途径免疫♀小鼠, 对免疫后母鼠生产的乳鼠(4日龄)用SA11株轮状病毒灌胃攻击, 观察腹泻的产生情况并进行腹泻评级.
结果: 获得了重组腺病毒rvAdEasyNSP4. Southern blot表明, 在重组腺病毒中确有特异性的NSP4基因整合, Western blot证明, 目的蛋白得到表达. 初次免疫小鼠后血清IgG抗体的滴度可达1:1 000, 但阳转率仅为28.5%; 再次免疫后, 血清抗体阳转率达到了85.7%; 第3次免疫后, 血清抗体阳转率达到100%. 血清IgA阳转率可以达到71.4%. 实验组乳鼠攻毒后腹泻的百分率和腹泻评分(反应腹泻严重程度)均较对照组低.
结论: 腺病毒载体可有效表达轮状病毒非结构蛋白NSP4并可有效诱导小鼠免疫反应, 这些结果的取得为新型轮状病毒疫苗的研制提供了依据.
引文著录: 王大燕, 王健伟, 王彦斌, 魏强, 屈建国, 洪涛. 轮状病毒NSP4基因在非复制型腺病毒载体中的表达及免疫活性. 世界华人消化杂志 2006; 14(9): 858-862
Revised: February 10, 2006
Accepted: February 13, 2006
Published online: March 28, 2006
AIM: To investigate the efficacy of passive protection induced by the recombinant adeno-virus bearing human rotavirus NSP4 gene and to explore the clues for novel rotavirus vaccine development.
METHODS: Human rotavirus NSP4 protein was expressed in a recombinant adenovirus. AdEasy system was recruited to facilitate the preparation and the NSP4 gene was inserted into the early 1 region of the vector by homologous recombination in E.coli. The expression of NSP4 was confirmed by Western blotting. The resultant recombinant adenovirus rvAdEasyNSP4 was induced to mice by intranasal (i.n.) immunization. Specific IgG and IgA antibodies were detected in the murine serum. Murine pups born to the rvAdEasyNSP4 immunized dams were challenged with simian rotavirus SA11 strain orally 4 d after birth, and the induced diarrhea was graded.
RESULTS: The recombinant adenovirus rvAdEasyNSP4 showed typical morphology under electron microscope. The transcription of NSP4 specific mRNA by rvAdEasyNSP4 was confirmed with RT-PCR in infected 293 cells, and the expression of the NSP4 protein was verified by Western blotting. After immunization for three times, the positive rates of serum IgG antibody were 28.5%, 85.7% and 100%, respectively, while after the first immunization, the titer of serum IgG reached 1:1 000. After immunization, the positive rate of IgA antibody reached the level of 71.4%. Moderate protection was achieved after simian rotavirus SA11 strain challenged in murine pups.
CONCLUSION: NSP4 protein of human rotavirus strain can be expressed by a recombinant adenovirus vector and trigger effective immune response in mice, laying a solid foundation for the development of novel rotavirus genetic engineering vaccine.
- Citation: Wang DY, Wang JW, Wang YB, Wei Q, Qu JG, Hong T. Generation and immunogenicity of a recombinant replication-incompetent adenovirus expressing human rotavirus NSP4 protein. Shijie Huaren Xiaohua Zazhi 2006; 14(9): 858-862
- URL: https://www.wjgnet.com/1009-3079/full/v14/i9/858.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i9.858
早在1980年代初, 人们就开始研制一些轮状病毒口服活疫苗, 用于预防儿童严重脱水性腹泻及其导致的死亡. 其中猴-人轮状病毒四价重配株口服活疫苗RotaShield于1998年在美国被批准作为计划免疫疫苗, 但是由于怀疑与肠套叠发病有关而于次年退出市场[1]. 在意外地发现RotaShield与肠套叠有关后, 口服活疫苗就在公众心中蒙上了阴影. 与口服疫苗不同, 肠道外轮状病毒疫苗、非复制型重组疫苗等可能不会涉及到肠套叠问题. 轮状病毒非结构蛋白NSP4(nonstructural protein 4)因其在轮状病毒的形态发生和致病性中发挥重要作用[2-3], 近来备受瞩目. 我们以非复制型重组腺病毒表达NSP4基因, 并以滴鼻途径免疫动物, 初步探讨其作为新型轮状病毒基因疫苗的可行性.
含有NSP4基因的克隆质粒pGEM-11zf-NSP4为本课题组构建. 腺病毒骨架质粒载体pAdEasy-1, 穿梭载体pShuttle-CMV质粒及E.coli BJ5183均由美国Johns Hopkins大学TC He博士惠赠; 腺病毒E1区转化的人胚肾细胞293购自美国ATCC. 用SalⅠ和NotⅠ双酶切pGEM-11zf-NSP4质粒, 回收NSP4片段, 克隆入pShuttle-CMV载体, 得到重组穿梭质粒pShuttle-CMV-NSP4. 用PmeⅠ单酶切线性化pShuttle-CMV-NSP4, 与腺病毒骨架质粒pAdEasy-1共同电转化E.coli BJ5183, 再将所得的重组腺病毒质粒pAdEasy-1-NSP4转化宿主菌DH10B(rec A1, end A1), 挑取目的克隆, 提取质粒用PacⅠ酶切线性化后, 使用Lipofectamine 2000(GIBCO)转染293细胞, 将获得的重组腺病毒命名为rvAdEasyNSP4. 用293细胞常规培养重组腺病毒, 待细胞病变完全后, 反复冻融3次, 离心后取病毒液上清少许, 经磷钨酸负染后在透射电子显微镜下观察病毒形态. 用PCR扩增鉴定目的基因片段. Southern blot: 采用Roche公司探针标记与杂交试剂盒, 按说明书进行操作. 使用野生型Ad5作为阴性对照. RT-PCR检测目的基因的转录, 按照试剂盒说明进行. Western blot分析目的蛋白表达, 方法参照分子克隆实验室手册[4].
将6-8周龄♀Balb/c纯系小鼠随机分组, 接种前, 通过小鼠尾部采取基础血进行轮状病毒和NSP4抗体检测. 鼻腔接种时, 先用乙醚麻醉小鼠, 然后将100 mL(2×108 IFU)的重组腺病毒滴入小鼠鼻腔. 分别于免疫后4 wk和8 wk, 再次经尾部采血, 并用与初次免疫时等量的病毒加强免疫, 对照组接种等量的野生型5型腺病毒, 其他处理完全相同. 按常规方法用间接ELISA法测定小鼠血清标本中抗NSP4的特异性IgG抗体, 用0.05 mol/L碳酸盐缓冲液(pH 9.6)稀释纯化的GST-NSP4T蛋白[5]包被96孔酶标板(Costar), 二抗为辣根过氧化物酶(HRP)标记的羊抗鼠IgG(Santa Cruz Biotechnology). 用间接ELISA法检测小鼠血清中特异性抗NSP4 IgA抗体, 二抗为HRP标记的抗鼠IgA抗体(Sigma-Aldrich). 乳鼠攻毒试验: 将小鼠免疫3次后与♂小鼠(轮状病毒抗体阴性)合笼, 使其怀孕, 对生产的乳鼠(4日龄)用SA11株轮状病毒灌胃(10DD50), 观察腹泻的产生情况并进行腹泻评级, 方法参见文献[6].
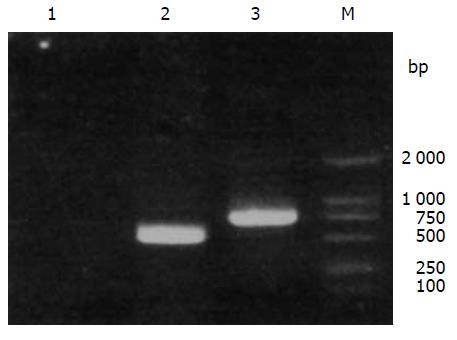
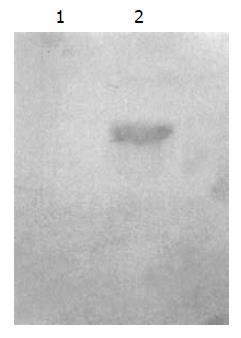
将穿梭载体pShuttle-CMV和pGEM-11zf-NSP4质粒分别用SalⅠ和NotⅠ酶切、回收、连接后, 得到pShuttle-CMV-NSP4(图1). 293细胞经反复冻融释放出重组腺病毒, 经磷酸钨负染, 在透射电镜下可见病毒典型二十面体结构, 直径约为70 nm, 具有典型的腺病毒形态. 分别用NSP4全长引物和编码区引物, 对获得的重组腺病毒进行PCR扩增, 可以检测到全长750 bp和编码区525 bp的特异性扩增条带(图2). Southern blot分析: 提取第10代重组腺病毒的DNA, 经BamHⅠ酶切、凝胶电泳、转膜后, 与针对NSP4的特异性探针进行杂交反应, 结果表明在重组腺病毒中确有特异性的RV NSP4基因稳定整合. 图3为重组腺病毒rvAdEasyNSP4的BamHⅠ酶切产物与NSP4探针杂交的结果. 实验中使用了野生型Ad5作为阴性对照.
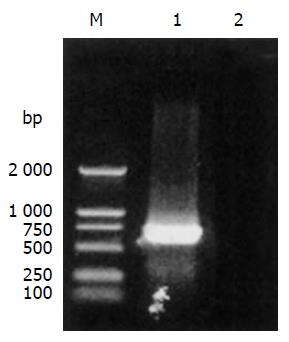
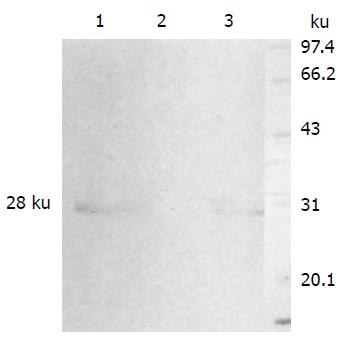
经RT-PCR获得的目的片段与预计的大小一致(图4). 分别用rvAdEasyNSP4、Ad5野毒株感染293细胞48 h后, 收获细胞, 行SDS-PAGE, 转膜后用山羊抗NSP4多克隆抗体进行Western blot以检测表达产物, 可见上清和沉淀在30 ku附近均检测到特异的条带(图5), 而Ad5对照则无特异条带产生.
以野生型腺病毒免疫后的小鼠血清为阴性对照. 初次免疫后血清抗体的滴度可达1:1 000, 但是阳转率仅为28.5%; 再次免疫后, 最高血清抗体滴度仍为1:1 000, 但是血清抗体阳转率有了较大幅度的提高, 达到了85.7%; 第三次免疫后, 血清抗体阳转率达到100%. 除了血清中的IgG外, 我们还对免疫后小鼠血清中IgA的产生情况进行了分析, 在第3次加强免疫后, 血清IgA的滴度为1:50-1:100, 阳转率可以达到71.4%.
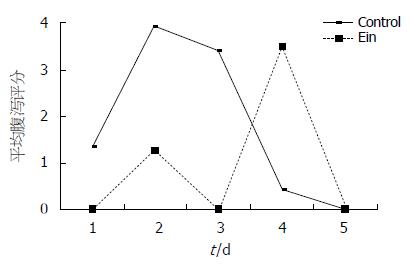
重组腺病毒免疫小鼠后能产生针对SA11株轮状病毒的免疫保护作用, 用SA11攻击后, 重组腺病毒免疫组腹泻的百分率和腹泻评分(反应腹泻严重程度)均较对照组低(图6).
预防接种是控制全世界婴幼儿轮状病毒腹泻最有效的手段, WHO将轮状病毒疫苗作为优先开发的疫苗项目之一. RV腹泻具有的较高发病率和死亡率造成的巨大的疾病负担[7-9], 对世界各个国家、地区和家庭的卫生保健带来相当大的影响, 发展安全、有效, 可用于世界各地儿童的轮状病毒疫苗迫在眉睫[10]. 轮状病毒非结构蛋白NSP4有可能成为轮状病毒疫苗的候选基因, 是因为: (1)非结构蛋白NSP4较外壳结构蛋白保守[11], 因此可能产生较好的交叉免疫保护作用, 有助于解决轮状病毒的高变异问题; (2)NSP4在病毒复制过程中发挥关键作用[12], 因而针对NSP4的免疫反应有可能在病毒复制的早期阶段便可发挥作用; (3)NSP4在轮状病毒致病中发挥重要作用[13-16], 是目前发现的唯一与轮状病毒腹泻发生直接相关的轮状病毒蛋白, 抗轮状病毒腹泻研究自然要考虑NSP4的作用; (4)已有的研究表明, 轮状病毒自然感染后有针对NSP4蛋白的免疫反应[17], 在血清中可以检测到低滴度的抗NSP4抗体. 对NSP4作为轮状病毒疫苗候选基因的研究工作不仅将为新型RV疫苗的研制提供理论依据, 而且对于其他病毒疫苗的研究也有借鉴作用.
由于腺病毒载体在哺乳动物及多种细胞上进行基因转移和蛋白表达的高效性, 使其在基因疫苗、基因治疗及蛋白功能等的研究中受到人们的青睐, 成为当今使用最多的病毒载体之一[18-21]. 与复制型腺病毒相比, 非复制型腺病毒更为安全, 而且因非复制型腺病毒是以低剂量的方式产生抗原蛋白, 不裂解细胞, 有利于激发长期的免疫反应[22-26]. 运用AdEasy系统, 我们获得了表达NSP4蛋白的重组腺病毒, 经滴鼻途径免疫动物, 结果表明, 重组腺病毒不仅能诱导高滴度的抗NSP4 IgG抗体, 而且能诱导IgA抗体的产生. 因为已知只有IgG可以通过胎盘, 活化T细胞、IgA等不能通过胎盘, 在重组腺病毒rvAdEasyNSP4免疫过的母鼠产生免疫反应之后, 其产下的乳鼠对轮状病毒攻击有抵抗作用, 腹泻的百分率和腹泻评分(反应腹泻严重程度)均较对照组低, 这提示抗NSP4的IgG具有保护作用. 但是也可以看出, 经SA11攻毒后, 试验组与对照组腹泻的持续时间并没有区别, 而且尚不能产生完全的免疫保护作用, 不过考虑到小鼠细胞并非人腺病毒的许可细胞, 而且使用的NSP4基因并未进行优化密码子的改造, 本研究取得的结果还是有积极意义的.
轮状病毒感染是腹泻住院的主要原因之一, 而预防接种是控制全世界婴幼儿轮状病毒腹泻最有效的手段, 故WHO将轮状病毒疫苗作为优先开发的疫苗项目之一. 轮状病毒腹泻对世界各个国家、地区和家庭的卫生保健带来相当大的影响, 发展安全、有效, 可用于世界各地儿童的轮状病毒疫苗迫在眉睫.
目前发展的轮状病毒疫苗主要有两大类: 口服轮状病毒活疫苗和非复制性疫苗. 口服轮状病毒活疫苗模拟自然轮状病毒感染的保护作用, 包括单价疫苗和重配疫苗. 非复制型疫苗有其理论上的优点, 即不需要人工减毒, 没有回复突变的危险等.
本研究立题依据充分, 起点高, 方法先进, 条理性强. 对防治轮状病毒具有重要的临床意义.
电编: 张敏 编辑:潘伯荣
| 1. | Murphy TV, Gargiullo PM, Massoudi MS, Nelson DB, Jumaan AO, Okoro CA, Zanardi LR, Setia S, Fair E, LeBaron CW. Intussusception among infants given an oral rotavirus vaccine. N Engl J Med. 2001;344:564-572. [PubMed] [DOI] |
| 2. | Silvestri LS, Tortorici MA, Vasquez-Del Carpio R, Patton JT. Rotavirus glycoprotein NSP4 is a modu-lator of viral transcription in the infected cell. J Virol. 2005;79:15165-15174. [PubMed] [DOI] |
| 3. | Huang H, Schroeder F, Estes MK, McPherson T, Ball JM. Interaction(s) of rotavirus non-structural protein 4 (NSP4) C- terminal peptides with model membranes. Biochem J. 2004;380:723-733. [PubMed] [DOI] |
| 4. | Sambrook J, Russell DW. Molecular Cloning: a laboratory manual (M), 3rd Ed. New York: Cold Spring Harbor Laboratory Press 1998; 254-325. |
| 6. | Horie Y, Nakagomi O, Koshimura Y, Nakagomi T, Suzuki Y, Oka T, Sasaki S, Matsuda Y, Watanabe S. Diarrhea induction by rotavirus NSP4 in the homo-logous mouse model system. Virology. 1999;262:398-407. [PubMed] [DOI] |
| 7. | Soriano-Gabarro M, Mrukowicz J, Vesikari T, Verstraeten T. Burden of rotavirus disease in European Union countries. Pediatr Infect Dis J. 2006;25:S7-S11. [PubMed] [DOI] |
| 8. | Leung AK, Kellner JD, Davies HD. Rotavirus gastroenteritis. Adv Ther. 2005;22:476-487. [PubMed] [DOI] |
| 9. | Gleizes O, Desselberger U, Tatochenko V, Rodrigo C, Salman N, Mezner Z, Giaquinto C, Grimprel E. Nosocomial rotavirus infection in European countries: a review of the epidemiology, severity and economic burden of hospital- acquired rotavirus disease. Pediatr Infect Dis J. 2006;25:S12-S21. [PubMed] [DOI] |
| 10. | Franco MA, Angel J, Greenberg HB. Immunity and correlates of protection for rotavirus vaccines. Vaccine. 2006;24:2718-2731. [PubMed] [DOI] |
| 11. | Borgan MA, Mori Y, Ito N, Sugiyama M, Minamoto N. Antigenic analysis of nonstructural protein (NSP) 4 of group A avian rotavirus strain PO-13. Microbiol Immunol. 2003;47:661-668. [PubMed] [DOI] |
| 12. | Mirazimi A, Magnusson KE, Svensson L. A cytop-lasmic region of the NSP4 enterotoxin of rotavirus is involved in retention in the endoplasmic reticu-lum. J Gen Virol. 2003;84:875-883. [PubMed] [DOI] |
| 13. | Ball JM, Tian P, Zeng CQ, Morris AP, Estes MK. Age-dependent diarrhea induced by a rotaviral nons-tructural glycoprotein. Science. 1996;272:101-104. [PubMed] [DOI] |
| 14. | Browne EP, Bellamy AR, Taylor JA. Membrane-destabilizing activity of rotavirus NSP4 is mediated by a membrane- proximal amphipathic domain. J Gen Virol. 2000;81:1955-1959. [PubMed] [DOI] |
| 15. | Zhang M, Zeng CQ, Dong Y, Ball JM, Saif LJ, Morris AP, Estes MK. Mutations in rotavirus nonstructural glycoprotein NSP4 are associated with altered virus virulence. J Virol. 1998;72:3666-3672. [PubMed] |
| 16. | Zhang M, Zeng CQ, Morris AP, Estes MK. A functional NSP4 enterotoxin peptide secreted from rotavirus-infected cells. J Virol. 2000;74:11663-11670. [PubMed] [DOI] |
| 17. | Iosef C, Chang KO, Azevedo MS, Saif LJ. Systemic and intestinal antibody responses to NSP4 entero-toxin of Wa human rotavirus in a gnotobiotic pig model of human rotavirus disease. J Med Virol. 2002;68:119-128. [PubMed] [DOI] |
| 18. | Majhen D, Ambriovi-Ristov A. Adenoviral vectors-How to use them in cancer gene therapy? Virus Res. 2006;. [PubMed] [DOI] |
| 19. | Maeda K, West K, Hayasaka D, Ennis FA, Terajima M. Recombinant adenovirus vector vaccine induces stronger cytotoxic T-cell responses than recombi-nant vaccinia virus vector, plasmid DNA, or a com-bination of these. Viral Immunol. 2005;18:657-667. [PubMed] [DOI] |
| 20. | Zhou D, Ertl HC. Therapeutic potential of adeno-virus as a vaccine vector for chronic virus infections. Expert Opin Biol Ther. 2006;6:63-72. [PubMed] [DOI] |
| 21. | Gao W, Soloff AC, Lu X, Montecalvo A, Nguyen DC, Matsuoka Y, Robbins PD, Swayne DE, Donis RO, Katz JM. Protection of mice and poultry from lethal H5N1 avian influenza virus through adenovirus-based immunization. J Virol. 2006;80:1959-1964. [PubMed] [DOI] |
| 22. | Holterman L, Vogels R, van der Vlugt R, Sieuwerts M, Grimbergen J, Kaspers J, Geelen E, van der Helm E, Lemckert A, Gillissen G. Novel replication-incompetent vector derived from adenovirus type 11 (Ad11) for vaccination and gene therapy: low seroprevalence and non-cross-reactivity with Ad5. J Virol. 2004;78:13207-13215. [PubMed] [DOI] |
| 23. | Chung I, Deisseroth AB. Recombinant adenoviral vector containing tumor-specific L-plastin promoter fused to cytosine deaminase gene as a transcription unit: generation and functional test. Arch Pharm Res. 2004;27:633-639. [PubMed] [DOI] |
| 24. | Duraiswamy J, Bharadwaj M, Tellam J, Connolly G, Cooper L, Moss D, Thomson S, Yotnda P, Khanna R. Induction of therapeutic T-cell responses to subdominant tumor-associated viral oncogene after immunization with replication- incompetent polye-pitope adenovirus vaccine. Cancer Res. 2004;64:1483-1489. [PubMed] [DOI] |
| 25. | Wolins N, Lozier J, Eggerman TL, Jones E, Aguilar-Cordova E, Vostal JG. Intravenous administration of replication- incompetent adenovirus to rhesus monkeys induces thrombocytopenia by increasing in vivo platelet clearance. Br J Haematol. 2003;123:903-905. [PubMed] [DOI] |