修回日期: 2006-01-15
接受日期: 2006-02-08
在线出版日期: 2006-03-08
目的: 探讨树突状细胞(DC)及CD4+CD25+调节性T细胞在胰岛素自身抗原sc所诱导的小鼠胰岛素依赖性糖尿病(IDDM)的免疫耐受中的重要作用.
方法: 低剂量链脲佐菌素(STZ)(40 mg/kg)ip连续5次在Balb/c小鼠体内建立IDDM模型, 胰岛素(100 μg)与不完全弗氏佐剂(IFA, 1∶1)混合液sc 1次/wk, 连续4 wk. 模型建立后每周测定血糖, 5 wk时处死动物, 取胰腺进行病理组织学检查. 分离骨髓DC前体及脾脏T淋巴细胞并进行体外培养. 采用流式细胞术测定DC表型和CD4+CD25+调节性T细胞, 以同种淋巴细胞刺激实验检测DC刺激淋巴细胞增殖功能.
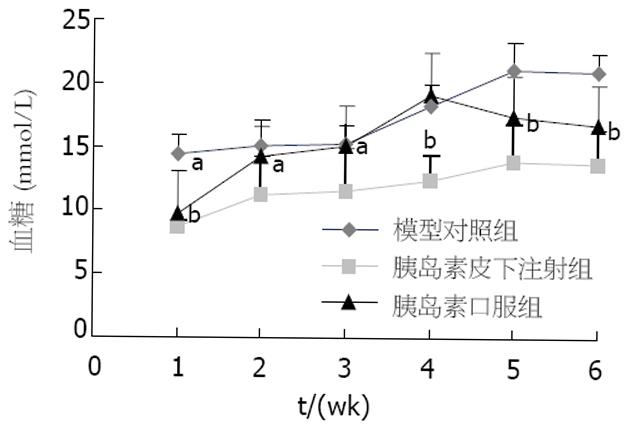
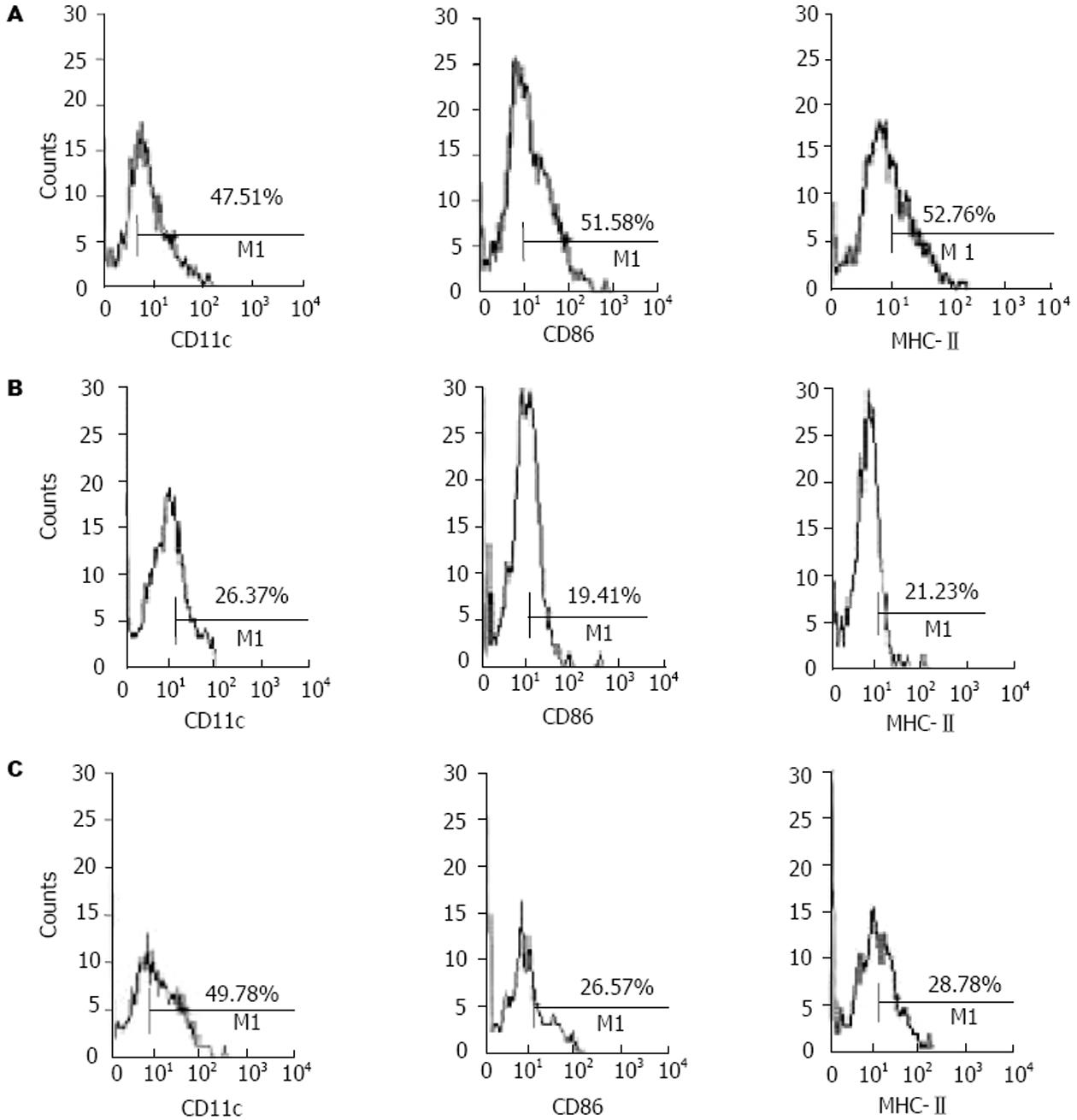
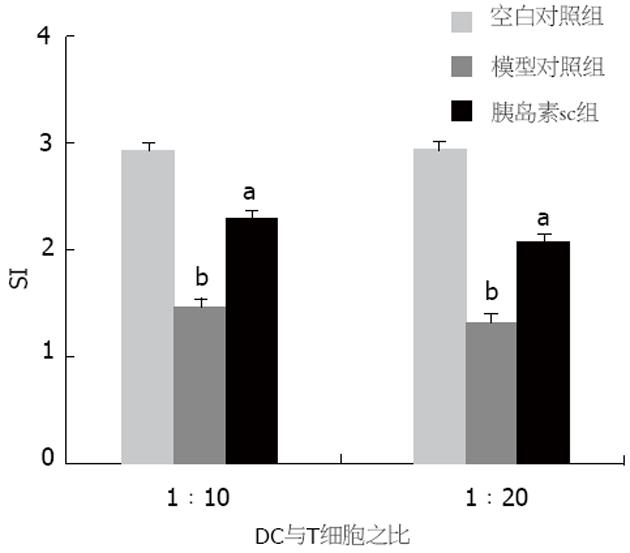
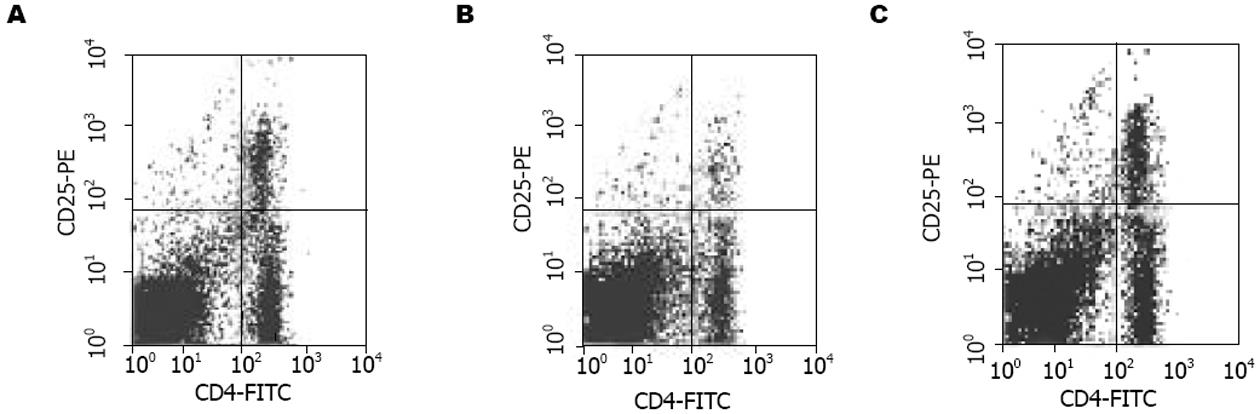
结果: 胰岛素sc 4 wk后可明显降低小鼠的血糖, 与模型对照组有极显著差异(13.79±2.71 mmol/L vs 20.98±1.43 mmol/L, P<0.05), 胰岛内炎症细胞浸润减少, 组织结构完整. IDDM模型建立后, 小鼠骨髓来源树突状细胞CD11c表达为26.4%, DC分化异常, 而正常小鼠CD11c表达为47.5%; 混合淋巴细胞反应中DC刺激能力减弱, 刺激指数分别为1.47±0.01和1.32±0.01(刺激细胞和反应细胞比例分别为1∶10和1∶20), 与正常小鼠相比, 差别具有极显著性意义(P值均小于0.01). 脾脏CD4+CD25+调节性T细胞减少到1.43%, 而正常小鼠为5.09%. 与此相反, 胰岛素自身抗原连续应用后, 不仅使血糖得到控制, 表达CD11c的树突状细胞数量增加, CD86和MHC-Ⅱ表面分子表达降低到26.6%和28.8%, 刺激淋巴细胞反应的能力弱于正常DC, 但强于模型小鼠的DC, 刺激指数分别为2.30±0.06(1∶10)和2.17±0.02(1∶20), CD4+CD25+调节性T细胞数量上升到7.15%.
结论: 胰岛素sc可预防STZ所致小鼠IDDM的发生, 自身抗原可以通过改善功能异常的树突状细胞, 诱导CD4+CD25+调节性 T细胞分化在模型小鼠体内建立免疫耐受.
引文著录: 向明, 张程亮, 邹晓蕾, 蔡晓寒, 彭佳蓓. 树突状细胞和调节性T细胞在自身抗原所致小鼠免疫耐受模型中的作用. 世界华人消化杂志 2006; 14(7): 687-692
Revised: January 15, 2006
Accepted: February 8, 2006
Published online: March 8, 2006
AIM: To investigate the important roles of dendritic cells (DC) and CD4+CD25+ regulatory T cells in immune prevention against insulin dependent diabetes (IDDM) by autoantigen insulin administration.
METHODS: The model of IDDM was established by intraperitoneal injection of low-dose streptozotocin (STZ) 40 mg/kg per day for 5 consecutive days in Balb/c mice. The bovine insulin (100 μg) in incomplete Freund's adjuvant (IFA, emulsified 1∶1) was given subcutaneously to the mice weekly for 4 wk. The blood glucose was examined once a week and all the mice were killed after 5 wk. Pancreas tissues were collected for histopathological examination. DC precursor cells from bone marrow and lymphocytes from spleen were isolated. The phenotype of DC and CD4+ CD25+ regulatory T cells were analyzed by fluorescence activated cell sorter (FACS). DC-stimulated proliferation of lymphacytes was determined by allo-mixed lymphocyte reaction (aMLR).
RESULTS: The level of blood glucose was decreased significantly after insulin injection in comparison with that in the model control group (13.79 ± 2.71 mmol/L vs 20.98 ± 1.43 mmol/L, P < 0.05). Fewer lymphocytes infiltration was observed and pancreatic histological structure was intact. The surface marker CD11c on DC from bone marrow was decreased markedly in IDDM mice (26.4%) than that in normal mice (47.5%). DC differentiated abnormally, and the capacity of stimulating proliferation of allogeneic T cell was weakened as compared with that of normal mice (1.47 ± 0.01 vs 2.93 ± 0.01, P < 0.01, and 1.32 ± 0.01 vs 2.94 ± 0.02, P < 0.01, at DC/T ratios of 1∶10 and 1∶20, respectively). The percentage of CD4+CD25+ T cells were decreased to 1.43%, while it was 5.09% in normal mice. In contrast, blood glucose in mice given insulin subcutaneously was well controlled, and the amount of DC with CD11c was increased (50% approximately); the expression of CD86 and MHC-Ⅱ was low (26.6% and 28.8%, respectively) and MLR showed that DC capacity in stimulating T cell proliferation was lower than those from the normal mice, but higher than those from IDDM model mice (2.30 ± 0.06 and 2.17 ± 0.02, at DC/T ratios of 1∶10 and 1∶20, respectively); the percentage of CD4+CD25+ T cells from spleen was enhanced to 7.15%.
CONCLUSION: Subcutaneous administration of insulin can confer protection to mice against IDDM induced by STZ. The immune protection of autoantigen may be associated with the establishment of immune tolerance by improving the function of abnormal DC and promoting the production of CD4+CD25+ T cells in vivo.
- Citation: Xiang M, Zhang CL, Zou XL, Cai XH, Peng JB. Roles of dendritic cells and regulatory T cells in autoantigen-induced murine immune tolerance model. Shijie Huaren Xiaohua Zazhi 2006; 14(7): 687-692
- URL: https://www.wjgnet.com/1009-3079/full/v14/i7/687.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i7.687
1型糖尿病, 即胰岛素依赖性糖尿病(IDDM)是T细胞介导的. 以胰岛素分泌性胰腺b细胞破坏为主要病理特点的自身免疫性疾病[1]. 建立抗原特异性T细胞耐受是目前防治自身免疫病的主要研究方向. 大量研究发现, 如果在自身免疫反应前期给予一定数量的可溶性b细胞或胰岛素自身抗原, 可通过诱导免疫耐受而发挥预防IDDM作用[2-5]. 去除或抑制CD4+CD25+调节性T细胞能打破天然的免疫耐受平衡, 导致自身免疫病[6,7]. 而体外处理或修饰树突状细胞可在NOD小鼠体内促进Th细胞的免疫偏离, 预防IDDM发生[8]. 因此免疫耐受与调节性T细胞和树突状细胞的关系倍受关注. 但目前对于诱导IDDM免疫耐受的方法较多, 结论也不完全一致[9]. 此外大多数耐受建立在NOD小鼠体内, 该种类小鼠发病有性别限制, 且口服抗原治疗仅使50%-60%的小鼠产生耐受[10]. 因此我们拟在IDDM模型小鼠体内建立胰岛素自身抗原诱导免疫耐受的方法, 并深入探讨免疫耐受与CD4+CD25+调节性T细胞以及树突状细胞的关系.
牛胰岛素、链脲佐菌素(STZ)购自Sigma公司. 不完全弗氏佐剂(IFA)购自Difco公司. Ficoll-Paque淋巴细胞分层液购自Amersham公司. MTT购自Amresco公司. RPMI 1640完全培养基购自Gibco公司. FITC标记anti-mouse CD4, PE标记anti-mouse CD25购自eBioscience公司. 集落刺激因子(GM-CSF)和白介素4(IL-4)购于R&D公司. FITC标记抗小鼠CD11c mAb, FITC标记抗小鼠CD86, MHC-Ⅱ(I-Ad)单克隆抗体购自BD Pharmingen公司. ♂Balb/c小鼠, 平均体质量22 g, 由华中科技大学同济医学院实验动物中心提供.
制备小鼠IDDM模型并诱导免疫耐受: 小鼠每日ip 40 mg/kg的链脲佐菌素, 连续5 d, 建立IDDM模型. 于造模前1 d分别sc或口服灌胃胰岛素和IFA的混合乳剂(1∶1, 100 μg/只), 每周给药1次或2次, 连续4 wk. 经尾静脉采血测血糖. 在非禁食状态下, 2次血糖值在16.7 mmol/L以上者确定为糖尿病. 胰岛病理组织学分析: 颈椎脱臼处死小鼠, 取胰腺, 于40 g/L中性甲醛固定, 制作石蜡切片, 镜检, 观察病理组织学变化. DC的制备及鉴定: 取小鼠胫骨骨髓, 过无菌尼龙网去除杂质, 清洗, 即可获得骨髓细胞悬液. 以淋巴细胞分层液分离细胞. 取3×107细胞加入含100 mL/L胎牛血清(FCS)的RPMI 1640液, 置于37℃ 50 mL/L CO2培养箱内培养过夜. 次日弃上清液和悬浮细胞, 清洗并加入RPMI 1640完全培养液(含20 µg/L GM-CSF和20 µg/L IL-4), 于37℃ 50 mL/L CO2培养箱内培养. 至第7天收获细胞, 于1×109/L细胞悬液200 µL中分别加入FITC标记抗小鼠CD11 mAb、FITC标记抗小鼠CD86和MHC-Ⅱ(I-Ad)mAb. 4℃孵育30 min后, 以PBS离心洗2次, 重新悬于0.4 mL的PBS液后, 采用FACScan(Becton-Dickinson公司)流式细胞仪检测树突状细胞表型. 另设正常小鼠淋巴细胞对照. 混合淋巴细胞增殖反应(MLR): 取培养7 d的DC用完全RPMI 1640培养液悬浮, 加入终浓度为25 mg/L的丝裂霉素C(MMT), 37℃孵育30 min作为刺激细胞. 无菌分离昆明种小鼠脾脏淋巴细胞, 于96孔板内每孔分别加入2×105个细胞作为反应细胞. 再分别加入2×104、1×104刺激细胞, 终体积200 µL, 每组设3个复孔. 37℃ 50 mL/L CO2条件下培养72 h后, 每孔加入5 g/L的MTT 20 µL, 继续培养4 h, 离心弃上清液, 每孔加入DMSO 150 µL, 用酶标仪在550 nm波长下测定各孔A值. 以刺激指数(刺激指数 = 实验组A值/对照组A值)评定细胞增殖程度. CD4+CD25+ T细胞亚群分析: 取小鼠脾脏, 碾磨过无菌尼龙网收集细胞, 清洗, 采用淋巴细胞分层液分离制备淋巴细胞悬液, 于1×1010/L细胞悬液200 µL中分别加入FITC标记抗小鼠CD4和PE标记抗小鼠CD25mAb或相关阴性对照, 同上法处理后, 采用流式细胞仪检测.
统计学处理 数据以mean±SD表示, 各组资料分析应用二组均数t检验法.
低剂量STZ连续5次ip后, Balb/c小鼠体内血糖明显升高(图1). 非禁食血糖值大于16.7 mmol/L, 因此确定为糖尿病. 此后至5 wk时, 高血糖持续存在, 与空白对照小鼠相比有极显著差异. 病理组织学分析显示, STZ模型组多数胰岛结构不完整, 且有明显的淋巴细胞及中性粒细胞浸润, 残余胰岛细胞散在分布, 呈现明显的炎性破损. 由此提示在Balb/c小鼠体内少量多次给予STZ可以诱导IDDM. 模型建立前1 wk开始sc胰岛素, 1次/wk, 小鼠血糖略有升高, 但连续5 wk均低于16.7 mmol/L, 没有出现糖尿病, 且胰岛HE染色显示多数胰岛结构保持完好, 胰岛细胞清晰可见, 几乎没有炎性细胞浸润. 胰岛素口服给药, 开始可控制血糖, 但2 wk后血糖便持续增高, 与模型对照组无明显区别. 结果说明胰岛素皮下注射可预防IDDM发展, 有效控制血糖.
正常小鼠DC前体经体外诱导培养7 d后, 镜下观察可见形态不规则、呈现树突状的典型DC表现. 47.5%的贴壁细胞经流式细胞术检测为表达CD11c的树突状细胞. IDDM模型组表达CD11c的细胞仅为26.4%, 且细胞形态异常. 胰岛素皮下注射组CD11c表达与正常组相当, 约为50%. 此外胰岛素处理组细胞表面抗原MHC-Ⅱ和共刺激分子CD86的表达显著低于正常组, 表现为非成熟状态, 而模型组表面抗原和共刺激分子的表达则低于胰岛素给药组(图2). DC表面抗原分析显示IDDM小鼠DC表型异常, DC的标志抗原CD11c表达明显降低, 胰岛素皮下注射组DC表型未受到明显破坏, 而且DC处于非成熟免疫耐受状态.
STZ诱导糖尿病模型组DC刺激脾T淋巴细胞增殖的能力比空白对照组明显降低(P<0.01, 图3). 胰岛素皮下注射组, 小鼠DC刺激淋巴细胞增殖的能力高于模型组, 但与正常小鼠DC刺激淋巴细胞的功能相比明显减弱(P<0.05). 此结果与DC表型分析一致, STZ所致的糖尿病模型DC表型和功能明显异常, 胰岛素皮下注射后, DC的表型和功能分析显示DC处于耐受状态, 与IDDM得以有效控制的结果一致.
STZ诱导的IDDM可持续发病5 wk以上, 模型建立后小鼠脾脏CD4+CD25+ T细胞经流式细胞仪检测仅为1.43%, 明显低于正常小鼠的5.09%, 由此说明STZ导致糖尿病小鼠外周调节性T细胞下降, 外周免疫耐受遭到破坏. 而胰岛素皮下注射4 wk后, CD4+CD25+ T细胞增加到7.15%, 明显高于模型对照组(图4), 每图右上象限表示CD4+CD25+ T细胞亚群. 以上结果进一步说明胰岛素sc可上调CD4+CD25+ T细胞水平, 建立外周免疫耐受, 保护胰岛β细胞免受损害.
3 讨论
1型糖尿病患者和NOD小鼠体内, Th1细胞针对自身抗原如胰岛素、谷氨酸脱羧酶(GAD)65或热休克蛋白(hsp)60肽p277产生Th1应答, 使体内DC异常, 不能促进足够的调节性T细胞生成, 由此导致免疫调节紊乱[11]. 本研究发现STZ所致的糖尿病模型小鼠表达CD11c的DC明显减少, 刺激T细胞增殖的能力减弱, CD4+CD25+ T细胞亚群也明显低于正常小鼠. 此结果与在IDDM患者和NOD小鼠发病后所观察到的树突状细胞表型和功能异常一致[12-15]. 因此我们采用STZ诱导小鼠糖尿病模型[16], 探讨DC及CD4+CD25+ T调节性细胞在胰岛素自身抗原诱导免疫耐受中的作用. 成熟的树突状细胞(mDC)是强抗原提呈细胞, 可促进T细胞免疫应答, 不成熟树突状细胞(iDC)在稳定状态下诱导外周T细胞耐受[17]. 然而临床上iDC并不适用于自身免疫病的治疗, 因为iDC很有可能在炎症环境下转化为mDC[18], 因此有效的治疗方法应该是采用特殊的淋巴因子、免疫原或者药物制剂诱导促进T调节性细胞分化的耐受性DC[19-21].
胰岛素是在胰岛β细胞上表达的特异性抗原. 完整的胰岛素分子, 胰岛素β链及其肽段B9-23经适宜的途径均可有效预防NOD小鼠、BB大鼠发病[22-23]. 研究发现, NOD小鼠口服胰岛素能诱导抗原特异性调节T细胞产生, 通过分泌IL-4, IL-10, TGF-β在胰岛内抑制Th1型细胞及其他效应细胞, 使IFN-g和诱导型一氧化氮合成酶(iNOS)表达显著下调, 从而保护胰岛免受破坏, 分泌胰岛素维持正常血糖[24]. 本结果显示, 胰岛素sc可有效防止IDDM的发生, 血糖虽高于正常小鼠, 但与模型组相比显著下降, 始终控制在正常范围内. 实验结果与文献报道的不同之处是口服胰岛素对STZ诱导的IDDM几乎无效. 其原因可能是模型本身与NOD小鼠有一定区别, 如发病率和性别限制等. 另外胰岛素可能在胃内代谢失活而影响结果. STZ所致小鼠IDDM, 除出现血糖升高和胰腺炎症细胞浸润等典型病理特征外, DC表型和功能明显异常, CD11c标志性表面抗原下调, DC减少, 混合淋巴细胞反应明显减弱, 骨髓DC分化异常. 相比之下胰岛素sc明显降低STZ所致的高血糖的同时, 也观察到DC表面抗原MHC-Ⅱ和共刺激分子CD86表达下降, DC刺激脾T淋巴细胞增殖能力减弱, 但DC表面抗原CD11c与正常小鼠接近, DC数量维持正常, 因此胰岛素sc后所产生的免疫保护作用可能与诱导耐受性DC形成, 减弱对T细胞增殖和分泌Th1型细胞因子的作用有关[25]. 我们还发现, 糖尿病模型小鼠脾脏CD4+CD25+ T细胞较正常小鼠低, 小鼠皮下注射胰岛素后, 脾脏CD4+CD25+ T细胞显著升高, 明显高于正常小鼠. 因CD4+CD25+ T细胞与控制自身免疫病发展的Th2细胞偏离有关[26-28]. 尽管耐受性DC和调节性T细胞均有免疫保护作用, 但无论是抗原特异性耐受还是针对T细胞的抗体防御措施均涉及调节性T细胞的活化和功能的发挥[29]. 因此推测胰岛素sc后诱导DC耐受, 外周不成熟的DC摄取抗原成分, 进入次级淋巴结, 刺激T细胞的前体分化为CD4+CD25+ T调节细胞, 后者一方面抑制抗原特异性T细胞增殖, 另一方面通过负反馈下调DC表面MHC分子和共刺激分子[30], 结果抑制DC与T细胞的相互作用, 导致生成更多的调节性T细胞, 诱导并维持免疫耐受, 防止由胰岛局部炎症所致的β细胞破坏, 从而发挥抗IDDM作用.
总之, 自身抗原胰岛素皮下注射可在STZ所致IDDM小鼠体内诱导免疫耐受的形成, 其机制与诱导耐受性DC产生, 促进CD4+CD25+调节性T细胞分化, 抑制T淋巴细胞低免疫应答有关. 自身抗原诱导免疫耐受中树突状细胞与调节性T细胞相互作用的方式以及耐受性树突状细胞和调节性T细胞的作用机制还有待于进一步研究
1型糖尿病属于自身免疫性疾病, 目前尚无有效药物防治1型糖尿病的发病, 因此成功诱导免疫耐受是防治1 型糖尿病的最佳方式. 近些年来, 以自身抗原为研究对象并经各种途径在糖尿病转基因动物中诱导免疫耐受已进行了大量的研究, 然而对于在疾病动物模型体内诱导免疫耐受的研究却少见报道.
树突状细胞的不同状态在自身免疫病发病和诱导免疫耐受中所起的作用, 一直是该领域研究的热点, 如何发挥和调控树突状细胞诱导免疫耐受是基础研究和临床应用研究领域所关注的焦点.
研究采用自身抗原皮下注射的方式在STZ诱导的IDDM模型中建立免疫耐受, 并且探讨树突状细胞和调节性T细胞的作用, 目前国内尚无报道, 而研究结果对于免疫耐受的基础研究和应用都具有重要的指导意义.
本文研究内容对于利用树突状细胞和调节性T细胞诱导自身免疫病免疫耐受发挥对疾病尤其是IDDM的免疫保护作用, 提供了理论依据, 也为自身抗原胰岛素诱导免疫耐受的临床应用提供重要的参考.
树突状细胞(dendritic cell): 已知机体内最重要的专职抗原提呈细胞(APC), 在体内数量较少, 是机体免疫应答的主要启动者, 同时在自身免疫耐受的维持中也发挥重要的作用;
免疫耐受(immunetolerance): 指在一定条件下, 机体免疫系统接触某种抗原后所产生的对该抗原的特异性弱应答或无应答状态.
电编: 张敏 编辑:潘伯荣
| 1. | Trucco M. Regeneration of the pancreatic beta cell. J Clin Invest. 2005;115:5-12. [PubMed] [DOI] |
| 2. | Bercovici N, Delon J, Cambouris C, Escriou N, Debre P, Liblau RS. Chronic intravenous injections of antigen induce and maintain tolerance in T cell receptor-transgenic mice. Eur J Immunol. 1999;29:345-354. [PubMed] [DOI] |
| 3. | Ploix C, Bergerot I, Fabien N, Perche S, Moulin V, Thivolet C. Protection against autoimmune diabetes with oral insulin is associated with the presence of IL-4 type 2 T-cells in the pancreas and pancreatic lymph nodes. Diabetes. 1998;47:39-44. [PubMed] [DOI] |
| 4. | Maron R, Guerau-de-Arellano M, Zhang X, Weiner HL. Oral administration of insulin to neonates supp-resses spontaneous and cyclophosphamide induced diabetes in the NOD mouse. J Autoimmun. 2001;16:21-28. [PubMed] [DOI] |
| 5. | Hartmann B, Bellmann K, Ghiea I, Kleemann R, Kolb H. Oral insulin for diabetes prevention in NOD mice: potentiation by enhancing Th2 cytokine expression in the gut through bacterial adjuvant. Diabetologia. 1997;40:902-909. [PubMed] [DOI] |
| 6. | Akbar AN, Taams LS, Salmon M, Vukmanovic-Stejic M. The peripheral generation of CD4+ CD25+ regulatory T cells. Immunology. 2003;109:319-325. [PubMed] [DOI] |
| 7. | Sakaguchi S, Sakaguchi N, Shimizu J, Yamazaki S, Sakihama T, Itoh M, Kuniyasu Y, Nomura T, Toda M, Takahashi T. Immunologic tolerance maintained by CD25+ CD4+ regulatory T cells: their common role in controlling autoimmunity, tumor immunity, and transplantation tolerance. Immunol Rev. 2001;182:18-32. [PubMed] [DOI] |
| 8. | Hackstein H, Morelli AE, Thomson AW. Designer dendritic cells for tolerance induction: guided not misguided missiles. Trends Immunol. 2001;22:437-442. [PubMed] [DOI] |
| 10. | Ridgway WM. The non obese diabetic (NOD) mouse: a unique model for understanding the inter-action between genetics and T cell responses. Rev Endocr Metab Disord. 2003;4:263-269. [PubMed] [DOI] |
| 12. | Todd JA, Wicker LS. Genetic protection from the inflammatory disease type 1 diabetes in humans and animal models. Immunity. 2001;15:387-395. [PubMed] [DOI] |
| 13. | Skarsvik S, Tiittanen M, Lindstrom A, Casas R, Ludvigsson J, Vaarala O. Poor in vitro maturation and pro-inflammatory cytokine response of dendri-tic cells in children at genetic risk of type 1 diabetes. Scand J Immunol. 2004;60:647-652. [PubMed] [DOI] |
| 14. | Lee M, Kim AY, Kang Y. Defects in the differentia-tion and function of bone marrow-derived dendritic cells in non-obese diabetic mice. J Korean Med Sci. 2000;15:217-223. [PubMed] [DOI] |
| 15. | Strid J, Lopes L, Marcinkiewicz J, Petrovska L, Nowak B, Chain BM, Lund T. A defect in bone marrow derived dendritic cell maturation in the nonobesediabetic mouse. Clin Exp Immunol. 2001;123:375-381. [PubMed] [DOI] |
| 16. | Mensah-Brown EP, Stosic Grujicic S, Maksimovic D, Jasima A, Shahin A, Lukic ML. Downregulation of apoptosis in the target tissue prevents low-dose streptozotocin-induced autoimmune diabetes. Mol Immunol. 2002;38:941-946. [PubMed] [DOI] |
| 17. | Lutz MB, Schuler G. Immature, semi-mature and fully mature dendritic cells: which signals induce tolerance or immunity? Trends Immunol. 2002;23:445-449. [PubMed] [DOI] |
| 18. | Roncarolo MG, Levings MK, Traversari C. Differen-tiation of T regulatory cells by immature dendritic cells. J Exp Med. 2001;193:F5-F9. [DOI] |
| 19. | Adorini L, Penna G, Giarratana N, Uskokovic M. Tolerogenic dendritic cells induced by vitamin D receptor ligands enhance regulatory T cells inhibit-ing allograft rejection and autoimmune diseases. J Cell Biochem. 2003;88:227-233. [PubMed] [DOI] |
| 20. | Jonuleit H, Schmitt E, Steinbrink K, Enk AH. Dendr-itic cells as a tool to induce anergic and regulatory T cells. Trends Immunol. 2001;22:394-400. [PubMed] [DOI] |
| 21. | Adorini L. Tolerogenic dendritic cells induced by vitamin D receptor ligands enhance regulatory T cells inhibiting autoimmune diabetes. Ann N Y Acad Sci. 2003;987:258-261. [PubMed] [DOI] |
| 22. | Muir A, Peck A, Clare-Salzler M, Song YH, Corneli-us J, Luchetta R, Krischer J, Maclaren N. Insulin immunization of nonobese diabetic mice induces a protective insulitis characterized by diminished intraislet interferon-gamma transcription. J Clin Invest. 1995;95:628-634. [PubMed] [DOI] |
| 23. | Alleva DG, Gaur A, Jin L, Wegmann D, Gottlieb PA, Pahuja A, Johnson EB, Motheral T, Putnam A, Crowe PD. Immu-nological characterization and therapeutic activity of an altered-peptide ligand, NBI-6024, based on the immunodominant type 1 diabetes autoantigen insulin B-chain (9-23) peptide. Diabetes. 2002;51:2126-2134. [PubMed] [DOI] |
| 24. | Leng Q, Bentwich Z. Beyond self and nonself: fuzzy recognition of the immune system. Scand J Immunol. 2002;56:224-232. [PubMed] [DOI] |
| 25. | Wakkach A, Fournier N, Brun V, Breittmayer JP, Cottrez F, Groux H. Characterization of dendritic cells that induce tolerance and T regulatory 1 cell differentiation in vivo. Immunity. 2003;18:605-617. [PubMed] [DOI] |
| 26. | Pontoux C, Banz A, Papiernik M. Natural CD4 CD25(+) regulatory T cells control the burst of superantigen-induced cytokine production: the role of IL-10. Int Immunol. 2002;14:233-239. [PubMed] [DOI] |
| 27. | Piccirillo CA, Shevach EM. Naturally-occurring CD4+CD25+ immunoregulatory T cells: central players in the area of peripheral tolerance. Semin Immunol. 2004;16:81-88. [PubMed] [DOI] |
| 28. | Jaffar Z, Sivakuru T, Roberts K. CD4+CD25+ T cells regulate airway eosinophilic inflammation by mo-dulating the Th2 cell phenotype. J Immunol. 2004;172:3842-3849. [PubMed] [DOI] |
| 30. | Morelli AE, Hackstein H, Thomson AW. Potential of tolerogenic dendritic cells for transplantation. Semin Immunol. 2001;13:323-335. [PubMed] [DOI] |