修回日期: 2006-02-05
接受日期: 2006-02-10
在线出版日期: 2006-03-08
目的: 研究siRNA(small interfering RNA)对人胃腺癌细胞SGC-7901的VEGF基因表达的影响.
方法: 选择血管内皮生长因子(VEGF)基因为靶基因, 设计两组针对VEGF mRNA的小干扰RNA, 合成DNA寡核苷酸链, 体外转录合成siRNA. 以人胃腺癌细胞系SGC-7901为靶细胞, 应用脂质体转染的方法, 将siRNA导入细胞. 采用Hoechst33258染色观察siRNA作用于SGC-7901细胞中出现凋亡小体的情况, 流式细胞仪检测细胞周期的改变, RT-PCR法比较转染前后VEGF mRNA表达水平的变化, ELISA法检测细胞培养液中VEGF蛋白分泌量的变化.
结果: 两组siRNA转染后均能有效地抑制SGC-7901细胞的生长, 诱导细胞凋亡产生凋亡小体. siRNA作用于SGC-7901细胞, 其细胞周期均发生了明显的变化, 主要表现为G0/G1期细胞增多, S期细胞减少, 并使细胞周期阻滞于G0/G1期(siRNA1组, siRNA2组G0/G1期 vs 对照组G0/G1期: 75.04%, 76.52% vs 58.37%, P<0.01; siRNA1组, siRNA2组S期 vs 对照组S期: 17.82%, 16.73% vs 39.52%, P<0.01), 而其他组则无明显变化. VEGF mRNA的表达量大幅度减少(siRNA1组, siRNA2组 vs 对照组: 0.638±0.078, 0.656±0.085 vs 0.941±0.046, P<0.01), 相对应的VEGF蛋白水平也显著降低(164.7±22.7, 166.3±26.6 vs 414.0±61.5, P<0.01), 而其他组siRNA转染后则无上述作用.
结论: 应用靶向VEGF基因RNA干扰技术可以有效抑制胃癌细胞SGC-7901的增殖.
引文著录: 徐文华, 葛银林, 徐宏伟, 王秀丽, 耿芳宋. VEGF基因表达抑制对胃腺癌细胞SGC-7901增殖的影响. 世界华人消化杂志 2006; 14(7): 655-659
Revised: February 5, 2006
Accepted: February 10, 2006
Published online: March 8, 2006
AIM: To study the effect of small interfering RNA (siRNA) on the gene expression of vascular endothelial growth factor (VEGF) as well as the proliferation of gastric cancer cell line SGC-7901.
METHODS: Two groups of siRNA were designed targeting VEGF mRNA and finally obtained by in vitro transcription. Then the obtained siRNA was transfected into cultured human gastric cancer cell line SGC-7901 by Lipofectamine. Hoechst33258 staining was used to observe the apoptotic bodies in the cells, and flow cytometry was used to detect the change of cell cycles. The level of VEGF mRNA expression was analyzed by reverse transcription polymerase chain reaction (RT-PCR) and the secretion of VEGF protein in the supernatant was examined by enzyme-linked immunosorbent assay (ELISA).
RESULTS: Both groups of VEGF-targeted siRNA inhibited the proliferation of SGC-7901 cells and induced cell apoptosis effectively and after transfection. The percentage of G0/G1 phase cells was significantly increased in siRNA1- and siRNA2-transfected cells in comparison with that in the control cells (75.04%, 76.52% vs 58.37%, P < 0.01), but the percentage of S phase cells was significantly decreased (17.82%, 16.73% vs 39.52%, P < 0.01). The level of VEGF mRNA expression was significantly inhibited in siRNA1- and siRNA2-transfected cells as compared with that in the controls (0.638 ± 0.078, 0.656 ± 0.085 vs 0.941 ± 0.046, P < 0.01), and the secretion of VEGF protein was also notably decreased in both siRNA-transfected cells (164.7 ± 22.7, 166.3 ± 26.6 vs 414.0 ± 61.5, P < 0.01).
CONCLUSION: VEGF-targeted siRNA can effectively inhibit the proliferation of human gastric cancer cell line SGC-7901.
- Citation: Xu WH, Ge YL, Xu HW, Wang XL, Geng FS. Effect of down-regulating vascular endothelial growth factor gene on proliferation of gastric cancer cell line SGC-7901. Shijie Huaren Xiaohua Zazhi 2006; 14(7): 655-659
- URL: https://www.wjgnet.com/1009-3079/full/v14/i7/655.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i7.655
胃癌是我国最常见的消化道肿瘤, 其死亡率居各种恶性肿瘤之首[1-3]. 探索治疗胃腺癌的新方法具有重要的临床价值. 肿瘤的基因治疗中抗血管生成疗法成为近年来较为引人注目的一种. 肿瘤血管的形成受多种因子调节, 其中最重要的是血管内皮生长因子(vascular endothelial growth factor, VEGF). VEGF基因位于染色体的6p21.3, 全长28 kb, 编码VEGF的基因长约14 kb, 由8个外显子和7个内含子交替构成. 其mRNA的不同剪接产生5种异构体, 即VEGF121, 145, 165, 189及206[4]. 大量研究发现, VEGF在胃腺癌组织中高表达, 其中VEGF165表达较高[5-7]. RNA干扰(RNA interference, RNAi)是将双链RNA寡核苷酸片段(dsRNA)导入细胞引起特异基因mRNA降解的一种细胞反应过程[8-9]. 一般使用19-23 bp的dsRNA可特异性地发挥RNAi作用[10]. 通过抑制VEGF的表达抑制肿瘤微血管形成是当前抗肿瘤研究的热点[11]. RNAi作为生命科学领域的新技术, 其应用非常广泛, 从单细胞生物一直到人, 作为基因表达干预的理想方法可应用于病毒和肿瘤的基因治疗[12-13]. 目前已成功用于基因功能和信号传递系统上下游分子相互关系的研究, 有可能成为继反义核酸、核酶之后的又一新手段[14]. 我们利用设计的针对VEGF基因的两组siRNA(19-23 bp), 研究对人胃腺癌细胞系SGC-7901 VEGF基因表达的抑制作用, 探讨RNAi在肿瘤基因治疗中的应用前景.
人胃腺癌细胞株SGC-7901购自中国医学科学院基础医学研究所; LipofectamineTM 2000、Trizol Reagent、RPMI 1640培养基等购自Invitrogen; T7 RiboMAXTM Express RNAi System试剂盒、Access RT-PCR Introductory System购自Promega; 人VEGF ELISA Kit购自武汉博士德生物工程有限公司. 从GenBank中获取已知的人VEGF mRNA序列(ACCESSION: AB021221). 采用Promega在线siRNA设计工具, 设计两组siRNA序列(每组中第1条链为编码链, 第2条为模板链)和错义序列组SCR序列[15-16](与第2组siRNA序列有相同的GC组成, 但是和人的mRNA没有同源性, 以此作阴性对照), 模板链的5'端带有T7启动子. 体外转录出来的siRNA分别标记为siRNA1、siRNA2和siRNASCR. 1: 5'-GAUCAAACCUCACCAAGGCUU-3'; 5'-GCCUUGGUGAGGUUUGAUCUU-3'. 2: 5'-GGAGUACCCUGAUGAGAUCUU-3'; 5'-GAUCUCAUCAGGGUACUCCUU-3'. 3(SCR组): 5'-GCGUAACGCGGGAAUUUACUU-3'; 5'-GUAAAUU CCCGCGUUACGCUU-3'. 目前干扰用siRNA的获得及高通量、大范围的应用仍以体外转录法为主[20,21], 具体参照Promega T7 Ribo MAXTM Express RNAi System试剂盒方案. SGC-7901细胞用含100 mL/L新生牛血清的RPMI 1640培养基, 于37℃ 50 mL/L CO2条件下培养.
1.2.1 细胞的凋亡: 取对数生长期的SGC-7901细胞, 配制6×107/L起始浓度的细胞悬液加到24孔板, 同时加入多聚赖氨酸包被的盖玻片, 24 h后弃上清, siRNA1, siRNA2, siRNASCR采用脂质体包裹转染的方法(200 nmol/L)转染48 h后, 吸净培养液, 加入多聚甲醛固定1 h, 去固定液, PBS洗3遍, 再加入10 mg/L的Hoechst33258(0.5 mL/孔)避光染色10 min, 用封片液(500 mL/L PBS+500 mL/L甘油)封片, 荧光显微镜观察. 各组细胞以1.5×105/L起始密度接种于25 cm2培养瓶, 同样方法转染后继续培养48 h, 胰酶消化离心收集并悬于PBS中, 4℃ 700 mL/L的乙醇固定30 min, 用含RNase及碘化丙锭(propidium iodide, PI)的染色液染色30 min. 根据流式细胞仪(EPICS-ELITE-ESP)进行细胞周期分析, 每个样本约检测11 000个细胞, 得出各期细胞数占细胞总数的百分率.
1.2.2 VEGF基因表达分析: 转染24 h后收获细胞, 用总RNA提取试剂盒Trizol提取各组细胞总RNA. 取1 µg总RNA进行RT-PCR扩增VEGF mRNA的部分片段. 上游引物: 5'-AATCGAGACCCTGGTGGACA-3', 下游引物: 5'-TTAACTCAAGCTGCCTCGCC-3'; 内参照基因GAPDH(甘油醛-3-磷酸脱氢酶)引物: 上游: 5'-CGTGGAAGGACTCATGACCA-3', 下游: 5'-TCCAGGGGTCTTACTCCTTG-3'. 反应体系体积为50 µL, 按照Promega"Access RT-PCR Introductory System"试剂盒方案: 45℃, 45 min进行反转录反应; PCR反应条件为94℃, 2 min, AMV反转录酶灭活和RNA/cDNA引物预变性; 94℃ 30 s, 52.5℃ 1 min, 68℃ 2 min, 40个循环, 最后68℃延伸7 min. RT-PCR产物进行20 g/L琼脂糖凝胶电泳, 凝胶紫外摄像系统中照相, 并运用天能分析软件对条带进行光密度扫描, 检测各组VEGF mRNA RT-PCR产物与其对应的内参GAPDH mRNA RT-PCR产物A值, 然后对AVEGF/AGAPDH的比值进行统计分析. 另收取转染24 h后细胞上清用于检测VEGF蛋白分泌量. 严格按试剂盒说明操作, 将不同浓度的VEGF标准品(7.8, 15.6, 31.2, 62.5, 125, 250, 500, 1 000 ng/L)以及不同组细胞上清液于Rayto2100C酶标仪中检测450 nm吸光度值. 读板后仪器自动绘制标准曲线并计算出各待测样本的VEGF定量值.
统计学处理 数据以mean±SD表示, 采用单因素方差分析, 用SPSS 11.5统计软件进行统计处理.
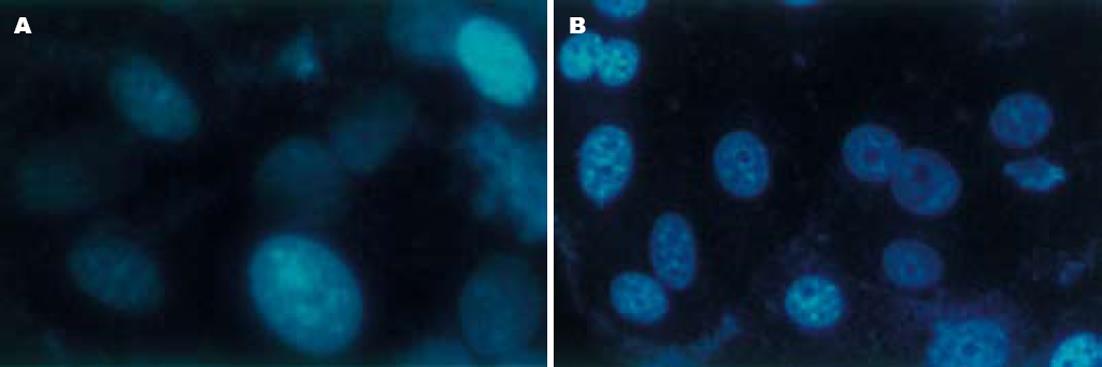
SGC-7901细胞的DNA结合了Hoechst33258之后, 紫外光激发式发射明显的蓝色荧光. siRNA组的细胞核出现典型的凋亡形态学改变, 凋亡细胞的主要特征为核染色质致密深染, 形成致密质块, 有时可碎裂, 产生凋亡小体[17]. 空白对照组、脂质体组、错义序列组的细胞没有出现这些细胞和染色质的形态学改变(图1).
流式细胞仪检测细胞周期变化见表1. siRNA作用的细胞G0/G1期(细胞静止期和DNA合成前期)比例升高, S期和G2/M期(DNA合成期与有丝分裂期)比例降低, 错义序列组、脂质体组无此变化, 证明siRNA对SGC-7901细胞生长有抑制作用.
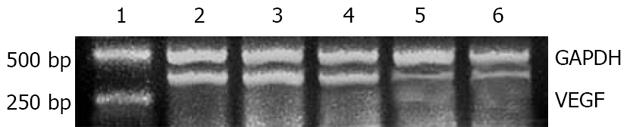
转染24 h后VEGF mRNA表达水平可见到明显变化, siRNA1组和siRNA
组较正常对照组、脂质体组和错义序列组VEGF mRNA表达水平明显降低, 说明发挥了特异的RNAi作用, 这与细胞增殖实验结果相符(图2, 表2). siRNA1和siRNA2组的VEGF分泌含量明显低于脂质体对照细胞组等其他3组, siRNA1和siRNA2组与脂质体对照组比较均有统计学意义(表2).
肿瘤(neoplasm)是一种常见多发病. 近年来, 我国胃腺癌的发病率逐年增高, 但至今仍无有效疗法. 新生血管过度生长是肿瘤快速生长和转移的重要基础. 抑制新生血管生长是防治恶性肿瘤的一条重要途径. 实体瘤的生长需要血管生成来输送营养和氧. 实验发现, 肿瘤细胞集落一旦发生血管化, 肿瘤将以几何数量级倍增. 此外, 还有其他多种病理过程与血管过度增生有关. 如: 慢性感染、特异性免疫反应等. 血管生成与动脉粥样硬化、关节炎、视网膜增生及内皮细胞恶变(如血管瘤)等也密切相关. 因而, 抑制新生血管生长是治疗上述疾病, 尤其是防治恶性肿瘤的一条重要途径. 目前已有一些血管生成抑制药物, 如某些激素和氨甲喋呤(methotrexate)等, 但大部分都由于毒性太大不能用于临床[12], 寻找新的高效无毒的血管生成抑制方法, 已引起人们的重视. 大量研究发现, VEGF基因在胃腺癌组织中高表达, 在血管生成中起着关键的作用. 而RNAi技术为基因表达干预的理想方法, 通过导入一段与内源基因同源的dsRNA序列, 可以高效、特异地降解有关基因的mRNA, 诱使细胞表现出特定基因缺失的表型[18]. 从而从基因水平抑制VEGF基因的表达, 达到减低甚至阻止VEGF分泌的效果; Spankuch-Schmitt et al[19]在乳腺癌细胞系、子宫颈癌细胞系、结肠癌细胞系等细胞中进行了成功的RNA干扰实验, 并观察到癌细胞增殖明显减少, 凋亡显著增加. 同时, RNAi具有特异、高效、毒性小的特点, 在肿瘤的基因治疗中具有良好的应用前景[16,12]. 若能联合上述作用, 必将极大增强多种恶性肿瘤的治疗效果. 利用RNAi基因干预技术, 阻止血管生成和淋巴管生成防治癌症的研究, 目前还没有人报道[20-21].
我们以人胃腺癌细胞系SGC-7901为对象, 利用分子生物学技术, 设计、体外转录针对VEGF基因的两组siRNA, 转染体外培养的SGC-7901细胞, 遏制VEGF基因的表达, 研究胃腺癌的防治方法. 结果表明, 从mRNA转录到蛋白质表达, siRNA都对VEGF基因的表达具有明显的抑制效果, 并抑制了胃腺癌细胞SGC-7901的增殖. 在胃腺癌的抗血管生成基因治疗中VEGF可以成为有效的靶位点. 实验所用体外转录试剂盒所转录出来的siRNA纯度高, 可直接应用于体外培养细胞的转染. 脂质体带正电, 可以靠静电作用结合RNA形成RNA-阳离子脂质体复合物, 同时又吸附在带负电的细胞膜表面. 因此, 脂质体转染法在短期应用的基因治疗中具有明显优点[16,22-23].
总之, 我们的结果为RNAi应用于肿瘤的基因治疗提供了一些实验基础. 验证了应用RNA 干扰技术可以有效抑制肿瘤相关基因的表达, 从而抑制瘤细胞的增殖、防治肿瘤的基因治疗思路, 为下一步动物实验打下了基础. 当然, 针对VEGF的RNAi技术临床应用于胃腺癌治疗尚需要进一步的细胞实验以及动物实验.
胃癌是我国最常见的消化道肿瘤, 其死亡率位于恶性肿瘤前列, 探索其治疗方法具有重要应用价值.
肿瘤的生长与血管的快速生长密切相关. 肿瘤血管的形成受多种因子调节, 其中最重要的是血管内皮生长因子(vascularendothelial growthfactor, VEGF). 在胃腺癌组织中VEGF165高表达. 如何抑制VEGF165表达, 已成为防治胃癌的热点. RNA干扰(RNAinterference, RNAi)是近几年刚刚发现的自然现象, 一小段双链RNA(dsRNA)可引起特定mRNA降解.
本研究所选靶基因为血管内皮生长因子基因, 不是一般癌基因; 利用DNA模板体外转录法合成小RNA, 纯度高, 无其他化学试剂.
本实验设计针对VEGF mRNA的两组siRNA, 抑制人胃腺癌细胞系SGC-7901VEGF基因的表达, 研究RNAi在肿瘤基因治疗中的应用前景.
1 血管内皮细胞生长因子(vascularendothelial growthfactor, VEGF)基因位于染色体的6p21.3, 全长28 kb, 编码VEGF的基因长约14 kb, 由8个外显子和7个内含子交替构成. 其mRNA的不同剪接产生5种异构体, 即VEGF121, 145, 165, 189及206.2 RNA干扰(RNAinterference, RNAi)是将双链RNA寡核苷酸片段(dsRNA)导入细胞引起特异基因mRNA降解的一种细胞反应过程. 一般使用19-23 bp的dsRNA可特异性地发挥RNAi作用.
本研究为RNAi应用于肿瘤的基因治疗提供了一些实验基础, 验证了应用RNA干扰技术可以有效抑制肿瘤相关基因的表达, 从而抑制瘤细胞的增殖、防治肿瘤的基因治疗思路, 为下一步动物实验打下了基础. 当然, 针对VEGF的RNAi技术临床应用于胃腺癌治疗尚需要进一步的细胞实验以及动物实验.
电编: 张敏 编辑:潘伯荣
| 1. | 吴 汉平, 吴 开春, 李 玲, 幺 立萍, 兰 梅, 王 新, 樊 代明. 人环氧合酶-2(hCOX-2)编码基因的克隆及其反义核酸转染胃癌细胞的初步研究. 世界华人消化杂志. 2000;8:1211-1217. [DOI] |
| 8. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interfer-ence by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 9. | Williams BR. Role of the double-stranded RNA-activated protein kinase (PKR) in cell regulation. Biochem Soc Trans. 1997;25:509-513. [PubMed] [DOI] |
| 10. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 11. | Kollermann J, Helpap B. Expression of vascular endothelial growth factor (VEGF) and VEGF recept-or Flk-1 in benign, premalignant, and malignant prostate tissue. Am J Clin Pathol. 2001;116:115-121. [PubMed] [DOI] |
| 12. | 顾 健人. 基因治疗的新进展. 2002济南国际肿瘤防治前沿学术大会. 2002;10. |
| 13. | Sohail M, Doran G, Riedemann J, Macaulay V, Southern EM. A simple and cost-effective method for producing small interfering RNAs with high efficacy. Nucleic Acids Res. 2003;31:e38. [PubMed] [DOI] |
| 14. | Hammond SM, Caudy AA, Hannon GJ. Post-transcriptional gene silencing by double-stranded RNA. Nat Rev Genet. 2001;2:110-119. [PubMed] [DOI] |
| 15. | Harborth J, Elbashir SM, Bechert K, Tuschl T, Weber K. Identification of essential genes in cultured mammalian cells using small interfering RNAs. J Cell Sci. 2001;114:4557-4565. [PubMed] |
| 16. | Martinez LA, Naguibneva I, Lehrmann H, Vervisch A, Tchenio T, Lozano G, Harel-Bellan A. Synthetic small inhibiting RNAs: efficient tools to inactivate oncogenic mutations and restore p53 pathways. Proc Natl Acad Sci USA. 2002;99:14849-14854. [PubMed] [DOI] |
| 17. | 苏 长青. 细胞凋亡的形态代谢特点及生物学意义. 临床与实践病理学杂志. 1996;12:346-348. |
| 18. | Bernstein E, Caudy AA, Hammond SM, Hannon GJ. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature. 2001;409:363-366. [PubMed] [DOI] |
| 19. | Spankuch-Schmitt B, Bereiter-Hahn J, Kaufmann M, Strebhardt K. Effect of RNA silencing of polo-like kinase-1 (PLK1) on apoptosis and spindle formation in human cancer cells. J Natl Cancer Inst. 2002;94:1863-1877. [PubMed] [DOI] |
| 21. | 吕 联煌. 反义基因药物治疗血液肿瘤研究进展. 中华医学会第七次全国血液学学术大会. 2002;11. |
| 22. | Donze O, Picard D. RNA interference in mammali-an cells using siRNAs synthesized with T7 RNA polymerase. Nucleic Acids Res. 2002;30:e46. [PubMed] [DOI] |
| 23. | 孟 和, 陈 学辉, 潘 玉春. RNA干扰用siRNA的体外转录合成. 上海交通大学学报(农业科学版). 2004;22:64-68. |