修回日期: 2006-01-09
接受日期: 2006-01-13
在线出版日期: 2006-02-28
目的: 探讨整个肝局灶性结节性增生(FNH)病变及各结节的克隆性, 以阐明其本质, 同时比较其与肝细胞腺瘤(HA)鉴别的克隆性组成.
方法: 女性肝脏标本3例共4个FNH病灶. 在病变区和非病变区取组织提取基因组DNA, 余标本制备石蜡切片, HE染色, 应用显微切割技术分离其中3个FNH内的小结节状病变, 提取基因组DNA, 经甲基化敏感的HpaⅡ或HhaⅠ消化, 巢式PCR扩增磷酸甘油酸激酶(PGK)和雄激素受体(AR)基因. 应用Bst XI酶切和琼脂糖凝胶电泳显示PGK基因的单核苷酸多态性; 应用变性聚丙烯酰胺凝胶电泳显示AR基因的CAG重复序列长度多态性. 2例HA和4例HCC作为肿瘤参照.
结果: 2例HA及4例HCC均为单克隆性. 4个FNH病变, 直径1.5-5.3 cm, 但缺乏特征性的中央星状瘢痕, 结果均显示为多克隆性病变; 其中的61个结节性病变中, 56个呈变异肝细胞结节(NAH)形态, 5个为普通再生结节. 克隆性分析结果显示, 56个NAH样病变中, 除4个未扩增成功外, 52个NAH中有21个(40.4%)显示X染色体失活嵌合性丢失, 提示为肿瘤性病变; 其中1例FNH的14个单克隆结节中, 有2个与其他病变失活带型不一致, 提示在同一FNH中, 存在着不同起源的NAH样病变. 5个普通肝细胞增生结节及病变周围肝组织均为多克隆组成.
结论: FNH是由无数个NAH构成的, 其整个病变是多克隆性, 但其中某些结节已经是肿瘤性增生. 克隆性检测有助于其与HA的鉴别, 而且所取样本必须是病变的整个切面或其大部分.
引文著录: 巩丽, 张宏图, 张伟, 李爱宁, 刘杉, 孙耘田, 刘贵秋, 苏勤. 克隆性分析技术在肝脏局灶性结节性增生诊断中的应用. 世界华人消化杂志 2006; 14(6): 568-575
Revised: January 9, 2006
Accepted: January 13, 2006
Published online: February 28, 2006
AIM: To study the clonality status of the whole lesions and each nodules of hepatic focal nodu-lar hyper-plasia (FNH), and simultaneously compare the clonal composition with hepato-cellular adenoma (HA).
METHODS: Four FNHs from 3 women, 2 HAs and 4 HCCs were examined by clonality assays based on X-chromosome inactivation mosaicism. Nodules were microdissected from paraffin sections. Genomic DNA was isolated from each nodules, the whole lesions and surrounding liver parenchyma, pretreated with Hpa II or Hha I, and then amplified via nested polymerase chain reaction (PCR) for phosphoglycerate kinase (PGK) and androgen receptor (AR) genes. The single nucleotide polymorphism at the PGK locus was identified by incubation with Bst XI and agarose gel electrophoresis, and the CAG repeat length polymorphism at AR locus was revealed on denaturing polyacrylamide gels and visualized by silver staining.
RESULTS: The FNH lesions sized 1.5-5.3 cm in diameter, without a central stelate scar for all of them. While monoclonality was confirmed in both of 2 HAs and all of 4 HCCs examined, polyclonality was shown in all of the 4 FNHs as determined by the whole lesions, demonstrating its distinction from neoplastic lesions. A total of 61 nodules, including 56 nodules of altered hepatocytes (NAH) and 5 ordinary regenerative nodules, were microdissected from 3 of the 4 FNH lesions. The clonality analysis was successful in 52 NAHs. Loss of X-chromosome inactivation mosaicism was detected in 21 (40.4%) of them, indicating the monoclonal, neoplastic nature. In one FNH, different X-chromosomal inactivation patterns were observed in separate monoclonal nodules, revealing different clonal origins. Polyclonality was demonstrated in all of the 5 ordinary regenerative nodules and the surrounding liver parenchyma.
CONCLUSION: FNH is composed of numerous NAHs. The whole lesion shows a polyclonal cell composition, but neoplastic transformation has occurred in some of the nodules. Clonality assay is useful for in the differential diagnosis of FNH from HA, and sampling the whole or larger part of the lesion is necessary.
- Citation: Gong L, Zhang HT, Zhang W, Li AN, Liu S, Sun YT, Liu GQ, Su Q. Application of clonality analysis in diagnosis of focal nodular hyperplasia. Shijie Huaren Xiaohua Zazhi 2006; 14(6): 568-575
- URL: https://www.wjgnet.com/1009-3079/full/v14/i6/568.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i6.568
局灶性结节性增生(focal nodular hyperplasia, FNH)是肝脏一种良性局部病变. 多数作者认为他是肝细胞对异常血液供应的增生性反应, 而不是一种肿瘤[1]. 其发生机制仍未定论. 虽然有报道称FNH与肝细胞癌(hepatocellular carcinoma, HCC)之间有一定的关联[2-3], 但并未得到广泛承认. 大约一半FNH大体上缺乏特征性的中央星状瘢痕[1], 这在与肝细胞腺瘤(hepatocellular adenoma, HA)的鉴别中会遇到困难. 克隆性增生是多数肿瘤性病变的特征[4], 已有作者提出FNH为多克隆细胞组成, 因而认为FNH不是肿瘤性病变[5-6]. 此研究的目的是澄清FNH, 尤其是无中央瘢痕FNH病变的克隆组成, 藉此提供与HA鉴别的一种可靠手段.
2003-02/2005-10第四军医大学唐都医院和中国医学科学院肿瘤医院病理科女性肝组织标本9例(表1), 均经40 g/L甲醛固定, 石蜡包埋的手术切除标本. 每例标本均经组织学检查, 经3位病理医师(苏勤, 张宏图, 巩丽)确诊, 参照形态学标准检出HA[7], FNH[8]及HCC[7-10], 根据Edmondson et al的标准[11]对HCC进行分级, 根据我们以前的观察[9]检出变异肝细胞结节(nodules of altered hepatocytes, NAH).
1.2.1 显微切割(microdissection)和DNA提取: 分别在4例HCC, 2例HA及3例4个FNH病变区和非病变区随机各取4片组织, HCC、HA和FNH取样面积均大于0.5 cm×0.5 cm. 用酚-氯仿法提取基因组DNA. FNH标本石蜡包埋后制备15 mm切片8张, 用于病变内不同小结节的显微切割. 经HE染色后, 用100%甘油覆盖组织, 在倒置光学显微镜4倍物镜下用4号半注射器针头将所需的组织剔出(图1), 收集到装有无水乙醇的1.5 mL Eppendorff管内. 同时分离相同面积的病变旁正常肝组织, 作为阴性对照. 经三次无水乙醇洗涤后, 室温放置, 待组织干燥后, 应用QIAamp DNA提取试剂盒(Qiagen GmbH, Germany)按照说明书提取基因组DNA.
1.2.2 克隆性分析: PGK和AR位点的克隆性检测是基于女性体细胞组织的X染色体失活嵌合性, 即所有女性体细胞的2条X染色体中的1条在胚胎发育早期必须通过永久甲基化而随机灭活, 另一条保持遗传活性[12]. PGK基因多态性表现为在甲基化位点下游有一个可以被Bst XI识别的单核苷酸多态性位点, 可经琼脂糖凝胶电泳显示[13]. AR基因多态性表现为其第一外显子的CAG串联重复序列(short-tandem repeat, STR)的长度不同, 即(CAG)n的n值有差别(11-31), 通过变性聚丙烯酰胺凝胶电泳显示[14]. 具有多态性位点的女性个体中正常和多克隆增生的组织显示两条带, 而肿瘤性病变仅显示一条带或以一条带为主[4]. 克隆性检测参照以前的方法进行[15-16]. PGK位点所用序列如下: PGK1A, 5'- CTG TTC CTG CCC GCG CGG TGT TCC GCA TTC-3'; PGK1B, 5'-ACG CCT GTT ACG TAA GCT CTG CAG GCC TCC-3'; PGK2A, 5'-AGC TGG ACG TTA AAG GGA AGC GGG TCG TTA-3'; PGK2B, 5'-TAC TCC TGA AGT TAA ATC AAC ATC CTC TTG-3'. DNA样品经Hpa Ⅱ消化3 h后, 巢式PCR扩增. 第1轮反应含有引物对PGK1A/PGK1B, 97 ℃ 7 min预变性, 94 ℃变性40 s, 58 ℃退火50 s, 72 ℃延伸1 min, 共35个循环, 72 ℃延伸15 min. 反应产物1:20稀释后, 取5 µL加入第2轮反应体系, 其中含有引物对PGK2A/PGK2B, 除退火温度为56 ℃外, 余条件与第一轮相同. 第2轮反应产物再经Bst XI酶48 ℃消化8-10 h后, 20 g/L琼脂糖凝胶电泳, 溴化乙锭染色显示结果. AR位点所用序列如下: AR1A, 5'-GAC GAG CTT TCC AGA ATC TG-3'; AR1B, 5'-CAT GGG CTT GGG GAG A-3'; AR2A, 5'-TCC AGA ATC TGT TCC AGA GC-3'; AR2B, 5'-TGG GGA GAA CCA TCC TCA CC-3'. DNA样品在37 ℃水浴锅内经Hha Ⅰ消化3 h后, 62 ℃灭活10 min, 巢式PCR扩增. 第1轮反应和第2轮反应的引物对分别为AR1A/AR1B和AR2A/AR2B, 退火温度均为56 ℃, 25个循环, 第1轮反应产物1:100稀释后, 取1 µL加入第2轮反应, 余反应参数同PGK位点的扩增反应. 琼脂糖凝胶(20 g/L)电泳评价AR基因扩增效果. 然后将4 µL产物和等体积的上样缓冲液混匀后, 加到厚度为0.8 mm的变性聚丙烯酰胺(100 g/L, 含尿素8 mol/L), 应用miniVE电泳系统(Amersham-Pharmacia Biotech, USA)120 V泳动4 h, 按以前描述的方法[15]进行银染. 电泳结果观察分别用UVP凝胶分析系统(UVP, Cambridge, UK)和光学照相记录数据, 用相应软件(LabWorksTM, UVP)比较Hpa Ⅱ或Hha Ⅰ消化前后一对等位基因扩增产物的强度差异, 其中1条带可比强度减弱达50%以上时才被认为有意义, 即X染色体失活嵌合性丢失[16].
1.2.3 免疫组织化学: 切片4 mm脱蜡入水后分别滴加针对Ki-67抗原、CK19、CK18和HBsAg的抗体. 参照以前的方法[9], 采用链霉菌抗生物素蛋白-过氧化酶(S-P)反应显示抗原-抗体结合, 二氨基联苯胺/过氧化氢溶液染色, 苏木素衬染. 上述试剂均购自福州迈新试剂有限公司. 应用已知有相应抗原表达的标本作为阳性对照; 应用相同稀释度的免疫前小鼠或家兔IgG进行阴性对照反应.
统计学处理 应用SPSS 12.0软件包进行统计计算. 应用单因素方差检验比较单克隆结节与多克隆结节的大小, P<0.05被认为有显著性差异.
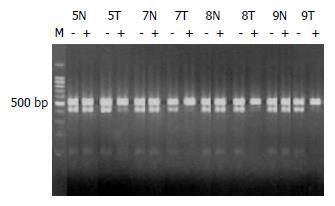
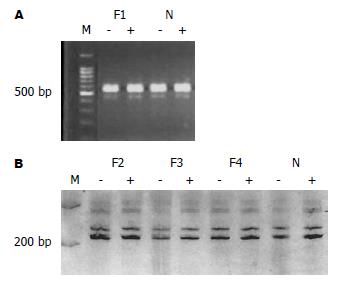
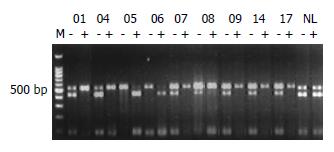
HCC(No.7-9)3例和HA(No.5)1例标本有PGK基因位点单核苷酸多态性, Hpa Ⅱ酶切前在530 bp与433 bp处DNA泳动位置各显示1条带, 酶切后下带完全消失或明显减弱, 而瘤旁正常肝组织酶切前后两条带的强度无明显改变(图2), 这些数据显示HCC和HA均为单克隆性. 余1例HA(No.4)和1例HCC(No.6)标本无PGK位点多态性, 但显示出AR基因CAG STR长度多态性. 在病变中多点取组织进行克隆性检测, HhaⅠ消化后一条带明显减弱或消失, 证实了他们的单克隆细胞构成(图3, 4).
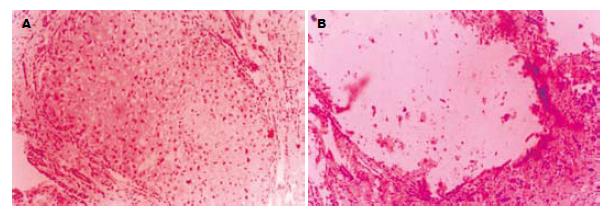
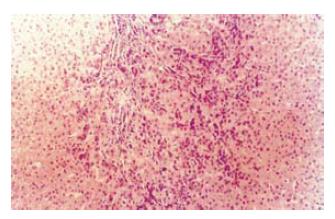
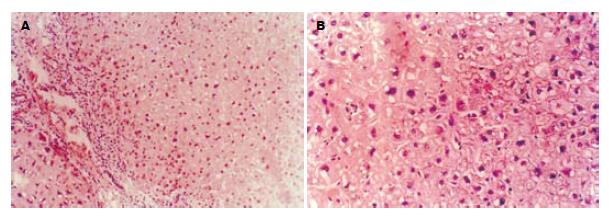
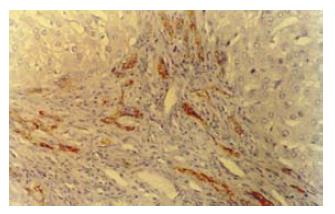
FNH3例共4个病变, 均为球形, 直径1.5-5.3 cm, 切面呈结节状外观, 未见明显的中央星状瘢痕(图5). 每个病变都由许多小结节组成, 其直径1.0-12 mm, 仅部分有纤维组织分隔. 镜下见病变呈膨胀性生长, 并被厚薄不一的纤维组织分隔为小结节. 纤维间隔内许多增生胆小管及慢性炎细胞浸润(图6), 并可见结构异常的血管. 多数小结节由透明细胞和嗜双色细胞构成, 多数肝板厚度约2层细胞, 结构上类似于早先描述的NAH, 但不伴有小细胞性改变(small-cell change, SCC)(图7A-B)[17]; 少部分结节形态类似于肝硬变组织中的普通再生结节[18], 结节中心有典型的汇管区. FNH病变区肝细胞Ki-67表达指数仅2.0%; CK19阳性仅见于胆管和胆小管结构(图8).
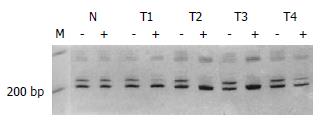
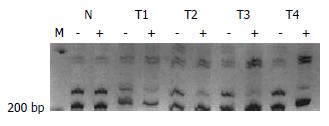
每个FNH病变中随机取2处片状组织(面积1.5 cm×1.5 cm或最大切面)进行克隆性检测, 均显示多克隆性细胞构成(图9A-B). 如表1所示, 4个FNH中共分离出61个结节. 如表2显示, 病例1的病变(FNH01)中显微切割共分离出42个小结节(图10), 对38个病变的扩增反应成功. 这些病变中4个为普通再生结节(长轴直径分别为2-7 mm), 显示为多克隆性; 其余34个均为混合细胞型NAH病变, 14个(41.2%)显示为单克隆性, 其中2个NAH与其他10个病变失活带型不一致(图11). 病例2病变(FNH02)的3张切片中共分离出6个NAH, 其中2个(33.3%)为单克隆性, 他们均位于同一张切片的相邻位置. 病例3的FNH03中分离出的13个病灶中, 1个为普通肝细胞增生结节(直径1 mm), 显示为多克隆性; 12个为NAH, 有5个(41.7%)显示为单克隆性, 而且灭活带型相同. 在分析的3个FNH病变中, 分离的52个NAH中有21个(40.4%)显示为单克隆性细胞构成(图12). 单克隆和多克隆性NAH病变的截面积分别为9.8±7.0 mm2和9.5±6.7 mm2, 二者无显著差别(P = 0.922, F = 0.01).
FNH是发生于结构正常肝脏的一种良性增生性疾病, 1958年由Edmondson提出, 并于1975年被WHO确认, 曾被称为"局部硬化"、"肝错构瘤"、"肝腺瘤"等[19]. 欧美1960年以来的报道有所增加, 90%左右发生于女性, 好发年龄30-40岁[20]. 至于FNH的病因, 国外资料统计50%-75%的患者, 特别是有症状或结节较大者都有口服避孕药物应用史, 并且认为是雌激素刺激肝细胞增生和血管改变所致[21]. Wanless et al[22]通过对51例FNH病变的分析提示该病的形成与肝局部血管畸形有关, 肝细胞的结节性增生可能是由于这些畸形血管提供了更多的血流所致. 有报道称FNH是纤维板层型HCC的前期病变, 理由是二者有时先后发生于同一患者[23], 然而, 这种情况极为罕见[2-3,24]. FNH的鉴别诊断主要包括HA和分化好的HCC. 对于典型的病变, 根据周围肝组织基本正常, 中央星状纤维疤痕和纤维隔中大量胆小管结构存在及缺乏小细胞改变不难做出正确诊断. 然而, 约一半的FNH病变缺乏中央星状瘢痕这一特征性改变[1,25-26], 他们与HA之间的鉴别常遇到困难; 此研究应用的4个FNH病变都属于这一类型, 基于其小结节状结构以及纤维隔内胆小管显著增生改变, 仍可以将其归入经典型FNH[1]; 当这样的病变中纤维间隔内胆小管结构较少时, 与HA的鉴别会构成外科病理诊断的难题. 由于这两种病变的临床表现和外科处理原则不同, 发展一种有助于二者鉴别诊断的客观指标是摆在肝脏病理学家面前的一项迫切任务.
FNH到底是一种反应性增生, 还是一种肿瘤? 目前尚未形成一致结论. Paradis et al[5]应用X染色体失活相关的克隆性分析技术检查了12例FNH, 均显示为多克隆病变. 据此, 他们认为FNH是一种反应性增生, 而不是肿瘤. Zhang et al[6]对1例伴有HCC发生的FNH两处病变分别进行了克隆性分析, 得出了相似的结果. Gaffey et al[27]用相同的方法对7例FNH进行了分析, 结果显示5例是单克隆性病变. Chen et al[28]对发生于同一个肝脏的FNH和HCC病变分别进行了分析, 都显示为单克隆性增生. 最近, Paradis et al[29]对一组毛细血管扩张型FNH进行了分析, 显示为单克隆性细胞组成, 据此他们把这种病变归入HA. 此研究中我们对来自3位女性患者4个FNH病变进行了克隆性检测, 显示这些病变整体上均为多克隆性细胞构成, 与Paradis et al[5]的结果一致. 基于上述数据, 我们认为FNH整体上是多克隆性病变, 据此可与HA和分化好的HCC鉴别.
FNH被认为是一种局部肝硬变表现[19]. 对不同原因引起的肝硬变观察显示, 部分所谓的"再生结节"已经被变异肝细胞占据, 并显膨胀性生长, 称为NAH[9], 这种病变由变异肝细胞病灶(foci of altered hepatocytes, FAH)发展而来[9]. FAH广泛出现于实验性肝癌发生模型的肝组织内[30]; FAH和NAH为HCC前期病变的不同阶段, SCC, 即肝实质的真性不典型增生[9-10]的出现会使进展明显加快. 我们以前的结果已经显示, FAH为HA和HCC的前体, 即肿瘤前期病变(preneoplastic lesion), 少部分(35%)不伴SCC的NAH以及所有伴有SCC的NAH病变是单克隆性, 属于微小肝细胞腺瘤(hepatocytic microadenoma)[18], NAH及FAH内SCC是肝脏的恶性前期病变(premalignant lesion)[10,31]. 在FNH病变中, 部分结节性病变由透明细胞性及嗜双色细胞性变异肝细胞组成并呈膨胀性生长, 形态学符合NAH的形态学标准, 属于透明细胞/嗜双色混合细胞性NAH, 只不过不伴SCC. 为了显示这些NAH病变的性质以及探讨文献中对FNH克隆性这一问题分歧的原因, 对这3个FNH中的多个病灶进行了显微切割, 并对分离的病变进行克隆性检测. 结果显示, 5个普通再生结节全为多克隆性, 反映了反应性增生本质; 52个NAH中, 21个(40.4%)是单克隆性(图12), 属于微小肝细胞腺瘤, 这与我们对肝硬变中NAH的分析结果一致[18]. 这从另一方面也证实, 这些病变属于NAH. 由此我们推断, FNH实际上是由许多个NAH所构成的局灶性病变. 至于这些肿瘤前期病变在此处成簇发生并进展的原因值得进一步探讨.
基于上述观察, 我们认为, 上述文献中有关FNH克隆性这一问题的分歧是病变中不同性质的结节组合不同以及不同实验室采集样本的大小不同所致. 经典型FNH中的小结节多数为多克隆病变, 即使是单克隆性NAH, 也可具有不同的X染色体失活类型. 当取材面积较大(本研究为1.5 cm×1.5 cm)时, 病变整体为多克隆性; 当取材较局限, 而且恰好位于相同X染色体失活类型的单克隆NAH病变区(图10)时, 可能会得出单克隆性检测结果. 至于毛细血管扩张型FNH的克隆性, 也需要更多的观察. 如果真正象Paradis et al[29]报道的那样, 整个病变内绝大部分肝细胞具有相同的克隆特征, 应该将其归入HA. 总之, 根据目前的研究, 我们的结果表明, FNH整个病变属于多克隆性, 据此可以与HA相区别. 实际上, FNH是由一簇NAH所构成的混合性病变, 且部分NAH已经属于微小肝细胞腺瘤, 他们才是FNH发生、发展的最终决定因素. 也许其中某个结节会进展为某种类型的HCC, 就象有的文献[2-3,24]指出的那样. 不过, FNH中每个NAH的体积远不如HA大, 因此癌变机率远低于HA.
此研究得益于与刘复生教授的讨论.
多数肿瘤由单克隆细胞组成, 而正常组织和反应性增生的病变是多克隆的. 利用克隆性分析方法探讨病变的克隆起源, 以区别其是否为肿瘤. 这项技术不但对于阐明某些未知病变的性质有重要价值, 而且对于肿瘤的诊断、预防和治疗均具有重要的意义.
一些作者提出FNH为多克隆细胞组成, 因而认为FNH不是肿瘤性病变; 而另一些作者却有相反的结论. 此研究的目的是澄清FNH, 尤其是无中央瘢痕FNH病变的克隆组成, 藉此提供与HA鉴别的一种可靠手段, 并且进一步探讨构成其病变的各个结节的克隆性, 以阐明他的本质.
本文运用显微解剖技术以及女性体细胞中PGK位点和AR位点多态性的克隆性分析方法, 探讨肝局灶性结节性增生整个病变和构成其的小结节的克隆性, 阐明了他的本质.
本文探讨整个肝局灶性结节性增生病变及各结节的克隆性, 以阐明其本质, 提供与HA鉴别的一种可靠手段, 并为进一步分析肝脏癌前病变, 阐明肝细胞癌的病理发生机制奠定基础. 这对肝细胞癌的预防、早期诊断及治疗均具有重要的意义.
本文探讨了克隆性分析技术在肝脏局灶性结节性增生诊断中的应用, 该研究是作者在前期的研究基础之上进行, 并具有一定的创新性, 为肝脏局灶性结节性增生的诊断和鉴别诊断提供了新思路和新方法. 从总体上来看, 该文具有一定的创新性和科学意义, 可读性较好, 能较好地反映我国胃肠病学基础研究的水平.
电编: 张敏 编辑:张海宁
| 1. | Nguyen BN, Flejou JF, Terris B, Belghiti J, Degott C. Focal nodular hyperplasia of the liver: a compre-hensive pathologic study of 305 lesions and recogni-tion of new histologic forms. Am J Surg Pathol. 1999;23:1441-1454. [PubMed] |
| 2. | Saul SH, Titelbaum DS, Gansler TS, Varello M, Burke DR, Atkinson BF, Rosato EF. The fibrola-mellar variant of hepatocellular carcinoma. Its association with focal nodular hyperplasia. Cancer. 1987;60:3049-3055. [PubMed] |
| 3. | Saxena R, Humphreys S, Williams R, Portmann B. Nodular hyperplasia surrounding fibrolamellar carcinoma: a zone of arterialized liver parenchyma. Histopathology. 1994;25:275-278. [PubMed] |
| 5. | Paradis V, Laurent A, Flejou JF, Vidaud M, Bedossa P. Evidence for the polyclonal nature of focal nodular hyperplasia of the liver by the study of X-chromosome inactivation. Hepatology. 1997;26:891-895. [PubMed] |
| 6. | Zhang SH, Cong WM, Wu MC. Focal nodular hy-perplasia with concomitant hepatocellular carci-noma: a case report and clonal analysis. J Clin Pathol. 2004;57:556-559. [PubMed] |
| 7. | Anthony PP. Tumors and tumor-like lesions of the liver and biliary tract: etiology, epidemiology and pathology. In: Macsween RNM, Burt AD, Portmann BC, Ishak KG, Scheuer PJ, Anthony PP (eds). Pathology of the liver. 2002;711-775. |
| 8. | Ishak KG, Anthony PR, Sobin LH. Desinition and explanatory notes: liver. In: Ishak KG, Anthony PR, Sobin LH (eds). Histological typing of tumors of the liver. International Histological Classification of Tumors. 1994;9-36. |
| 9. | Su Q, Benner A, Hofmann WJ, Otto G, Pichlmayr R, Bannasch P. Human hepatic preneoplasia: phenotypes and proliferation kinetics of foci and nodules of altered hepatocytes and their relation-ship to liver cell dysplasia. Virchows Arch. 1997;431:391-406. [PubMed] |
| 10. | Su Q, Bannasch P. Relevance of hepatic preneopla-sia for human hepatocarcinogenesis. Toxicol Pathol. 2003;31:126-133. [PubMed] |
| 11. | Edmondson Ha, Steiner Pe. Primary carcino-ma of the liver: a study of 100 cases among 48,900 necropsies. Cancer. 1954;7:462-503. [PubMed] |
| 12. | Lyon MF. X-chromosome inactivation and develop-mental patterns in mammals. Biol Rev Camb Philos Soc. 1972;47:1-35. [PubMed] |
| 13. | Gilliland DG, Blanchard KL, Levy J, Perrin S, Bunn HF. Clonality in myeloproliferative disorders: analysis by means of the polymerase chain reaction. Proc Natl Acad Sci USA. 1991;88:6848-6852. [PubMed] |
| 14. | Allen RC, Zoghbi HY, Moseley AB, Rosenblatt HM, Belmont JW. Methylation of HpaII and HhaI sites near the polymorphic CAG repeat in the human androgen-receptor gene correlates with X chromo-some inactivation. Am J Hum Genet. 1992;51:1229-1239. [PubMed] |
| 16. | Wang SF, Liu Q, Zhang W, Liu J, Su Q. Clonality of uterine leiomyomas, an assay using X chromosome polymorphism at the phosphoglycerate kinase locus. Disi Junyi Daxue Xuebao. 2001;22:1576-1582. |
| 17. | Watanabe S, Okita K, Harada T, Kodama T, Numa Y, Takemoto T, Takahashi T. Morphologic studies of the liver cell dysplasia. Cancer. 1983;51:2197-2205. [PubMed] |
| 18. | 初 霞, 苏 勤, 巩 丽, 张 伟, 王 淑芳, 朱 少君, 李 爱宁, 冯 英明. 慢性乙型肝炎和肝硬化组织中变异肝细胞结节的克隆性. 世界华人消化杂志. 2005;13:945-952. [DOI] |
| 19. | Kerlin P, Davis GL, McGill DB, Weiland LH, Adson MA, Sheedy PF 2nd. Hepatic adenoma and focal nodular hyperplasia: clinical, pathologic, and radiologic features. Gastroenterology. 1983;84:994-1002. [PubMed] |
| 20. | Vilgrain V. Focal nodular hyperplasia. Eur J Radiol. 2006;. [PubMed] |
| 21. | Cherqui D, Rahmouni A, Charlotte F, Boulahdour H, Metreau JM, Meignan M, Fagniez PL, Zafrani ES, Mathieu D, Dhumeaux D. Management of focal nodular hyperplasia and hepatocellular adenoma in young women: a series of 41 patients with clinical, radiological, and pathological correlations. Hepatology. 1995;22:1674-1681. [PubMed] |
| 22. | Wanless IR, Mawdsley C, Adams R. On the patho-genesis of focal nodular hyperplasia of the liver. Hepatology. 1985;5:1194-1200. [PubMed] |
| 23. | Ji Y, Zhu X, Tan Y, Zeng H, Ye Q, Tang Z. A clini-copathological study of hepatic focal nodular hype-rplasia. Zhonghua Binglixue Zazhi. 2000;29:334-338. [PubMed] |
| 24. | Imkie M, Myers SA, Li Y, Fan F, Bennett TL, Forster J, Tawfik O. Fibrolamellar hepatocellular carcinoma arising in a background of focal nodular hyperplasia: a report of 2 cases. J Reprod Med. 2005;50:633-637. [PubMed] |
| 25. | Terada T, Kitani S, Ueda K, Nakanuma Y, Kitagawa K, Masuda S. Adenomatous hyperplasia of the liver resembling focal nodular hyperplasia in patients with chronic liver disease. Virchows Arch A Pathol Anat Histopathol. 1993;422:247-252. [PubMed] |
| 26. | Matsushita M, Hajiro K, Suzaki T, Takakuwa H, Sawami H, Kusumi F, Konishi Y, Maruo M, Ohana M, Okano A. Focal nodular hyperplasia of the liver without central scar. Dig Dis Sci. 1995;40:2407-2410. [PubMed] |
| 27. | Gaffey MJ, Iezzoni JC, Weiss LM. Clonal analysis of focal nodular hyperplasia of the liver. Am J Pathol. 1996;148:1089-1096. [PubMed] |
| 28. | Chen TC, Chou TB, Ng KF, Hsieh LL, Chou YH. Hepatocellular carcinoma associated with focal nodular hyperplasia. Report of a case with clonal analysis. Virchows Arch. 2001;438:408-411. [PubMed] |
| 29. | Paradis V, Benzekri A, Dargere D, Bieche I, Laurendeau I, Vilgrain V, Belghiti J, Vidaud M, Degott C, Bedossa P. Telangiectatic focal nodular hyperplasia: a variant of hepatocellular adenoma. Gastroenterology. 2004;126:1323-1329. [PubMed] |
| 30. | Bannasch P. Preneoplastic lesions as end points in carcinogenicity testing. II. Preneoplasia in various non-hepatic tissues. Carcinogenesis. 1986;7:849-852. [PubMed] |