修回日期: 2005-12-05
接受日期: 2005-12-24
在线出版日期: 2006-02-08
目的: 检测幽门螺杆菌(Helicobacter pylori, H. pylori)阳性消化性溃疡(peptic ulcer, PU)患者胃窦黏膜组织学改变和炎症相关基因核因子κB(Nuclear-κB, NF-κB)、人b-防御素-2(human β-denfensin-2, HBD-2)蛋白表达, 探讨胃窦黏膜炎症及NF-κB、HBD-2在H. pylori相关性PU中的作用及其意义.
方法: 57例PU患者, 其中H. pylori感染者40例, 非H. pylori感染者17例, 另设正常对照组8例; 观察各组患者胃窦组织学改变, 免疫组化法检测胃窦黏膜NF-κBp65、HBD-2的表达. 观察NF-κBp65、HBD-2的细胞定位情况, 用One-Way ANOVA方法比较H. pylori感染者与非H. pylori感染者及正常组胃黏膜NF-κBp65、HBD-2表达量, 并对PU不同分期患者胃黏膜NF-κBp65, HBD-2的表达量进行比较; 非参数统计方法分析H. pylori感染与PU患者胃窦炎症程度的关系、NF-κBp65、HBD-2表达与胃窦炎症程度的关系及H. pylori阳性PU NF-κBp65与HBD-2表达的相关性.
结果: PU患者胃窦的炎症程度与H. pylori的感染程度呈正相关(活动性r = 0.374, P<0.01; 慢性r = 0.333, P<0.05). 在H. pylori阳性PU患者NF-kBp65主要表达于胃黏膜上皮细胞和固有层间质细胞胞核, HBD-2主要表达于胃黏膜表层上皮细胞胞质, 二者的表达均较H. pylori阴性组显著增强(6.4±3.28 vs 3.78±2.16, P<0.01; 12.96±5.03 vs 4.69±2.05, P<0.01), 且均与胃窦黏膜炎症程度具有显著相关性(活动性r = 0.744, 0.524, P<0.01, 慢性r = 0.650, 0.606, P<0.01); H. pylori阳性PU胃黏膜NF-kBp65表达与HBD-2表达呈正相关关系(r = 0.438, P<0.01). 愈合期和疤痕期PU患者NF-kBp65(4.28±2.11, 3.65±2.27)、HBD-2(8.15±4.28, 6.24±3.71)的表达较活动期者(7.14±3.24, 13.56±5.43)显著降低(P<0.05, P<0.01).
结论: H. pylori感染导致胃黏膜NF-kBp65, HBD-2表达增加, 胃黏膜炎症程度增强. NF-kB可能通过诱导HBD-2的表达, 参与胃窦黏膜炎症反应, 从而影响了H. pylori相关性PU的病理生理过程.
引文著录: 凌江红, 李家邦, 聂海明, 蒋荣鑫, 申定珠, 韦宗平. 幽门螺杆菌阳性消化性溃疡患者胃黏膜核因子κB、β-防御素-2表达及其与胃窦炎症的关系. 世界华人消化杂志 2006; 14(4): 376-381
Revised: December 5, 2005
Accepted: December 24, 2005
Published online: February 8, 2006
AIM: To investigate the roles of nuclear factor kappa B (NF-κB), human β-defensin-2 (HBD-2) and antral gastritis in H. pylori-positive peptic ulcer (PU).
METHODS: Patients with H. pylori-positive (n = 40) or H. pylori-negative (n = 17) PU were included in this study. Eight individual were selected as normal controls. Antral histopathology was observed in the patients and controls. The expression of NF-κBp65 and β-denfensin-2 were measured by immunohistochemistry, and then compared between H. pylori-positive and negative patients and normal group as well as between patients with different stages of PU by One-Way ANOVA. Nonparametric statistics was used to analyze the correlations of H. pylori infection, NF-κBp65, HBD-2 expression with the degree of antral gastritis. Meanwhile, the relationship between expression of NF-κBp65 and HBD-2 was also analyzed in H. pylori-positive PU.
RESULTS: The histological severities of both active and chronic inflammation were correlated with H. pylori density (active: r = 0.374, P < 0.01; chronic: r = 0.333, P < 0.05). NF-κBp65 was expressed mainly in the nucleus of gastric epithelial and mesenchymal cells in lamina propria while HBD-2 was expressed mainly in the cytoplasm of the surface cells of gastric mucosal epithelium. The expression of NF-κBp65 and HBD-2 were significantly higher in H. pylori-positive patients than those in H. pylori-negative ones (6.4 ± 3.28 vs 3.78 ± 2.16, P < 0.01; 12.96 ± 5.03 vs 4.69 ± 2.05, P < 0.01), and both expression of NF-κBp65 and HBD-2 were correlated with histological severity of active and chronic inflammation (active: r = 0.744, 0.524, P < 0.01; chronic: r = 0.650, 0.606, P < 0.01). There was a positive correlation between the expression of NF-κBp65 and HBD-2 (r = 0.438, P < 0.01). The expression of NF-κBp65 (4.28 ± 2.11, 3.65 ± 2.27) and HBD-2 (8.15 ± 4.28, 6.24 ± 3.71) in PU patients at the stage of healing and scaring were lower significantly than those (7.14 ± 3.24, 13.56 ± 5.43) of PU patients at active stage (P < 0.05 or P < 0.01).
CONCLUSION: H. pylori infection leads to the over-expression of NF-κB and HBD-2 and enhancement of active and chronic inflammation. NF-κB activation may contribute to the induction of HBD-2 expression, and play an important role in the pathogenesis of H. pylori-positive PU.
- Citation: Ling JH, Li JB, Nie HM, Jiang RX, Shen DZ, Wei ZP. Expression of nuclear factor-kappa B and β-defensin-2 in patients with Helicobacter pylori-positive peptic ulcer and their relations with antral gastritis. Shijie Huaren Xiaohua Zazhi 2006; 14(4): 376-381
- URL: https://www.wjgnet.com/1009-3079/full/v14/i4/376.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i4.376
幽门螺杆菌(Helicobacter pylori, H. pylori)已被证实为消化性溃疡(PU)的主要病因, 炎症反应是其中一个重要的致病机制. 核因子κB(NF-κB)是一种重要的多功能核转录因子, 参与许多基因特别是炎症反应相关基因的表达及调控. 人β-防御素-2(human β-denfensin-2, HBD-2)是第一种在炎症刺激下合成的人类抗菌多肽. 我们用免疫组化法检测H. pylori阳性PU患者胃窦黏膜NF-κB、HBD-2的表达并探讨其与胃窦组织学的关系, 为进一步阐明H. pylori相关性PU的发病机制提供理论依据.
选择因上腹不适到广西医科大学胃镜室行胃镜检查的患者, 经尿素酶检查和胃黏膜活检两者确诊为H. pylori阳性的胃或十二指肠溃疡40例和H. pylori阴性的胃或十二指肠溃疡17例, 其中男34例, 女23例, 年龄21-59(41.70±11.48)岁, 有消化性出血等并发症和其他系统严重合并症, 胃镜前使用过任何制酸剂和针对H. pylori的抗菌素者不列入研究对象. 另取8例无黏膜病变且H. pylori阴性患者的胃黏膜活检标本作正常对照组. NF-κB/p65(Rel A)Ab-1兔多克隆抗体为美国Lab Vision公司产品. β-denfensin-2兔多抗、链酶亲和素生物素复合体(SABC)试剂盒为武汉博士德生物工程公司产品. 即用型快速免疫组化Max Vision试剂盒(主要成分辣根过氧化物酶标记的多聚羊抗兔IgG)、R-二联氨苯胺(DAB)显色试剂盒购自福建迈新公司.
胃镜下溃疡分期采用日本学者畸田隆夫倡导的分期法, 分为活动期、愈合期和瘢痕期. 在胃小弯胃窦距幽门5 cm处取活检标本6块, 1块做H. pylori尿素酶试验, 5块40 g/L多聚甲醛固定, 常规石蜡包埋, 4 mm厚连续切片以备HE染色、Warthin-Starry银染色及免疫组织化学检测. H. pylori诊断采用快速尿素酶试验和Warthin-Starry银染色, 2项结果均阳性诊断为H. pylori阳性, 2项结果均阴性诊断为H. pylori阴性. 根据中华医学会消化病学分会2000年全国慢性胃炎研讨会共识意见中组织学分级标准将H. pylori、活动性、慢性炎症分成无、轻度、中度、重度四个等级.
1.2.1 NF-κBp65、HBD-2蛋白的免疫组化检测: 石蜡切片置60℃的烤箱5-6 h后, 主要步骤如下: 切片常规脱蜡至水, 30 mL/L过氧化氢-甲醇室温下孵育10 min, 以阻断内源性过氧化物酶的活性, 高压加热方法修复抗原, 滴加NF-κB p65、HBD-2一抗(工作浓度分别为1︰100、1︰150), 4℃过夜, 滴加即用型Max Vision试剂, 室温15 min, 滴加SABC, 室温30 min, DAB显色, 镜下控制反应时间, 充分水洗, 苏木素轻度复染, 脱水、透明、封片. 以PBS代替一抗作为阴性对照.
1.2.2 免疫组织化学结果判断: 由于NF-κBp65在激活情况下是位于核内的, 故以胞核出现棕褐色颗粒为阳性表达. HBD-2以细胞质出现棕黄色染色为阳性表达. 以病理图像分析仪进行图像分析, 测量阳性反应的细胞密度(即阳性反应细胞面积/测量框面积), 所测数据以mean±SD表示.
统计学处理 采用SPSS 13.0统计软件对数据进行处理, 两组间比较采用t检验; 多组间比较用One-Way ANOVA进行分析, 方差齐采用LSD方法, 方差不齐采用Tamhane'sT2. 相关分析采用非参数统计方法, 计算Spearman相关系数.
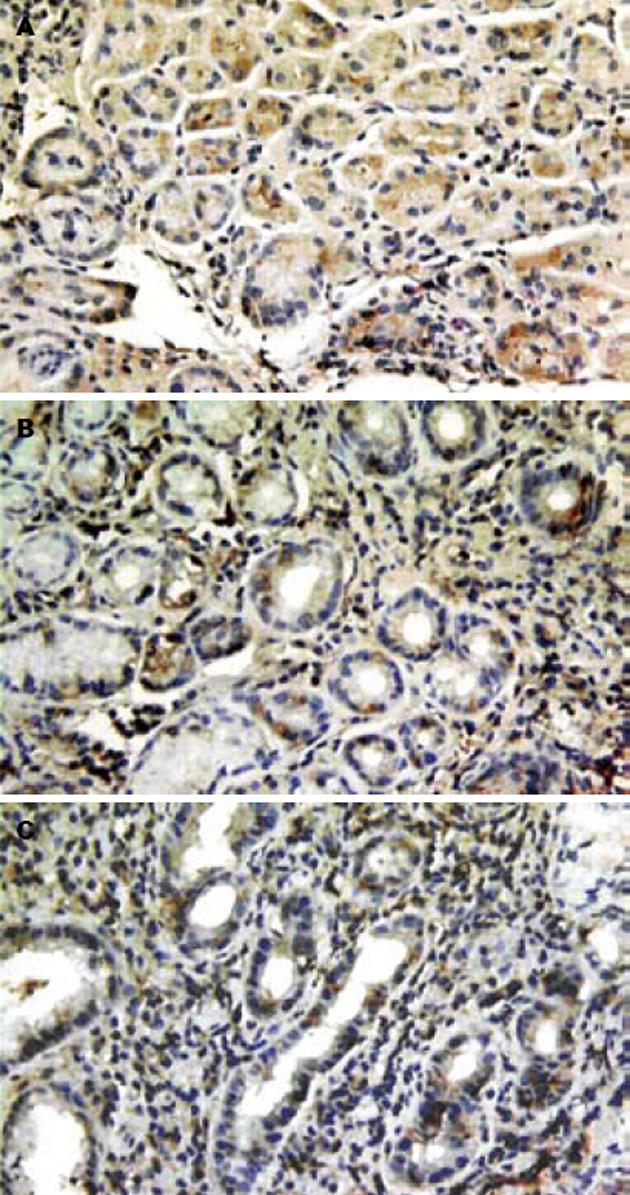
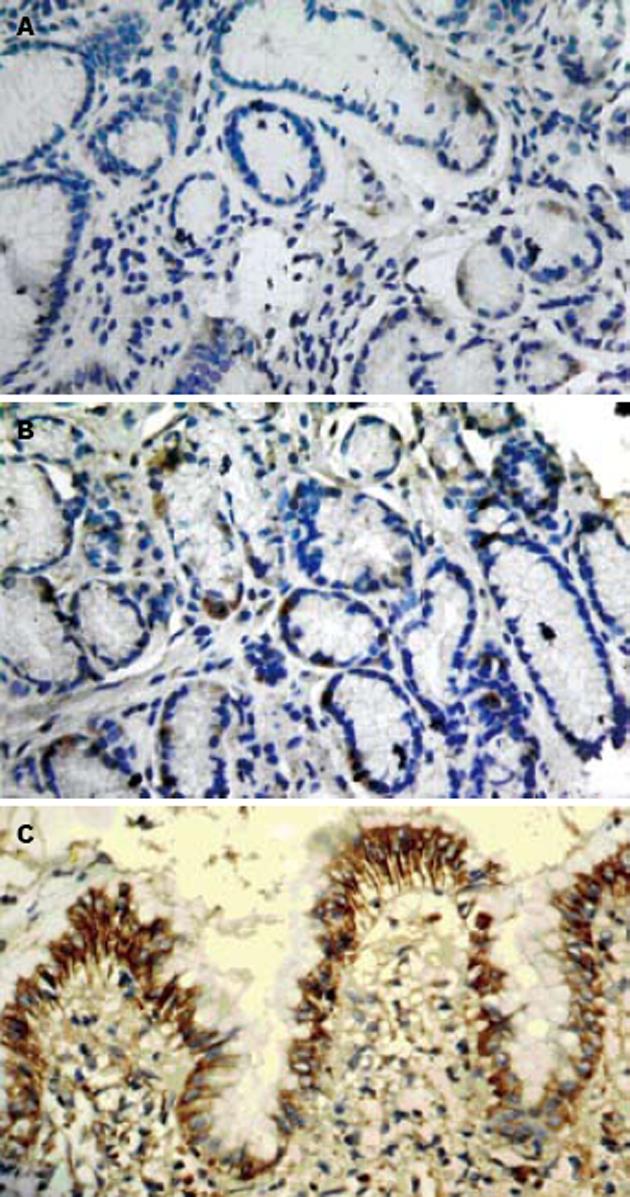
NF-κBp65主要表达于胃黏膜腺上皮细胞和固有层炎性细胞. 正常胃黏膜中NF-κBp65染色主要在胃黏膜腺上皮细胞胞质, H. pylori阴性胃黏膜NF-κB p65胞核胞质表达并存, 而H. pylori感染者胃黏膜中则以胞核着色为主, 尤以固有层间质细胞为著(图1). HBD-2蛋白在正常胃黏膜无表达, 在H. pylori阴性胃黏膜上皮细胞胞质中有少量表达, 而H. pylori感染胃黏膜中HBD-2蛋白表达明显增多, 主要位于胃黏膜表层上皮细胞胞质(图2).
PU患者NF-κBp65、HBD-2的表达较正常组相比均显著增高(P<0.01), 其中H. pylori阳性患者与H. pylori阴性患者及正常组比较, NF-κBp65、HBD-2的表达均显著增高(P<0.01)、H. pylori阴性患者NF-κBp65、HBD-2的表达亦较正常组显著增高(P<0.01). 在不同H. pylori密度之间比较, NF-κBp65、HBD-2表达随H. pylori密度增高, 但差别无显著性(表1).
活动期较愈合期和疤痕期相比, NF-κBp65、HBD-2的表达显著增加(P<0.01) (表2).
Spearman等级相关分析显示PU患者胃窦活动性和慢性炎症程度均与H. pylori的感染程度呈正相关(分别P<0.01, P<0.05, 表3).
| H. pylori | n | 活动性 | 慢性 | ||||||
| 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | ||
| 无 | 17 | 7 | 5 | 3 | 2 | 0 | 8 | 9 | 0 |
| 轻度 | 13 | 5 | 3 | 3 | 2 | 0 | 4 | 7 | 2 |
| 中度 | 19 | 2 | 3 | 10 | 4 | 0 | 4 | 11 | 4 |
| 重度 | 8 | 1 | 1 | 3 | 3 | 0 | 1 | 5 | 2 |
Spearman等级相关分析显示, NF-κBp65、HBD-2的表达均与胃窦慢性炎症程度相关(r = 0.650, P = 0.000; r = 0.606, P = 0.000); 与活动性炎症程度相关(r = 0.744, P = 0.000; r = 0.524, P = 0.000).
经Spearman等级相关分析发现, H. pylori阳性PU患者胃窦黏膜NF-κBp65表达与HBD-2表达呈正相关(r = 0.438, P = 0.000).
NF-κB是一种作用广泛的转录因子, 在未受刺激的细胞中, 以非活性状态存在于胞质. 我们发现较正常组和H. pylori阴性PU相比, H. pylori阳性PU胃黏膜NF-κB以胞核着色为主, 其表达量明显增多, 提示H. pylori感染诱导和激活胃黏膜NF-κB, 使其移位入胞核, 发挥转录调节功能. 文献[1-6]支持此观点. 我们研究还发现NF-κB核表达量有随H. pylori密度增高的趋势, 但重度与中度比较差别并无统计学意义, 可能与样本例数不足有关, 亦可能与H. pylori毒力有关, 有报道含cag致病岛的H. pylori更具激活NF-κB的能力[7-9].
在感染、炎症反应中, NF-κB激活可进一步调控前炎症介质[如肿瘤坏死因子-a(TNF-a), 白介素-1、6(IL-1、IL-6)]、黏附分子、趋化因子(如单核细胞趋化蛋白-1和IL-8)和一些炎性相关酶类使之过度或持续表达, 致大量的炎性细胞积聚浸润于炎症部位, 而NF-κB调节的产物, 如 TNF-a和IL-1b又能激活NF-κB[10-12]. 这意味着存在一个放大且延续炎症反应的复杂的调节环路, NF-κB是其中一个中心环节. 本研究显示, H. pylori感染与PU患者胃窦活动性和慢性炎症程度相关; NF-κB的表达与PU患者胃窦活动性和慢性炎症程度均呈正相关, PU愈合后NF-κB表达明显减低, 可能与胃黏膜炎症随溃疡愈合减轻有关, 提示H. pylori感染激活NF-κB后诱导的胃窦黏膜的炎症反应与PU的发生密切相关.
HBD-2是一种在炎症刺激下合成的人类抗菌多肽. 有研究发现细胞毒H. pylori和IL-1b能显著上调AGS、MKN7细胞系HBD-2表达, 且其作用呈时间、剂量依赖性[13,14]. 正常胃窦活检组织不能检出HBD-2表达, 但H. pylori阳性胃炎、胃十二指肠溃疡患者HBD-2显著增加[15-20]. 我们的研究表明, H. pylori感染使HBD-2的表达明显增强并与胃黏膜炎症的活动性和慢性炎症程度显著相关. HBD-2基因启动子区域存在数个NF-κB的结合位点, 细胞中NF-κB的激活可诱导HBD-2的基因转录增强[21-24]. 我们的研究显示, H. pylori阳性PU NF-κBp65与HBD-2表达呈正相关, 推测NF-κB可能通过HBD-2基因的转录参与H. pylori阳性PU的发生, HBD-2在H. pylori相关性PU中的表达与H. pylori感染后以NF-κB为中心的炎症反应诱导有关. 体外实验发现HBD-2在浓度为10-7 mol/L(0.3 mg/L)时可抑制50% H. pylori生长, 而10-5 mol/L(30 mg/L)则可完全抑制H. pylori生长[15]. 提示HBD-2的诱导表达可能对H. pylori相关性PU具有保护作用, HBD-2表达缺失可能会加重H. pylori相关性胃窦黏膜炎症反应, 导致组织损伤. 但同时也应认识到HBD-2在发挥清除H. pylori的有利作用的同时, 可能也引起了胃和十二指肠黏膜的进一步损伤[19,25], 因而其意义有待进一步研究.
H. pylori感染引起胃黏膜局部的炎症反应是导致消化性溃疡发生、难以愈合和容易复发的主要原因. NF-κB是一种重要的多功能核转录因子, 参与许多基因特别是炎症反应相关基因的表达及调控, HBD-2是第一种在炎症刺激下合成的人类抗菌多肽. HBD-2基因启动子区域存在数个NF-κB的结合位点, 细胞中NF-κB的激活可诱导HBD-2基因转录增强, NF-κB对HBD-2的调控表达在H. pylori相关性消化性溃疡的胃黏膜炎症反应中的作用和意义尚不清楚, 国内外未见相关报道.
1 Isomoto H, Mizuta Y, Miyazaki M, Takeshima F, Omagari K, Murase K, Nishiyama T, Inoue K, Murata I, Kohno S. Implication ofNF-kappaB inHelicobacterpyloriassociatedgastritis. AmJ Gastroenterol 2000; 95:2768-2776
2 Ohara T, Morishita T, Suzuki H, Masaoka T, Nagata H, Hibi T. Pathophysiologicalrole ofhuman betadefensins 2 in gastricmucosa. Int JMol Med 2004; 14: 1023-1027
HBD-2作为一种炎症诱导表达的抗菌肽, 其抗微生物活性倍受重视, 但本文发现H. pylori感染后可激活NF-κB, 后者诱导HBD-2表达参与炎症反应并引起胃和十二指肠黏膜的进一步损伤, 即HBD-2可能还具有"前炎症因子"样作用.
抗菌肽: 天然免疫的重要介质, 是机体在进化过程中为适应环境、求得生存而最早产生的免疫活性分子, 是炎症反应起保护作用的重要分子基础. 他是由单基因编码的、植物和动物(包括人类)细胞产生的小分子肽类物质, 具有广谱抗微生物活性.防御素(defensins): 在哺乳动物中性粒细胞和上皮细胞中发现的一组富含半胱氨酸阳离子的小分子抗菌多肽, 分子量为3.5-4 ku, 含29-34个氨基酸, 具有广泛的抗微生物活性, 可激活参与天然免疫和获得性免疫的宿主细胞, 诱导参与炎症预激的细胞因子. 防御素是一个主要抗菌肽家族, 根据一级结构和二硫键形成次序的不同可分为α和b两个亚家族.
研究NF-kB和HBD-2可以增加对H. pylori致病因素的了解, 对研究H. pylori的致病机制有较大意义. 本文研究立题有依据, 选择病例可靠, 幽门螺杆菌诊断规范, 试剂和试验方法标准, 统计科学, 结果可信,免疫组化胃黏膜组织图谱清晰优质, 讨论切题, 条理性较强. 不足之处是所研究的NF-kBp65与HBD-2主要是与胃窦黏膜的慢性炎症的关系, 而与消化性溃疡关系不很确切.
电编: 张敏 编辑:张海宁
| 1. | Isomoto H, Miyazaki M, Mizuta Y, Takeshima F, Murase K, Inoue K, Yamasaki K, Murata I, Koji T, Kohno S. Expression of nuclear factor-kappaB in Helicobacter pylori-infected gastric mucosa detected with southwestern histochemistry. Scand J Gastroenterol. 2000;35:247-254. [PubMed] [DOI] |
| 2. | Chu SH, Kim H, Seo JY, Lim JW, Mukaida N, Kim KH. Role of NF-kappaB and AP-1 on Helicobater pylori-induced IL-8 expression in AGS cells. Dig Dis Sci. 2003;48:257-265. [PubMed] [DOI] |
| 3. | Kim JM, Kim JS, Jung HC, Oh YK, Chung HY, Lee CH, Song IS. Helicobacter pylori infection activates NF-kappaB signaling pathway to induce iNOS and protect human gastric epithelial cells from apoptosis. Am J Physiol Gastrointest Liver Physiol. 2003;285:G1171-G1180. [PubMed] [DOI] |
| 4. | Isomoto H, Mizuta Y, Miyazaki M, Takeshima F, Omagari K, Murase K, Nishiyama T, Inoue K, Murata I, Kohno S. Implication of NF-kappaB in Helicobacter pylori-associated gastritis. Am J Gastroenterol. 2000;95:2768-2776. [PubMed] [DOI] |
| 5. | Seo JH, Lim JW, Kim H, Kim KH. Helicobacter pylori in a Korean isolate activates mitogen-activated protein kinases, AP-1, and NF-kappaB and induces chemokine expression in gastric epithelial AGS cells. Lab Invest. 2004;84:49-62. [PubMed] [DOI] |
| 6. | Nozaki K, Tanaka H, Ikehara Y, Cao X, Nakanishi H, Azuma T, Yamazaki S, Yamaoka Y, Shimizu N, Mafune K. Helicobacter pylori-dependent NF-kappa B activation in newly established Mongolian gerbil gastric cancer cell lines. Cancer Sci. 2005;96:170-175. [PubMed] [DOI] |
| 7. | Chang YJ, Wu MS, Lin JT, Sheu BS, Muta T, Inoue H, Chen CC. Induction of cyclooxygenase-2 over-expression in human gastric epithelial cells by Heli-cobacter pylori involves TLR2/TLR9 and c-Src-dependent nuclear factor-kappaB activation. Mol Pharmacol. 2004;66:1465-1477. [DOI] |
| 8. | Yang GF, Deng CS, Xiong YY, Gong LL, Wang BC, Luo J. Expression of nuclear factor-kappa B and target genes in gastric precancerous lesions and adenocarcinoma: association with Helicobactor pylori cagA (+) infection. World J Gastroenterol. 2004;10:491-496. [PubMed] [DOI] |
| 9. | Brandt S, Kwok T, Hartig R, Konig W, Backert S. NF-kappaB activation and potentiation of proin-flammatory responses by the Helicobacter pylori CagA protein. Proc Natl Acad Sci USA. 2005;102:9300-9305. [PubMed] [DOI] |
| 10. | Tergaonkar V, Bottero V, Ikawa M, Li Q, Verma IM. IkappaB kinase-independent IkappaBalpha degradation pathway: functional NF-kappaB activity and implications for cancer therapy. Mol Cell Biol. 2003;23:8070-8083. [PubMed] [DOI] |
| 11. | Jobin C, Sartor RB. The I kappa B/NF-kappa B system: a key determinant of mucosalinflammation and protection. Am J Physiol Cell Physiol. 2000;278:C451-C462. [PubMed] |
| 12. | Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest. 2001;107:7-11. [DOI] |
| 13. | Bajaj-Elliott M, Fedeli P, Smith GV, Domizio P, Maher L, Ali RS, Quinn AG, Farthing MJ. Modu-lation of host antimicrobial peptide (beta-defensins 1 and 2) expression during gastritis. Gut. 2002;51:356-361. [PubMed] [DOI] |
| 14. | O'Neil DA, Cole SP, Martin-Porter E, Housley MP, Liu L, Ganz T, Kagnoff MF. Regulation of human beta-defensins by gastric epithelial cells in response to infection with Helicobacter pylori or stimulation with interleukin-1. Infect Immun. 2000;68:5412-5415. [PubMed] [DOI] |
| 15. | Hamanaka Y, Nakashima M, Wada A, Ito M, Kurazono H, Hojo H, Nakahara Y, Kohno S, Hiray-ama T, Sekine I. Expression of human beta-defensin 2 (hBD-2) in Helicobacter pylori induced gastritis: antibacterial effect of hBD-2 against Helicobacter pylori. Gut. 2001;49:481-487. [PubMed] [DOI] |
| 16. | Wehkamp J, Schmidt K, Herrlinger KR, Baxmann S, Behling S, Wohlschlager C, Feller AC, Stange EF, Fellermann K. Defensin pattern in chronic gastritis: HBD-2 is differentially expressed with respect to Helicobacter pylori status. J Clin Pathol. 2003;56:352-357. [PubMed] [DOI] |
| 17. | Uehara N, Yagihashi A, Kondoh K, Tsuji N, Fujita T, Hamada H, Watanabe N. Human beta-defensin-2 induction in Helicobacter pylori-infected gastric mucosal tissues: antimicrobial effect of overexpression. J Med Microbiol. 2003;52:41-45. [PubMed] [DOI] |
| 18. | Isomoto H, Mukae H, Ishimoto H, Nishi Y, Wen CY, Wada A, Ohnita K, Hirayama T, Nakazato M, Kohno S. High concentrations of human beta-defensin 2 in gastric juice of patients with Helico-bacter pylori infection. World J Gastroenterol. 2005;11:4782-4787. [PubMed] [DOI] |
| 19. | Ohara T, Morishita T, Suzuki H, Masaoka T, Nishizawa T, Hibi T. Investigation of the possibi-lity of human-beta defensin 2 (hBD2) as a mole-cular marker of gastric mucosal inflammation. Hepatogastroenterology. 2005;52:1320-1324. [PubMed] |
| 20. | Taha AS, Faccenda E, Angerson WJ, Balsitis M, Kelly RW. Gastric epithelial anti-microbial peptides-histological correlation and influence of anatomical site and peptic ulcer disease. Dig Liver Dis. 2005;37:51-56. [PubMed] [DOI] |
| 21. | Wada A, Ogushi K, Kimura T, Hojo H, Mori N, Suzuki S, Kumatori A, Se M, Nakahara Y, Naka-mura M. Helicobacter pylori-mediated transcriptional regulation of the human beta-defensin 2 gene requires NF-kappaB. Cell Microbiol. 2001;3:115-123. [PubMed] [DOI] |
| 22. | Wehkamp K, Schwichtenberg L, Schroder JM, Harder J. Pseudomonas aeruginosa- and IL-1beta-mediated induction of human beta-defensin-2 in keratinocytes is controlled by NF-kappaB and AP-1. J Invest Dermatol. 2006;126:121-127. [PubMed] [DOI] |
| 23. | Wehkamp J, Harder J, Wehkamp K, Wehkamp-von Meissner B, Schlee M, Enders C, Sonnenborn U, Nuding S, Bengmark S, Fellermann K. NF-kappaB- and AP-1-mediated induction of human beta defensin-2 in intestinal epithelial cells by Escherichia coli Nissle 1917: a novel effect of a probiotic bacterium. Infect Immun. 2004;72:5750-5758. [PubMed] [DOI] |
| 24. | Tsutsumi-Ishii Y, Nagaoka I. NF-kappa B-mediated transcriptional regulation of human beta-defensin-2 gene following lipopolysaccharide stimulation. J Leukoc Biol. 2002;71:154-162. [PubMed] |
| 25. | Ohara T, Morishita T, Suzuki H, Masaoka T, Nagata H, Hibi T. Pathophysiological role of human beta-defensins 2 in gastric mucosa. Int J Mol Med. 2004;14:1023-1027. [PubMed] |