修回日期: 2006-10-13
接受日期: 2006-10-18
在线出版日期: 2006-12-28
目的: 探讨PPARg激动剂吡格列酮对重症急性胰腺炎大鼠胰腺组织ICAM-1表达的影响并探讨其意义.
方法: D大鼠54只随机分成SAP组(n = 18)、假手术组(n = 18)和吡格列酮干预组(n = 18). 采用改良的Aho法制作SAP模型, 通过免疫组织化学方法动态观察3组大鼠胰腺组织中ICAM-1的表达, 同时观察胰腺组织病理变化.
结果: 病理观察显示, SAP组大鼠胰腺组织有明显坏死、出血及炎症细胞聚集, 而吡格列酮干预组炎症反应明显减轻. 从造模后3 h起, 胰腺组织中ICAM-1即持续上调, 呈时间依赖性, SAP组3, 6, 12 h表达分别为0.73±0.27, 0.93±0.41, 1.36±0.54, 12 h与3 h比较差异显著(P<0.05); 干预组ICAM-1在3, 6, 12 h的表达分别为0.57±0.21, 0.86±0.40, 0.80±0.53, 12 h时显著低于SAP组(P<0.05); 假手术组呈弱阳性表达, 并随时间延长而消失.
结论: CAM-1参与了大鼠SAP的炎症反应, 吡格列酮对ICAM-1的表达有抑制作用.
引文著录: 徐萍, 李清华, 陈令全, 陈江, 谢勇, 吕农华, 侯晓华. PPARγ激动剂干预对大鼠重症急性胰腺炎的影响. 世界华人消化杂志 2006; 14(36): 3457-3460
Revised: October 13, 2006
Accepted: October 18, 2006
Published online: December 28, 2006
AIM: To investigate the changes in intercellular adhesion molecule-1 (ICAM-1) expression after pioglitazone treatment in rats with severe acute pancreatitis (SAP).
METHODS: A total of 54 Sprague Dawley rats were randomly and averagely divided into 3 groups, named group A, C and I. Group A and C served as SAP model and sham operation group, respectively. The rats in group I were treated with pioglitazone, an agonist of peroxisome proliferator activated receptor. The modified Aho's method was used to reproduce SAP models, and the expression of ICAM-1 in pancreatic tissues was determined by immunohistochemical staining.
RESULTS: The histological examination revealed obvious necrosis, hemorrhage, as wel1 as inflammatory cell infiltration in pancreatic tissues after SAP model was induced, but the above pathological changes were alleviated in group I. After modeling, the expression of ICAM-1 was persistently increased from the 3rd hour. In group A, the expression of ICAM-1 was 0.73 ± 0.27, 0.93 ± 0.41, and 1.36 ± 0.54 at the 3rd, 6th, and 12th hour, respectively, and there was significant difference between those at the 12th and 3rd hour (P < 0.05). In group I, ICAM-1 expression was 0.57 ± 0.21, 0.86 ± 0.40, and 0.80 ± 0.53 at the 3rd, 6th, and 12th hour, respectively, and there was marked difference at the 12th hour between group A and I (P < 0.05). ICAM-1 expression was weakly positive in group C, and faded away as the time increased.
CONCLUSION: ICAM-1 is involved in the inflammatory response of SAP, while pioglitazone can inhibit the expression of ICAM-1 in SAP.
- Citation: Xu P, Li QH, Chen LQ, Chen J, Xie Y, Lv NH, Hou XH. Effect of pioglitazone on expression of intercellular adhesion molecule-1 in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2006; 14(36): 3457-3460
- URL: https://www.wjgnet.com/1009-3079/full/v14/i36/3457.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i36.3457
急性胰腺炎(AP)是临床常见的急腹症, 近年来, 发病率有所增高[1]. 大量的临床及实验研究表明, 重症急性胰腺炎(SAP)发病后病情加重的核心问题主要涉及单核巨噬细胞、中性粒细胞(PMN)、血管内皮细胞(VEC)等的参与介入, 其释放的多种细胞因子和其他炎性介质在SAP的病情演变过程中起着至关重要的作用. 近年来越来越多的研究发现, SAP时激活的PMN参与胰腺及胰外组织的损伤, 是SAP时胰腺局部及远隔器官功能损伤的重要病理因素. 我们采用免疫组化方法, 观察SAP时细胞间黏附分子-1(ICAM-1)在胰腺的表达情况, 同时观察吡格列酮干预前后ICAM-1的表达情况的差异, 探讨ICAM-1与SAP时组织损伤的关系.
健康♂SD大鼠(南昌大学医学院动科部提供)54只, 体质量160-200 g. 随机分成SAP组(A组, n = 18)、假手术组(C组, n = 18)和干预组(I组, n = 18). SAP模型制作参照Aho法并加以改良: 大鼠术前禁食不禁水12 h; 术前2 h ip无菌100 g/L DMSO溶液(10 mL/kg); 50 g/L盐酸氯胺酮(0.1 g/kg) ip麻醉, 开腹后沿十二指肠内侧找到胆胰管开口, 用5.5号穿刺针在近十二指肠开口端逆行刺入胆胰管, 以2枚血管夹分别夹住肝门部胆管和穿刺针; 以0.1 mL/min速度向胰管内匀速注射50 g/L牛磺胆酸钠(1 μL/g); 观察胰腺变化后连续缝合关腹. 假手术组: 开腹后不注射50 g/L牛磺胆酸钠溶液, 只翻动胰腺并以钝器轻划胰腺3次. 以2 g/L DMSO-吡格列酮(20 mL/kg)代替100 g/L DMSO, 作为干预组. 分别于术后3, 6, 12 h 3个时段经腹主动脉放血将大鼠处死, 每个时段每组各取6只大鼠. 取胰头部组织用40 g/L中性甲醛固定后送检.
胰腺组织经固定、包埋、常规HE染色制片, 依据Kusske[2]标准进行评分. 胰腺组织ICAM-1的表达检测情况如下: 切片常规脱蜡至水, 微波修复抗原, 30 g/L过氧化氢-甲醇阻断内源性过氧化物酶, PBS冲洗, 加兔抗ICAM-1 (1:50), 湿盒内4 ℃冰箱过夜, 加非生物素化的二抗, 37 ℃孵育30 min, PBS冲洗, DAB显色, 苏木素复染、中性树胶封片. PBS代替一抗为阴性对照. 胞质或胞膜呈棕黄色为阳性. 阳性积分计算方法[3]: 随机观察3个高倍视野, 分别计算阳性细胞数N1、总细胞数N; 同时进行阳性细胞着色强度(F)判断: 浅黄色为1分, 黄色为2分, 棕黄色为3分, 最终的阳性积分 = N1/N×F.
统计学处理 数据采用mean±SD表示, 采用SPSS 11.5软件包进行统计学分析, 以P<0.05为差异有统计学意义.
A组胰腺明显水肿, 小叶间隔增大, 间质内充斥大量淡红色水肿液, 部分腺泡呈孤岛状; 术后3 h即有炎症细胞从血管壁游出, 随时间延长炎症细胞浸润明显; 术后3和6 h腺泡细胞颗粒样变性或空泡变性, 实质内可见散在的灶状凝固性坏死, 术后12 h胰腺大片坏死, 腺小叶排列紊乱, 坏死区腺泡结构消失, 细胞萎缩、胞核溶解消失; 综合评分以12 h点改变最明显. I组镜下表现与A组大体相似, 亦呈现出不同程度的组织水肿、炎症细胞浸润、腺泡细胞的变性坏死等特征, 但与A组同时段相比病变程度轻; I组病理评分与A组同时段比较, 术后3 h差异无统计学意义(P>0.05), 在6和12 h两个时段两组差异均有显著性(P<0.01). C组胰腺间质仅见轻度充血水肿, 小叶结构存在, 间质清晰, 间质内偶见炎症细胞浸润, 但随时间延长病理改变逐渐减轻, 与I, A组同时段相比差异均有显著性(P<0.01)(表1).
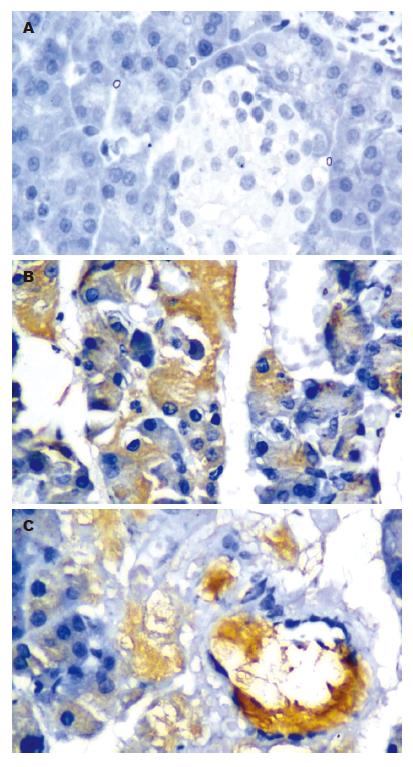
阳性染色定于胰腺腺泡细胞的胞膜、胞质及血管内皮细胞(图1): C组仅有少量弱阳性表达于腺泡细胞和血管内皮细胞, 随时间延长阳性染色消失; 术后3 h, A组ICAM-1在胞质或血管内皮有较强表达, 此后表达持续增强, 12与3 h比较差异有统计学意义(P<0.05); I组各时段均见阳性染色, 但较同时段A组弱, 阳性表达于6 h达高峰, 不同时段之间差异无统计学意义(P>0.05); A组与C组同时段相比差异均有显著性(P<0.01); I组与C组同时段相比, 在3, 6 h点两组差异有显著性(P<0.01), 12 h点差异有统计学意义(P<0.05); A组与I组比较, 术后12 h差异有统计学意义(P<0.05)(表2).
ICAM-1又称CD54, 是一条单链跨膜糖蛋白, 属于免疫球蛋白家族中的主要代表. 生理条件下ICAM-1仅低量表达于内皮细胞和上皮细胞表面[4], 炎症反应时, 炎症部位常见大量ICAM-1表达[5]. AP时PMN自循环血液中游出并在炎症区域募集是引起和加重胰腺损伤及导致远隔器官并发症的中心环节[6]. PMN的游出与募集又需要多种黏附分子的参与, 其中ICAM-1介导的PMN稳定黏附和穿越内皮细胞向炎症部位的游出起关键作用[7]. 且ICAM-1表达的时态及表达量是影响白细胞黏附、迁移并释放损伤性炎性介质的重要因素[8]. 因此, 阻断ICAM-1的表达, 亦即阻断了白细胞聚集与浸润, 打断细胞因子连锁反应, 是治疗SAP的有效手段. 不论是急性水肿性胰腺炎(acute edematous pancreatitis, AEP)还是SAP, ICAM-1表达大多显著上调. 本研究发现, SAP大鼠胰腺组织中可见ICAM-1表达, 随时间推移表达增强, 组织炎症加重, 12与3 h比较ICAM-1表达明显上调, 提示ICAM-1参与了胰腺组织的炎症过程.
PPARγ是细胞增殖和炎症反应的调节剂, 可调节炎症相关基因的表达, 参与机体的炎症反应过程, 且抗炎作用广泛而强大. 最先报道的PPARγ合成配体是噻唑烷二酮类药物, 包括吡格列酮、环格列酮、曲格列酮、罗格列酮等, 对PPARγ有高度选择性, 在毫微克分子浓度水平即可激活PPARγ, 临床上主要用于2型糖尿病的治疗; 但近年研究显示, 该类药物可通过激活PPARγ而调控炎症反应. 目前, 国内外对PPARγ配体与AP之间关系的研究主要集中在15d-PGJ2和罗格列酮, 有关吡格列酮对AP作用的研究尚无相关报道. Hashimoto et al[9]对AP大鼠干预性应用15d-PGJ2后, 大鼠COX-2, ICAM-1, IL-6表达下调, NF-κB活性下降, 胰腺组织学改变减轻, 认为15d-PGJ2发挥效应是通过抑制抑制蛋白(Inhibitory κB, IκB)的降解而实现, 第一次体内实验证明, PPARγ配体可能是AP的治疗靶点. 本研究首次采用吡格列酮对AP大鼠施实干预后表明, 干预组胰腺ICAM-1表达降低, 高峰提前至6 h, 病理评分改善, 与Cuzzocrea et al[10]采用罗格列酮干预治疗的结果一致, 且ICAM-1下调与组织学评分减低之间具有一致性, 提示吡格列酮可能通过抑制ICAM-1的表达而减轻AP的炎症程度, 表明PPARγ激动剂有可能成为一种有效的治疗手段.
重症急性胰腺炎(SAP)的发病机制十分复杂, SAP发病后病情加重的核心问题主要涉及单核巨噬细胞、中性粒细胞(PMN)、血管内皮细胞(VEC)等的参与介入, 其释放的多种细胞因子和炎性介质如ICAM-1在SAP的病情演变过程中起着至关重要的作用. PPARγ途径在体外实验及动物模型中具有抑制单核/巨噬细胞系统活化, 减少炎症细胞积聚和炎症因子释放等发挥抗炎症作用.
近年来国内外研究表明, 过氧化酶体增殖因子活化受体γ(PPARγ)参与机体的炎症反应过程, 其激活可导致NF-κB活性下调, 减少炎症介质的产生. PPARγ与多种细胞因子、黏附分子基因的转录和表达关系密切, 并借此影响急、慢性炎症的发生、发展. PPARγ激动剂有可能成为急性胰腺炎一种有效的治疗手段.
Hashimoto对AP大鼠干预性应用15d-PGJ2后, ICAM-1, IL-6表达下调, NF-κB活性下降, 胰腺组织学改变减轻, 认为15d-PGJ2发挥效应是通过抑制抑制蛋白(inhibitorykB, IkB)的降解而实现. Cuzzocrea对AP小鼠的研究也得出类似结果. 这些研究均提示PPARγ激动剂有可能成为一种有效的治疗手段.
近年研究显示, 噻唑烷二酮类药物可通过激活PPARγ而调控炎症反应. 目前, 国内外对PPARγ配体与急性胰腺炎之间关系的研究主要集中在15d-PGJ2和罗格列酮, 有关吡格列酮对AP作用的研究尚无相关报道.
SAP的发病机制十分复杂, 迄今为止, 其具体机制仍未完全明确, 目前尚无特异治疗手段. 因此, 如何有效的防治SAP成为当今医务人员面临的挑战. 用吡格列酮干预治疗可减轻大鼠SAP炎症程度, 为PPARγ激动剂用于临床治疗SAP提供了实验依据.
过氧化物酶体增殖剂激活受体(PPAR): 属于Ⅱ型核受体超家族成员, 是配体激活转录因子. 因能被一类脂肪酸样化合物过氧化物酶体增殖剂(PP)激活, 被命名为PP激活受体;
ICAM-1(细胞间黏附分子-1)又称CD54, 是一条单链跨膜糖蛋白.
本文探讨PPARγ激动剂吡格列酮对SAP大鼠胰腺组织ICAM-1表达的影响, 结果提示, 吡格列酮可能通过抑制ICAM-1的表达而减轻急性胰腺炎的炎症程度, 表明PPARγ激动剂有可能成为一种有效的治疗手段, 这对于急性胰腺炎时全身炎症反应综合征的防治有一定意义, 文章有一定学术价值.
电编: 张敏 编辑: 张焕兰
| 1. | Goldacre MJ, Roberts SE. Hospital admission for acute pancreatitis in an English population, 1963-98: database study of incidence and mortality. BMJ. 2004;328:1466-1469. [PubMed] |
| 2. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] |
| 3. | Sasaki H, Nio M, Iwami D, Funaki N, Sano N, Ohi R, Sasano H. E-cadherin, alpha-catenin and beta-catenin in biliary atresia: correlation with apoptosis and cell cycle. Pathol Int. 2001;51:923-932. [PubMed] |
| 4. | van de Stolpe A, van der Saag PT. Intercellular adhesion molecule-1. J Mol Med. 1996;74:13-33. [PubMed] |
| 5. | Marcus BC, Wyble CW, Hynes KL, Gewertz BL. Cytokine-induced increases in endothelial permeability occur after adhesion molecule expression. Surgery. 1996;120:411-416; discussion 416-417. [PubMed] |
| 6. | Frossard JL, Saluja A, Bhagat L, Lee HS, Bhatia M, Hofbauer B, Steer ML. The role of intercellular adhesion molecule 1 and neutrophils in acute pancreatitis and pancreatitis-associated lung injury. Gastroenterology. 1999;116:694-701. [PubMed] |
| 7. | Berney T, Gasche Y, Robert J, Jenny A, Mensi N, Grau G, Vermeulen B, Morel P. Serum profiles of interleukin-6, interleukin-8, and interleukin-10 in patients with severe and mild acute pancreatitis. Pancreas. 1999;18:371-377. [PubMed] |
| 8. | Diamond MS, Staunton DE, Marlin SD, Springer TA. Binding of the integrin Mac-1 (CD11b/CD18) to the third immunoglobulin-like domain of ICAM-1 (CD54) and its regulation by glycosylation. Cell. 1991;65:961-971. [PubMed] |
| 9. | Hashimoto K, Ethridge RT, Saito H, Rajaraman S, Evers BM. The PPARgamma ligand, 15d-PGJ2, attenuates the severity of cerulein-induced acute pancreatitis. Pancreas. 2003;27:58-66. [PubMed] |
| 10. | Cuzzocrea S, Pisano B, Dugo L, Ianaro A, Britti D, Patel NS, Di Paola R, Genovese T, Di Rosa M, Caputi AP. Rosiglitazone, a ligand of the peroxisome proliferator-activated receptor-gamma, reduces acute pancreatitis induced by cerulein. Intensive Care Med. 2004;30:951-956. [PubMed] |