修回日期: 2006-10-03
接受日期: 2006-10-11
在线出版日期: 2006-12-28
目的: 研究益气活血软坚解毒方(YHRJ)含药血清对人肝癌细胞系Bel-7402细胞凋亡调控基因Fas, FasL, Bcl-2, Bax, P53, NF-κB表达影响.
方法: 将细胞分为对照组(NS)组、NS+DDP (顺氯氨铂)组、YHRJ等剂量组(YHRJD)、YHRJD+DDP组、YHRJ高剂量组(YHRJG)、YHRJG+DDP组, 应用流式细胞术、免疫组化、原位杂交、RT-PCR等方法对用药24, 48 h的Bel-7402细胞凋亡的主要调控基因Fas, FasL, Bcl-2, Bax, P53, NF-κB mRNA与蛋白表达进行检测.
结果: 流式细胞术检测显示: 与NS组相比, NS+DDP、YHRJD、YHRJD+DDP及YHRJG+DDP组Fas蛋白表达均明显提高(30.12%±22.94%, 10.50%±8.41%, 30.35%±22.98%, 32.61%±26.87% vs 8.77%±6.93%, P<0.01), YHRJG组效果不明显(P>0.05); NS+DDP、YHRJD+DDP组FasL蛋白表达也升高(16.40%±7.168%, 8.41%±6.74% vs 4.12%±2.60%, P<0.01), 而YHRJG组FasL蛋白表达降低(3.05%±2.53% vs 4.12%±2.60%, P<0.01). 免疫组化结果显示: 除YHRJG+DDP组外, 其余各组突变型P53蛋白表达明显降低(30.2%, 14.6%, 19.8%, 17.3% vs 60.0%, P<0.05); 各加药组Bax蛋白表达明显增高(40.7%, 40.4%, 72.1%, 68.9%, 42.2% vs 30.0%, P<0.05); NS+DDP组与YHRJG组Bcl-2蛋白表达明显降低(26.3%, 24.4% vs 30.5%, P<0.05), 而YHRJD、YHRJG+DDP、YHRJG+DDP组Bcl-2表达明显升高(41.8%, 39.3%, 45.6% vs 30.5%, P<0.05); 各加药组NF-κB蛋白表达明显降低(15.9%, 13.3%, 14.1%, 7.8%, 14.6% vs 24.2%, P<0.05). 原位杂交结果显示: 各加药组NF-κB mRNA表达明显降低(30.5%, 13.3%, 21.4%, 17.4%, 53.2% vs 58%, P<0.05). RT-PCR结果显示: YHRJ等效剂组凋亡调控基因Bcl-2 mRNA表达明显降低(0.717±0.198 vs 1.327±0.097, P<0.001); DDP、YHRJD、YHRJG组凋亡调控基因Bax mRNA表达明显增高(46.22±6.22, 56.19±7.36, 62.32±11.06 vs 35.22±4.38, P<0.05).
结论: YHRJ含药血清诱导人肝癌细胞系Bel-7402细胞凋亡可能的基因调控机制在于通过抑制凋亡信号转导基因FasL基因蛋白表达, 促进凋亡调控基因Bax基因蛋白表达, 抑制NF-κB基因mRNA及蛋白表达来实现的.
引文著录: 李东涛, 孙桂芝, 裴迎霞, 祁鑫, 李杰, 李富玉, 李军艳, 许彦来, 陈美南. 益气活血软坚解毒方含药血清诱导人肝癌细胞系Bel-7402细胞凋亡过程中部分凋亡调控基因变化. 世界华人消化杂志 2006; 14(36): 3443-3449
Revised: October 3, 2006
Accepted: October 11, 2006
Published online: December 28, 2006
AIM: To investigate the effects of Yiqi Huoxue Ruanjian Jiedu (YHRJ) decoction on the expression of apoptosis-related genes Fas, FasL, Bcl-2, Bax, P53 and NF-κB in human hepatocellular carcinoma cell line BEL-7402.
METHODS: Human hepatocellular carcinoma BEL-7402 cells were divided into 6 groups, and treated with normal saline (NS), NS plus cisplatin (DDP), equal-dose YHRJ decoction, YHRJ decoction plus DDP group, high-dose YHRJ decoction, high-dose YHRJ decoction plus DDP, respectively. Flow cytometry, immunohistochemistry, in situ hybridization, and reverse transcription-polymerase chain reaction (RT-PCR) were used to analyze the expression of Fas, FasL, Bcl-2, Bax, P53 and NF-κB.
RESULTS: Flow cytometry revealed a dramatic increase of Fas expression in the cells treated with NS plus DDP, equal-dose YHRJ and equal-dose YHRJ plus DDP, and high-dose YHRJ plus DDP in comparison with that in the control cells (30.12% ± 22.94%, 10.50% ± 8.41%, 30.35% ± 22.98%, 32.61% ± 26.87% vs 8.77% ± 6.93%, P < 0.01), but not in the cells treated with high-dose YHRJ (P > 0.05). The expression of FasL was significantly higher in NS+DDP and YHRJD+DDP treatment group than that in the normal controls (16.40% ± 7.168%, 8.41% ± 6.74% vs 4.12% ± 2.60%, P < 0.01), but lower in high-dose YHRJ group (3.05% ± 2.53% vs 4.12% ± 2.60%, P < 0.01). Immunohistochemistry showed a significant decrease of P53 expression in all the drug-treated cells (30.2%, 14.6%, 19.8%, 17.3% vs 60.0%, P < 0.05) except high-dose YHRJ plus DDP treated ones; The expression of Bax protein in all the drug-treated cells was higher significantly than that in the controls (40.7%, 40.4%, 72.1%, 68.9%, 42.2% vs 30.0%, P < 0.05); There was a notable decrease of Bcl-2 expression in NS plus DDP and high-dose YHRJ treated cells (26.3%, 24.4% vs 30.5%, P < 0.05) as well as of NF-κB expression in all the drug-treated cells (40.7%, 40.4%, 72.1%, 68.9%, 42.2% vs 30.0%, P < 0.05). In situ hybridization also demonstrated that the mRNA expression of NF-κB was markedly decreased in all the drug-treated groups as compared with that in the control group (30.5%, 13.3%, 21.4%, 17.4%, 53.2% vs 58%, P < 0.05). RT-PCR revealed a significant decrease of Bcl-2 mRNA expression in equal-dose YHRJ treated cells (0.717 ± 0.198 vs 1.327 ± 0.097, P < 0.001) as well as a dramatic increase of Bax mRNA expression in DDP, YHRJD, and YHRJG treated cells (46.22 ± 6.22, 56.19 ± 7.36, 62.32 ± 11.06 vs 35.22 ± 4.38, P < 0.05).
CONCLUSION: YHRJ decoction may induce apoptosis in human hepatocellular carcinoma by down-regulating the expression of FasL, up-regulating the expression of Bax and inhibiting the activation of NF-κB.
- Citation: Li DT, Sun GZ, Pei YX, Qi X, Li J, Li FY, Li JY, Xu YL, Chen MN. Yiqi Huoxue Ruanjian Jiedu decoction regulates expression and activity of apoptosis-regulated genes in human hepatocellular carcinoma cell line BEL-7402. Shijie Huaren Xiaohua Zazhi 2006; 14(36): 3443-3449
- URL: https://www.wjgnet.com/1009-3079/full/v14/i36/3443.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i36.3443
益气活血软坚解毒方(YHRJ)是中国中医研究院广安门医院孙桂芝主任医师在总结古代中医与现代中医文献的基础上, 结合几十年的临床实践总结出来的应用于肝癌患者的主要治则治法. 以往的研究证实, 以YHRJ法治疗肝癌在临床上取得了抑制肿瘤生长, 提高生活质量, 延长生存期的作用[1-2]; 并能降低甲胎蛋白(AFP)水平, 对失调的细胞因子肿瘤坏死因子-α(TNF-α)及白细胞介素-18(IL-18)有调节作用[3]. 以此方法组方的肝康冲剂提取物有诱导人肝癌细胞系Bel-7402细胞凋亡作用[4]. 我们前期的细胞学实验研究证实YHRJ含药血清有抑制人肝癌细胞系Bel-7402细胞生长并有诱导细胞凋亡作用[5], 并能促进细胞内Ca2+内流与降低线粒体膜电位的作用[6]. 为进一步研究其诱导细胞凋亡的分子机制, 我们对主要的细胞凋亡相关基因进行了检测.
新西兰大白兔12只, ♀, 体质量2.45-2.7 kg, 购于中国药品及生物制品检定所. 对数生长期的Bel-7402细胞, 由中国中医研究院广安门医院提供. 益气活血软坚解毒方(YHRJ)水煎剂: 组方为生黄芪、炒白术、田三七、水红花子、藤梨根、凌霄花、炮山甲、白花舌蛇草、半枝莲, 常规水提取, 生药浓度3.4 kg/L, 4 ℃保存备用. YHRJ含药血清的制备: 健康新西兰大耳白兔12只, 随机分为NS, YHRJ等效剂量(YHRJD, 约为人用量的5倍)、YHRJ高剂(YHRJG, 约为人用量的10倍)3组, 每组4只, 8:00, 14:00点各给药1次, 中药每只每次稀释成10 mL灌喂, 重复给药5次, 末次给药前12 h禁食不禁水, 末次给药后1-1.5 h之内分别从耳中央动脉无菌采血10 mL, 室温静置2 h, 冷冻离心机1500 r/min, 离心10 min, 吸取血清, 56 ℃ 30 min灭活, 22 μm针式微孔滤膜过滤, -20 ℃冰箱保存备用. 顺氯氨铂(DDP): 山东齐鲁制药厂产品. RPMI1640完全培养液: RPMI培养干粉(Gibco)内含2 mmol/L谷氨酰胺, 青霉素100 kU/L、链霉素100 mg/L, 应用时加入100 mL/L灭活的小牛血清. RPMI1640完全培养基、碘化丙啶(PI)、RNA酶: 美国Sigma公司产品. Bcl-2, Bax, P53(突变型)免疫组化染色试剂盒、NF-κB P65原位杂交检测盒: 武汉博士德生物工程有限公司产品. NF-κB多克隆抗体, Fas(CD95)、FasL(CDl73) mAb, 美国Santa Cruz公司产品. 动物总RNA提取试剂盒: 北京鼎国生物技术发展中心产品. TaKaRa RNA PCR Kit(AMV)Ver.2: 宝生物工程(大连)有限公司产品. 引物由赛百盛公司合成. Bax: 上游5'-GCGTCCACCAAGAAGCTGA-3'(159 site), 下游5'-ACCACCCTGGTCTTGGATCC-3'(470 site), Fragement: 312 bp; Refer to GenBank: XM 009093; Bcl-2: 上游5'-CAGCTGCACCTGACGCCCTT-3'(383 site), 下游5'-GCCTCCGTTATCCTGGATCC-3'(613 site), Fragement: 231 bp Refer to GenBank: XM 14745. 内对照β-actin的引物序列: 北京鼎国生物技术发展中心提供, Fragement: 212 bp. FACSort流式细胞仪(FCM): 美国Becton-Dicknson公司生产. PTC-100TMPCR扩增仪: 美国MJ-Research lnc公司产品. UVI凝胶成像系统: 英国UVItec公司.
处于对数生长期的人肝癌细胞Bel-7402细胞, 经2.5 g/L胰酶消化后, 分瓶, 传代细胞处于对数生长期时分组为NS, NS+DDP, YHRJD, YHRJD+DDP, YHRJG, YHRJG+DDP 6组, 分别加入生理盐水兔血清至终浓度为100 mL/L、生理盐水兔血清至终浓度为100 mL/L+DDP至终浓度4.5 mg/L、YHRJD兔血清至终浓度为100 mL/L、YHRJD兔血清至终浓度为100 mL/L+DDP至终浓度4.5 mg/L、YHRJG兔血清至终浓度为100 mL/L、YHRJG兔血清至终浓度为100 mL/L+DDP至终浓度4.5 mg/L. 50 mL/L湿化的CO2培养箱中分别孵育24 h后处理细胞.
1.2.1 间接免疫荧光标记、FCM测定细胞凋亡信号转导基因Fas、FasL蛋白表达: 常规消化, PBS液(pH 7.4)离心洗涤2次, 加入FITC标记鼠抗人Fas, FasL mAb 10 μL; 阴性对照组取肿瘤细胞100 μL, 加入FITC标记小鼠IgG mAb 10 μL; 以上两组轻轻混匀室温下避光染色30 min; 离心1500 r/min, 5 min; 弃上清, 每管加PBS缓冲液0.6 mL, 上机测定.
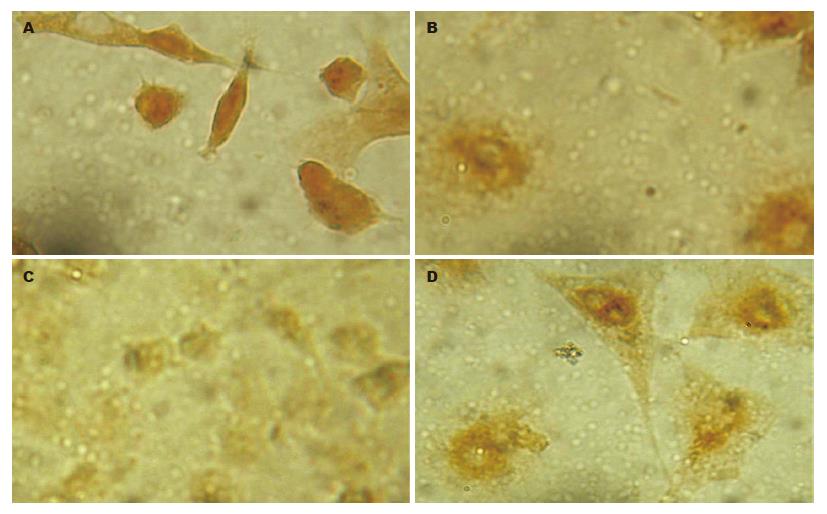
1.2.2 免疫组化法检测细胞凋亡调控基因P53、Bax、Bcl-2、NF-κB蛋白表达: 按免疫组化试剂盒说明操作. 结果判定: P53出现明显的核膜表达, 其余主要为胞质表达. 观察1000个细胞, 计数其阳性细胞数, 根据色泽深浅进行分级, -为阴性表达, +为浅黄, ++为橘黄, +++为棕黄, ++++为褐黄.
1.2.3 原位杂交法检测细胞凋亡调控基因NF-κB mRNA表达: 按原位杂交试剂盒说明进行操作, 观察方法同免疫组化.
1.2.4 RT-PCR检测细胞调控基因Bax、Bcl-2 mRNA表达: 细胞总RNA提取按试剂盒说明操作, 紫外分光光度计测A值计算RNA含量符合要求. RNA电泳, 观察可见18 S, 28 S RNA带. 按以下条件进行反转录反应. 30 ℃, 10 min; 42 ℃, 30 min; 99 ℃, 5 min; 5 ℃, 5 min. 按以下条件进行PCR反应: 94 ℃, 2 min, 1次; 94 ℃ 50 s, 62 ℃ 50 s, 72 ℃ 1 min, 循环35次. DNA电泳: 取PCR产物10 μL与2 μL的上样缓冲液混合, 用1×TAE缓冲液配制20 g/L琼脂糖进行水平平板电泳, 电压5 V/cm, 电泳40 min, 然后在254 nm波长的紫外灯下观察, 应用UVI凝胶成像系统摄取凝胶图像.
统计学处理 计量资料采用方差分析, 等级资料采用Ridit分析.
间接免疫荧光标记, FCM测定结果显示, 各加DDP组与中药YHRJD组均能明显提高Fas蛋白表达; NS+DDP组同时也提高FasL蛋白表达, 而YHRJG组确能降低FasL蛋白表达(表1).
| 分组 | Fas | FasL | ||
| 表达百分比(%) | 荧光强度 | 表达百分比(%) | 荧光强度 | |
| NS | 8.77±6.93 | 15.09±13.83 | 4.12±2.60 | 31.03±21.12 |
| NS+DDP | 30.12±22.94b | 35.07±30.42 | 16.40±7.17b | 45.53±28.47 |
| YHRJD | 10.50±8.41b | 21.99±20.16 | 6.24±4.66b | 43.09±37.96 |
| YHRJD+DDP | 30.35±22.98b | 38.49±34.30 | 8.41±6.74b | 76.22±61.06 |
| YHRJG | 8.54±6.78 | 10.51±9.02 | 3.05±2.53b | 8.25±7.71 |
| YHRJG+DDP | 32.61±26.87b | 34.31±29.99 | 4.16±3.61 | 11.62±10.87 |
对P53蛋白表达检测结果显示, 与NS组比较, 除YHRJG组+DDP组外, 其余各组明显降低P53突变型基因蛋白表达(P<0.05); 与DDP组相比, YHRJD, YHRJG与YHRJD+DDP组P53突变型基因蛋白表达也有所降低(P<0.05)(表2). 对Bax基因蛋白表达检则结果显示, 与NS组相比, 各加药组明显增强Bax基因蛋白(P<0.05); 与DDP组相比, 各中药组也明显增强Bax基因蛋白(P<0.05)(表2). 对Bcl-2基因蛋白检则结果显示, 与NS组相比, 只有DDP组与YHRJG组能明显降低Bcl-2基因蛋白(P<0.05), 其余各组表达有所增强(表2). 对NF-κB基因蛋白检则结果显示, 与NS组相比, 各加药组明显降低NF-κB基因蛋白表达(P<0.05); 与DDP组比较, 各中药组也明显降低NF-κB基因蛋白表达(P<0.05)(表2).
| 分组 | - | + | ++ | +++ | ++++ | 阳性表达率(%) |
| P53 | ||||||
| NS | 400 | 322 | 225 | 53 | 0 | 60.0 |
| NS+DDP | 698 | 150 | 99 | 53 | 0 | 30.2a |
| YHRJD | 864 | 92 | 54 | 0 | 0 | 14.6ac |
| YHRJD+DDP | 792 | 116 | 82 | 0 | 0 | 19.8ac |
| YHRJG | 836 | 112 | 61 | 0 | 0 | 17.3ac |
| YHRJG+DDP | 455 | 267 | 206 | 72 | 0 | 54.5c |
| Bax | ||||||
| NS | 700 | 105 | 166 | 29 | 0 | 30.0 |
| NS+DDP | 593 | 240 | 93 | 74 | 0 | 40.7a |
| YHRJD | 596 | 93 | 149 | 113 | 49 | 40.4ac |
| YHRJD+DDP | 279 | 124 | 182 | 110 | 305 | 72.1ac |
| YHRJG | 311 | 113 | 93 | 282 | 201 | 68.9ac |
| YHRJG+DDP | 588 | 102 | 149 | 93 | 78 | 42.2ac |
| Bcl-2 | ||||||
| NS | 695 | 67 | 133 | 105 | 0 | 30.5 |
| NS+DDP | 737 | 70 | 125 | 68 | 0 | 26.3a |
| YHRJD | 588 | 163 | 136 | 121 | 0 | 41.8ac |
| YHRJD+DDP | 607 | 156 | 138 | 99 | 0 | 39.3ac |
| YHRJG | 766 | 114 | 62 | 68 | 0 | 24.4ac |
| YHRJG+DDP | 544 | 134 | 206 | 116 | 0 | 45.6ac |
| NF-κB | ||||||
| NS | 758 | 118 | 69 | 53 | 0 | 24.2 |
| NS+DDP | 841 | 58 | 73 | 31 | 0 | 15.9a |
| YHRJD | 867 | 80 | 37 | 13 | 0 | 13.3ac |
| YHRJD+DDP | 859 | 41 | 81 | 18 | 0 | 14.1ac |
| YHRJG | 922 | 31 | 49 | 0 | 0 | 7.8ac |
| YHRJG+DDP | 854 | 60 | 16 | 70 | 0 | 14.6ac |
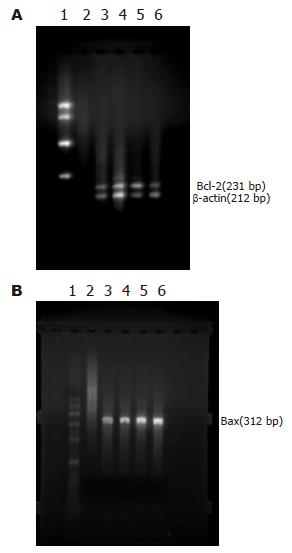
原位杂交法检测NF-κB mRNA表达结果显示, 与NS组相比, 各加药组明显降低NF-κB基因mRNA表达(P<0.05); 与DDP组相比, YHRJD、YHRJG及YHRJD+DDP组明显降低NF-κB基因mRNA表达(P<0.05)(表3, 图1).
YHRJD组明显降低凋亡调控基因Bcl-2 mRNA表达, 与NS组及DDP组比较, 差异显著(P<0.05)(表4, 图2A). 与NS组相比, 各加药组明显升高凋亡调控基因Bax mRNA表达, 差异显著(P<0.05); 与DDP组相比, YHRJD组Bax mRNA表达也有所增强(P<0.05)(表5, 图2B).
细胞凋亡(apoptosis)是细胞由于内外环境的变化或死亡信号触发以及在基因调控下所引起细胞主动死亡的过程, 是细胞死亡的两种方式之一. 现代医学研究表明, 诱导细胞凋亡是药物发挥抗肿瘤作用的重要机制之一. 在细胞的凋亡过程中, 许多癌基因、原癌基因和抑癌基因参与了细胞凋亡过程的调控[7-8], 主要有Fas/FasL、Bcl-2基因家族、P53抑癌基因、NF-κB基因. 其中Fas属于肿瘤坏死因子/神经生长因子转移膜受体(TNF/NGF)超家族, 当他受到抗体及配体FasL的刺激时诱导细胞凋亡[9]. Bcl-2和Bax同为Bcl-2家族成员, Bax能促进细胞凋亡, Bcl-2能抑制细胞凋亡, 在促凋亡因素刺激下, Bcl-2/Bax比值将决定细胞的死活[10-11]. P53基因与肿瘤关系最为密切, 60%以上的人类肿瘤细胞中存在P53基因的突变失活, 野生型P53能抑制肿瘤发生, 是抗癌基因, 而突变型则反而促进肿瘤发生, 成为癌基因[12-13]. NF-κB是由Rel蛋白家族中的成员以同源或异源二聚体形式组成的一类蛋白蛋, 以非活性形式存在于胞质. 一旦接受刺激信号, NF-κB活化并易位核内, 调节下游基因的表达. 最近发现, 许多诱导细胞凋亡的因子, 如化疗药物、电离辐射在诱导肿瘤细胞凋亡的同时, 由于活化了NF-κB, 会使其诱导凋亡的作用下降, 因此NF-κB活化的抑制已成为肿瘤治疗研究的热点之一[14].
现代中药药理研究发现, 许多中药具有诱导肝癌细胞凋亡的作用[15-16]. 如周振华et al[17]研究发现, 健脾理气方有促进小鼠HAC肝癌细胞凋亡作用, 能上调肿瘤细胞bax基因蛋白表达. 郭伟剑et al[18]研究发现, 健脾理气药对肝癌细胞株SMMC-7721具一定的诱导凋亡及抑制肝癌细胞效应, 能上调P53, P2lWAF1/CIP1基因的表达, 且对肿瘤细胞端粒酶活性有抑制作用. 杨雁 et al[19]研究发现, 黄芪总甙具有诱导肝癌细胞株HepG2细胞和Bel-7402细胞凋亡的作用, 能上调肝癌细胞的wtP53表达. 以上说明, 在抑制肝癌生长方面, 中药可能主要是通过诱导细胞凋亡实现的. 前期的研究结果显示, YHRJ对人肝癌癌细胞系Bel-7402细胞具有诱导细胞凋亡作用[5]. 从对诱导凋亡信号转导基因(Fas/FasL)、凋亡相关蛋白(Bax/Bcl-2)等检测结果得到的数据显示, 中药YHRJ可能主要从以下方面来诱导人肝癌细胞系Bel-7402细胞凋亡: (1)调节凋亡信号转导基因Fas/FasL表达水平. 体外实验结果显示, YHRJ含药血清能抑制人肝癌细胞系Bel-7402肿瘤凋亡信号转基因FasL基因蛋白表达. 降低FasL表达, 能增强机体T淋巴细胞对其的免疫监视作用, 减少由于肝癌细胞过度表达FasL导致CTL细胞凋亡使肿瘤细胞免疫逃逸[20]; (2)调节凋亡相关调控基因Bax/Bcl-2, NF-κB的表达. 从实验结果看, YHRJ含药血清能促进凋亡调控基因Bax基因蛋白表达, 抑制NF-κB基因mRNA及蛋白表达. Bax/Bcl-2是调节细胞凋亡的重要相关基因, Bcl-2高表达, 可提高细胞凋亡的阈值, 抑制细胞凋亡, 而Bax的高表达则可促进细胞凋亡. NF-κB是TNF死亡途径中重要的抑制凋亡的基因, 其高表达的作用可以产生高浓度的IAP, 进而下降caspase而阻断细胞凋亡[21]. 中药复方的特点是多成分、多系统、多器官、多效应, 因此作用机制可能是多方面[22-28]. 以上研究表明, YHRJ对肝癌细胞凋亡的多个环节均有一定影响, 是中医复方多种有效成份相互作用的结果.
益气活血软坚解毒(YHRJ)法是孙桂芝教授通过几十年的中医临床实践总结出来的应用于肝癌患者的主要治则治法. 以往的研究证实, 该法治疗肝癌在临床上取得了抑制肿瘤生长, 提高生活质量, 延长生存期的作用. 本文前期的细胞学实验研究证实YHRJ含药血清有抑制人肝癌细胞系Bel-7402细胞生长并有诱导细胞凋亡作用, 并能促进细胞内Ca2+内流与降低线粒体膜电位的作用.
一些中医工作者从不同角度与层面在中药诱导肝癌细胞凋亡方面做了不少工作. 刘琳et al三氧化二砷选择性诱导人肝癌细胞凋亡及相关基因的实验研究及孟志强et al以健脾理气方药物血清对肝癌细胞端粒酶活性及凋亡的影响都证实中药无论复方, 还是某些单体都可以从诱导细胞凋亡角度对肿瘤产生作用. 从总的来看, 不同中药诱导细胞凋亡作用强度不同, 同一种药物对不同细胞作用强度也不同, 因此在临床上应合理选择.
根据本文实验结果, 中医益气活血软坚解毒综合治法可以被视为肝癌细胞凋亡诱导剂加以应用.
电编: 张敏 编辑: 张焕兰
| 3. | 李 东涛, 孙 桂芝. 益气活血软坚解毒法对肝癌患者免疫因子的影响. 中国中西医结合消化杂志. 2005;13:226-228, 232. |
| 5. | 李 东涛, 孙 桂芝, 裴 迎霞, 祁 鑫, 李 杰, 林 洪生. 益气活血软坚解毒含药血清诱导人肝癌细胞系Bel-7402细胞的凋亡. 世界华人消化杂志. 2005;13:2217-2221. [DOI] |
| 7. | 曾 小莉, 涂 植光. 细胞凋亡基因调控机制研究进展. 国外医学临床生物化学及检验学分册. 1999;20:80-82. |
| 9. | 王 文恭, 童 坦君. 小鼠成纤维细胞凋亡过程中P53与bcl-2表达的时序性. 中国生物化学与分子生物学报. 1998;14:318-322. |
| 10. | Schendel SL, Montal M, Reed JC. Bcl-2 family proteins as ion-channels. Cell Death Differ. 1998;5:372-380. [PubMed] |
| 11. | Apte SS, Mattei MG, Olsen BR. Mapping of the human BAX gene to chromosome 19q13.3-q13.4 and isolation of a novel alternatively spliced transcript, BAX delta. Genomics. 1995;26:592-594. [PubMed] |
| 12. | Hsu IC, Metcalf RA, Sun T, Welsh JA, Wang NJ, Harris CC. Mutational hotspot in the p53 gene in human hepatocellular carcinomas. Nature. 1991;350:427-428. [PubMed] |
| 16. | 周 振华, 宋 明志, 于 尔辛, 朱 雄增. 健脾理气方对小鼠HAC肝癌细胞凋亡和bax基因蛋白表达影响的实验研究. 中国中西医结合脾胃杂志. 2000;8:78-79, 82. |
| 17. | 郭 伟剑, 于 尔辛, 郑 颂国, 沈 兆忠, 罗 建明, 吴 国华, 夏 士安. 健脾理气药诱导人肝癌细胞SMMC772l凋亡的研究. 世界华人消化杂志. 2000;8:52-55. [DOI] |
| 19. | 李 海民, 窦 科峰, 李 韧, 周 景师, 帝 振宇, 张 福琴. 肝癌组织中Fas和FasL mRNA表达水平的变化及其意义. 中国普外基础与临床杂志. 2005;12:284-286. |
| 22. | 李 东涛, 孙 桂芝, 吴 志奎. 中医药治疗原发性肝癌作用机理实验研究进展. 中国中医基础医学杂志. 2002;8:72-74. |
| 24. | 范 恒, 邱 明义, 梅 家俊, 沈 关心, 刘 松林. 理肠中药方对溃疡性结肠炎大鼠结肠细胞凋亡及其调控基因表达的影响. 世界华人消化杂志. 2004;12:1119-1124. [DOI] |