修回日期: 2006-10-04
接受日期: 2006-10-11
在线出版日期: 2006-12-18
目的: 研究反义Snail转录因子体外抑制肝癌转移的作用.
方法: 采用RT-PCR技术分别检测肝癌细胞株HepG2中Snail mRNA和E钙黏蛋白(E-cadherin) mRNA的表达水平. 将HepG2细胞分为转染反义Snail质粒(反义组)和空载体质粒(对照组), 观察Snail对E-cadherin mRNA表达的逆转作用及对肝癌细胞体外侵袭、运动的抑制作用.
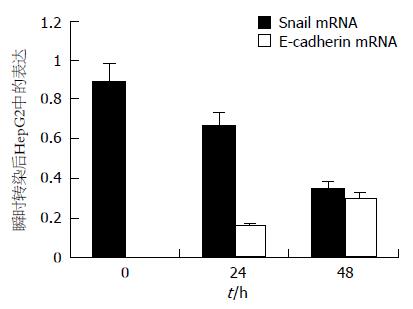
结果: Snail mRNA在HepG2细胞中有表达, E-cadherin mRNA在HepG2细胞中没有表达. HepG2细胞瞬时转染0, 24, 48 h时, Snail mRNA的表达水平分别为0.887±0.005, 0.665±0.010, 0.348±0.012; 同时, E-cadherin mRNA开始有表达, 分别为0, 0.160±0.001, 0.299±0.005, 各时间点间分别比较, 有显著性差异(P<0.05). HepG2细胞稳定转染后, 反义组、对照组Snail mRNA表达水平分别为0.131±0.010, 0.3577±0.020, 两组比较有显著性差异(P<0.05); 反义组E-cadherin mRNA开始有表达, 表达水平为0.476±0.030, 而对照组为0, 两组比较有显著性差异(P<0.01); 检测间质细胞标志物纤维连接蛋白mRNA的表达水平, 反义组显著低于对照组(0.201±0.010 vs 0.558±0.010, P<0.01). 体外细胞运动实验表明, 反义组、对照组跨膜细胞数分别为(48±2)个和(401±17)个, 有显著性差异(P<0.01). 重组细胞基底膜侵袭实验显示, 两组穿透基底膜细胞数分别为(39±8)个和(211±61)个, 显著性差异(P<0.05).
结论: 肝癌细胞中存在Snail mRNA与E-cadherin mRNA表达的负向关系, 抑制Snail mRNA的表达对肝癌细胞的侵袭和运动有抑制作用, 可能为肝癌的基因治疗提供新的靶点.
引文著录: 刘海, 王志强. 反义Snail转录因子抑制肝癌转移. 世界华人消化杂志 2006; 14(35): 3409-3413
Revised: October 4, 2006
Accepted: October 11, 2006
Published online: December 18, 2006
AIM: To investigate the inhibitory effects of antisense plasmid Snail on the invasion of hepatoma carcinoma cells in vitro.
METHODS: The expression of Snail and E-cadherin mRNA in hepatoma carcinoma cell lines HepG2 were detected by reverse transcription-polymerase chain reaction (RT-PCR). Antisense Snail plasmid was transfected into HepG2 cells, and then antisense group and control group were established. Lipofectin reagent was used to investigate the relationship between E-cadherin and Snail expression, and the inhibitory effects of antisense Snail mRNA were detected by Transwell motility assay and Matrigel invasion assay.
RESULTS: The expression of Snail mRNA was confirmed by RT-PCR, but E-cadherin mRNA expression was absent. The expression of Snail mRNA were 0.887 ± 0.005, 0.665 ± 0.010, 0.348 ± 0.012 at the 0, 24th, 48th h after transfection, and E-cadherin mRNA expression were 0, 0.160 ± 0.001, 0.299 ± 0.005, respectively. There were significant differences among the different time points for Snail and E-cadherin mRNA (P < 0.05). The mRNA levels of Snail and E-cadherin after stable transfection were significantly different between the antisense group and control group (0.131 ± 0.010 vs 0.357 ± 0.020, P < 0.05; 0.476 ± 0.030 vs 0, P < 0.01). In comparison with that in the control group, the fibronectin mRNA, a mensenchymal marker, was also apparently down-regulated in the antisense group after stable transfection (0.201 ± 0.010 vs 0.558 ± 0.010, P < 0.01). The motility and invasion activity of antisense-Snail transfected cells were obviously decreased as compared with those of control cells (48 ± 2 vs 401 ± 17, P < 0.01; 39 ± 8 vs 211 ± 61, P < 0.05).
CONCLUSION: A reverse correlation exists between E-cadherin and Snail expression in hepatoma carcinoma cells. Snail may be a potential target to block the invasion in human hepatocellular carcinoma.
- Citation: Hai-Liu, Wang ZQ. Inhibitory effects of antisense Snail on invasion of hepatoma carcinoma cells. Shijie Huaren Xiaohua Zazhi 2006; 14(35): 3409-3413
- URL: https://www.wjgnet.com/1009-3079/full/v14/i35/3409.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i35.3409
Snail是一种锌指蛋白转录因子, 可以介导上皮细胞向间充质细胞的转化, 在转录水平抑制E-cadherin的表达, 促进肿瘤的侵袭和复发转移[1]. 在皮肤癌、乳腺癌、结肠癌、口腔癌以及黑色素细胞癌的研究中均发现, Snail与肿瘤的侵袭和复发转移有关[2-3]. 肝细胞性肝癌(hepatocellular carcinoma, HCC)的发病率和死亡率呈逐年上升趋势, 我国每年约有30万人死于HCC, 在恶性肿瘤死亡顺位中仅次于胃癌居第2位[4]. HCC高死亡率的原因是早期转移, 但是目前发生复发转移的机制尚不完全明了, 对其机制的研究一直是国内外研究的热点. 本研究探讨了Snail mRNA在肝癌细胞中的表达情况; 并观察肝癌细胞株HepG2细胞转染反义Snail质粒后, HepG2细胞中Snail mRNA表达水平的变化及其E-cadherin mRNA表达及体外侵袭、运动能力的变化.
HepG2细胞株为华中科技大学同济医学院附属同济医院肝脏外科中心提供; DMEM细胞培养基购自美国Pierce生物技术公司; RT-PCR试剂盒和脂质体转染试剂盒购自Gibico公司; 反义Snail质粒由美国Geron Corporation, Villeponteau博士惠赠; Transwell小室购自美国Corning-Costar公司.
1.2.1 反义Snail质粒的构建: HepG2细胞在37 ℃, 50 mL/L CO2, 饱和湿度的培养箱中培养. 培养液为含100 mL/L胎牛血清的DMEM细胞培养基. 向pcDNA3质粒中反向插入了含有人Snail基因编码序列的第1-355位的碱基, 其转录产物与Snail mRNA互补结合, 从转录水平阻断Snail的表达. 碱基序列插入的准确性可通过测序的方法来验证.
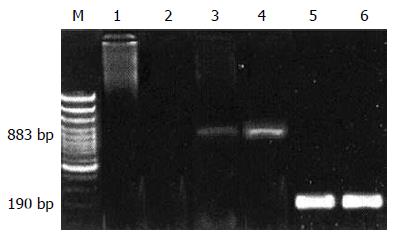
1.2.2 引物的设计及合成: 检测肝癌细胞中Snail和E-cadherin mRNA的表达, 细胞生长至对数生长期, 按TRIzol试剂盒提供的操作步骤提取总RNA, -70 ℃保存; 按逆转录试剂盒说明合成cDNA, cDNA产物-20 ℃保存; 取2 μg逆转录产物进行PCR扩增. Snail, E-cadherin反应条件为: 94 ℃变性5 min; 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s, 40个循环; 72 ℃延伸10 min. 反应体系用甘油醛232磷酸脱氢酶(GAPDH)作内参照. 利用美国应用生物系统公司引物设计软件Primer Express Version 1.0设计, Snail上游引物: 5'-TTCTTCGCTACTGCTGCG-3', 下游引物: 5'-GGGCAGGTATGGAGAGGAAGA-3', 扩增产物为883 bp; E-cadherin上游引物: 5'-CTGGTTCAGATCAAATCCAAC-3', 下游引物: 5'-TTCTCAGGCACCTGACCCTT-3', 扩增产物为502 bp; GAPDH上游引物: 5'-TGGTATCGTGGAAGGACTCATGAC-3', 下游引物: 5'-ATGCCAGTGAGCTTCCCGTTCAGC-3', 扩增产物为190 bp. 同时, 扩增间质细胞标志物纤维连接蛋白, 其上游引物: 5'-TCAGCTGTACCATTGCAAATC-3', 下游引物: 5'-TCCTGGTGTCCTGATCATTG-3', 扩增产物为314 bp. 复性温度54 ℃. 产物用10 g/L琼脂糖凝胶电泳并观察拍照, 凝胶图像分析系统扫描各电泳条带的灰度值, 以Snail/GAPDH、E-cadherin/GAPDH、纤维连接蛋白/GAPDH的比值代表标本Snail、E钙黏蛋白、纤维连接蛋白mRNA的半定量水平.
1.2.3 脂质体转染: HepG2细胞在37 ℃, 50 mL/L CO2, 含100 mL/L胎牛血清的DMEM细胞培养基中培养, 待细胞融合达60%-70%时, 去除培养基, 用无血清培养基洗涤细胞3次. 取反义Snail质粒(反义组)和空载体质粒(对照组)各2 μg, 分别与无血清培养基100 μL混匀. 将脂质体12 μL和无血清培养基200 μL混匀. 放置5 min, 将两种质粒分别与100 μL脂质体无血清混合液混匀, 室温静置20 min, 各自加入800 μL无血清培养基后, 直接滴到细胞表面, 37 ℃, 50 mL/L CO2培养箱中放置8 h, 换成100 mL/L胎牛血清培养基继续培养. 瞬时转染: 分别于转染后0, 24, 48 h收集细胞行RT-PCR技术检测Snail mRNA和E-cadherin mRNA的表达. 稳定转染: 在瞬时转染24 h后, 反义Snail质粒和空载体质粒转染的细胞分别用胰酶消化, 1:10传代于24孔板中, 同时用含800 mg/L G418培养基筛选高表达阳性克隆, 以获得稳定转染的细胞. 稳定转染细胞株建立后, 分别检测反义组和对照组Snail mRNA和E-cadherin mRNA以及纤维连接蛋白mRNA的表达.
1.2.4 体外细胞运动实验: 取Transwell小室放入24孔板中, 将稳定转染后的HepG2细胞经胰酶消化, 稀释成1×106/mL, 于Transwell小室滤膜的上方加10 μL细胞悬液. 37 ℃, 50 mL/L CO2培养箱中孵育24 h, 滤膜冰甲醇固定1 min后行HE染色. 棉棒轻轻擦去滤膜上层的细胞. 各选择5个无重叠区, 于高倍镜(×200)下分别计数滤膜底面和24孔板中的细胞数. 每株细胞设3个复孔, 实验重复3次, 结果以均值表示(下同).
1.2.5 重组细胞基底膜侵袭实验: 取Transwell小室放入24孔板中, 小室滤膜的上方加重组细胞基底膜(Matrigel) 20 μg形成基质胶层, 随后加入200 μL含1×104个细胞的细胞悬液, 37 ℃, 50 mL/L CO2孵育72 h. 滤膜冰甲醇固定1 min后行HE染色. 棉棒轻轻擦去滤膜顶层的细胞. 各选择5个无重叠区, 于高倍镜(×200)下分别计数穿过基质膜滤膜底面和24孔板中的细胞数.
统计学处理 应用SPSS12.0软件进行统计学分析, 实验结果用mean±SD表示, 采用配对t检验.
肝癌细胞株HepG2细胞中Snail mRNA在883 bp处有表达, 未检测到E-cadherin mRNA的表达, GAPDH mRNA在190 bp处有表达(图1).
瞬时转染反义Snail质粒后, Snail mRNA表达降低, 0与24 h时相比, 有显著性差异(P<0.05); 24与48 h时相比, 有显著性差异(P<0.01); 同时, E-cadherin mRNA开始有表达, 并随转染时间的增加而增加, 各时间点比较, 有显著性差异(P<0.05, 图2).
空载体质粒和反义Snail质粒分别转染后的HepG2细胞, 经筛选扩增各获得6个和5个细胞克隆. RT-PCR检测结果显示, 反义组和对照组Snail mRNA表达水平分别为0.131±0.010, 0.377±0.020, 两组比较, 有显著性差异(P<0.05). 反义组E-cadherin mRNA开始有表达, 表达水平为0.476±0.030, 而对照组为0, 两组有显著性差异(P<0.01). 纤维连接蛋白mRNA的表达反义组为0.201±0.010, 对照组为0.558±0.010, 反义组显著低于对照组(P<0.01).
Transwell小室体外运动实验显示, 反义组和对照组跨膜细胞数分别为(48±2)和(401±17)个/高倍镜(×200), 两组比较, 有显著性差异(P<0.01). Matrigel侵袭实验显示, 反义组和对照组穿透基底膜细胞数分别为(39±8)和(211±61)个/高倍镜(×200), 两组比较, 有显著性差异(P<0.05).
肝癌是全球第5位常见恶性肿瘤, 我国发病率居恶性肿瘤第3位[5], 近年来, 以手术为主的系统序贯治疗使得肝癌5年生存率提高到30%-40%[6], 但肝癌的转移仍然是影响预后的一个重要因素. E-cadherin介导细胞与细胞之间的黏附, 维持细胞结构和形态的稳定. 其表达下调可降低细胞间的黏附, 使细胞相互分离, 造成细胞的脱落和扩散, 促使癌细胞局部侵袭, 进而发生远处转移[7]. 研究认为, 侵袭、转移的过程通常表现为失去上皮细胞标志物而重新表达间充质细胞标志物, 即发生上皮细胞向间充质细胞的转化[8]. 常伴随以E-cadherin为主的成分丢失, 因而失去细胞间黏附, 是恶性肿瘤细胞的重要特性[9]. 许多研究证明, 恶性肿瘤细胞的这种特性与E-cadherin表达的下调密切相关[10]. 近几年的研究显示, Snail可以在上皮性肿瘤的进展中直接抑制E-cadherin的表达, 因而促进转移的发生[11]. Cano et al[1]的研究首次证明, Snail直接结合E-cadherin CDH1启动子, 下调E-cadherin的表达, 通过降低细胞间的黏附, 破坏正常组织形态, 促进肿瘤侵袭. 临床研究表明, Snail和E-cadherin在很多上皮性癌(包括鳞癌、肝癌、黑色素瘤等)中存在明显的反向表达[2-3]. 本研究表明, 肝癌细胞株HepG2细胞中存在Snail mRNA的表达, 却未检测到E-cadherin mRNA的表达, 仅在转染反义Snail质粒后HepG2细胞中可检测到E钙黏蛋白mRNA的表达. 说明在肝癌细胞中存在Snail mRNA与E-cadherin mRNA表达的负向关系. 为进一步证明这种负向关系的存在, 我们选择有Snail mRNA表达而无E-cadherin mRNA表达的肝癌细胞株HepG2, 瞬时转染反义Snail质粒, 观察Snail和E-cadherin mRNA表达的变化. 结果发现, HepG2细胞中Snail mRNA表达降低的同时E-cadherin mRNA开始有表达, 且随转染时间的延长E-cadherin mRNA表达增强. 因此证明, 肝癌细胞中存在Snail mRNA与E-cadherin mRNA表达的逆转关系, 抑制Snail mRNA的表达可以使E-cadherin mRNA开始有表达, 增强细胞间的黏附力. 稳定转染后HepG2细胞中除了检测到E-cadherin mRNA开始有表达, 还可以看到纤维连接蛋白mRNA表达的下降. 由于上皮细胞向间充质细胞转化时, 产生大量细胞间质成分如纤维连接蛋白, 从而通过阻断Snail mRNA表达减少间质细胞成分纤维连接蛋白的表达, 部分逆转上皮细胞向间充质细胞的转化. 肿瘤细胞在缺失E-cadherin表达时侵袭性增强, 容易发生转移[12]. Miyoshi et al[13]最新研究证明, 在肝癌细胞株中, Snail不仅抑制E-cadherin的表达, 还通过间接调控基质金属蛋白酶家族成员的表达增加细胞的侵袭能力. 我们发现, 稳定转染反义Snail质粒后使HepG2细胞开始表达E-cadherin mRNA; 体外侵袭和运动实验表明, 反义组Snail mRNA受到抑制后, 可以显著降低HepG2细胞的运动能力, 同时其侵袭细胞外基质的能力也明显下降. 但Snail介导的肝癌细胞侵袭能力的改变是否与基质金属蛋白酶家族成员有关尚需进一步的实验证明.
总之, 揭示肝癌中Snail mRNA调节E-cadherin mRNA的表达, 并使肿瘤细胞获得侵袭和复发转移能力的过程中起重要作用, E-cadherin在肝癌发生、发展过程中发挥重要作用, 基因表达的下调或缺失是肝癌重要的恶性生物学指标. 阻断Snail mRNA的表达可能会抑制肝癌侵袭和复发转移, 对临床治疗有一定的指导意义.
Snail是一种锌指蛋白转录因子, 可以介导上皮细胞向间充质细胞的转化, 在转录水平抑制E-钙黏素(E-cadherin)的表达, 促进肿瘤的侵袭和复发转移. E-cadherin是属于钙黏素族典型的钙黏素亚族中一员, 是一种钙依赖性黏附分子, 广泛存在于各类上皮细胞中, 主要介导同型细胞间的黏附反应, 并起细胞骨架作用, 目前发生复发转移的机制尚不完全明了.
本文认为, 侵袭、转移的过程通常表现为失去上皮细胞标志物而重新表达间充质细胞标志物, 即发生上皮细胞向间充质细胞的转化, 常伴随以E-cadherin为主的成分丢失, 因而失去细胞间黏附, 是恶性肿瘤细胞的重要特性, 肿瘤细胞在缺失E-cadherin表达时侵袭性增强, 容易发生转移.
本文的重要意义在于, 揭示肝癌中SnailmRNA能调节E-cadherinmRNA的表达, 并使肿瘤细胞获得侵袭和复发转移能力的过程中起重要作用, E-cadherin在肝癌发生、发展过程中发挥重要作用, 基因表达的下调或缺失是肝癌重要的恶性生物学指标, 阻断SnailmRNA的表达可能会抑制肝癌侵袭和复发转移, 对临床治疗有一定的指导意义.
作者通过体外转染将Snail质粒导入HepG2细胞, 观察Snail对E-cadherinmRNA表达的逆转作用及对肝癌细胞体外侵袭、运动的抑制作用. 结果发现, 肝癌细胞中存在SnailmRNA与E-cadherinmRNA表达的负向关系, 抑制SnailmRNA的表达对肝癌细胞的侵袭和运动有抑制作用, 实验设计合理, 具有一定学术意义.
电编: 张敏 编辑: 王晓瑜
| 1. | Cano A, Perez-Moreno MA, Rodrigo I, Locascio A, Blanco MJ, del Barrio MG, Portillo F, Nieto MA. The transcription factor snail controls epithelial-mesenchymal transitions by repressing E-cadherin expression. Nat Cell Biol. 2000;2:76-83. [PubMed] |
| 2. | Yokoyama K, Kamata N, Hayashi E, Hoteiya T, Ueda N, Fujimoto R, Nagayama M. Reverse correlation of E-cadherin and snail expression in oral squamous cell carcinoma cells in vitro. Oral Oncol. 2001;37:65-71. [PubMed] |
| 3. | Jiao W, Miyazaki K, Kitajima Y. Inverse correlation between E-cadherin and Snail expression in hepatocellular carcinoma cell lines in vitro and in vivo. Br J Cancer. 2002;86:98-101. [PubMed] |
| 5. | Parkin DM, Bray F, Ferlay J, Pisani P. Estimating the world cancer burden: Globocan 2000. Int J Cancer. 2001;94:153-156. [PubMed] |
| 7. | Stambolic V, Mak TW, Woodgett JR. Modulation of cellular apoptotic potential: contributions to oncogenesis. Oncogene. 1999;18:6094-6103. [PubMed] |
| 8. | Thiery JP. Epithelial-mesenchymal transitions in tumour progression. Nat Rev Cancer. 2002;2:442-454. [PubMed] |
| 9. | Sun D, Baur S, Hay ED. Epithelial-mesenchymal transformation is the mechanism for fusion of the craniofacial primordia involved in morphogenesis of the chicken lip. Dev Biol. 2000;228:337-349. [PubMed] |
| 10. | Endo K, Ueda T, Ueyama J, Ohta T, Terada T. Immunoreactive E-cadherin, alpha-catenin, beta-catenin, and gamma-catenin proteins in hepatocellular carcinoma: relationships with tumor grade, clinicopathologic parameters, and patients' survival. Hum Pathol. 2000;31:558-565. [PubMed] |
| 11. | Hemavathy K, Ashraf SI, Ip YT. Snail/slug family of repressors: slowly going into the fast lane of development and cancer. Gene. 2000;257:1-12. [PubMed] |
| 13. | Miyoshi A, Kitajima Y, Sumi K, Sato K, Hagiwara A, Koga Y, Miyazaki K. Snail and SIP1 increase cancer invasion by upregulating MMP family in hepatocellular carcinoma cells. Br J Cancer. 2004;90:1265-1273. [PubMed] |